二氯乙酸钠对人骨肉瘤MG63细胞周期及凋亡影响的初步研究
于雅丽,王雷鸣
(郑州市骨科医院检验科,河南 郑州 450052)
二氯乙酸钠对人骨肉瘤MG63细胞周期及凋亡影响的初步研究
于雅丽,王雷鸣
(郑州市骨科医院检验科,河南 郑州 450052)
目的 探讨不同浓度的二氯乙酸钠(DCA)对人骨肉瘤MG63细胞活性、周期及凋亡的影响。方法 用含质量分数10%胎牛血清的RPMI-1640培养基培养MG63细胞,不同浓度DCA作用于对数生长期的细胞,CCK8试剂盒检测50、100、200 μg·mL-1DCA处理24 h、48 h后细胞增殖情况;流式细胞术检测100、200 μg·mL-1DCA-Na作用24 h、48 h后细胞周期和凋亡情况;qRT-PCR检测100、200 μg·mL-1DCA处理后细胞周期相关基因CDK2的变化。结果 CCK8检测结果显示50、100、200 μg·mL-1DCA均能抑制MG63细胞的生长,且有时间和浓度依赖性;不同浓度的DCA-Na分别干预MG63细胞不同时间后都明显阻滞细胞于G2/M期,且细胞凋亡率增加(P均<0.001);不同浓度的DCA干预MG63细胞后,细胞中的CDK2 mRNA的相对表达量明显降低(P均<0.001)。结论 DCA通过抑制CDK2使MG63细胞阻滞于G2/M期,进而诱导细胞凋亡,抑制细胞的生长。
二氯乙酸钠;骨肉瘤;周期蛋白依赖激酶;细胞周期
骨肉瘤是5~20岁青少年最常见的原发性恶性骨肿瘤[1-2],其恶性程度高,肺转移早,易复发,病死率约70%[3],而其发病机制不明确,传统化疗药物效果差,副作用大[4-5],因此阐明其发病机制及找到治疗的生物靶点刻不容缓。周期蛋白依赖激酶(cyclin-dependent kinase,CDK)是细胞周期调控的中心环节[6],而恶性肿瘤的生物学特点就是细胞周期的脱靶,使细胞无限的增殖,而大量的文献证实骨肉瘤中CDK处于过表达或失去正常调控机制的状态[7],因此,通过抑制CDK活性来达到肿瘤细胞周期阻滞和凋亡[8]。已有文献[9]证实二氯乙酸钠(sodium dichloroacetate,DCA)通过抑制线粒体丙酮酸脱氢酶激酶后启动三羧酸循环,促进葡萄糖的氧化磷酸化,而激活了线粒体介导的凋亡通路抑制人乳腺癌、非小细胞肺癌和胶质母细胞瘤细胞株的生长。研究[10]发现DCA通过诱导凋亡和阻滞细胞周期G2期在不影响非肿瘤细胞生长的情况下抑制结肠癌细胞生长,显著降低结肠癌细胞增殖。而课题组先前的研究发现能量抑制剂的活性诱导骨肉瘤MG63细胞凋亡,抑制人骨肉瘤细胞MG63生长。为探讨DCA是否也通过抑制了CDK2阻滞细胞于周期G2期来起作用,我们设计了此课题,观察观察不同浓度DCA作用于MG63细胞后对细胞活性及周期的影响。
1 材料与方法
1.1 材料 人骨肉瘤MG63细胞株由郑州大学基础医学院提供。
1.2 试剂 CCK-8试剂盒购于日本Dojindo公司;Trizol细胞裂解液购自美国Invitrogen公司;SYBR Green PCR Master Mix购自Beyotime公司;流式细胞凋亡检测试剂盒购自Beyotime公司;RPMI-1640培养基购自澳大利亚Gbico公司;DCA自美国Sigma-Aldrich公司。
1.3 方法 在加质量分数10%胎牛血清RPMI-1640培养基中培养人骨肉瘤细胞株MG63,pH值为6.8~7.2,于37 ℃、体积分数5% CO2培养箱培养48 h后,用质量分数0.25%胰酶消化传代。取生长旺盛的对数生长期细胞,制作细胞浓度为1×105·mL-1的细胞悬液,取100 μL转种96孔培养板中,于37 ℃、5% CO2培养箱中培养24 h,细胞贴壁后,弃去培养基,分别加入含DCA终浓度为50、100、200 μg·mL-1的培养基100 μL,对照组不加药,每组设3个复孔。
培养24 h、48 h、72 h后每孔分别加入5 mg·mL-1的CCK-8溶液10 μL,混匀,将培养板置于培养箱内继续孵育1~4 h,用酶标仪测定450 nm波长下测定吸光度值(OD值),测3次,取平均值,依照抑制率公式相对抑制率=[1-(药物干预实验组OD值)/(对照组OD值)]×100%,计算各组抑制率。
Annexin V-FITC/PI试剂盒检测不同浓度DCA对细胞周期和细胞凋亡的影响取对数生长期细胞,常规消化制成单细胞悬液,以细胞浓度1.25×105·mL-1接种于细胞培养瓶中,24 h后加入不同浓度DCA-Na (100、200 μg·mL-1)培养24 h、48 h,收集细胞,离心5 min,弃去上清,体积分数70%冰乙醇固定,4 ℃过夜。检测时,PBS清洗细胞,吹打混匀,加入Rnase 5 μL(10 mg·mL-1),37 ℃放置1 h,加入2 μL Annexin V-FITC和2 μL PI染液,室温避光染色30 min,计数10 000个细胞,FCW流式细胞术检测细胞周期时相和凋亡情况,各组细胞均重复实验3次,取其平均值。
实时荧光定量PCR(qRT-PCR)根据GenBank提供的CDK2序列合成引物Sense (5’-3’): 5’-CCGCCTGGACACTGAGACT-3’,Anti-Sense(3’-5’):5’-GTGGAGGACCCGATGGA-3’,产物长度270 bp。然后,提取各组细胞总RNA,取qRT-PCR合成cDNA,qRT-PCR进行定量检测mRNA的相对表达量。本次使用25 μL Real Time PCR反应体系,AB17500机器进行PCR反应。以2-△△Ct法计算CDK2基因mRNA相对表达差异,每组重复3次,取平均值。

2 结果
2.1 不同浓度DCA对MG63细胞的活性抑制作用 50、100、200 μg·mL-1的DCA分别作用于MG63细胞后,其OD值均较对照组(0 μg·mL-1DCA)下降,差异均有统计学意义(P均<0.05)。见图1。
2.2 不同浓度DCA对MG63细胞周期的影响 流式细胞术结果提示不同浓度DCA作用24 h、48 h后细胞周期明显阻滞于G2/M期,且有时间和浓度依赖性。见表1。
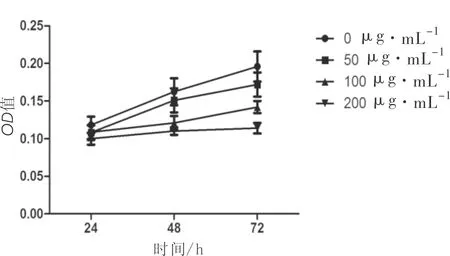
图1 不同浓度DCK作用于MG63细胞后活性抑制曲线
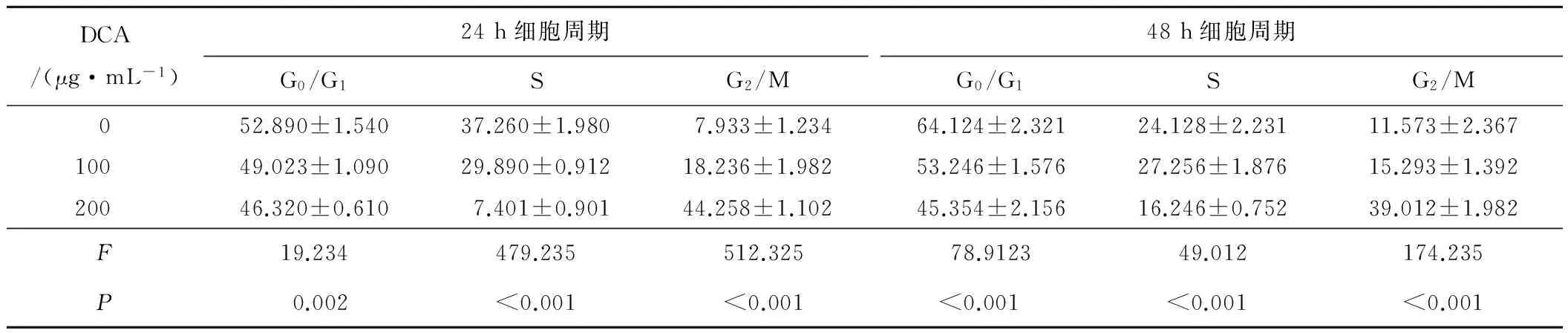
DCA/(μg·mL-1)24h细胞周期G0/G1SG2/M48h细胞周期G0/G1SG2/M052.890±1.54037.260±1.9807.933±1.23464.124±2.32124.128±2.23111.573±2.36710049.023±1.09029.890±0.91218.236±1.98253.246±1.57627.256±1.87615.293±1.39220046.320±0.6107.401±0.90144.258±1.10245.354±2.15616.246±0.75239.012±1.982F19.234479.235512.32578.912349.012174.235P0.002<0.001<0.001<0.001<0.001<0.001
注:方差分析显示,F24 h=7.102,P=0.004;F48 h=12.214,P<0.001。与0 μg·mL-1DCA比较,1)P<0.05;与100 μg·mL-1DCA比较,2)P<0.05
2.3 不同浓度的DCA对MG63细胞凋亡的影响 流式细胞术检测结果显示,不同浓度的DCA处理后MG63细胞均呈现明显的凋亡现象。见表2。
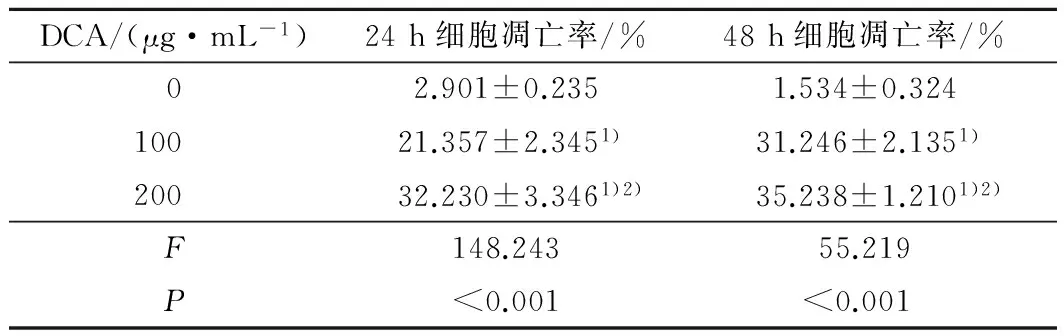
表2 不同浓度的DCA对MG63细胞凋亡的影响
注:与0 μg·mL-1DCA比较,1)P<0.05;与100 μg·mL-1DCA-Na比较,2)P<0.05
2.4 不同浓度的DCA对MG63细胞CDK2 mRNA相对表达量的影响 不同浓度的DCA干预MG63细胞后,细胞中的CDK2 mRNA的相对表达量明显降低(P均<0.001)。见表3。
3 讨论
CCK8实验结果证明了,不同浓度的DCA抑制MG63细胞的活性,且具有时间和浓度依赖性。这提示,DCA能诱导肿瘤细胞的凋亡和抑制细胞周期,而流式细胞术结果显示,不同浓度的DCA作用于MG63细胞24 h和48 h后,G2期的细胞明显增多,而且随着浓度的增加,G2期的细胞也增加,这说明DCA抑制肿瘤细胞的G2周期,这与文献不符。Wong等[11]认为DCA激活线粒体介导的细胞凋亡通路是能通过激活丙酮酸脱氢酶活性启动三羧酸循环,释放大量的ATP,促进线粒体膜去极化、降低膜电位。而Cao等[12]认为DCA联合化疗药能阻滞肿瘤细胞周期G1期并能增加肿瘤细胞的凋亡率,但是单独DCA对细胞周期不起任何作用。我们的研究与Madhok等[10]的报道是一致的,他的研究是DCA诱导凋亡和阻滞期G2期抑制结肠癌细胞生长,显著降低结肠癌细胞增殖,但不影响非肿瘤细胞生长。本实验用不同浓度的DCA作用细胞24 h和48 h,然后提取RNA进行qRT-PCR,结果显示,CDK2的表达明显下调,说明DCA抑制CDK2的表达,但是否说明DCA通过抑制CDK2来进行细胞周期的调节,这需要进一步实验。另外,我们的实验也存在缺点,没有进行非肿瘤细胞的对照,因此,我们的后续研究会进一步完善实验过程,力求实验结果真是可靠。总之,DCA通过抑制CDK2使MG63细胞阻滞于G2/M期,进而诱导细胞凋亡,抑制细胞的生长。
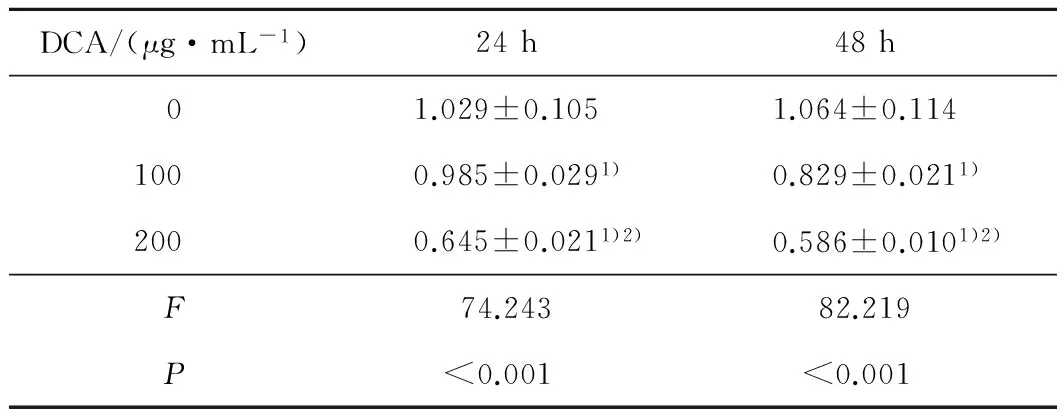
表3 不同浓度的DCA对MG63细胞CDK2 mRNA相对表达量的影响
注:与0 μg·mL-1DCA-Na比较,1)P<0.05;与100 μg·mL-1DCA-Na比较,2)P<0.05
[1]NAYAK D,ASHE S,RAUTA PR,et al.Bark extract mediated green synthesis of silver nanoparticles: Evaluation of antimicrobial activity and antiproliferative response against osteosarcoma[J]. Mater Sci Eng C Mater Biol Appl,2016,58:44-52.
[2]YU C,WANG W.Relationship Between P15 Gene Mutation and Formation and Metastasis of Malignant Osteosarcoma[J].Med Sci Monit,2016,22:656-661.
[3]FUJIWARA T,FUJIWARA M,NUMOTO K,et al. Second primary osteosarcomas in patients with retinoblastoma[J].Jpn J Clin Oncol,2015,45(12):1139-1145.
[4]JIANG F,SHI Y,LU H,et al. Armadillo Repeat-Containing Protein 8 (ARMC8) Silencing Inhibits Proliferation and Invasion in Osteosarcoma Cells[J]. Oncol Res,2016,24(5):381-389.
[5]BARØY T,CHILAMAKURI CS,LORENZ S,et al. Genome Analysis of Osteosarcoma Progression Samples Identifies FGFR1 Overexpression as a Potential Treatment Target and CHM as a Candidate Tumor Suppressor Gene[J].PLoS One,2016,11(9):e0163859.
[6]ZHAO C,FU MJ,QIU LH,et al. Molecular cloning and functional characterization of cyclin E and CDK2 from Penaeus monodon[J].Genet Mol Res,2016,15(3).
[7]QIE S,DIEHL JA. Cyclin D1,cancer progression,and opportunities in cancer treatment[J].J Mol Med (Berl),2016. [Epub ahead of print]
[8]WEIMER AK,BIEDERMANN S,SCHNITTGER A.Specialization of CDK regulation under DNA damage[J].Cell Cycle,2016. [Epub ahead of print]
[9]RICHARD SM,MARTINEZ MARIGNAC VL.Sensitization to oxaliplatin in HCT116 and HT29 cell lines by metformin and ribavirin and differences in response to mitochondrial glutaminase inhibition[J].J Cancer Res Ther,2015,11(2):336-340.
[10]MADHOK BM,YELURI S,PERRY SL,et al. Dichloroacetate induces apoptosis and cell-cycle arrest in colorectal cancer cells[J].Br J Cancer,2010,102(12):1746-1752.
[11]WONG JY,HUGGINS GS,DEBIDDA M,et al. Dichloroacetate induces apoptosis in endometrial cancer cells[J].Gynecol Oncol,2008,109(3):394-402.
[12]CAO W,YACOUB S,SHIVERICK KT,et al. Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cells in vitro to radiation[J].Prostate,2008,68(11):1223-1231.
Effect of Sodium Dichloroacetate on Cell Cycle and Apoptosis of Human Osteosarcoma Cell Line MG63
YU Yali,WANG Leiming
(DepartmentofClinicalLaboratory,ZhengzhouCityOsteopathicHospital,Zhengzhou450052,China)
Objective To determine the effect of sodium dichloroacetate (DCA) on human osteosarcoma cell line MG63 in vitro activity,cell cycle and apoptosis.Methods The MG63 cells were cultured with RPMI-1640 medium including 10% of fetal bovine serum as usual,and treated with different concentration DCA. Then CCK8 kit was used to observe growth suppression of cells under different concentrations of DCA at 24 h,48 h; Flow cytometry assay was used to determine the cycle and apoptosis of the cells that were treated by different concentrations of DCA for 24 h,48 h,respectively. Finally,qRT-PCR was used to determine the mRNA relative expression of cell cycle related gene CDK2 after DCA invention.Results Different concentration of DCA inhibited cell growth and proliferation in a time-and dose-dependent manner; different concentration of DCA-Na acting on different time respectively arrested cell cycle G2/M phase,and improved apoptosis(P<0.001); and decreased the expression of CDK2 gene(P<0.001).Conclusion DCA can arrest G2/M cell cycle phase through inhibiting activity of CDK2,and then DCA induce apoptosis of MG63 cells and inhibit the growth of tumor cells.
sodium dichloroacetate; osteosarcoma; cyclin-dependent kinase; cell cycle
郑州市科技计划项目(编号:153PKJGG084)
于雅丽(1983-),女,硕士,主治医师,主要从事骨肉瘤的基础与临床研究。E-mail:wa2yl@126.com
王雷鸣(1959-),男,硕士,主任医师,主要从事骨肉瘤的基础与临床研究。E-mail:wanglm3@126.com
10.3969/j.issn.1673-5412.2017.01.002
R738.1
A
1673-5412(2017)01-0007-04
2016-07-20)

