非小细胞肺癌通过EPO/EPOR信号促进自身增殖的分子机制研究
赵丽娟,李正民,何 磊,周继明,马晓雯,郝 强,李维娜,张 存,薛晓畅,张 伟,张英起,李 萌
(1.第四军医大学药学系,陕西 西安 710032;2.第四军医大学唐都医院,陕西 西安 710032)
非小细胞肺癌通过EPO/EPOR信号促进自身增殖的分子机制研究
赵丽娟1,李正民2,何 磊1,周继明1,马晓雯1,郝 强1,李维娜1,张 存1,薛晓畅1,张 伟1,张英起1,李 萌1
(1.第四军医大学药学系,陕西 西安 710032;2.第四军医大学唐都医院,陕西 西安 710032)
目的 研究促红细胞生成素(EPO)及其受体(EPOR)在非小细胞肺癌(NSCLC)中的表达情况及其对NSCLC发生发展的影响。方法 qPCR、western blot检测EPO/EPOR在9种肺癌细胞系中的表达水平;MTT法检测rhEPO促细胞增殖的作用,流式细胞术检测rhEPO对细胞凋亡和周期的影响,Transwell检测细胞迁移;qPCR、western blot检测rhEPO对Cyclin D1和Cyclin A表达水平的影响。结果 EPO/EPOR在部分肺癌细胞中高表达,rhEPO促进高表达EPO/EPOR的肺癌细胞的增殖,而对肺癌细胞凋亡和迁移无影响,rhEPO诱导Cyclin D1表达,使用Jak2/Stat5抑制剂或干涉Jak2/Stat5后rhEPO作用消失。结论 高表达EPO/EPOR非小细胞肺癌通过Jak2/Stat5/Cyclin D1通路促进自身增殖。
促红细胞生成素;促红细胞生成素受体;非小细胞肺癌;细胞增殖
促红细胞生成素(erythropoietin,EPO)是一种重要的促进红细胞生成的糖蛋白,主要由胎儿肝脏和成人肾脏产生[1]。此外,EPO还具有促进组织修复和再生的作用。EPO主要通过促红细胞生成素受体(erythropoietin receptor,EPOR)发挥其生物学功能。目前,以重组人红细胞生成素(recombinant human erythropoietin,rhEPO)为主要成份的红细胞生成刺激剂(erythropoiesis stimulating agents,ESAs)类药物被广泛用于肿瘤患者化疗后发生的贫血。然而,有研究[2-6]表明,EPO/EPOR共表达在各种肿瘤,并且与肿瘤细胞的生长、迁移和侵袭有关,ESAs的使用也会促进肿瘤发展,缩短患者生存期[7-10]。然而,也有文献[11-13]认为EPO/EPOR不具有促肿瘤发生、发展的作用。
我国每年肺癌新发病例约73.3万,死亡60余万,发病率和死亡例数均居各类恶性肿瘤首位[14]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的80%以上,NSCLC的治疗主要以手术和铂类化疗为主。尽管各种手术方案和化疗手段对于NSCLC的治疗已取得长足进步,但是NSCLC的5 a生存率仍然很低。与其他肿瘤类似,EPO/EPOR对肺癌发生、发展的作用目前也存在较大争议[15-18]。确定EPO/EPOR在NSCLC中的表达情况,明确EPO/EPOR对NSCLC发生、发展的作用不仅对于研究NSCLC的发生、发展机制有重要意义,而且对肺癌患者化疗后大量使用ESAs的情况具有重要的临床指导意义。
因此,我们检测了EPO/EPOR在肺癌细胞系中的表达水平,筛选出EPO/EPOR高表达细胞株,并且证明了rhEPO能够促进EPO/EPOR高表达肺癌细胞的增殖。本研究发现,部分NSCLC细胞株能够分泌EPO,并且表达EPOR。在这些细胞中,EPO/EPOR信号通路能够通过上调细胞周期蛋白Cyclin D1促进肿瘤细胞增殖。该研究结果提示至少部分NSCLC患者化疗后ESAs是不安全的,应予以进一步研究。
1 资料与方法
1.1 材料 正常人支气管上皮细胞HBEC-3KT和NSCLC细胞系HCC15、H44、H2073、H1993、H1155、H1819、H1833、H3122由美国德州大学西南医学中心John Minna教授实验室提供,NSCLC细胞系A549购自美国典型培养物保藏中心,人EPO依赖性白血病细胞系UT-7购自中国典型培养物保藏中心。所有细胞系经过短串联重复序列基因分型鉴定并且传代少于6个月。
1.2 试剂 抗EPO、EPOR、Jak2、Stat5、β-actin抗体均购自美国Abcam公司;抗phospho-EPOR、Cyclin D1的抗体及EPO中和抗体均购自美国R&D公司;抗phospho-Jak2、phospho-Stat5、Akt、phospho-Akt、P38、phospho-P38的抗体均购自美国Cell Signaling Technology公司。Jak2抑制剂(AG490)、Stat5抑制剂(CAS285986)、PI3k/Akt抑制剂(LY294002)、p38 MAPK抑制剂 (PD98059)均购自美国Merck Millipore公司。
1.3 研究方法
1.3.1 细胞培养 HBEC-3KT细胞在补充有表皮生长因子、牛垂体提取物和庆大霉素的角质形成细胞-无血清培养基中培养。A549在含体积分数10%胎牛血清(FBS)和抗生素的DMEM/F12(11)培养基中培养。其他细胞均在含体积分数10% FBS和抗生素的RPMI-1640培养基中培养。培养条件37 ℃、体积分数5% CO2。
1.3.2 qPCR 从细胞中提取RNA,定量后取500 ng总RNA进行反转录制备cDNA,以cDNA为模板进行实时定量PCR。引物序列如下:EPO:5’-GATAAAGCCGTCAGTGGCCTTC-3’,5’-GGGAGATGGCTTCCTTCTGG G-3’;EPOR:5’-CCTGACGCTCTCCCTCATCC-3’,5’-GCCTTCAAACTCGCTCTCTGG-3’; Cyclin A: 5’-CACTCACTGGCTTTTCATCTTC-3’,5’-CAGAAAACCATTGGTCCCTC-3’;Cyclin D1:5’-TGAGGCGGTAGTAGGACAGG-3’,5’-GACCTTCGTTGCCCTCTGT-3’;βactin:5’-AGAGGGAAATCGTGCGTGAC-3’,5’-CAATAGTGATGACCTGGCCGT-3’。
1.3.3 western blot 收集细胞,以含蛋白酶抑制剂的裂解缓冲液裂解。BCA法进行蛋白定量,取等量蛋白样品进行SDS-PAGE电泳后转至PVDF膜,5% BSA室温封闭2 h,将PVDF膜与待检测的一抗4 ℃过夜孵育,再用加入HRP标记的二抗室温孵育,洗膜后用ECL发光试剂盒处理PVDF膜,发光显影。β-actin用作内参。
1.3.4 MTT检测 分5组:PBS对照组、5 IU rhEPO、10 IU rhEPO、20 IU rhEPO、10 IU rhEPO+EPO中和抗体(5 μg·mL-1),细胞以5 000个/孔接种于96孔板,设5个副孔,加药培养24 h后加20 μL 5 mg·mL-1MTT培养4 h。培养结束后去上清加200 μL DMSO,震荡10 min测490 nm光密度(OD)值。
1.3.5 流式细胞术 细胞用50 μmol·L-1依托泊苷或50 μmol·L-1依托泊苷+10 IU·mL-1EPO处理后FITC Annexin V/PI双染色检测细胞凋亡。细胞用PBS或10 IU·mL-1rhEPO处理后检测细胞周期,数据使用FlowJo软件分析。
1.3.6 Transwell 提前12 h用Matrigel 17稀释液包被Transwell小室基底膜,将小室放入6孔板中,用无血清培养基在37 ℃,30 min水化基底膜。制备细胞悬液,以1×105·mL-1200 μL接种于小室,6孔板下室加入rhEPO 10 IU·mL-1,以PBS做阴性对照,TGF-β(0.5 μg·mL-1)做阳性对照,培养48 h后用结晶紫染色观察细胞侵袭。
1.3.7 siRNA转染 将细胞接种于6孔,待细胞密度大于50%时准备转染,转染方法按Lipofectamine 2000说明书进行。siRNA序列:Jak2:siJAK2:sense:CCACCUGAAUGCAUUGAAATT,antisense:UUUCAAUGCAUUCAGGUGGTT,siCONsense:CUAGCUAGGTTUCCAUTCCTT,antisense:AUCGCCUTTCGGUAUAUTCTT;STAT5:siSTAT5:sense,CCGGCACAUUCUGUACAAUTT;antisense:AUUGUACAGAAUGUGCCGGTT,siCON:sense,CAUTUGGCCUTUTAACGUATT,antisense:ACCUCGAUTA CUGGCGUAATT。
2 结果
2.1 EPO/EPOR在NSCLC细胞系中的表达 qPCR和western Blot结果显示,相对于EPO/EPOR高表达的UT-7细胞和EPO/EPOR低表达的正常肺上皮细胞HBEC-3KT,H1155、H1819、H1833和H3122具有较高水平的EPO/EPOR表达,而 A549、HCC15、H44、H1993和H2073细胞中EPO/EPOR表达水平较低(图1),EPO与EPOR有共表达特征。
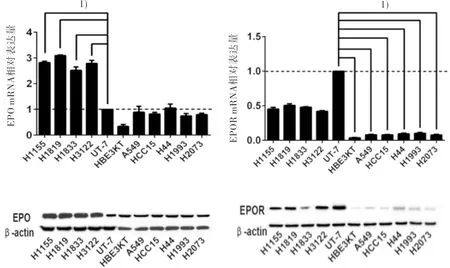
图1 EPO和EPOR在肺癌细胞系中的表达
2.2 rhEPO促进EPO/EPOR高表达NSCLC细胞的增殖 为了证明EPO对于NSCLC细胞的作用,我们选择了2种EPO/EPOR高表达的肺癌细胞系H1155、H1819和1种EPO/EPOR低表达的细胞系HCC15。同时,UT-7细胞被用做阳性对照细胞。MTT结果显示rhEPO能够明显促进H1155、H1819和UT-7细胞的增殖,而对HCC15细胞增殖无影响。EPO中和抗体(EPO-NA)能够有效拮抗rhEPO对H1155和H1819的增殖促进作用(图2)。流式细胞术结果显示,rhEPO对于化疗药物Etoposide诱导的细胞凋亡没有保护作用(图3)。Transwell实验证明rhEPO对于NSCLC细胞的迁移也没有影响,而阳性对照转化生长因子TGFβ可有效诱导细胞迁移(图4)。以上结果说明EPO/EPOR能够促进EPO/EPOR高表达的NSCLC细胞的增殖,而对于凋亡和迁移无影响。
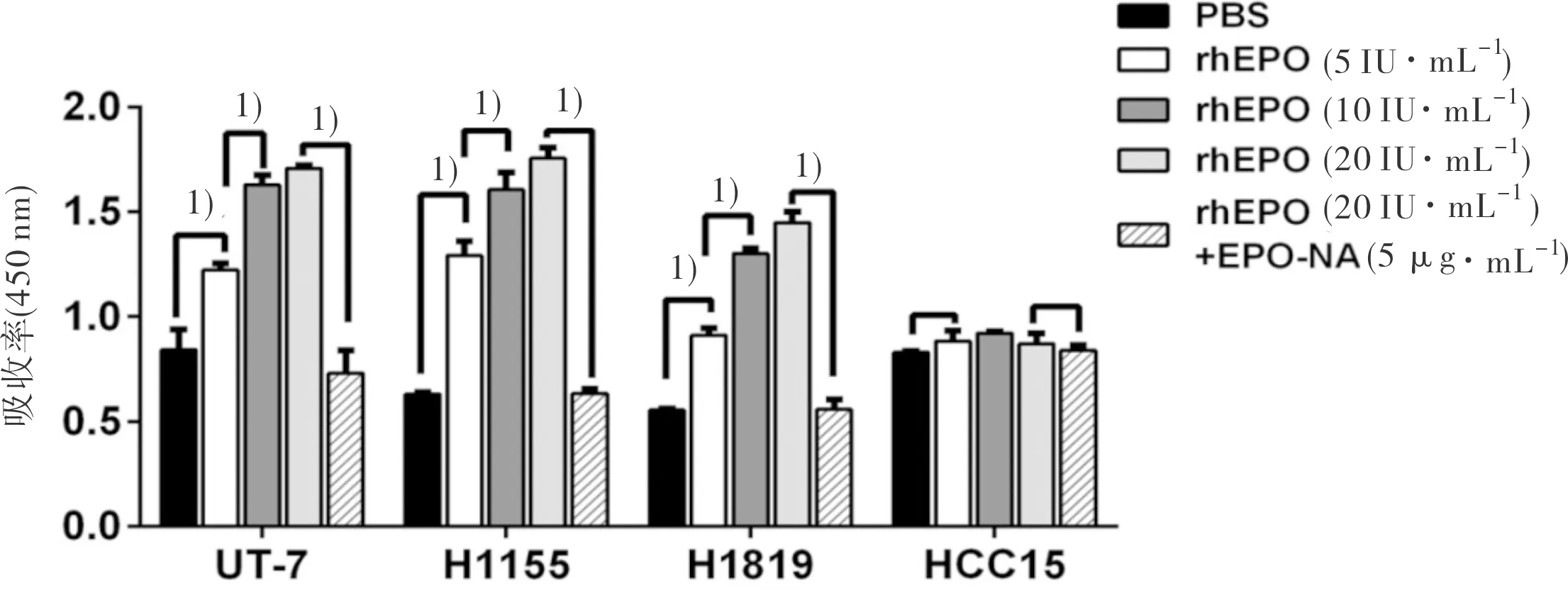
图2 rhEPO促进EPO/EPOR高表达NSCLC细胞的增殖

图3 rhEPO对于化疗药物Etoposide诱导的细胞凋亡没有保护作用

图4 rhEPO对于NSCLC细胞的迁移没有影响
2.3 rhEPO上调Cyclin D1促进EPO/EPOR高表达NSCLC细胞的细胞周期 流式细胞术检测细胞周期结果显示,rhEPO能够明显促进H1819和H1155的S期细胞数量,减少G0/G1期细胞比例,而对HCC15的细胞周期无影响(图5)。因此,该结果说明rhEPO通过促进细胞周期发挥其促细胞增殖的作用。
由于rhEPO促进G1期细胞向S期细胞转换,因此我们在H1819细胞中检测了细胞周期蛋白Cyclin D1和Cyclin A表达的变化。实时定量PCR和Western Blot结果显示rhEPO作用后,Cyclin D1的表达明显上调,而Cyclin A的水平无变化。该结果说明Cyclin D1是rhEPO促进细胞增殖的关键周期蛋白(图6)。
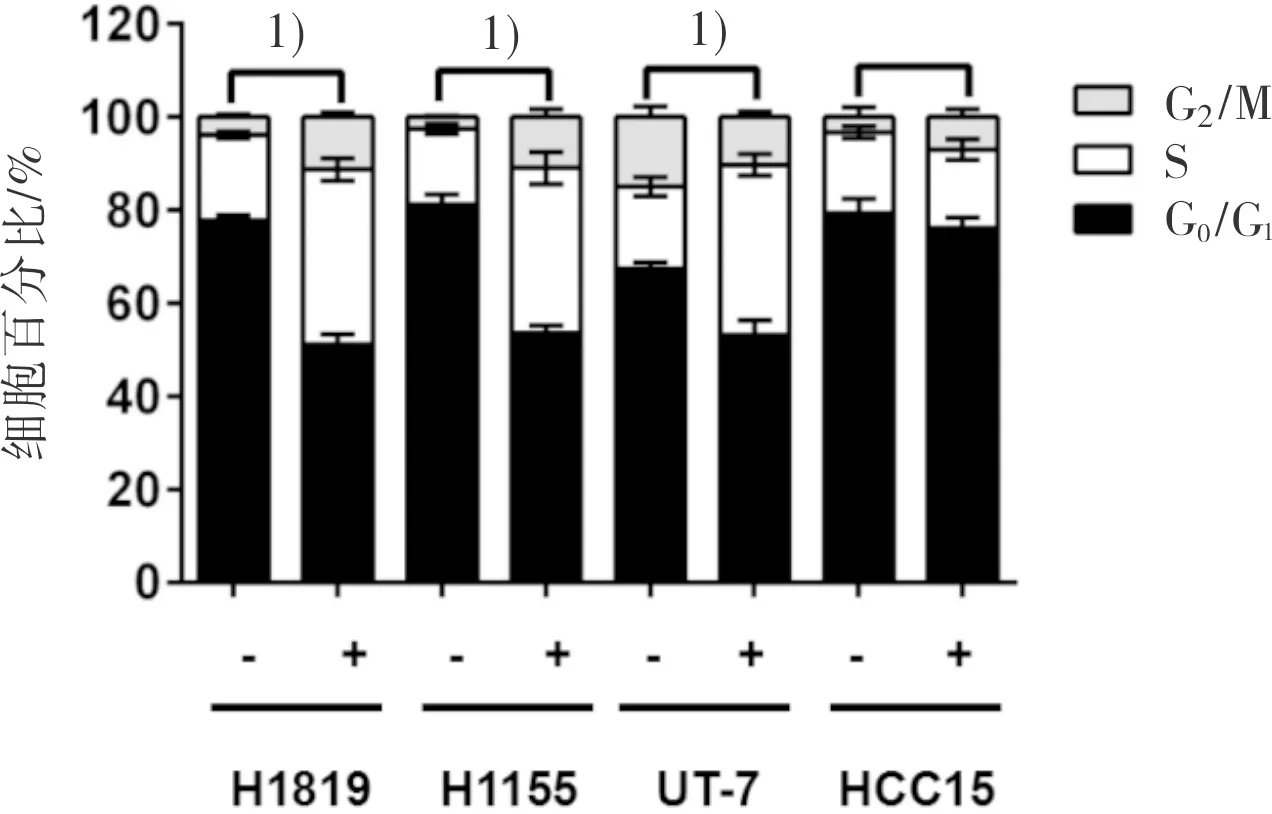
图5 rhEPO(10 IU·mL-1)明显促进EPO/EPOR高表达细胞的细胞周期
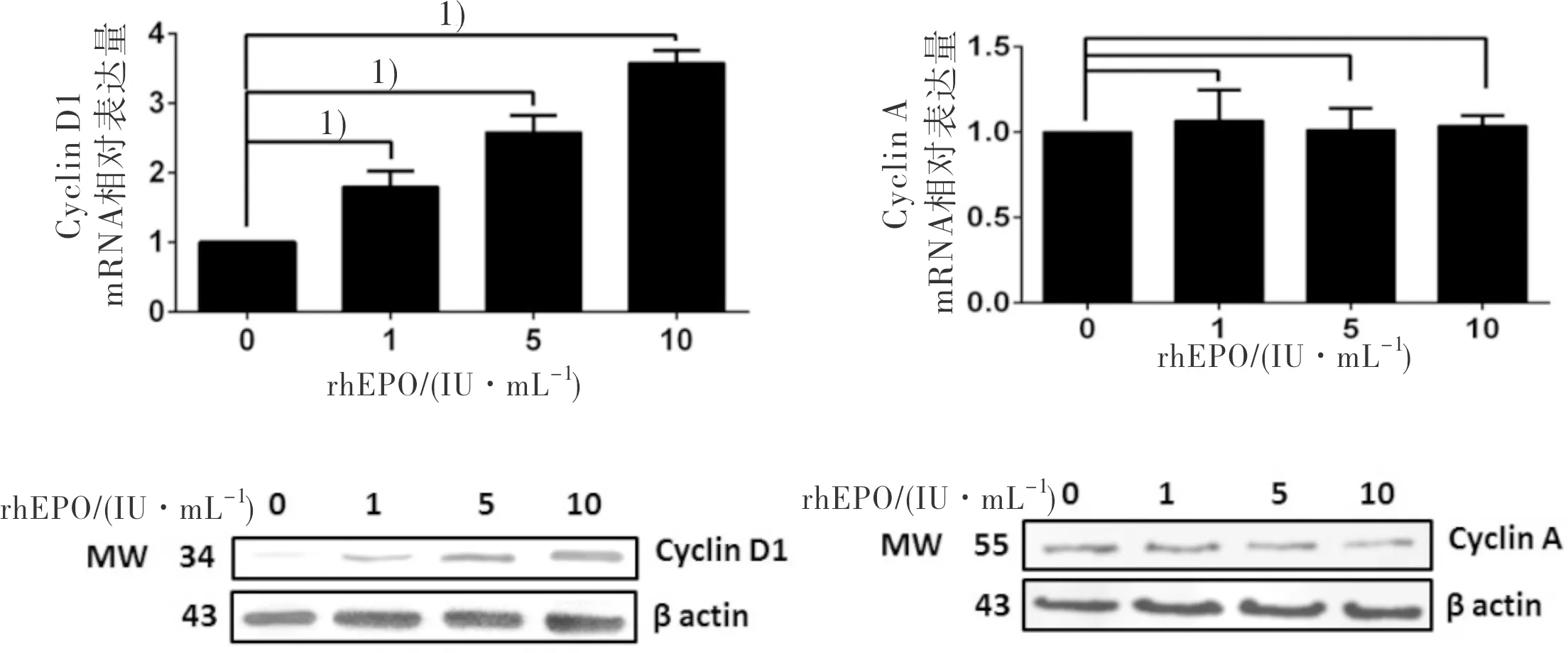
图6 rhEPO明显促进H1819细胞Cyclin D1的表达,而对Cyclin A 无影响
2.4 rhEPO通过激活EPOR/JAK2/STAT5上调Cyclin D1 既往文献报道,EPO/EPOR诱导Jak2磷酸化并激活下游Stat5、PI3k/Akt或RAS/RAF/ERK等信号通路发挥其生物学作用。为了明确EPO/EPOR上调Cyclin D1的信号通路,我们使用Jak2抑制剂(AG490)、Stat5抑制剂(CAS285986)、PI3K/Akt抑制剂(LY294002)或P38MAPK抑制剂(PD98059)分别作用,观察其对EPO/EPOR上调Cyclin D1的影响。qRT-PCR和western Blot结果显示Jak2抑制剂(AG490)或Stat5抑制剂(CAS285986)能够抑制rhEPO上调Cyclin D1,而PI3K/Akt抑制剂(LY294002)或P38MAPK抑制剂(PD98059)对该过程无影响,siRNA干涉Jak2或Stat5的表达后,也发现了相似的结果(图7)。以上结果说明EPO/EPOR通过Jak2/Stat5信号通路上调Cyclin D1的表达。
3 讨论
目前,EPO/EPOR对于NSCLC发生、发展的影响这一问题尚存在很大争议,比如Saintigny等[17]认为肿瘤组织高表达EPO/EPOR会导致更短的生存期,而Rózsás等[19]则认为肿瘤组织表达EPO是预后较好的标志。因此,证明EPO对NSCLC的作用对于NSCLC发生、发展机制的研究具有重要意义。此外,由于rhEPO被广泛用于NSCLC患者,治疗化疗引发的贫血,所以研究EPO对NSCLC发生发展的影响对于rhEPO的临床应用意义重大。
本研究中我们首次分析了EPO/EPOR在9种NSCLC细胞系中的表达情况,通过与EPO/EPOR高表达的UT-7细胞比较,H1155、H1819、H1833、H3122等4种细胞EPO/EPOR高表达,而其他5种细胞的EPO/EPOR表达水平较低。这一现象与前期报道的近50%的NSCLC患者肿瘤标本中EPO/EPOR表达增高的情况具有一致性,说明部分肺癌高表达EPO[15,17]。为了证明EPO/EPOR高表达细胞与低表达细胞对于rhEPO的反应是否一致,我们选择了2种高表达细胞(H1155、H1819)和1种低表达细胞(HCC15)为研究对象,进行细胞学实验。结果证明,rhEPO能够明显促进EPO/EPOR高表达细胞的增殖,而对于EPO/EPOR低表达的细胞无影响。该结果说明rhEPO至少促进部分NSCLC细胞的增殖,也提示rhEPO对于肿瘤组织高表达EPO/EPOR的患者应该是不安全的。
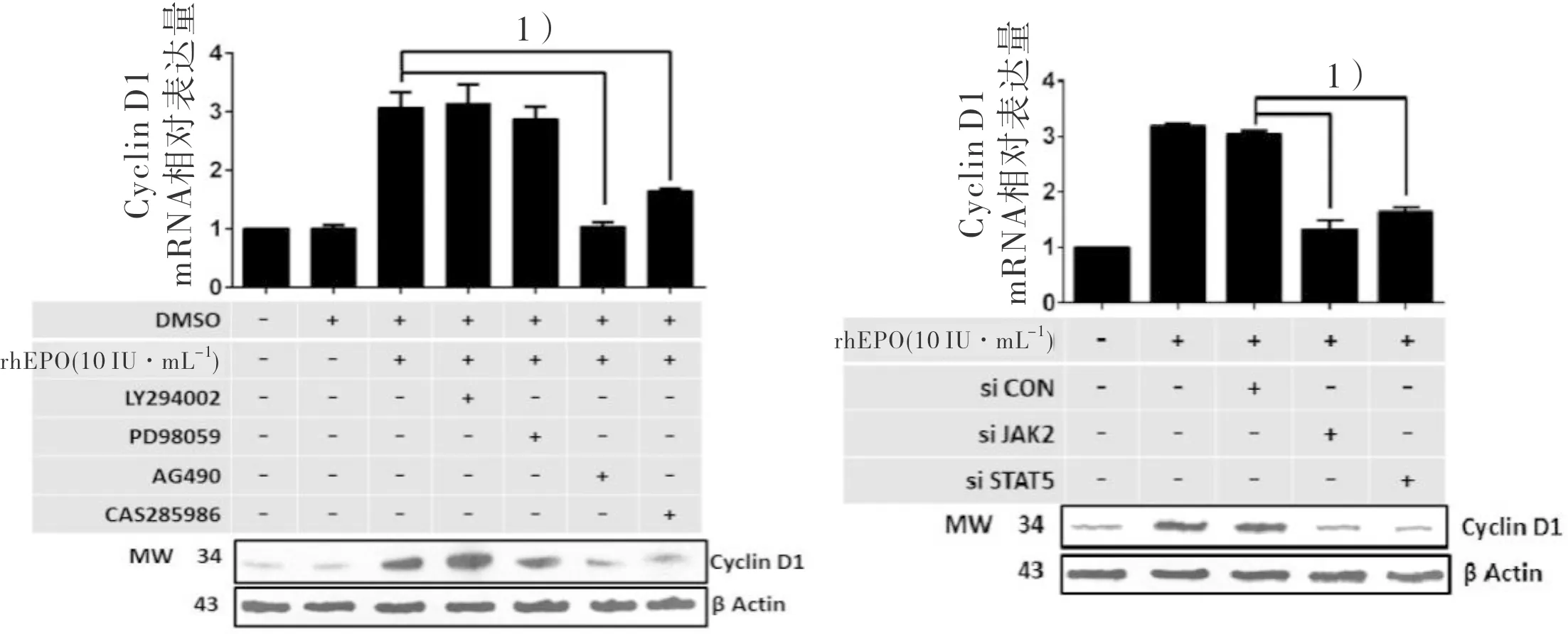
图7 rhEPO通过Jak2/Stat5途径上调Cyclin D1的表达
为了明确rhEPO促进NSCLC细胞增殖分子机制,我们检测了细胞周期。结果证明rhEPO通过促进细胞周期发挥促EPO/EPOR高表达细胞增殖的作用,并且证明了Cyclin D1是rhEPO促进细胞周期的重要周期蛋白。以往文献[4,20]曾报道活化的EPOR通过Jak2和下游Stat5、PI3K/Akt或Ras/Raf/Erk等信号通路来促进肿瘤细胞增殖或抗凋亡。为了寻找rhEPO上调Cyclin D1的具体分子机制,我们使用了以上分子的抑制剂来进行研究。结果证明只有Jak2/Stat5的抑制剂抑制了rhEPO上调Cyclin D1的作用。因此,我们认为rhEPO 通过Jak2/Stat5/Cyclin D1途径促进EPO/EPOR高表达细胞的增殖。
综上所述,我们的研究证明NSCLC细胞中的EPO/EPOR表达不一致,约50%的细胞系EPO/EPOR高表达;rhEPO能够促进EPO/EPOR高表达细胞的增殖;rhEPO促进增殖的分子机制主要是通过Jak2/Stat5途径上调周期蛋白Cyclin D1的表达。以上结果提示rhEPO对于肿瘤组织高表达EPO/EPOR的患者应该是不安全的,需要予以注意。
[1]FISHER JW.Erythropoietin: physiology and pharmacology update[J].Exp Biol Med (Maywood),2003,228(1):1-14.
[2]AAPRO M,JELKMANN W,CONSTANTINESCUSN,et al.Effects of erythropoietin receptors and erythropoiesis-stimulating agents on disease progression in cancer[J].Br J Cancer,2012,106(7):1249-1258.
[3]HEDLEY BD,CHU JE,ORMOND DG,et al.Recombinant human erythropoietin in combination with chemotherapy increases breast cancer metastasis in preclinical mouse models[J].Clin Cancer Res,2011,17(19):6151-6162.
[4]SHI Z,HODGES VM,DUNLOP EA,et al.Erythropoietin-induced activation of the JAK2/STAT5,PI3K/Akt,and Ras/ERK pathways promotes malignant cell behavior in a modified breast cancer cell line[J].Mol Cancer Res,2010,8(4):615-626.
[5]KUMAR SM,ZHANG G,BASTIAN BC,et al.Erythropoietin receptor contributes to melanoma cell survival in vivo[J].Oncogene,2012,31(13):1649-1660.
[6]PONIEWIERSKA-BARAN A,SUSZYNSKA M,SUN W,et al.Human rhabdomyosarcoma cells express functional erythropoietin receptor:Potential therapeutic implications[J].Int J Oncol,2015,47(5):1989-1997.
[7]GLASPY J.Hematology: ESAs to treat anemia--balancing the risks and benefits[J].Nat Rev Clin Oncol,2009,6(9):500-502.
[8]GALLI L,RICCI C,EGAN CG.Epoetin beta for the treatment of chemotherapy-induced anemia: an update[J].Onco Targets Ther,2015,8:583-591.
[9]SMITH RE JR,AAPRO MS,LUDWIG H,et al.Darbepoetin alpha for the treatment of anemia in patients with active cancer not receiving chemotherapy or radiotherapy: results of a phase Ⅲ,multicenter,randomized,double-blind,placebo-controlled study[J].J Clin Oncol,2008,6(7):1040-1050.
[10]LEYLAND-JONES B,SEMIGLAZOV V,PAWLICKI M,et al.Maintaining normal hemoglobin levels with epoetin alfa in mainly nonanemic patients with metastatic breast cancer receiving first-line chemotherapy: a survival study[J].J Clin Oncol,2005,23(25):5960-5972.
[11]BELDA-INIESTA C,PERONA R,CARPEO JDE C,et al.Human recombinant erythropoietin does not promote cancer growth in presence of functional receptors expressed in cancer cells[J].Cancer Biol Ther,2007,6(10):1600-1605.
[12]VATSVEEN TK,SPONAAS AM,TIAN E,et al.Erythropoietin (EPO)-receptor signaling induces cell death of primary myeloma cells in vitro[J].J Hematol Oncol,2016,9(1):75.
[13]MITTELMAN M,NEUMANN D,PELED A,et al.Erythropoietin induces tumor regression and antitumor immune responses in murine myeloma models[J].Proc Natl Acad Sci U S A,2001,98(9):5181-5186.
[14]CHEN W,ZHENG R,BAADE PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016 ,66(2):115-132.
[15]DAGNON K,PACARY E,COMMO F,et al.Expression of erythropoietin and erythropoietin receptor in non-small cell lung carcinomas[J].Clin Cancer Res,2005,11(3):993-999.
[16]DOLESCHEL D,RIX A,ARNS S,et al.Erythropoietin improves the accumulation and therapeutic effects of carboplatin by enhancing tumor vascularization and perfusion[J].Theranostics,2015,5(8):905-918.
[17]SAINTIGNY P,BESSE B,CALLARD P,et al.Erythropoietin and erythropoietin receptor coexpression is associated with poor survival in stage I non-small cell lung cancer[J].Clin Cancer Res,2007,13(16):4825-4831.
[18]VANSTEENKISTE J,GLASPY J,HENRY D,et al.Benefits and risks of using erythropoiesis-stimulating agents (ESAs) in lung cancer patients: study-level and patient-level meta-analyses[J].Lung Cancer,2012 ,76(3):478,485.
[20]BROXMEYER HE.Erythropoietin: multiple targets,actions,and modifying influences for biological and clinical consideration[J].J Exp Med,2013,210(2):205-208.
The Effect of EPO/EPOR on Non-small Cell Lung Cancer Cells and Its Molecular Mechanism
ZHAO Lijuan1,LI Zhengmin2,HE Lei1,ZHOU Jiming1,MA Xiaowen1,HAO Qiang1,LI Weina1,ZHANG Cun1,XUE Xiaochang1,ZHANG Wei1,ZHANG Yingqi1,LI Meng1
(1.DepartmentofPharmacy,theFourthMilitaryMedicalUniversity,Xi’an710032,China;2.SlushHospital,theFourthMilitaryMedicalUniversity,Xi’an710032,China)
Objective To investigate the mechanism of erythropoietin (EPO) and its receptor (EPOR) on the progression of non-small cell lung cancer (NSCLC).Methods The expression level of EPO and EPOR in nine NSCLC cell lines were detected by qPCR and western blot.Cell proliferation was detected by MTT assay.Apoptosis and cell cycle were detected by flow cytometry.Transwell was used to detect cell invasion.QPCR and western blot were used to detect the effect of rhEPO on the expression of Cyclin D1 and Cyclin A.Results EPO/EPOR were highly expressed in some lung cancer cells.RhEPO promoted the proliferation of lung cancer cells with high expression level of EPO/EPOR,but had no effect on the cell apoptosis and invasion.RhEPO induced the expression of Cyclin D1 but not Cyclin A.The rhEPO-induced Cyclin D1 expression abrogated by Jak2 or Stat5 inhibitor or siRNA.Conclusion EPO/EPOR promotes NSCLC proliferation through Jak2/Stat5 /Cyclin D1 pathway.
erythropoietin; erythropoietin receptor; non-small cell lung cancer; proliferation
国家自然科学基金面上项目(编号:81272517、81673020);陕西省自然科学基础研究基金资助项目(编号:2016JM8096,2016SF256)
赵丽娟(1993-),女,硕士,主要从事肿瘤发生发展机制的基础研究。E-mail:1508002893@qq.com
李萌(1978-),博士,副教授,主要从事抗肿瘤药物研发及基础研究。E-mail:limeng@fmmu.edu.cn
10.3969/j.issn.1673-5412.2017.01.001
R734.2;R730.23
A
1673-5412(2017)01-0001-07
2016-10-21)

