血管球瘤中FLi-1、h-caldesmon及collagen Ⅳ的表达及临床病理分析
杨 勇,王瑞琳,徐 瑾,尹海波
血管球瘤是一种少见的软组织肿瘤,是由位于真皮网状层的微动静脉吻合管(Suequet-hoyer管)周围的与平滑肌类似的细胞构成的间叶性肿瘤。文献报道,免疫组化标记h-caldesmon和collagen Ⅳ对诊断血管球瘤有帮助。本实验采用免疫组化EnVision法检测35例血管球瘤中h-caldesmon及collagen Ⅳ的表达,观察具体阳性部位,此外将Friend白血病集成转录因子-1(FLi-1)作为血管内皮的标志物同时也进行了检测并观察,并同h-caldesmon及collagen Ⅳ进行分析比较,旨在进一步提高对该肿瘤的认识水平。
1 材料与方法
1.1临床资料收集天津市天津医院病理科2014年12月~2016年3月存档的血管球瘤患者蜡块标本35例,全部位于手部,其中男性8例,女性27例,年龄15~67岁,平均41岁。
1.2方法标本均经10%中性福尔马林固定,脱水,石蜡包埋,常规切片,HE染色,光镜观察。免疫组化采用EnVision法,h-caldesmon、collagen Ⅳ及FLi-1单克隆抗体均购自Dako公司,4 μm厚连续石蜡切片,二甲苯脱蜡,梯度乙醇水化以及0.3%过氧化氢阻断内源性过氧化物酶后,h-caldesmon经0.01 mmol/L枸橼酸钠缓冲液(pH6.0)微波沸煮修复,FLi-1经EDTA高压沸煮修复,collagen Ⅳ经胃酶37 ℃孵育30 min。然后分别加h-caldesmon、FLi-1及collagen Ⅳ的Ⅰ抗标志物,4 ℃冰箱过夜,后加HRP过氧化物酶标记的羊抗鼠试剂,最后用含0.15%过氧化氢的DAB显色,苏木精复染后树脂封固。每次试验均设阳性和阴性对照。
此外,由于血管球瘤的形态学易与其他肿瘤有相似之处,一抗还选用了vimentin、SMA、CD34、EMA、CgA、desmin、S-100、CD99及CD68对肿瘤进行免疫组化标记用以鉴别诊断,抗体均购自Dako公司,操作严格按照说明书进行。
1.3结果判定参照血管球瘤的诊断标准,依据细胞质/细胞核出现明显棕黄色显色颗粒为阳性,h-caldesmon阳性定位于胞质,collagen Ⅳ阳性定位于细胞周围基膜,FLi-1阳性定位于细胞核和细胞质(血管内皮定位于细胞核)。在400倍光镜下随机选取10个视野,以阳性细胞占肿瘤细胞总数为阳性强度:<10%为阴性;10%~30%为弱阳性;31%~60%为中等阳性;>60%为强阳性。
1.4统计学方法采用SPSS 12.0软件对数据进行Fisher确切概率法检验,以P<0.05为差异有统计学意义。
2 结果
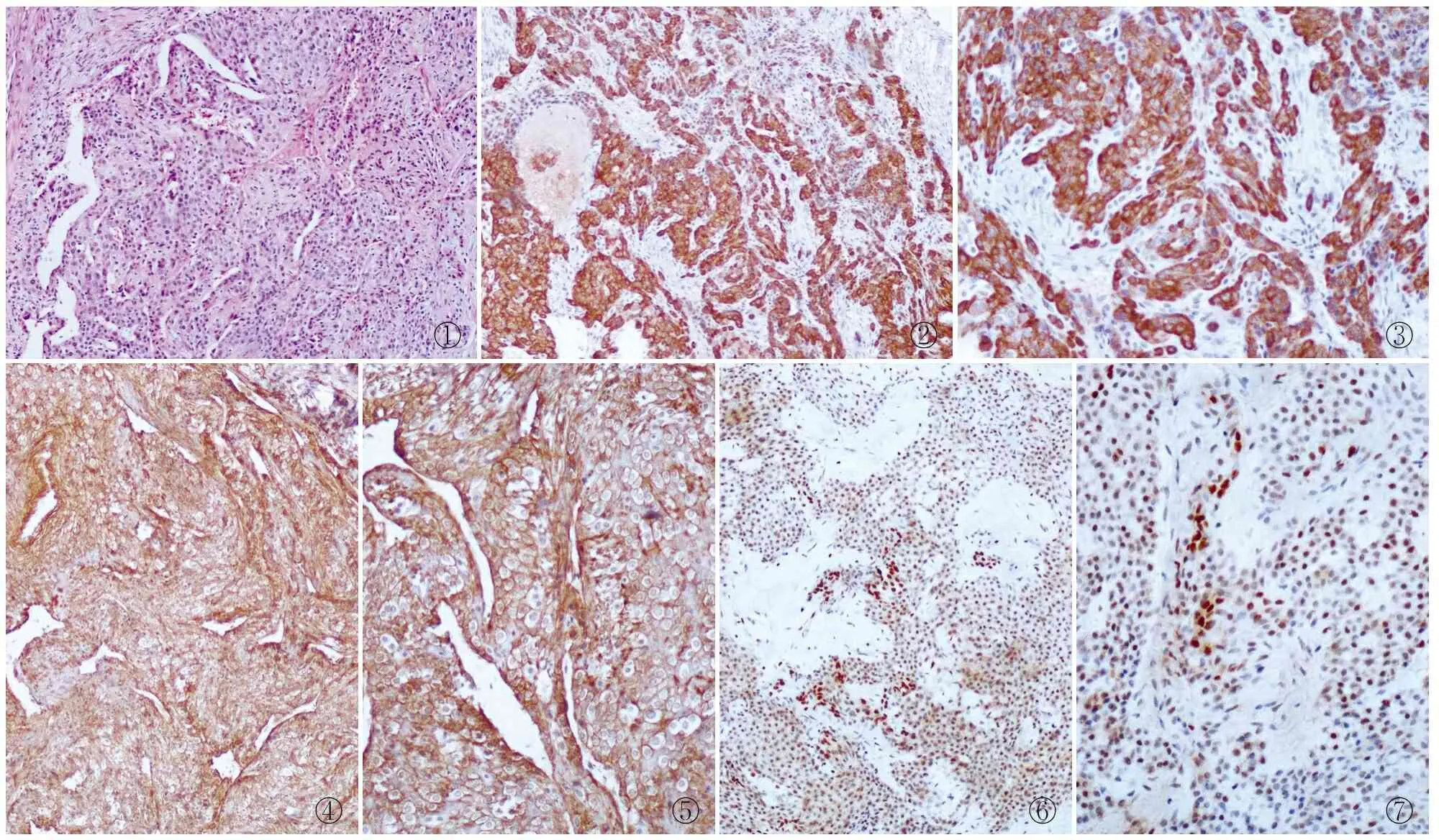
2.1镜检肿瘤由形态一致的圆形细胞组成,呈片状分布在血管之间或呈环状围绕在血管周围(图1),这些小血管如毛细血管大小,腔窄而弯曲。瘤细胞呈圆形或多边形,边界清晰,外形规则,细胞质淡嗜双色或嗜酸,细胞核圆形,位于中央,核膜清楚,有时见瘤细胞与梭形平滑肌细胞移行过渡。
2.2免疫表型35例血管球瘤中h-caldesmon均阳性,其中强阳性者占57.1%,(表1)。h-caldesmon在肿瘤细胞中弥漫分布(图2),无背景着色,与collagen Ⅳ和FLi-1相比,主间质区分更明显(图3)。34例表达collagen Ⅳ,阳性率为97.1%,镜下观察阳性部位集中在细胞边缘的基膜位置,使肿瘤细胞呈棋格状分布(图4),相比HE染色更能清楚的显示细胞边界(图5),实性型尤为明显。collagen Ⅳ抗原修复强烈建议使用胃酶修复,实验曾尝试不同的修复方法,选择经0.01 mmol/L pH 6.0枸橼酸钠缓冲液微波沸煮修复时仅1例达满意效果。24例表达FLi-1,阳性率为68.6%,与以往FLi-1表达在血管内皮的细胞核部位不同,本组实验发现FLi-1同时表达在血管球瘤细胞的细胞核和细胞质(图6),但是细胞核阳性强度相比其中的血管内皮细胞染色强度为弱(图7)。FLi-1在血管瘤型的血管球瘤中阳性率最高,在其他两个亚型中的阳性率差异无显著性(表2)。相比手工操作,FLi-1经全自动免疫组化仪染色后,细胞质的阳性颗粒会更明显。其他免疫组化结果:35例血管球瘤中vimentin和SMA均呈(+),2例CD34呈局灶(+),1例desmin呈(+),EMA、S-100、CgA、CD68及CD99均呈(-)。
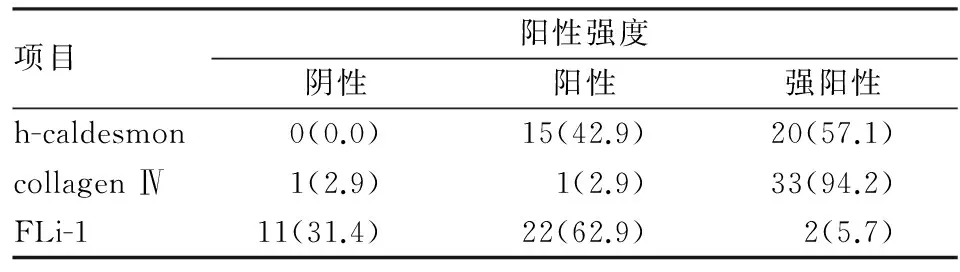
表1 35例血管球瘤免疫组化结果[n(%)]
2.3血管球瘤组织学类型与临床特征的关系患者性别及肿物的体积与血管球瘤的不同组织学类型之间无相关性(P>0.05),而患者年龄与血管球瘤的组织学类型之间有显著相关性(P=0.01,表3)。
3 讨论
血管球是一个神经动脉化学感受器,分布在微动静脉吻合管周围,可以敏感的调节体温和小动脉的血流量。血管球瘤最早于1812年由Wood首先描述,当时称之为“痛性皮下结节”,随之有一些类似的报道,直至1924年Masson认为该种肿瘤来源于神经肌动脉球(血管球),并命名为“血管球瘤”。后来通过对血管球瘤的电镜下特征进行观察,结果显示血管球瘤有平滑肌分化特点,胞质含有微肌丝、梭形致密体,相邻细胞间有连结结构,细胞周围有基膜。目前WHO定义瘤细胞是一种与正常血管球细胞体中修饰的平滑肌细胞非常类似的细胞,WHO(2002)软组织肿瘤分类将其列入血管周细胞性肿瘤。
①②③④⑤⑥⑦
图1镜下见肿瘤细胞成片分布于血管之间,瘤细胞呈规则圆形,细胞质淡染图2h-caldesmon在肿瘤细胞中呈弥漫阳性,EnVision法
图3h-caldesmon表达在肿瘤细胞和间质成分中界限清晰,EnVision法图4collagen Ⅳ在肿瘤细胞中呈阳性,EnVision法图5肿瘤细胞周围collagen Ⅳ呈强阳性,但间质成分同样呈阳性,使主间质分界不够清晰,EnVision法图6FLi-1同时表达于肿瘤细胞胞质和胞核,EnVision法图7间质中的血管内皮细胞FLi-1的表达强于肿瘤细胞,EnVision法
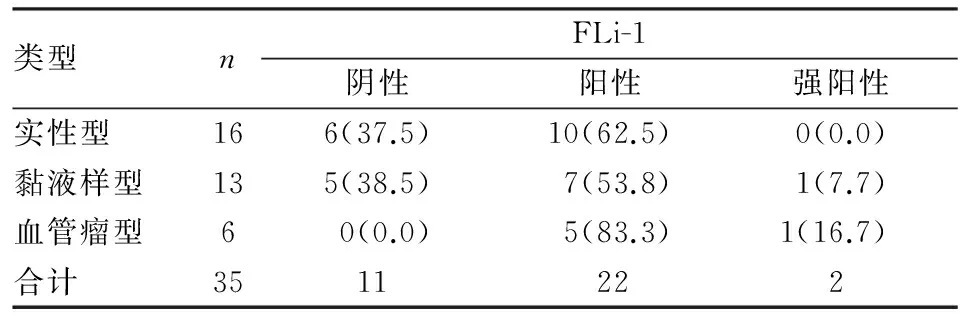
表2 FLi-1在血管球瘤不同组织学分型中的表达[n(%)]
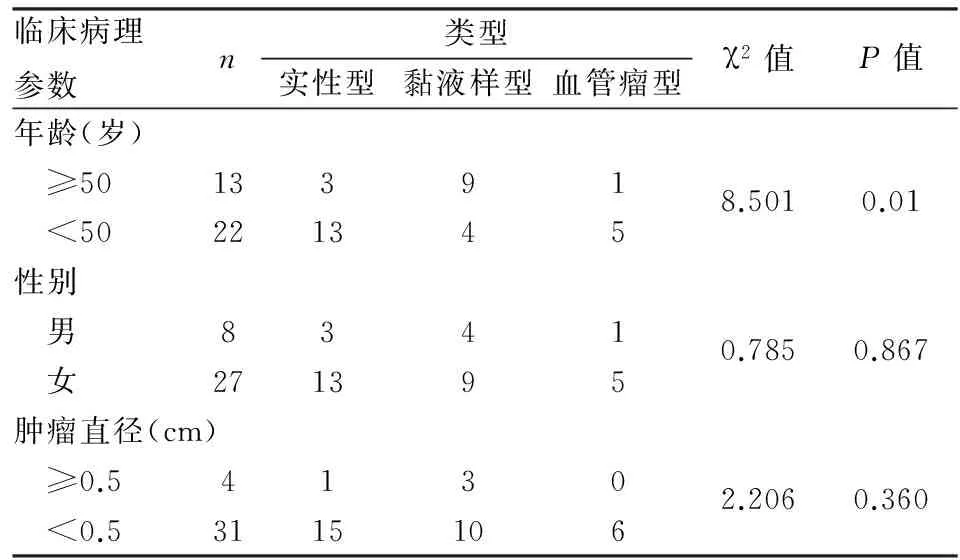
表3 血管球瘤组织学类型与临床病理特征的关系
血管球瘤比较少见,占软组织肿瘤的2%,好发于20~40岁,女性多于男性,身体的大部分组织器官均可发生,最好发于手部甲下,约占全身的75%。90%的血管球瘤为单发,多发性血管球瘤常发生于青年男性,且多无疼痛[1],多发性血管球瘤常具有遗传性,与常染色体1p21.1不全外显有关[2]。
关于血管球瘤的组织学分类目前并不完全一致,WHO(2002)软组织肿瘤将其分为实体型血管球瘤、球血管瘤和球血管肌瘤3个类型,也有其他文献将其分为实性型、黏液样型和血管瘤型[3]。根据日常工作的体会,作者认为采用后一种分类方法更便于掌握,另外,作者观察无论哪种分型均只是从组织学观察上的区分,对肿瘤的免疫组化表达和预后无显著差异,但是如果按照后一种分类方法,其中的黏液样型患者平均年龄比其余两种类型较大,推测可能是该类患者的病史较长,肿瘤发生黏液变性所致。
血管球瘤需与以下肿瘤鉴别:(1)肌周皮细胞瘤(myopericytoma):多发生于皮下,常累及肢体远端,表现为皮下缓慢生长的无痛性结节,组织学形态由相对一致的卵圆形及短梭形肌样细胞分布于大小不一的血管周围,局部可见多层肌样细胞围绕血管呈同心圆状或漩涡状生长,有时与血管球瘤难以区分[4],鉴别诊断主要依靠病理形态和临床资料综合分析。(2)孤立性纤维性肿瘤(solitary fibrous tumor, SFT):可发生于躯体多个部位,经典的SFT瘤细胞多呈无结构性或无模式性生长(patternless pattern),可见特征性“鹿角”状分支血管,免疫组化表达CD99和CD34,血管球瘤一般不表达。(3)血管瘤样纤维组织细胞瘤(angiomatoid fibrous histiocytoma, AnFH):好发于儿童和青少年四肢浅表部位的间叶性肿瘤,由结节状、不规则成片或呈巢的梭形至卵圆形组织细胞样细胞组成,肿瘤内含有多灶性出假血性腔隙,肿瘤主要表达EMA、CD99和desmin[5],CD68主要标记肿瘤内的组织细胞,借此可与血管球瘤鉴别。(4)神经内分泌肿瘤:好发于胃肠道,肿瘤细胞呈实性巢片状,由纤细的纤维血管分隔,细胞质呈嗜酸性颗粒状,免疫组化表达CgA及Syn等神经内分泌标志物,不表达SMA,血管球瘤偶可表达Syn[6],但不表达其他神经内分泌标志物。
FLi-1是ETS转录因子家族中的一员,最早由Ben-David等在Friend病毒诱导的红白血病细胞中发现。正常生理条件下,FLi-1主要在造血干细胞和血管内皮细胞中表达,参与调控定向造血干细胞和祖细胞的增殖与分化[7],其过表达能够促进血液性肿瘤和实体性肿瘤的发生[8]。研究发现,在尤因肉瘤、非霍奇金淋巴瘤和乳腺髓样癌中,过表达的FLi-1能促进以上肿瘤的发展,证实了FLi-1不仅在血细胞和血管生成中起重要作用,而且还具有促进肿瘤发生、发展的作用。
钙结合蛋白(caldesmon)是一种与平衡肌收缩调节相关的特异蛋白,分为低分子量钙结合蛋白和高分子量钙结合蛋白两种亚型。h-caldesmon只存在于内脏和脉管的平滑肌细胞和肌上皮细胞中,研究表明,h-caldesmon可以结合肌动蛋白、肌球蛋白、原肌球蛋白和降钙素,通过这种结合来调节肌肉收缩[9]。主要用于肌源性肿瘤及肌纤维母细胞瘤的鉴别诊断。
collagen Ⅳ是基膜的主要网状支架结构,以往偏重于对其物理结构的研究及其对组织的支撑分隔作用,后来发现collagen Ⅳ分子结构中也存在重复序列及复杂的多功能位点机构,可以控制调节肿瘤细胞的黏附、增殖和迁徙过程。
有研究结果表明,在血管球瘤免疫表型中虽然存在变异性,但均有h-caldesmon的表达;肿瘤细胞周围有丰富的基膜,有collagen Ⅳ的表达,对诊断和鉴别诊断有一定的价值[10]。本组实验对35例血管球瘤进行h-caldesmon免疫组化染色,均呈阳性,与文献报道一致,而collagen Ⅳ免疫组化染色,除1例以外,其他病例肿瘤细胞周围均出现明显的阳性,显示出细胞周围的基膜结构。FLi-1在血管球瘤中的表达存在差异性,从无表达到强阳性。
通过观察比较,h-caldesmon在血管球瘤中表达令人满意,细胞表达的分布有一定的特点,在靠近血管周围的肿瘤细胞中阳性最强,而后向外阳性强度逐渐减弱,在距离血管较远位置的细胞甚至出现失表达;除此以外,h-caldesmon在体积较大的肿瘤细胞相比体积较小的肿瘤细胞阳性更强。collagen Ⅳ因为表达在肿瘤细胞周围的基膜,因而更能清楚地显示出肿瘤细胞的边界,因间质中以及血管周围也有基膜成分存在,可能会在肿瘤细胞的实际观察中造成干扰,不如h-caldesmon主间质明显区分,这一点略有欠缺。另外在观察中发现,在某些血管球瘤内的部分细胞出现一定的异型性,表现为细胞核增大,轻度深染,形状多样,但无核分裂和坏死,在这些细胞周围collagen Ⅳ表达明显减弱,提示细胞周围的基膜成分显著减少,推测这一现象是因为肿瘤细胞退变所致,关于这一问题还有待进一步的研究。在血管球瘤的三种亚型中FLi-1的阳性标记更强,因为其本身为血管内皮的标志物,因此更能显示出肿瘤血管的分布。总体而言,collagen Ⅳ染色效果最好,h-caldesmon在主间质中分布更加清晰,FLi-1在血管内皮结构中更清楚。
本实验采用免疫组化法检测了血管球瘤中FLi-1、h-caldesmon和collagen Ⅳ的表达,观察三种抗体各自染色的特点,旨在比较这些抗体在血管球瘤中表达的差异,探讨其在血管球瘤诊断中的作用。结果提示,h-caldesmon和collagen Ⅳ均是可靠的血管球瘤诊断的标志物,FLi-1可作为一种辅助参考标志物,有助于血管球瘤的诊断。
[1] Sammaniego E, Crespo A, Sanz A. Key diagnostic features and treatment of subungual glomus tumor[J]. Actas Dermosifiliogr, 2009,100(10):875-882.
[2] Perry A W, Sosin M, Weissler J M,etal. Multiple glomus tumors presenting as an aesthetic abnormality[J].Aesthetic Plast Surg, 2015,39(2):236-239.
[3] 施作霖, 黄良祥, 唐秀如. 13例血管球瘤光镜和免疫组织化学观察[J]. 中华病理学杂志, 1994,23(4):241.
[4] 张宏图, 陈素萍, 郭 蕾, 等. 血管球肿瘤8例临床病理学观察[J]. 临床与实验病理学杂志, 2008,24(1):54-57.
[5] 武彤彤, 胡维维, 杨清绪, 赖日权. 血管瘤样纤维组织细胞瘤6例临床病理分析[J]. 临床与实验病理学杂志, 2013,29(7):761-764.
[6] Miettinen M, Paal E, Lasota J,etal. Gastrointestinal glomus tumors: a clinicopathologic, immunohistochemical, and molecular genetic study of 32 cases[J]. Am J Surg Pathol, 2002,26(3):301-311.
[7] Li Y, Luo H, Liu T,etal. The ets transcription factor Fli-1 in development, cancer and disease[J]. Oncogene, 2015,34(16):2202-2231.
[8] Gao P, Yuan M, Ma X,etal. Transcription factor Fli-1 positiverly regulats lipopolysaccharide-induced interleukin-27 production in macrophages[J]. Mol Immunol, 2016,71:184-191.
[9] Walther S, Strittmatter F, Roosen A,etal. Expression and alpha1-adrenoceptor regulation of caldesmon in human prostate smooth muscle[J]. Urology, 2012,79(3):745.e5-12.
[10] Gombos Z, Zhang P J. Glomus tumor[J]. Arch Pathol Lab Med, 2008,132(9):1448-1452.

