阳性血培养瓶里“失踪”的肺炎链球菌
周世娟

[摘要]目的 探讨如何鉴定阳性血培养瓶里“失踪”的肺炎链球菌(Streptococcus pneumoniae,S.pn)。方法 采用靶向DNA测序(16S rRNA基因扩增)的方法最后鉴定出“失踪”的细菌。结果 “失踪”的细菌被鉴定为肺炎链球菌。结论 依据靶向DNA测序(16S rRNA基因扩增)鉴定可及时、准确鉴定出因自溶死亡的肺炎链球菌,启示微生物检验程序中血培养报阳后应立即涂片、转种平板,并结合血培养生长曲线、涂片染色结果作进一步的分析等,以提高血培养的阳性检出率,有利于减少漏报及误报的发生。
[关键词]16S rRNA;测序;肺炎链球菌;自溶
[中图分类号] R446.5 [文献标识码] A [文章编号] 1674-4721(2017)01(c)-0126-03
[Abstract] Objective To explore how to identify the disappeared Streptococcus pneumoniae in positive blood culture flask.Methods By targeted DNA sequencing (16S rRNA gene amplification),the disappeared bacterium was finally identified.Results The disappeared bacterium was identified as Streptococcus pneumoniae.Conclusion By targeted DNA sequencing (16S rRNA gene amplification) identification can detect the Streptococcus pneumoniae dead due to autolysis.It is indicated that in the process of bacteriological examination,smear and transmission to plate combined with growth curve and smear results of blood culture are performed right away after blood culture being positive.Together with growth curve of blood culture and outcomes of smear staining,further analysis is needed in order to increase positive detection rate of blood culture and reduce occurrence of report in fail and mistake.
[Key words]16S rRNA;Sequencing;Streptococcus pneumoniae;Autolysis
血流感染(blood stream infection,BSI)是一种严重的全身感染性疾病,包括菌血症和败血症,是致病菌或条件致病菌侵入血液中生长繁殖并释放毒素和代谢产物而引起的急性重症感染性疾病,其发病率和致死率都较高[1]。全球每年约发生200 000例BSI,病死率为20%~50%,是最严重的感染性疾病之一[2]。美国每年约有750 000例患者患血源性感染,导致215 000例死亡,是美国第十大死因,占总死亡人数的6%[3-4]。在儿童患者中,革兰阳性菌引起的BSI病毒死率达19.2%,革兰阴性菌引起的BSI病死率为45.2%,真菌菌血症则为35.8%。在医院感染中,BSI占15%,不仅延长了患者的住院时间,还增加了患者的经济负担[2]。
血培养是临床判断患者BSI的最重要依据[1]。所以实验室对阳性血培养瓶分离鉴定出病原菌,对临床感染性疾病的诊断起了决定性的作用。目前血培养病原菌的鉴定主要依赖转种分离得到纯菌后,才可进一步做细菌的鉴定。对于一些苛养菌、固体培养基不生长细菌的鉴定就比较困难,提高警惕,以防漏报、误报。现将本室在血培养检测工作中的1例阳性血培养瓶中细菌的神秘“失踪”后的辗转鉴定过程报道如下。
1资料与方法
1.1一般资料
2016年4月,患者男,65岁,肿瘤科新入院肺癌患者,不规则发热1周余,偶有咳嗽、喘憋、呼吸增快、呼吸困难等,入院查体,体温38.3℃,血常规:WBC 20.46×109/L,中性粒细胞百分比96.7%,C-反应蛋白58.96 mg/L,降鈣素原9.66 mg/ml,抽取单瓶血需氧培养送微生物室做检查(本微生物室尚未开展厌氧培养)。
1.2检测用仪器、试剂
仪器:Versa TREK-96全自动血培养仪(美国TREK公司);Olympus CX21显微镜(奥林巴斯公司);CO2培养箱WJ-Ⅲ-50B型(上海跃进医疗器械有限公司);普通培养箱WS2-134-65型(上海跃进医疗器械有限公司);3730XL测序仪(ABI公司)等。
试剂:血平板(广州迪景微生物科技有限公司)、巧克力平板、麦康凯平板(法国梅里埃)等;快速革兰染液、抗酸染液(珠海贝索公司)、瑞氏染液(杭州天和微生物试剂有限公司);需氧血培养瓶(美国TREK公司配套);肺炎链球菌抗原检测试剂(美国Binax NOW公司)。
1.3质量控制
革兰染色采用省临检中心提供的质控菌株金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922标准菌株分别做阳性、阴性质控对照,其他项目室内质控都在控。
1.4接收标本后鉴定流程
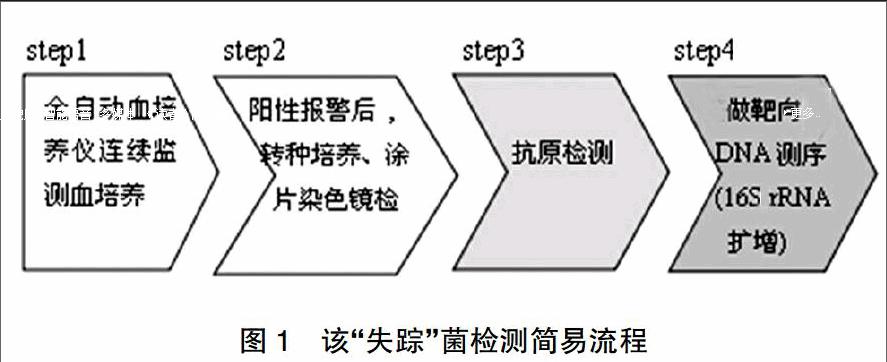
简易流程见图1。
第1天:标本采集与培养方法参照《血培养检测规范化操作》[5]进行标本的正确采集并将其快速置于全自动血培养仪中进行连续振荡培养和监测,未见阳性报警。
第2天:早上8:00上班时将阳性报警瓶(曲线典型)卸出,见瓶内上清呈轻微混浊,后无菌操作抽取培养液转种血平板、巧克力平板(35℃,5%CO2孵箱)、麦康凯平板(35℃孵箱),阳性瓶内容物涂片同时进行革兰染色镜检为革兰阴性成对排列球菌(图2)。
第3天:转种培养后的血平板、巧克力平板、麦康凯平板均无菌生长;重新将报警阳性瓶内容物涂片进行革兰染色、抗酸染色、瑞氏染色后均无菌,前1 d涂片看见的G-成双排列球菌却神秘“失踪”了,重抽取阳性报警瓶(瓶内上清变澄清)中原始培养物注入新的血培养瓶(传代培养瓶)上全自动血培养仪继续监测培养,再将原阳性报警瓶重新转种培养至血平板、巧克力平板、麦康凯平板。原阳性培养液瓶上清澄清,仅见管底留有少许米黄色沉淀。另取出肺炎链球菌抗原检测板,抽取阳性报警瓶中原始培养物2 ml,离心取上清,用配套的Binax棉签蘸取上清标本加入到试剂模孔内,往孔内滴入3滴试剂A,静止15 min后读取结果为阳性。“失踪”菌疑为肺炎链球菌因“自溶”而死亡消失概率大,遂立即将原阳性血培养瓶上送广州金域检验中心进行靶向DNA测序鉴定。
第4天后:传代培养瓶监测培养期间未见阳性报警,卸下瓶内澄清,未见沉淀,涂片镜检未见细菌;重新转种培养后的血平板、巧克力平板、麦康凯平板仍无菌生长。
2结果
该原阳性血培养瓶第2天涂片“昙花一现”见“影”——G-成对排列球菌后,第3天后就“无影无踪”,遂加做阳性报警瓶中原始培养物肺链抗原检测为阳性(目标锁定为肺炎链球菌和缓症链球菌)[6],并将有少许米黄色沉淀的原阳性报警瓶上送广州金域检验中心做基因测序,有效序列经分析显示与肺炎链球菌的相似度为100%。由此真相大白:阳性血培养瓶“失踪”菌为肺炎链球菌,因“自溶”使菌体从“有影”到“无踪”。
回顾性检查全自动血培养仪中该阳性血培养瓶的初报阳时间为接收标本次日凌晨1:30报警,但因条件所限(本室晚上无夜班轮岗)没及时转种,次日8:00(距离初报阳>6.5 h)上班同事才处理阳性血培养瓶,涂片可见G-成对排列球菌,而第3天转种未见细菌生长及原阳瓶重涂片细菌却“失踪”了,传代培养瓶进行连续监测培养,未见阳性报警,种种迹象符合蔡婷婷等[7]的报道结果:肺炎链球菌阳性报警后6 h为革兰阴性球杆菌,在阳性报警后可在8~10 h内自溶死亡。我室在阳性报警6.5 h后方进行转种、涂片染色等处理,错过最佳处理时间。
3讨论
1881年肺炎链球菌首次由巴斯德(Louis Pasteur)及G.M.Sternberg分别在法国及美国从患者痰液中分离出。肺炎链球菌常定植于人体呼吸道,尤以鼻咽部最常见,罗小铭等[8]报道中山地区正常人群鼻咽部肺炎链球菌携带率为26.6%,少年儿童鼻咽部携带率较成人高。由此可见呼吸道黏膜对肺炎链球菌存在很强的自然抵抗力。随着各种血液留置导管的介入,临床抗菌药物的广泛应用和大量免疫受损宿主的出现,各种原因使机体抵抗力下降时易发生侵袭性肺炎链球菌疾病,包括菌血症、败血症、脑膜炎、脓胸、骨髓炎等[9]。在化脓性球菌中,肺炎链球菌的致病力仅次于金黄色葡萄球菌。刘德华等[1]报道从2013~2014年全国细菌耐药监测网云南地区28家三级医院的14 519株血培养阳性菌株中肺炎链球菌110株,构成比占0.76%。本病例为肺癌患者,机体抵抗力低下,易受侵袭。
肺炎链球菌属链球菌科,链球菌属。肺炎链球菌是革兰阳性菌,肺炎链球菌菌体为革兰阳性,呈矛头状,多成双排列(故亦称为肺炎双球菌),宽端相对,尖端相背,有较厚荚膜(有毒株在体内形成荚膜:普通染色时荚膜不着色,表现为菌体周围透明环),无鞭毛,不形成芽胞。当菌体衰老时,或由于自溶酶的产生将细菌裂解后,可呈现革兰染色阴性[2]。本菌为苛养菌,营养要求较高,需在含血液或血清的培养基中生长。在固体培养基上形成小圆形、隆起、表面光滑、湿润的草绿色菌落。培养初期菌落隆起呈穹隆形,随着培养时间的延长,细菌产生的自溶酶裂解细菌,使菌落中央凹陷,边缘隆起呈“脐窝状”或火山口状。在血清肉汤中培养稍久亦因细菌自溶而使混浊的培养液渐变澄清[10]。
肺炎链球菌本身存在自溶的特性,主要原因是其自溶素(细胞壁水解酶,autolysin of S.pn,LytA)通过裂解-N-乙酰胞壁酰-L-丙氨酸,导致细胞壁肽聚糖骨架断裂,使细胞壁坍塌,最终导致细胞溶解死亡[11],过程中会引起菌体革兰染色特性的改变(G+→G-),见图2。肺炎链球菌当生长进入稳定期后会立即引起溶菌[12],表现在培养24 h左右使血平板菌落中心塌陷呈脐窝状,在液体培养基随着培养时间的延长溶解死亡而使培养基澄清,仅见管底留有少许沉淀。蔡婷婷等[7]研究肺炎链球菌在阳性血培养瓶报警后6 h革兰染色镜检为G-球杆,并在8~10 h内自溶死亡。所以及时转种阳性血培养瓶是减少肺炎链球菌漏检的关键。
以前,肺炎链球菌的鉴定只能依赖对分离的活菌采用传统方法:菌落形态(自溶现象、脐窝状菌落、宽大草绿色溶血环)、革蘭染色特征(G+,菌体呈矛头状,多呈双排列,宽端相对,尖端相背,有较厚荚膜)及奥普托欣敏感试验、菊糖阳性试验、血清学试验和胆盐溶菌试验等[13-14]进行鉴定。随着医学检验技术的飞速发展,鉴定此菌检验方法也日新月异,如自动化细菌鉴定仪、肺炎链球菌抗原试验、乳胶凝集试验、分子生物学检测(质谱技术及基因测序)等。本菌当面临转种后无活菌生长时,用传统方法鉴定已不可能,只能选择免疫分析及遗传学方法补救鉴定。Petti等[6]对于阳性血培养瓶中的疑似肺炎链球菌标本,选用免疫层析试条检测肺炎链球菌抗原发现缓症链球菌与肺炎链球菌有交叉反应,特异性不够强。因此,最后选择遗传学——分子生物学的诊断方法[2],如靶向DNA测序(16S rRNA基因扩增)鉴定。细菌16S rRNA的相对分子量大小适中,约1500 bp,适合序列分析,又因其含有对所有细菌种及可变区的广泛区段[15]。因此16S rRNA基因成为细菌系统分类鉴定的理想靶序列,也广泛被细菌学家和分类学家接受和使用。在DNA序列分析中,16S rRNA最常用于鉴定细菌的种,鉴定快速、简便、特异性好,是目前对在临床苛养菌以及固体培养基不生长细菌进行鉴定、检测和新菌种发现方面最可靠的方法之一[2]。
综上所述,血培养是当前BSI病原学诊断的“金标准”,通过对本院1例血培养中肺炎链球菌自溶现象的阐述,启示在微生物检验过程序中时常会出现一些假阳性及假阴性结果,各实验室应建立一个有效的减少漏报及误报情况的机制,如建议临床双瓶送检培养;建立微生物室预警机制,报警后立即涂片、转种平板,并结合血培养生长曲线、涂片染色结果行进一步的分析等,有利于防止如本案例肺炎链球菌假阴性培养的发生,提高血培养的阳性检出率,减少漏报及误报的发生。
[参考文献]
[1]刘德华,张红娟,杜艳,等,14519例血流感染病原菌构成及耐药分析[J].中国抗生素杂志,2016,41(2):137-143.
[2]周庭银,倪语星,王明贵,等.血流感染实验诊断与临床诊治[M].2版.上海:上海科学技术出版社,2014:168-171.
[3]Martin GS,Mannino DM,Eaton S,et al.The epiderniology of sepsis in the United States from 1979 through 2000[J].N Engl J Med,2003,348(16):1546-1554.
[4]Kung HC,Hoyert DL,Xu J,et al.Deathsfinal data for 2005[J].Natl Vital Stat Rep,2008,56(10):1-120.
[5]徐英春,倪语星,王金良.血培养检测规范化操作[M].上海:上海科学技术出版社,2012.
[6]Petti CA,Woods CW,Reller LB.Streptococcus pneumoniae antigen test using positive blood culture bottles as an alternative method to diagnose pneumococcal bacteremia[J].J Clin Microbiol,2005,43(5):2510-2512.
[7]蔡婷婷,屈平华,穆小萍,等.连续监测血培养系统中肺炎链球菌自溶特点分析[J].临床检验杂志,2013,31(12):945-947.
[8]罗小铭,古有婵,梁建平,等.中山市正常人群鼻咽部肺炎链球菌的携带情况调查[J].中国微生态学杂志,2002,14(4):223-224.
[9]李遲佳,王亚亭.侵袭性肺炎链球菌疾病的研究进展[J].实用儿科临床染志,2010,25(10):776-778.
[10]陈东科,孙长贵.临床微生物学鉴定图谱[M].北京:人民卫生出版社,2016:136-159.
[11]邹琴,罗红.肺炎链球菌自溶素LytA研究进展[J].中国病原生物学杂志,2014,9(1):88-91.
[12]Maria JF,Jose MC,Mario R.The autolysin LytA contributes to efficient bacteriophage progeny reliase in Streptococcus pneumoniae[J].J Bacteriol,2009,191(17):5428-5440.
[13]尚红,王毓三,申子瑜,等.全国临床检验操作规程[M].4版.北京:人民卫生出版社,2015:656.
[14]张秀珍,朱德妹.临床微生物检验问与答[M].2版.北京:人民卫生出版社,2014:92-93.
[15]沈定树,周雪艳.诺卡菌属的分类与实验室检查[J].临床检验杂志,2010,28(1):57-58.
(收稿日期:2016-11-20 本文编辑:方菊花)

