林蛙油小鼠免疫调节作用的实验研究
王彦武+赵鹏+覃光球+何励+傅伟忠+张陆娟
[摘要]目的 探讨林蛙油对小鼠的免疫调节作用。方法 将240只小白鼠随机分为6个免疫群组,每个免疫群组40只。每个免疫群组根据人口服推荐剂量(5、10、20倍)设林蛙油低、中、高剂量组[分别为334、667、1334 mg/(kg·BW)]和阴性对照组,每组10只动物。按0.2 ml/(10 g·BW)的体积经口给予小鼠灌胃,每天灌胃1次,连续灌胃30 d后,进行各项免疫指标的测定。结果 林蛙油剂量组与阴性对照组比较能促进小鼠脾淋巴细胞增殖、转化作用(P<0.05),促进小鼠的迟发型变态反应(P<0.05),促进小鼠的抗体生成细胞增加及提高小鼠的血清溶血素水平(P<0.05),增强小鼠的单核-巨噬细胞吞噬能力(P<0.05),提高小鼠的NK细胞活性(P<0.05)。结论 林蛙油具有增强免疫力的功能。
[关键词]林蛙油;小鼠;免疫调节
[中图分类号] R-332 [文献标识码] A [文章编号] 1674-4721(2017)01(c)-0004-03
[Abstract]Objective To explore the effect of Oviductus ranae on the function of immunoregulation.Methods 240 mice were randomly divided into 6 groups of immune group,each group had 40 mice,each immune group was divided into low,medium and high dose group [334,667,1344 mg/(kg·BW)] and negative control group according to recommended oral dose (5,10,20 times) of Oviductus ranae 10 rats in each group.The mice were given intragastric administration according to volume of 0.2 ml/(10 g·BW),intragastric administration was given 1 time a day,and the immune indexes were measured after continuous intragastric administration of 30 d.Results The results of Oviductus ranae dose groups in comparison with the negative control group showed that proliferation and transformation of splenic lymphocyte were enhanced (P<0.05);promoting mice late hairstyle allergy (P<0.05);quantity of mice antibody-producing cell and sheep erythrocyte antibody levels in serum were raised(P<0.05);mononuclear celiac macrophage phagocytic activity were increased (P<0.05);the activity of NK cells in mice was inhanced(P<0.05).Conclusion It is suggested that Oviductus ranae can enhance immune function.
[Key words]Oviductus ranae;Mice;Immunoregulation
林蛙油(oviductus ranae)又叫雪蛤油、蛤蟆油,特指中国林蛙长白山亚种雌哈蟆的输卵管。林蛙油具有生津润肺、益胃健脾、益精补肾等功效,其营养保健价值极高。现代医学研究表明,林蛙油具有增强免疫力、抗衰老、抗氧化、抗疲劳、调节血脂、抗焦虑等多种作用[1-5]。目前国内报道中关于林蛙油免疫调节作用的文献不少[6-8],但均局限于细胞免疫功能检测,对体液免疫功能检测报道不足。本实验通过细胞免疫和体液免疫等方面检测的全面研究,为评价林蛙油对小鼠的免疫调节作用提供实验依据。
1材料与方法
1.1受试物
林蛙油由黑龙江省五常市某营养品有限公司送检,受试物的成人每日口服推荐折合剂量为66.7 mg/(kg·BW)。
1.2动物
采用健康KM种小白鼠240只,雄性,体重18~22 g,SPF级,广西医科大学实验动物中心提供。动物实验使用许可证号:SYXK(桂)2011-0005。本动物试验经过广西壮族自治区疾病预防控制中心伦理审查委员会认可。
1.3主要仪器与试剂
实验主要仪器设备包括酶标仪(美国贝斯特960)、二氧化碳培养箱(精密科仪L5410-220)、电子分析天平(赛多利斯BS224S)、半自动生化分析仪(日立KY-2000)、显微镜(徕卡DM6000B)等。
实验主要试剂包括ConA(Sigma);MTT(Sigma);RPMI1640培养液(赛默飞世尔);YAC-1细胞(上海素尔生物科技有限公司);DNFB(天津市光复精细化工研究所,批号080908);印度墨汁(北京天佑达生物工程科技有限公司,批号12/2011);绵羊红细胞(SRBC)及补体(豚鼠血清):由本实验室制备等。
1.4實验方法
先将动物随机分组,每40只小鼠为1个免疫群组,共6个免疫群。每个免疫群组根据人口服推荐剂量(5、10、20倍)设林蛙油低、中、高剂量组[分别为334、667、1334 mg/(kg·BW)]和阴性对照组,每组10只动物。动物灌胃按0.2 ml/(10 g·BW)玉米油的体积给予,每天灌胃1次,连续灌胃30 d。
参照文献《保健食品检验与评价技术规范》[9]相关试验方法进行下列七项检测:采用MTT法检测ConA诱导的小鼠脾淋巴细胞转化能力和耳肿胀法检测迟发型变态反应2项细胞免疫功能检测;采用Jerne改良玻片法检测抗体生成细胞数和血凝法检测血清溶血素水平2项体液免疫功能检测;采用小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法)和小鼠碳廓清实验2项单核-巨噬细胞吞噬功能检测;NK细胞活性检测采用乳酸脱氢酶测定法。
1.5观察指标
①小鼠体重及增重,进行脏器/体重比值测定;②小鼠脾淋巴细胞的增殖能力,用加ConA孔的吸光度(D570)值减去不加ConA孔的D570值表示;③DTH的程度,以左右耳重量之差值表示;④空斑數表示抗体生成细胞数;⑤观察血球凝集程度计算抗体积数;⑥每只小鼠腹腔液制片后,油镜下计数100个巨噬细胞,计算腹腔巨噬细胞对鸡红细胞的吞噬率和吞噬指数;⑦称取肝、脾脏重量,测定注入墨汁后的静脉血D600值,计算碳廓清吞噬指数(a);⑧测定反应孔、自然释放孔、最大释放孔值(D490),计算NK细胞活性。
1.6统计学方法
采用SPSS 16.0统计软件对数据进行方差分析,计量资料用均数±标准差(x±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2结果
2.1受试物对小鼠体重和脏器/体重比值的影响
受试物各剂量组的小鼠每期体重、体重增重、胸腺/体重及脾脏/体重比值与阴性对照组间比较,差异均无统计学意义(P>0.05)(表1),提示受试物对小鼠的体重增长和免疫器官重量无明显影响。
2.2受试物对小鼠细胞免疫的影响
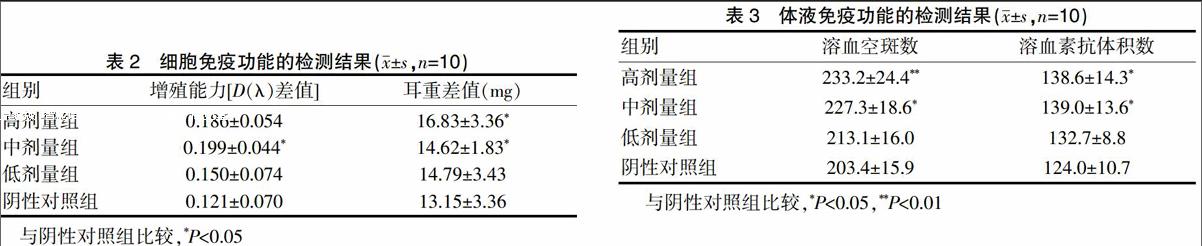
小鼠脾淋巴细胞转化能力实验中受试物各剂量组的增殖能力[D(λ)差值]高于阴性对照组,其中中剂量组与阴性对照组比较,差异有统计学意义(P<0.05)。迟发型变态反应实验中受试物各剂量组的左右耳片重量差值高于阴性对照组,其中高、中剂量组与阴性对照组比较,差异有统计学意义(P<0.05)(表2)。
2.3受试物对小鼠体液免疫的影响
抗体生成细胞数检测中受试物各剂量组的溶血空斑数均高于阴性对照组,其中高、中剂量组与阴性对照组比较,差异有统计学意义(P<0.05)。血清溶血素水平检测中受试物各剂量组的溶血素抗体积数高于阴性对照组,其中高、中剂量组与阴性对照组比较,差异有统计学意义(P<0.05)(表3),提示体液免疫试验结果阳性。
2.4受试物对小鼠单核-巨噬细胞吞噬功能的影响
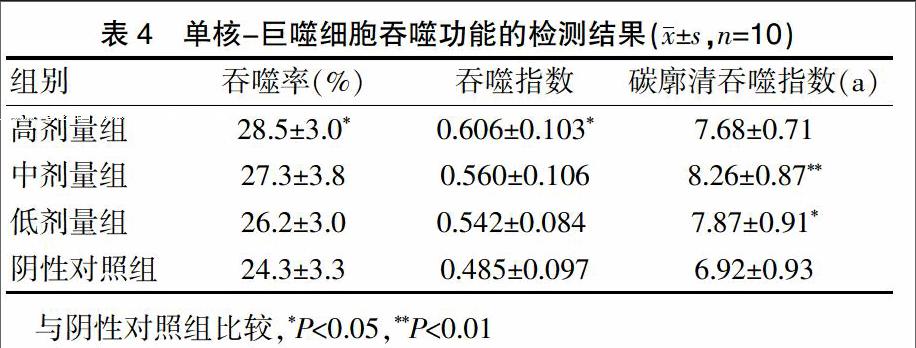
吞噬鸡红细胞实验中受试物各剂量组小鼠的腹腔巨噬细胞对鸡红细胞的吞噬百分率和吞噬指数均高于阴性对照组,其中高剂量组的吞噬百分率和吞噬指数与阴性对照组比较,差异有统计学意义(P<0.05)。小鼠碳廓清实验中受试物各剂量组的碳廓清吞噬指数高于阴性对照组,其中中、低剂量组与阴性对照组比较,差异有统计学意义(P<0.05)(表4)。
2.5受试物对小鼠NK细胞活性的影响
受试物各剂量组的NK细胞活性高于阴性对照组,在经转换数据后的统计比较中,高、中剂量组与阴性对照组比较,差异有统计学意义(P<0.05)(表5)。
3讨论
研究结果表明,林蛙油营养成分中包含粗蛋白(>50%)、脂肪酸、核酸、且富含多种维生素、微量元素及氨基酸。生物活性成分包括三碘甲状腺原氮酸、甲状腺素、促绒毛膜性腺激素、雌二醇、孕酮、睾酮等等[10-12]。睾酮和雌二醇分别是雄性激素和雌性激素中生理作用最强的激素,具有显著的调节机体作用和滋阴强肾激发免疫功能。林蛙油含丰富的氨基酸和蛋白质,且含有矿物质和大量的维生素,是一种广谱免疫调节剂和增效剂,可以提高T细胞和吞噬细胞活性[8]。
谢程等[13]研究了免疫功能低下和增强小鼠免疫器官均萎缩,在免疫过度增强时,免疫器官也受到一定损伤。本实验研究中,受试物剂量组的小鼠脏器/体重比值未出现差异,提示林蛙油对正常小鼠免疫器官重量无明显影响。本实验研究中,667 mg/(kg·BW)剂量组能明显促进小鼠的脾淋巴细胞增殖(P<0.05)及1334、667 mg/(kg·BW)剂量组明显促进了小鼠的迟发型变态反应(P<0.05),显示提高了T淋巴细胞介导的细胞免疫,与顾红缨等[7]报道的结果一致。林蛙油能明显增加外周血T淋巴细胞的酯酶染色率,能提高特异性细胞免疫功能[14];提高小鼠的血清溶血素水平和分泌抗体的抗体生成细胞数,从而提高B淋巴细胞介导的体液免疫[15]。本实验研究还对单核-巨噬细胞吞噬功能及NK细胞活性等方面进行了探讨,结果提示林蛙油具有增强免疫力的功能。林蛙油中含有一定量的激素以及生物效应的多样性,对于林蛙油的安全性、功效和分子机制还有待进一步的深入研究。
[参考文献]
[1]王春清,郑华艳,吕树臣,等.中国林蛙卵的药理作用及开发利用[J].黑龙江畜牧兽医,2016,2(1):131-132.
[2]包玉晓.林蛙油化学成分的研究进展[J].畜牧兽医杂志,2009,28(3):37-38.
[3]金伟,欧兵,谢惠萍,等.林蛙油软胶囊缓解体力疲劳功能的研究[J].中国热带医学,2010,10(10):1230.
[4]鲍悦,姜威,刘冬,等.中国林蛙的药理研究进展[J].中国现代中药,2016,18(8):1077-1080.
[5]梁磊,张绪慧,周毅,等.哈蟆油胶囊对衰老模型小鼠生殖器官的保护作用[J].南方医科大学学报,2008,28(6):982-985.
[6]顾红缨,林卓,徐云,等.蛤蟆油调节小鼠细胞免疫功能的实验研究[J].吉林中医药,2010,30(12):1103-1104.
[7]朱红秋.人参蛤蟆油胶囊细胞免疫调节作用的实验研究[J].中国卫生工程学,2012,(2):107.
[8]朱红秋.人参蛤蟆油胶囊细胞免疫调节作用的实验研究[J].中国卫生工程学,2012,11(2):107-108.
[9]卫生部.保健食品检验与评价技术规范[Z].2003:22-34.
[10]李梁,范宁,刘少华,等.东北林蛙卵活性成分及药理活性研究进展[J].医药导报,2016,35(4):363-366.
[11]胡鑫,刘成柏,陈晓平,等.林蛙油中主要营养保健成分含量的研究[J].吉林农业大学学报,2003,25(2):218-220.
[12]白云,杨晓英.中国林蛙油中睾酮的含量测定[J].黑龙江医学,2003,16(2):97-99.
[13]谢程,张兰杰.蛤蟆油对免疫功能低下或增强小鼠的免疫调节作用[J].中国老年学杂志,2010,30(21):3132-3133.
[14]白雪松,宋春梅,杜鹃,等.林蛙油研究进展[J].吉林医药学院学报,2009,30(4):227-229.
[15]王彦武,赵鹏,高玉秋,等.国产玛咖小鼠免疫调节作用的实验研究[J].海峡药学,2016,28(8):43-45.
(收稿日期:2016-11-16 本文编辑:方菊花)

