低剂量脂多糖对哮喘小鼠T淋巴细胞产生IL—17的影响
雷盛钦+胡水婷+程丽+黄小燕
[摘要]目的 探讨低剂量脂多糖(LPS)刺激对哮喘小鼠T淋巴细胞产生IL-17的影响及其机制。方法 复制哮喘小鼠模型,体外分离培养脾脏来源的T淋巴细胞,分为对照组和LPS组,其中LPS组又分为LPS1组和LPS2组,分别以1、2 ng/ml的LPS体外刺激T细胞72 h。对照组以生理盐水代替LPS。采用ELISA法检测细胞培养上清液中的IL-17水平,观察IL-17的水平浓度变化。结果 以低剂量LPS刺激哮喘小鼠T淋巴细胞后,其培养上清液中IL-17的水平较对照组明显降低,差异有统计学意义(P<0.01)。结论 低剂量LPS可以抑制哮喘T细胞IL-17的分泌,可能与机体的免疫耐受相关。
[关键词]脂多糖;哮喘小鼠;T细胞;白介素-17
[中图分类号] R-332 [文献标识码] A [文章编号] 1674-4721(2017)01(c)-0120-03
[Abstract]Objective To explore the influence of LPS with low dosage on the secretion of IL-17 and the potential mechanism.Methods The asthma mouse model was copied successfully and the T cells from spleen were isolated and cultured in vitro,and the mice were divided into the control group and the LPS group.The mice in LPS group were divided into the LPS group 1 and the LPS group 2,and were stimulated with 1,2 ng/ml LPS respectively for 72 hours.The control group was stimulated with the same volume of saline.The concentrations of IL-17 in the supernatant were detected with ELISA,the change of concentration of IL-17 was observed.Results After stimulation with lower dosages of LPS,the secretion of IL-17 in the supernatant decreased significantly in the LPS groups than that in the control group,with significant difference (P<0.01).Conclusion Low dosage of LPS can inhibit the secretion of IL-17 in T cells of asthma,and it may be related with immune tolerance.
[Key words]Lipopolysaccharide;Asthma mice;T cell;Interleukin-17
支氣管哮喘是全球常见的慢性疾病之一,是由T细胞、B细胞、嗜酸粒细胞、肥大细胞等多种炎症细胞和细胞因子参与的慢性气道炎症性疾病[1-2]。T细胞及其亚群如Th2细胞分泌的细胞因子如白介素-4(interleukin-4,IL-4)、IL-5、IL-13、IL-17等直接参与了哮喘的炎症过程,进而诱发哮喘的一系列症状[3]。IL-17是一种主要由CD4+T淋巴细胞、嗜酸粒细胞等分泌的前炎性细胞因子,具有强大的募集中性粒细胞及促进多种炎性因子释放的作用,参与了机体多种炎症性疾病的发生、发展[4-5],在哮喘的慢性气道炎症过程中,也发挥着重要的作用[6]。本实验利用低剂量脂多糖(lipopolysaccharide,LPS)在体外刺激哮喘小鼠T细胞,检测其IL-17的产生情况,探讨低剂量LPS诱导IL-17的产生及哮喘T淋巴细胞免疫耐受的可能机制。
1材料与方法
1.1主要试剂及仪器
RPMI 1640培养基、胎牛血清(Hyclone公司),Al(OH)3(A8222,Sigma公司),鸡卵清蛋白(A5503,Sigma公司),尼龙毛柱(Cat.146-04231,日本Wako公司),小鼠红细胞裂解液(碧云天公司),小鼠IL-17 ELISA试剂盒(Diaclone公司),倒置显微镜(日本Nikon),Eppendorf离心机,流式细胞仪(美国Beckman Coulter公司),雾化器(boyo37G6000型,德国百瑞公司),空气压缩泵(德国百瑞公司)。
1.2实验动物与分组
BALB/c小鼠15只,清洁级,4~6周龄,体重20~30 g,雌雄不限,随机分为两组,对照组5只,LPS组10只,其中LPS组又分为LPS1组和LPS2组,各5只。小鼠购自温州医学院实验动物中心,在普通清洁条件下饲养,自由取水、摄食。
1.3哮喘小鼠模型的制作
10只LPS组小鼠分别于第1、14天致敏,即经小鼠腹腔注射OVA 10 μg与Al(OH)3凝胶20 mg的混合液,总体积200 μl;第25天开始,将小鼠放置于容积为5 L的密闭容器中,通过连接雾化吸入器的空气压缩泵,以3%的OVA气溶胶激发小鼠,30 min/次,1次/d,总共3次。5只正常对照组小鼠以等量的生理盐水代替OVA致敏及激发。最后1次激发后48 h处死小鼠,收集标本。
1.4 T细胞的体外分离培养
无菌状态下分别切除各组小鼠脾脏,剪碎过100目钢网,收集细胞混悬液,过T细胞尼龙毛柱,放置于37℃,5%CO2培养箱中孵育1 h,再用RPMI 1640冲洗尼龙毛柱,即得到分离、纯化的T细胞。流式细胞仪检测CD3,检测T细胞纯度。按实验要求重新调整T细胞浓度为1×106/ml。
1.5 LPS体外刺激T细胞
取24孔培养板,每孔加入哮喘小鼠脾脏来源的T细胞1×106/ml(共1 ml),再分别加入终浓度为1、2 ng/ml的LPS生理盐水溶液,对照组以0.1 ml生理盐水替代加入。以上各组均设20个复孔。置培养板于5% CO2、37℃细胞培养箱中培养72 h后,取上清液测其IL-17水平。
1.6 ELISA法测定IL-17水平
按照说明书步骤进行。加100 μl标准对照、待测样品和空白对照(样品稀释液)到已包被好的培养板孔内,37℃孵育90 min;洗板,每孔加入50 μl抗体,混合30 s,37℃孵育60 min;洗板,每孔加入50 μl抗体,混合30 s,37℃孵育60 min;洗板,每孔加入50 μl抗体,混合30 s,37℃孵育60 min;洗板,用50 μl终止液终止显色,10 min内用酶标仪在450 nm波长处测定光密度值。
1.7统计学处理
采用SPSS 11.5统计学软件对数据进行分析,计量资料以x±s表示,不同组别间数据比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2结果
2.1 T细胞的培养和鉴定
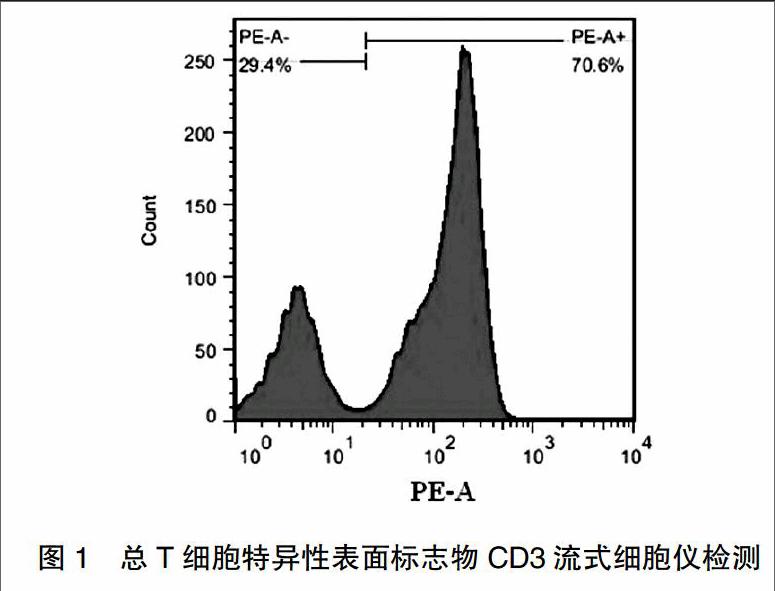
流式细胞仪检测总T细胞特异性表面标志物CD3,结果如图1所示,经尼龙毛柱法分析获得的T细胞的纯度为70.6%,可以满足本次实验的需要。
2.2低剂量LPS对T细胞分泌IL-17的影响
对照组的IL-17水平为(10.48±1.47)pg/ml,LPS1组的IL-17水平为(9.34±1.63)pg/ml,LPS2组的IL-17水平为(9.57±1.66)pg/ml。与对照组相比,低剂量LPS(LPS1组、LPS2组)刺激哮喘T淋巴细胞后,其细胞培养上清液中的IL-17水平下降,差异有统计学意义(P<0.01)。
3讨论
支气管哮喘的发病机制复杂,多种免疫细胞及细胞因子参与了其中的病理过程[7],其中T细胞及其亚群发挥非常重要的作用,是造成哮喘炎症反应和各种临床症状的根源[8-9]。T细胞在抗原肽、主要组织相容性复合物分子的相互作用下,被抗原提呈细胞活化,然后增殖、分化成各种效应T细胞,分别分泌相应的细胞因子发挥各种功能[10]。
近年来有学者提出哮喘免疫调节机制的“卫生假说”,其核心是Th1/Th2细胞因子的平衡学说。该学说认为,哮喘的发生是Th2细胞过度活化,释放较多的Th2细胞因子,而Th1细胞因子表达不足使Th1/Th2平衡失调[11]。根据此理论,当哮喘小鼠模型建成后,其血清中与Th2细胞相关的细胞因子水平如IL-4、IL-5、IL-13、IL-17等应该上升,但是在本实验中,低剂量LPS刺激哮喘小鼠T淋巴细胞后,其培养上清液中的IL-17水平下降,低于对照组,可能的机制是低剂量LPS短期刺激可能抑制DC细胞的成熟,从而阻断Th2细胞的活化,进而阻止变态反应性疾病的发生、发展。莫碧云等[12]的研究显示,LPS通过激活Toll样受体4在哮喘气道炎症和气道重塑过程中发挥双相调节作用,这与本课题研究结果一致。
研究显示,支气管哮喘患者肺组织中IL-17A+CD4+细胞增加,证实了Th17細胞群的存在,IL-17和Th17细胞在支气管哮喘的发病机制中发挥重要作用。Th17细胞及其分泌的IL-17A、IL-17F、IL-22均参与了支气管哮喘的发病。李贱等[13]的研究结果显示,与健康对照组相比,哮喘患者中Th17细胞数量升高,其分泌的IL-17水平亦升高。进一步的研究发现,与轻度、中度、重度哮喘相比,IL-17升高的水平与支气管哮喘的严重程度成正比。涂国华等[14]的研究显示,哮喘患者痰液中IL-17A和IL-8 mRNAs水平显著升高,提示Th17细胞以及IL-17A通过IL-8导致了哮喘中的中性粒细胞炎症。痰液中的IL-17A增加也与哮喘中支气管高反应性有关[15]。痰液中IL-17A增加也是重度哮喘的独立危险因素[16]。
气道上皮细胞分泌的IL-17可以促进淋巴细胞和巨噬细胞浸润以及黏液分泌增加。IL-17基因沉默后,小鼠Th2细胞因子的产生明显增加,嗜酸粒细胞功能明显增强,提示Th17与Th2之间可能存在分化拮抗作用[17]。在IL-17家族细胞因子中,IL-17A和IL-17F与哮喘严重程度和肺部中性粒细胞募集的关系最密切[18]。
在本实验中,与对照组相比,经低剂量LPS处理后T细胞没有发生明显的凋亡,其原因可能是LPS与T细胞在体外培养的时间较短,T细胞尚未发生凋亡,但T细胞处于对变应原不反应的状态,因此Th2细胞因子如IL-17等生成减少。
综上所述,低剂量LPS可以诱导哮喘免疫耐受,为哮喘的免疫治疗提供理论依据,但是其中具体的机制还有待更加深入和全面的研究。
[参考文献]
[1]王丹丹,柴若楠,戚菲菲,等.Ⅱ型固有淋巴细胞在支气管哮喘发病机制中作用的研究进展[J].中华微生物学和免疫学杂志,2016,36(8):634-638.
[2]何旗,王凌伟,邱晨.microRNA与支气管哮喘的研究进展[J].广东医学,2016,37(14):2196-2199.
[3]Shalaby KH,Martin JG.Overview of asthma;the place of the T cell[J].Curr Opin Pharmacol,2010,10(3):218-225.
[4]朱双桂,陈强.IL-17与过敏性疾病[J].中华临床医师杂志(电子版),2011,5(7):2032-2035.
[5]陈啸洪,李华浚,姚欢银,等.外周血Th17和CD4+CD25+调节性T细胞变化与患儿支气管哮喘活动状态的相关性研究[J].中国全科医学,2015,18(7):969-971.
[6]蔡正维,王敏,李蓓,等.IL-17的生物学作用及其与哮喘的关系[J].临床肺科杂志,2011,16(3):429-430.
[7]Vijverberg SJ,Koenderman L,Koster ES,et al.Biomarkers of therapy responsiveness in asthma:pitfalls and promises[J].Clin Exp Allergy,2011,41(5):615-629.
[8]黄伟强,李惠,袁梅,等.支气管哮喘患者外周血T细胞亚群Th1、Th2及其相关细胞因子水平变化及意义[J].山东医药,2015,55(20):40-41.
[9]董玉红,史应进,宋玉娥.支气管哮喘患儿血清白细胞介素-17与白细胞介素-23的变化[J].中国医刊,2015,50(1):87-89.
[10]Lloyd CM,Hessel EM.Functions of T cells in asthma:more than just T(H)2 cells[J].Nat Rev Immunol,2010,10(12):838-848.
[11]Siwiec J,Zaborowski T,Jankowska O,et al.Evaluation of Th1/Th2 lymphocyte balance and lipopolysaccharide receptorexpression in asthma patients[J].Pneumonol Alergol Pol,2009,77(2):123-130.
[12]莫碧文,张贞貞,韦江红,等.脂多糖对哮喘大鼠气道炎症、气道重塑及TLR4表达的影响[J].中国应用生理学杂志,2013,29(2):153-157.
[13]李贱,邹朋成,杨莉容,等.Th17细胞在哮喘发病中的作用研究进展[J].中国呼吸与危重监护杂志,2013,12(3):322-324.
[14]涂国华,钱金强,易阳,等.小剂量依托红霉素对哮喘患儿痰液中性粒细胞及血清白介素-8、白介素-17的影响[J].临床儿科杂志,2012,30(5):431-434.
[15]高惠,罗征秀,刘超,等.支气管哮喘患儿诱导痰IL-17水平分析[J].重庆医科大学学报,2011,36(9):1094-1096.
[16]魏颖,董竞.Th17在支气管哮喘中的作用研究进展[J].中国医药生物技术,2015,10(2):157-160.
[17]娄春艳.IL-17在支气管哮喘气道重塑中的作用[J].国际儿科学杂志,2013,40(3):237-239.
[18]陈菲菲,黄茂.Th17细胞及IL-17在支气管哮喘发病机制中的作用[J].国际呼吸杂志,2013,33(21):1653-1656.
(收稿日期:2016-11-12 本文编辑:祁海文)

