欧前胡素与异欧前胡素同牛血清白蛋白相互作用研究∗
张宇洁,樊珊珊,张裕沛
(西安医学院 药学院,陕西 西安710021)
药物在进入人体内后会与体内的白蛋白发生不同程度结合,这种结合会延长药物在体内的停留时间,但同时也会使药物游离浓度减少,因此药物与白蛋白的结合会改变药物在体内的吸收、分布、代谢、排泄等过程。在临床上容易与白蛋白结合的药物,在体内的游离浓度较小,其代谢较慢,如果存在竞争结合作用的药物,将会大幅度增加其游离浓度,进而可能发生毒副反应。当游离药物在组织或血液中被代谢后,结合态药物与白蛋白通过发生解离来提高血液中游离药物的浓度,从而保证药物的疗效。因此出于对药物的安全性、有效性的考虑,研究药物与白蛋白作用具有非常重要的意义。
欧前胡素、异欧前胡素是同分异构体,都属于6,7-呋喃香豆素类,均具有抗菌、抗炎、镇痛、抗肿瘤、舒张血管活性等多种药理活性[1-3],目前有报道欧前胡素及异欧前胡素的药代动力学研究[4-5],但其与蛋白的作用尚未见报道。目前高效液相色谱与微透析技术联用[6-9],用于药物与白蛋白的结合作用及药物与蛋白的竞争结合研究较多。作者采用HPLC结合平衡透析法建立测定欧前胡素与异欧前胡素同牛血清白蛋白结合率的方法,为临床合理用药提供依据。
1 实验部分
1.1 试剂与仪器
欧前胡素对照品:批号14110724,异欧前胡素对照品:批号14110715,牛血清白蛋白:批号14081710,均为上海士锋生物科技有限公司;甲醇:色谱纯,其它试剂均为分析纯,均为天津科密欧化学试剂有限公司。
高效液相色谱仪:DIONEX P680,紫外检测器:DIONEX UVD170U,美国戴安;酸度计:E-201-9型,上海佑科仪器仪表有限公司。
1.2 溶液的配制
1.2.1 对照品溶液
精密称取欧前胡素与异欧前胡素对照品各10 mg,加甲醇溶解摇匀,制备成欧前胡素与异欧前胡素质量浓度为1.0 mg/m L的对照品,溶液于4℃冷藏备用。
1.2.2 牛血清白蛋白溶液
称取牛血清白蛋白适量,用二次蒸馏水溶解制成质量浓度为40 mg/m L的溶液,置于4℃冰箱中,备用。
1.3 样品的制备
分别精密量取异欧前胡素对照品溶液适量,加入袋外透析液中(透析液中加入0.005 g/m L的吐温80作为增溶剂),使透析外液的药物质量浓度分别为100、200、300μg/m L。
1.4 透析袋前处理
将透析袋剪成约10 cm长的小段,用0.02 g/mL Na HCO3和1.0 mmol/L EDTA的混合液,将透析袋煮沸10 min,用蒸馏水彻底清洗后用30%乙醇浸泡,于4℃保存备用,临用前再用蒸馏水将透析袋清洗干净。
1.5 样品的处理
取BSA 1.0 m L加至透析袋中,平行3份。将透析袋置于盛有20 m L含药PBS液的比色管中,37℃水浴震荡,透析至平衡,取透析平衡后的袋外透析液200μL,离心10 min,取上清液10μL进样,测定袋外透析液中的欧前胡素和异欧前胡素药物质量浓度,计算血浆蛋白结合率Fb=(ρtρf)/ρt×100%。其中,Fb为药物与蛋白的结合率;ρt为透析前透析液中药物的总质量浓度;ρf为平衡时透析液中游离药物的质量浓度。
1.6 色谱条件和系统适用性
色谱柱:250 mm×4.6 mm,5μm,流动相:V(甲醇)∶V(水)=70∶30,流速:1 mL/min,检测波长:280 nm,柱温:27℃,进样量:10μL,在此条件下测得欧前胡素与异欧前胡素的色谱图,见图1。
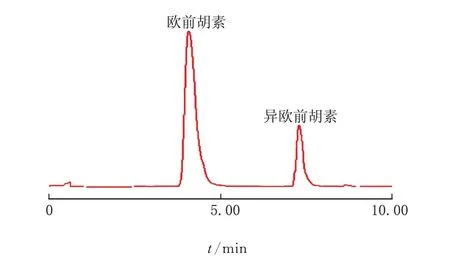
图1 欧前胡素、异欧前胡素高效液相色谱图
2 结果与讨论
2.1 方法学考察
2.1.1 标准曲线的绘制
分别精密量取不同质量浓度欧前胡素和异欧前胡素对照品溶液适量,用磷酸盐缓冲液(p H=7.4)稀释,分别制成0.01、0.05、0.1、0.2、0.3、0.4 mg/mL的系列质量浓度标准样品,取10μL注入HPLC中,在拟定的色谱分析条件下检测。以欧前胡素和异欧前胡素的质量浓度(mg/m L)为横坐标,峰面积为纵坐标进行线性回归,得回归方程如下。欧前胡素:y=222.37x+0.210 7,r=0.999 9(n=6),欧前胡素的线性范围0.01~0.4 mg/m L;异欧前胡素:y=121.31x+0.232 6,r=0.999 8(n=6),异欧前胡素的线性范围0.01~0.4 mg/m L。
2.1.2 精密度实验
分别吸取欧前胡素和异欧前胡素对照品溶液,用磷酸盐缓冲液(p H=7.4)配制成1.0 mg/m L的溶液,连续进样6次。计算欧前胡素和异欧前胡素的RSD值分别为0.5%和0.5%,
2.1.3 重复性实验
取平衡透析后的欧前胡素和异欧前胡素样品适量,连续进样6次,计算欧前胡素与异欧前胡素峰的RSD值为1.3%、1.2%。
2.1.4 稳定性实验
吸取欧前胡素和异欧前胡素对照品溶液,用磷酸盐缓冲液(p H=7.4)配制成1.0 mg/m L的溶液,37℃恒温箱放置,分别在配制后4、8、12、18、24 h取样测定,计算欧前胡素的RSD值为2.7%,异欧前胡素的RSD值为2.2%,表明在两种成分在24 h内稳定性良好。
2.1.5 回收率实验
吸取已知含量的同一质量浓度的样品6份,分别加入欧前胡素与异欧前胡素对照品各10μg,透析平衡后取10μL注入HPLC中,计算回收率。欧前胡素与异欧前胡素的回收率分别为99.5%,98.9%。结果详见表1。
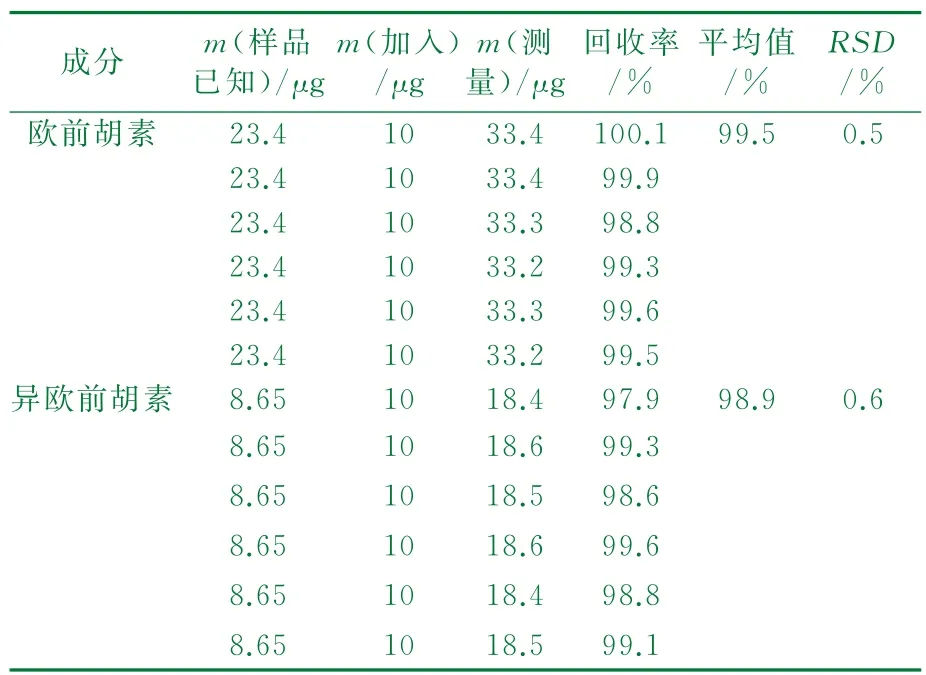
表1 加样回收率实验结果(n=6)
2.2 平衡透析结合HPLC实验
2.2.1 结合率和结合常数的计算方法
透析袋临用前在超纯水中浸泡5 min,取含药的20 m L透析液于比色管中,透析袋内加入BSA1.0 m L,透析袋扎紧后,放入上述比色管中。37℃恒温箱放置,直至结合态药物与游离态药物处于动态平衡。药物与蛋白的结合率计算方法与1.5相同。
2.2.2 透析平衡时间的确定
给透析袋内加入1 m L磷酸盐缓冲液,将其放入含药100μL和20 m L透析液的比色管中,使袋外的欧前胡素和异欧前胡素药物浓度分别为300、200、100μg/m L,37℃水浴振荡,分别于4、8、12、16、18、24 h测定药物的质量浓度。结果表明在12 h已达到了平衡,因此优化平衡透析时间为12 h。
2.2.3 蛋白结合率测定结果
透析平衡后测定ρf,根据公式(1),计算不同药物浓度下的血浆蛋白结合率Fb。结果详见表2。
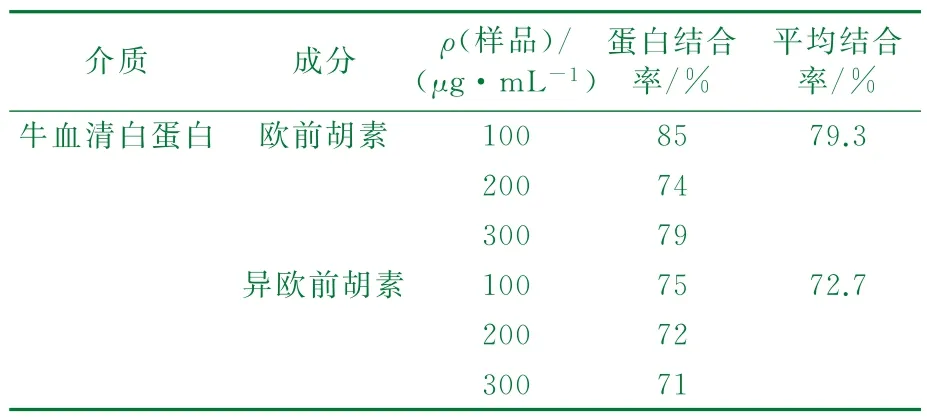
表2 蛋白结合率测定结果(n=3)
3 结 论
实验结果表明,欧前胡素的蛋白结合率在79.3%,异欧前胡素的蛋白结合率约72.7%,蛋白结合率均较高,因此该药物在临床应用时受患者病理状态或其它药物合用的交互作用可能有一定的影响,所以,同服其它药物时,应注意药物间与血浆蛋白的竞争性结合。
欧前胡素与异欧前胡素属于香豆素类化合物,难以溶于磷酸盐缓冲液,作者采用0.005 g/m L的吐温80作为增溶剂,由于时间问题未探讨吐温80是否对牛血清白蛋白产生影响,还有待进一步研究。
药物与白蛋白的结合作用及药物与蛋白的竞争结合研究除了高效液相色谱与微透析联用的技术,还有采用超滤法与高效液相色谱联用[10-11],毛细管电泳法[12-13],荧光光谱法[14],紫外-可见分光光度法[15]等,每种方法各有特点,各方法之间的区别还有待进一步研究。
[1] 杨小花,胡晓.欧前胡素与异欧前胡素的药理学研究进展[J].南昌大学学报(医学版),2012,52(3):95-97,100.
[2] KWON Y S,KOBAYASHI A,KAJIYAMA S,et al.Antimicrobial constituents of Angelica dahurica roots[J].Phytochemistry,1997,44(5):887-889.
[3] YANG PY,RUI Y C,LI K,et al.Expression of intercellular adhesion molecule-1 in U937 foam cells and inhibitory effect of imperatorin[J].Acts Pharmacol Sin,2002,23(4):327-330.
[4] 刘严宏,刘延平,耿雅杰,等.LC-MS/MS法同时测定犬血浆中延胡索乙素和欧前胡素及其在元胡止痛片药动学研究中的应用[J].中草药,2016,47(15):2668-2675.
[5] 陈丹霞,何志高,金丽,等.RP-HPLC法测定大鼠血浆中香柑内酯、欧前胡素和蛇床子素及其药动学研究[J].中国药房,2013,24(47):4433-4435.
[6] 任非,段坤峰,吴宗耀,等.高效液相色谱法测定芹菜素在不同血浆中的蛋白结合率[J].中国医院药学杂志,2012,32(9):678-682.
[7] 曹露晔,陈子君,李云森,等.高效液相色谱法研究蓝萼甲素与大鼠血浆蛋白的结合率[J].中草药,2007,38(5):693-695.
[8] 汪海林,邹汉法,张玉奎.微透析-液相色谱法研究药物与蛋白竞争结合[J].中国科学(B辑),1998,28(1):71-77.
[9] 曹旭,谢玉敏,朱迪,等.杜仲提取物中五个成分血浆蛋白结合率的测定[J].中国药理学通报,2015,31(1):13-15.
[10]张二锋,赵军利,杨 静,等.超超滤法和HPLC法测定14-去氧穿心莲内酯的血浆蛋白结合率[J].中成药,2016,38(3):689-691.
[11]刘鹏,陈莹.HPLC-超滤法测定雷公藤红素与家兔、大鼠、人血浆的蛋白结合率[J].中国药房,2015,26(1):62-64.
[12]刘春叶,张雪娇,苗延青,等.毛细管电泳法研究牛血清白蛋白与盐酸异丙肾上腺素的相互作用[J].分析科学学报,2015,31(3):313-317.
[13]钱凯,陈旭,陈沁.压力驱动亲和毛细管电泳法研究3种龙血素与人血清白蛋白的结合作用[J].分析测试学报,2015,34(9):1061-1065.
[14]邢惟青,黄鹏翔,丘玉昌,等.现代荧光光谱法在药物与蛋白相互作用研究中的应用[J].华西药学杂志,2011,26(5):503-507.
[15]陈毅挺,李艳霞,黄露.维生素K3的解离常数测定及其与牛血清白蛋白的相互作用[J].理化检验-化学手册,2016,52(1):61-65.

