参参康心胶囊对冠心病气虚血瘀证小鼠Notch1和Jagged1表达的影响
金永兰,刘喜平,张 炜,崔国宁,董俊刚,李沛清
(1.甘肃省人民医院,甘肃 兰州 730000;2.甘肃中医药大学,甘肃 兰州 730000;3.兰州大学第一医院,甘肃 兰州 730000)
参参康心胶囊对冠心病气虚血瘀证小鼠Notch1和Jagged1表达的影响
金永兰1,刘喜平2*,张 炜3,崔国宁2,董俊刚2,李沛清2
(1.甘肃省人民医院,甘肃 兰州 730000;2.甘肃中医药大学,甘肃 兰州 730000;3.兰州大学第一医院,甘肃 兰州 730000)
目的 观察参参康心胶囊对冠心病气虚血瘀证小鼠Notch1和Jagged1表达的影响。方法 采用游泳、高脂饲料饥饿饲养及垂体后叶素(Pituitrin;Pit)腹腔注射建立冠心病气虚血瘀证动物模型,检测小鼠心电图,统计心率及T波变化,蛋白质免疫印迹法(Western blot法)检测Notch1和Jagged1蛋白的表达,荧光定量PCR检测Notch1和Jagged1 mRNA的表达。结果 建立的动物模型中医证候评分符合气虚血瘀“证”的特征,心电图检测符合冠心病“病”的特征。模型组Notch1蛋白及其基因表达水平明显下降,Jagged1蛋白及其基因表达明显升高,与空白对照组比较有显著性差异(P<0.05);参参康心胶囊各剂量均可升高Notch1表达水平,降低Jagged1表达水平,以中剂量组最为显著(P<0.05)。结论 参参康心胶囊防治冠心病气虚血瘀证的机制可能与调节Notch信号通路中Notch1受体及Jagged1配体表达水平有关,中等剂量可能是最佳剂量。
参参康心胶囊;冠心病;气虚血瘀证;Notch1;Jagged1
参参康心胶囊源于名老中医验方,由水蛭等3味药物组成,经现代制药工艺加工而成,临床应用多年,对冠心病、心肌梗死等心肌损伤性疾病有显著疗效。我们以往的研究表明,该制剂可减轻阿霉素(Adriamycin,ADR)心肌毒性[1]致肌损伤及防治气虚血瘀型冠心病,其作用机理与抗氧化,清除氧自由基,调节ATP酶活性[2]减轻缺血造成的心肌线粒体水肿,阻止缺血心肌膜损伤,保护心肌超微结构[3],升高血清6酮前列腺素F1α(6-keto-prostaglandinF1α,6-keto-PGF1α)、一氧化氮(Nitric Oxide,NO)含量,降低血栓素B2(ThromboxaneB2,TXB2)、内皮素-1(Endothelin-1,ET-1)含量[4,5]有关。近年来研究发现Notch信号通路在调节心血管疾病的发生发展方面具有重要意义[6]。为了进一步揭示冠心病气虚血瘀证的证候本质,探讨参参康心胶囊防治冠心病的作用机理,本文观察了参参康心胶囊对冠心病气虚血瘀证小鼠Notch1和Jagged1表达的影响,以期为临床应用提供科学依据。
1 材料
1.1 实验动物
SPF级昆明小鼠,雌雄各半,体重(30±2)g,共90只。由甘肃中医药大学实验动物中心提供,动物许可证号:SCXK(甘)2011-0001-0001163。
1.2 实验用药
参参康心胶囊处方药材饮片吉林红参、参三七、水蛭购自兰州复兴厚药材有限责任公司,经甘肃中医药大学中药鉴定教研室景明教授鉴定符合《中华人民共和国药典》规定。以上3味药物,取水蛭超微粉碎成细粉;其余吉林红参、参三七两味,加水煎煮二次,每次45 min,合并二次煎液,滤过,滤液减压浓缩成相对密度为1.15~1.20(25℃)浸膏,喷雾干燥,收集细粉,与水蛭细粉充分混匀,干压法制粒,装入胶囊,即得。规格为每粒0.5 g(每粒相当于生药1 g),实验时用生理盐水溶解为120 mg生药/ml。地奥心血康胶囊(批号:1207010,成都地奥制药集团有限公司),垂体后叶素(批号:110624,安徽宏业药业有限公司)。
1.3 试剂及仪器
Green Master MIX荧光定量试剂盒(批号:00000740533,普洛麦格上海生物产品有限公司),EastepTM通用型总RNA提取试剂盒(批号:LS1OO,普洛麦格上海生物产品有限公司),RNAse-Exitus PLUS酶清除试剂(批号:OD008558,德国Applichem公司),PVDF蛋白转移膜(美国Amersham Piscataway),SDS-PAGE凝胶(美国Invitro Life Tech公司),HRP山羊抗兔二抗(美国Sigma公司),Notch1及 Jagged1抗体(批号:RMA0546,兰州维科生物工程有限公司),兔抗人GAPDH多克隆抗体及羊抗兔IgG(美国Novus公司),心电图机(ECG6511,上海光电医用电子仪器有限公司),超微量分光光度计(K5500,北京凯奥科技公司),超声波破碎仪(德国merck公司),PCR热循环仪(C1000,美国BIO RAD公司),凝胶成像分析仪(170-8170,美国BIO RAD公司)。
2 方法
2.1 分组及给药
将小鼠随机分为空白对照组、模型组、地奥心血康组、参参康心胶囊实验组(小剂量组、中剂量组、大剂量组),每组15只。参考文献[7]方法,除空白对照组给予正常饮食外,其余各组均采用游泳,并给予高脂饲料饥饿(正常小鼠饮食的60%)喂养4 w。参参康心胶囊实验组按60 kg成人常规剂量折算后作为中剂量组(3 g生药/kg体重),高剂量组为中剂量组放大一倍(6 g生药/kg体重),小剂量组为中剂量组缩小一倍(1.5 g生药/kg体重)。各剂量组每天灌胃2次,空白对照组及模型组每日给予相同体积的生理盐水,连续1 w,模型组按0.076 g/kg体重、1 ml/次灌胃。模型组及各用药组小鼠在第一w灌胃30 min后腹腔注射Pit(剂量30 u/kg体重)[8],空白对照组注射等体积生理盐水。
2.2 各组小鼠中医证候评分及心电图检测
方法[9],于注射Pit15 min后对各组小鼠进行气虚血瘀证的中医证候评价,气虚证的评分标准:(1)精神萎顿(3分),倦怠嗜睡(5分),对抗性、攻击性完全消失(7分);(2)毛发枯黄无润泽(3分),毛发结穗打卷(5分),毛发稀疏脱落(7分);(3)轻度稀便(3分),中度稀便(5分),重度稀便或黄绿褐色黏臭便(7分)。血瘀评分标准:(1)舌质暗淡(3分),舌质绛紫(5分);(2)眼球由淡红转为深红(3分),转为暗红(5分);(3)尾尖至根部出现轻度瘀血点(3分),尾尖至根部出现中度以上瘀斑(5分)。评分结束后进行戊巴比妥钠麻醉,取仰卧位,行心电图检测,观察心率和T波高度变化,并记录数据。
2.3 Western Blot法检测各组小鼠心肌组织Notch1和Jagged1蛋白的表达
各组小鼠心电图观察后,颈椎脱臼处死,立即摘取心脏,剪取小鼠心肌组织,超声波破碎仪粉碎组织,按每100 mg组织加1 ml预冷的蛋白提取试剂,4℃,15 000转离心15 min,超微量分光光度计测蛋白质浓度。蛋白定量后的各组样品等量上样,电泳。完成后,将SDS-聚丙烯酰胺凝胶(SDS-PAGE)移置于转移电泳槽内,制备转印蛋白夹层,将聚偏二氟乙烯膜(PVDF)置于阳极,添加适量转移用的缓冲液,于低温条件下将蛋白转移至PVDF膜上,后在4℃条件下用5%脱脂奶粉封闭液封闭1 h。去除封闭液,将转移了蛋白的PVDF膜分别与兔源抗小鼠的Notch1及Jagged1抗体(1∶1 000)4℃孵育过夜后,以TBST清洗3次,每次5 min。再加入辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔二抗(1∶500)室温下孵育1.5 h。以TBST漂洗4次,每次5 min,然后加Western Blot ECL显色液。以GAPDH(1∶2 000)作为内参照,在凝胶图像处理系统中曝光检测,并用Quantity One 4.2软件分析目标条带与CAPDH光密度比值,计算相对量。
2.4 荧光定量PCR检测小鼠心肌组织Notch1和Jagged1 mRNA的表达
取各组小鼠心肌组织,用PBS缓冲液及清水反复清洗干净,置于1 ml离心管中,电动研磨棒进行研磨,取30~50 mmg,按照试剂盒使用说明配成20 ml的RT反应体系,将配好的体系放到PCR扩增化设置25℃5 min,42℃60 min,70℃15 min进行cDNA逆转录合成反应。引物采用 Primer premier 5及Oligo 6生物软件设计,Notch1的上游序列为AATGGAGGGAG GTGCGAAGT,下游序列为TGCTGAGGCAAGGATTGGA;Jagged1的上游序列为TACCCCAGCCAGTGTCAACA,下游序列为TCTTGCCCTTCGCCTCTTC,以100 bp为目的基因片段长度,150 bp为内参片段长度,β-actin内参上游序列为AGGGAAATCGTGCGTGACAT,下游序列为GAACCGCTCGTTGCCAATAG。设置94℃4 min,94℃20 s,60℃30 s,72℃30 s,35个循环为荧光定量PCR扩增条件,取扩增好的目的基因和内参进行琼脂糖凝胶电泳。紫外分光光度计下拍照观察,凝胶成像分析仪计算目的基因的改变倍数,结果以2-⊿⊿Ct表示。
2.5 统计学方法
用SPSS 19.0统计软件对数据结果进行处理分析,数据以均数±标准差(±s)表示。采用单因素方差分析的方法,组间比较采用LSD与SNK法检验。以0.05为检验水准。
3 结果
3.1 各组小鼠中医证候评分及心电图变化
结果见表1、表2。模型组的动物气虚与血瘀证候积分明显升高,与空白对照组比较有显著性差异(P<0.01);参参康心胶囊各剂量均可降低气虚与血瘀证候积分,以中剂量组最为显著(P<0.01),与地奥心血康组比较有显著性差异(P<0.05)。模型组的心率加快,T波幅度下降,与空白对照组比较有显著性差异(P<0.05,P<0.01);参参康心胶囊各剂量均可升高T波幅度,降低心率,与模型组比较有显著性差异(P<0.05,P<0.01),与地奥心血康组比较有显著性差异(P<0.05,P<0.01),其中以中剂量组最为显著(P<0.05)。
表1 各组小鼠气虚血瘀中医证候评分(±s,分)
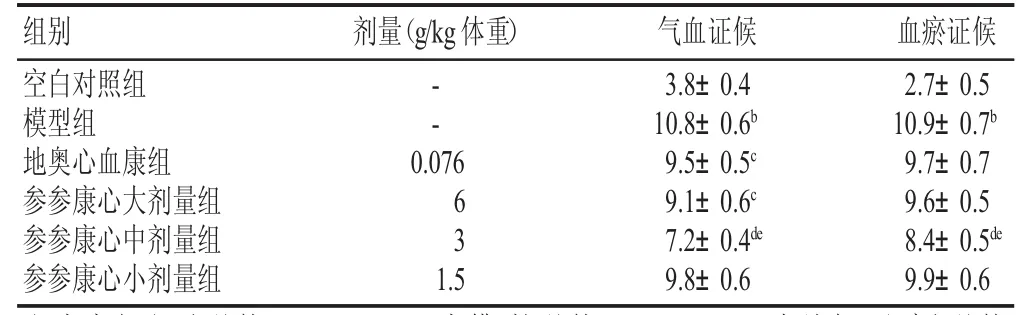
表1 各组小鼠气虚血瘀中医证候评分(±s,分)
注:与空白对照组比较aP<0.05,bP<0.01;与模型组比较cP<0.05,dP<0.01;与地奥心血康组比较eP<0.05(下同)
组别 剂量(g/kg体重)空白对照组模型组地奥心血康组参参康心大剂量组参参康心中剂量组参参康心小剂量组--10.8±0.6b10.9±0.7b0.076 63 1.5气血证候3.8±0.4 9.5±0.5c9.1±0.6c7.2±0.4de9.8±0.6血瘀证候2.7±0.5 9.7±0.7 9.6±0.5 8.4±0.5de9.9±0.6
表2 各组小鼠心电图变化(±s,n=15)
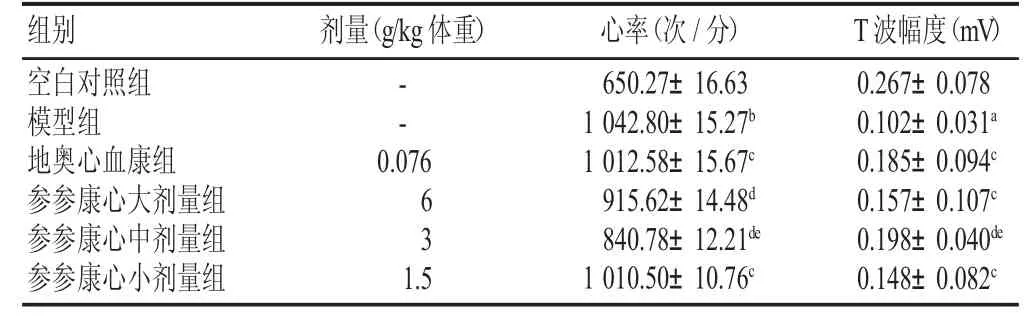
表2 各组小鼠心电图变化(±s,n=15)
组别空白对照组模型组地奥心血康组参参康心大剂量组参参康心中剂量组参参康心小剂量组剂量(g/kg体重) T波幅度(mV)0.267±0.078 0.102±0.031a0.185±0.094c0.157±0.107c0.198±0.040de0.148±0.082c--心率(次/分)650.27±16.63 0.076 1 042.80±15.27b1 012.58±15.67c63 915.62±14.48d840.78±12.21de1.51 010.50±10.76c
3.2 各组小鼠心肌组织Notch1和Jagged1蛋白表达的变化
结果见图1、表3。模型组Notch1蛋白表达水平明显下降,Jagged1蛋白表达明显升高,与空白对照组比较有显著性差异(P<0.05,P<0.01);参参康心胶囊各剂量均可升高Notch1蛋白表达水平,以中剂量组最为显著(P<0.05),与地奥心血康组比较无显著性差异;参参康心胶囊各剂量组均可降低Jagged1蛋白表达水平,以中剂量组最为显著(P<0.05),明显优于地奥心血康组(P<0.05)。

图1 各组小鼠心肌组织Notch1和Jagged1蛋白表达的变化
表3 各组小鼠心肌组织Notch1和Jagged1蛋白表达(s,n=15)
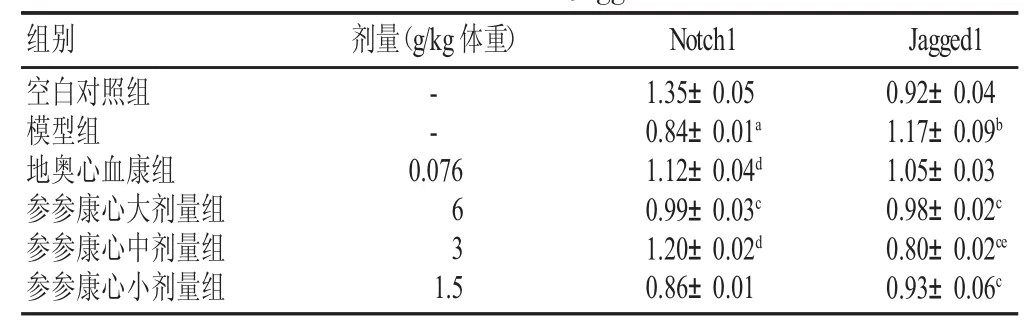
表3 各组小鼠心肌组织Notch1和Jagged1蛋白表达(s,n=15)
组别 剂量(g/kg体重)空白对照组模型组地奥心血康组参参康心大剂量组参参康心中剂量组参参康心小剂量组--0.076 63 1.5 1.35±0.05 0.84±0.01a1.12±0.04d0.99±0.03c1.20±0.02d0.86±0.01 Notch1 Jagged1 0.92±0.04 1.17±0.09b1.05±0.03 0.98±0.02c0.80±0.02ce0.93±0.06c
3.3 各组小鼠心肌组织Notch1和Jagged1 mRNA表达的变化
结果见表4。模型组Notch1蛋白表达水平明显下降,Jagged1蛋白表达明显升高,与空白对照组比较有显著性差异(P<0.05,P<0.01);参参康心胶囊各剂量均可升高Notch1蛋白表达水平,以中剂量组最为显著(P<0.05),与地奥心血康组比较无明显差异;参参康心胶囊各剂量组均可降低Jagged1蛋白表达水平,以中剂量组最为显著(P<0.05),明显优于地奥心血康组(P<0.05)。
表4 各组小鼠心肌组织Notch1和Jagged1 mRNA表达的变化(±s,n=15)
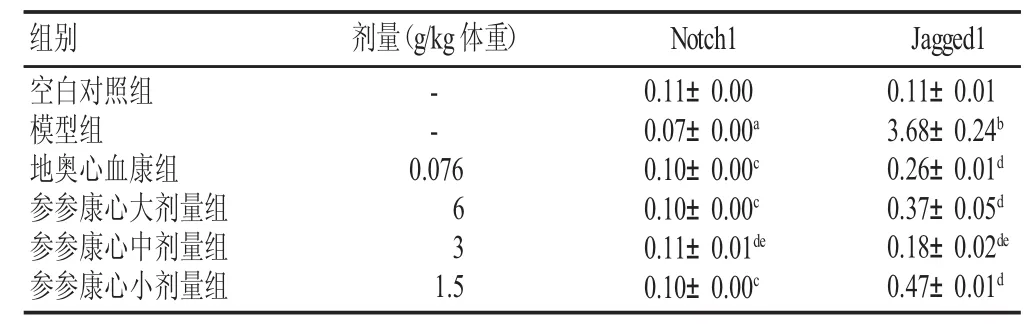
表4 各组小鼠心肌组织Notch1和Jagged1 mRNA表达的变化(±s,n=15)
组别 剂量(g/kg体重)空白对照组模型组地奥心血康组参参康心大剂量组参参康心中剂量组参参康心小剂量组--0.076 63 1.5 0.11±0.00 0.07±0.00a0.10±0.00c0.10±0.00c0.11±0.01de0.10±0.00cNotch1 Jagged1 0.11±0.01 3.68±0.24b0.26±0.01d0.37±0.05d0.18±0.02de0.47±0.01d
4 讨论
冠心病属中医“胸痹”“心痛”范畴。本虚标实为其病理特征,本虚责之于气、血、阴、阳不足,以心气不足最为突出,标实主要涉及气滞、血瘀、痰饮、寒凝、火热等病理产物或因素,以心络瘀阻为主。故气虚血瘀是冠心病的主要中医发病机制,益气养心,活血通络当为冠心病的基本治法。参参康心胶囊由红参、参三七、水蛭按一定比例组方,经现代制药工艺研制而成,方中以红参为君药,益气养心,使气旺促血行,祛瘀而不伤正;三七活血化瘀而又兼止血,既可祛瘀血,又不会使血液妄行,为臣药;佐以搜剔走窜之水蛭,以活血通络。全方药少力专,组方精炼,标本兼顾,使气旺以促血行,祛瘀而不伤正,共奏益气养心,活血通络之效。全方组方严谨,药少力专,尤其适宜于冠心病气虚血瘀证的治疗。我们以往的研究表明,该制剂可减轻阿霉素(ADR)心肌毒性[1]致肌损伤及防治气虚血瘀型冠心病,其作用机理与抗氧化,清除氧自由基,调节ATP酶活性[2]减轻缺血造成的心肌线粒体水肿,阻止缺血心肌膜损伤,保护心肌超微结构[3],升高血清6-keto-PGF1α、NO含量,降低TXB2、ET-1含量[4,5]有关。为了进一步揭示冠心病气虚血瘀证的证候本质,探讨参参康心胶囊防治冠心病的作用机理,本研究采用病证结合模型,观察了冠心病气虚血瘀证小鼠心肌组织Notch信号通路中Notch1和Jagged1表达的影响及参参康心胶囊的干预作用。
Notch信号通路在哺乳动物的包括心血管[10]在内的各组织器官中广泛表达。既往对于Notch的研究常局限于肿瘤及发育方面。近年来的研究提示Notch信号通路不但能够影响胚胎期心脏的发育成型[11],而且能够调节成年动物心血管疾病的发生发展[12]。Notch信号通路由Notch受体、Notch配体(DSL蛋白)、CSL(CBF-1,Suppressor of hairless,Lag的合称)DNA结合蛋白等组成。已知哺乳动物有 Notchl/2/3/4 4种 Notch受体和Deltal/2/3/4及Jaggedl/2等5种配体。其中,Jagged1是最早被证实的Notch配体,其广泛表达于多种组织中并发挥重要生物学作用[13],不但能够影响心血管的发生和发育过程,而且能够影响到各种疾病的发生发展[14],Jagged1可以与Notch1/2/3等多种受体结合[15],激活 Notch信号通路,进而激活 Hes1、Nur77及NF-κB等相关转录因子调节目的基因转录。
本研究采用游泳、高脂饲料饥饿饲养及垂体后叶素(Pit)腹腔注射建立的小鼠模型,中医证候评分符合气虚血瘀“证”的特征,心电图检测符合冠心病“病”的特征,较成功地建立了冠心病气虚血瘀证“病证结合”的动物模型。研究显示模型组Notch1蛋白及其基因表达水平明显下降,Jagged1蛋白及其基因表达明显升高,与空白对照组比较有显著性差异(P<0.05,P<0.01)。提示Notch信号通路中Notch1受体及Jagged1配体参与了心肌组织缺血缺氧的病理反应,冠心病气虚血瘀证可能与Notch信号通路中Notch1及Jagged1有一定的相关性。参参康心胶囊各剂量均可升高Notch1表达水平,降低Jagged1表达水平,以中剂量组最为显著(P<0.05),提示参参康心胶囊防治冠心病的机制可能与调节Notch信号通路中Notch1受体及Jagged1配体表达水平有关,中等剂量可能是参参康心胶囊干预冠心病气虚血瘀证的最佳剂量。
参考文献:
[1]吴红彦,张建刚,刘永琦,等.参参康心胶囊抗阿霉素心肌毒性的实验研究[J].中国实验方剂学杂志,2003,9(3):18-20.
[2]李沛清,王燕,刘喜平,等.参参康心胶囊对缺血小鼠心肌线粒体损伤的保护作用[J].中医药学报,2007,35(1):19-21.
[3]刘喜平,李沛清,刘勍,等.参参康心胶囊对小鼠缺血心肌线粒体超微结构及Na+、Mg2+、Ca2+含量的影响[J].中成药,2011,33(2):329-331.
[4]刘洁,白鹤,刘喜平,等.参参康心胶囊对冠心病气虚血瘀证模型小鼠TXB-2、6-keto-PGF-(1α)的影响[J].中医研究,2014,27(1):62-64.
[5]刘洁,白鹤,刘喜平,等.冠心病气虚血瘀证小鼠血清NO、ET-1的变化及参参康心胶囊的干预作用研究[J].光明中医,2014,29(3):486-488.
[6]Quillard T,Charreau B.Impact of notch signaling on inflammatory responses in cardiovascular disorders[J].International Journal of Molecular Sciences,2013,14(4):6863-6888.
[7]任建勋,林成仁.多因素复合刺激诱导建立大鼠气虚血瘀证动物模型的探索性研究[J].中国中药杂志,2011,36(1):72-76.
[8]赵明奇,刘艳,赵丹洋,等.通心络改善缺血心肌供血的NO机制研究[J].中国实验方剂学杂志,2003,9(6):43-45.
[9]尹军祥,田金洲,宋崇顺,等.气虚血瘀证动物模型制作方法与评价[J].中华中医药杂志,2006,21(7):424-426.
[10]Alessandro B,Konrad U,Angelo N,et al.Notch1 regulates the fate of cardiac progenitor cells[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(40):15529-15534.
[11]Paschalis K,Catarina C Ekaterina,et al.Distinct roles for cell-autonomous notch signaling in cardiomyocytes of the embryonic and adult heart[J].Circulation Research,2010,106(3):559-572.
[12]Zhao Jun L,Yurong T,Beecham G W,et al.Notch activation induces endothelial cell senescence and pro-inflammatory response:implication of Notch signaling in atherosclerosis[J].Atherosclerosis,2012,225(2):296-303.
[13]Varnum Finney,B Purton,L EYu,et al.The notch ligand,jagged-1,influences the development of primitive hematopoietic precursor cells[J].Journal of Maoming University,1998,36(7):577-584.
[14]Kamath B M,Bason L,Piccoli D A,et al.Consequences of JAG1 mutations[J].Journal of Medical Genetics,2003,40(12):891-895.
[15]Shimizu K,Chiba S,Kumano K,et al.Mouse Jagged1 Physically Interacts with Notch2 and Other Notch Receptors[J].Journal of Biological Chemistry,1999,274(46):32961-32969.
(*通讯作者:刘喜平)
R965
B
1671-1246(2017)01-0107-04
注:本文系甘肃省中医药英才基金项目(GZK-2010-53)

