桔橙小单孢菌产几丁质脱乙酰酶的酶学性质研究
王瑶,李永成*
(海南大学食品学院,海南海口570228)
桔橙小单孢菌产几丁质脱乙酰酶的酶学性质研究
王瑶,李永成*
(海南大学食品学院,海南海口570228)
从海边红树林虾场土壤中筛选的一株产几丁质脱乙酰酶(CDA)的放线菌桔橙小单孢菌(Micromonospora aurantiaca),研究其产CDA的酶学性质。结果表明,CDA的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳结果显示为单一条带,分子质量为81.8ku。最适pH值为7.0;最适温度为40℃;Ca2+对此CDA酶活有促进作用,而Cu2+、Zn2+、Mg2+表现出了抑制作用。CDA对虾壳来源的几丁质有明显的脱乙酰效果,红外光谱测得样品脱乙酰度由39.03%提高至78.40%。扫描电镜发现CDA酶解过的几丁质样品表面疏松多孔、出现凹槽、晶体消失,进一步印证了该酶的良好脱乙酰效果,也力证了该酶拥有较好的特性。
几丁质;脱乙酰酶;酶学性质;脱乙酰
几丁质又称甲壳素,是一种含氮多糖类物质,广泛存在于甲壳类(虾、蟹、昆虫等)动物的外壳及真菌细胞中。作为目前唯一发现的碱性多糖,几丁质性质独特,具有广泛的生物活性和良好的生物相容性[1]。几丁质和壳聚糖的差别在于N-脱乙酰度的不同,壳聚糖具有较高的脱乙酰度。不断的化学改性赋予其更多的功能,其降解后的低聚糖、氨基葡萄糖及各种壳聚糖显示出更丰富的活性。使得壳聚糖在食品、医疗、纺织等各领域都有广泛的应用。目前壳聚糖最新应用在抗肿瘤[2]、食品添加助剂[3]、药物载体[4]、功能性食品[5]等。壳聚糖的制备方法主要是化学法和酶法,但是化学法污染严重,酶法却避免了化学法带来的污染。
几丁质脱乙酰酶(chitin deacetylase,CDA)可将几丁质分子中的乙酰基直接脱去生成壳聚糖。目前,对不同来源CDA的报道有很多[6],如真菌、放线菌、蜗牛消化道等。酶的分离纯化[7-9]、酶的特征性质[7-9]、基因序列[9]等也有颇多文献进行报道。大多数报道也显示了不同来源的CDA,性质有所不同。
小单孢菌科菌(Micromonosporaceae)是一类分布广泛且具多种生物活性的稀有放线菌[10]。它不仅能产生庆大霉素、罗沙米星等多种抗菌抗生素还能产生一些具有独特结构的抗肿瘤抗生素[11]。目前,以放线菌小单孢菌科为来源研究几丁质脱乙酰酶(CDA)的不多,且小单孢菌是仅次于链霉菌的可以产生新型活性物质的重要来源,因此本实验对桔橙小单孢菌(Micromonospora aurantiaca)产CDA的酶学性质进行研究,对于以后CDA的应用及工业化生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
桔橙小单孢菌(Micromonospora aurantiaca),本实验室从海口东寨港红树林虾场土壤中筛选及鉴定,4℃条件下保存;虾壳来源的几丁质:北京基尼亚生物技术有限公司。1.1.2培养基
筛选培养基[12]:胶体几丁质0.25%;K2HPO40.07%;KH2PO40.03%;MgSO40.05%;NaCl 1.0%;对硝基乙酰苯胺0.2%;琼脂2.0%。
发酵培养基:葡萄糖0.5%;酵母浸膏1.0%;胶体几丁质0.03%;CaCl20.15%;NaCl 1.0%;pH7.0。
1.2 仪器与设备
T6新世纪紫外可见分光光度计:北京普析通用有限公司;TGL-16M离心机:上海卢湘仪;HZQ-X300C恒温振荡器:上海一恒科学仪器有限公司;Milipore Labscale切向流超滤系统:美国密理博公司;TENSOR27傅里叶红外光谱仪:德国布鲁克公司;S-3000N 30KV扫描电子显微镜:日本日立公司。
1.3 实验方法
1.3.1 胶体几丁质制备[13]
称取粉碎后的几丁质0.5 g,加20 mL预冷(4℃)浓HCl,磁力搅拌器搅拌至几丁质全部溶解(期间控温超声20min),加入200mL预冷蒸馏水和体积分数为95%乙醇混合液(1∶1,V/V)中,4℃静置过夜,次日将悬浮液以8 000 r/min离心10 min,沉淀用蒸馏水洗至中性,4℃保存备用。
1.3.2 酶液的制备
将活化后的橙黄小单孢菌菌株种子液按4%接种量接种于装液量为100 mL/500 mL的锥形瓶中,30℃、180 r/min培养84 h,过滤后发酵液经过Milipore Labscale切向流超滤系统(>10 ku)浓缩6倍,备用。
浓缩发酵液经硫酸铵沉、DEAE-纤维素离子层析及Sephadex G-100凝胶层析分离纯化,冷冻干燥后的样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳以检测此几丁质脱乙酰酶的纯度及分子质量。
1.3.3 几丁质脱乙酰酶(CDA)酶活测定方法[13]
酶活测定方法:10 mL具塞试管中加入1mL 200 mg/L的对硝基乙酰苯胺溶液、3mL 50 mmol/L的pH 7.0磷酸盐缓冲液,50℃水浴3 min,加入1 mL酶液,50℃水浴15 min,沸水浴终止酶促反应,加水定容至10 mL,若出现浑浊现象,在5 000 r/min条件下离心10 min,在波长400 nm处测定吸光度值。空白对照组添加1 mL灭活酶液,其余同上。
酶活的定义:在该反应条件下每小时产生1 μg对硝基苯胺所需要的酶量定义为1个酶活力单位(U/mL)。
1.3.4 几丁质脱乙酰酶的酶学性质
pH对CDA酶活的影响:测定CDA在pH4.0~10.0的酶活曲线,确定CDA的最适pH。其中pH4.0~6.0为100mmol/L柠檬酸缓冲液;pH7.0~9.0为100 mmol/L硼酸缓冲液;pH10.0为100 mmol/L碳酸盐-碳酸氢盐缓冲液。
温度对酶活的影响:在最适pH条件下测定(40℃、50℃、60℃、70℃、80℃)温度条件下对酶活的影响,每隔5 min测一次酶活。
金属离子对酶活的影响:在发酵液中按1%添加量添加Mg2+、Cu2+、Ca2+、Zn2+、K+,测定发酵液的酶活,确定金属离子对酶活的影响。
1.3.5 几丁质脱乙酰酶的脱乙酰效果
冷冻干燥后的CDA溶于20 mL蒸馏水中,加0.2 g虾壳来源的几丁质底物,40℃,置于水浴锅中恒温水浴1 h,后将底物于50℃烘干。将样品按照大约1∶100的比例与溴化钾磨粉压片进项红外光谱测定,取少许样品镀金后进行电镜扫描。
2 结果与分析
2.1 几丁质脱乙酰酶的SDS-PAGE检测
采用SDS-PAGE凝胶电泳测定CDA的纯度及分子质量,电泳结果如图1所示。由图1可知,粗酶液纯化后,蛋白在电泳图上呈现为单一条带。根据Marker各条带的相对迁移率,计算出桔橙小单孢菌(Micromonospora aurantiaca)来源的几丁质脱乙酰酶分子质量为81.8 ku。然而报道[9,14]的大多数来源的CDA电泳结果显示分子质量在50~60 ku之间。80 ku左右分子质量的CDA还少见报道。表明此种来源的CDA显示了较高的特性。

图1 几丁质脱乙酰酶的SDS-PAGE电泳图Fig.1 SDS-PAGE electrophoretogram of chitin deacetylase
2.2 pH对CDA酶活的影响[15-16]
由图2可知,在pH 7.0时CDA有最大酶活27.30 U/mL。这可能与起始培养条件及放线菌特性有关。pH<7.0时在pH 6.0处酶活最大,为最大酶活的28%;pH>7.0时,各测定点酶活均高于酸性条件下。因此,桔橙小单孢菌(Micromonospora aurantiaca)来源的几丁质脱乙酰酶属于中性酶,此种来源的CDA酶最适pH值为7.0,在中偏碱性条件下酶活较高,这也为CDA的进一步研究提供依据。

图2 不同pH对酶活的影响Fig.2 Effects of different pH on enzyme activity
2.3 温度对酶活的影响
由图3可知,酶在温度40~70℃条件下表现了较高的酶活力。40℃条件下,酶活在15 min时出现了一个小高峰,当反应进行到25 min时,酶活达到最大48 U/mL;当反应温度为70℃时,酶活呈缓慢升高的趋势,在酶处理时间达到25 min时,酶活达到最大值28 U/mL。当温度为50℃、60℃时,酶活在15 min时也出现了小高峰。当酶处理时间达到30 min,在各个温度条件下,酶活都呈现急剧下降的趋势。然而,报道称大多数来源的CDA都在50℃表现最佳酶活[17]。甚至在最适温度下草酸青霉(Penicillium oxalicum)产CDA半衰期达693.10min[9]。更有报道称其CDA酶活范围在30~100℃[18]。结果表明,此种来源的CDA酶最适温度为40℃,并在40~70℃条件下具有较高的活性。

图3 不同温度对酶活的影响Fig.3 Effects of different temperature on enzyme activity
2.4 金属离子对酶活的影响

图4 不同金属离子对酶活的影响Fig.4 Effects of different metal ions on enzyme activity
Cu2+、Co2+、Fe2+、Cd2+、Mg2+、Ca2+对CDA有促进作用,而Mo2+、Zn2+、Pb2+、Bi2+、1 mmol/L的乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)对CDA则具有抑制作用[9,19]。由图4可知,Ca2+对CDA的有明显的促进作用,Zn2+也有明显的抑制作用。然而Cu2+、Mg2+却与报道不同表现出了抑制作用。说明不同来源的CDA有细微的差别[20]。
2.5 CDA的红外光谱分析[21]
由图5可知,波数3 453 cm-1对照于残糖基上的羟基和乙酰氨基;壳聚糖分子的羟基和氨基发生衍生化反应可明显的发现峰变尖锐。脱乙酰的几丁质红外光谱中,波数3 265 cm-1的酰胺谱代被削弱,在波数3 110 cm-1附近出现一个弱的吸收峰;在部分脱乙酰的几丁质红外光谱中波数2938cm-1明显减弱。波数2880cm-1为CH2伸缩振动,变尖锐则表明样品脱乙酰度较高。波数1000~1100cm-1范围内的平行谱带为C—O伸缩振动。
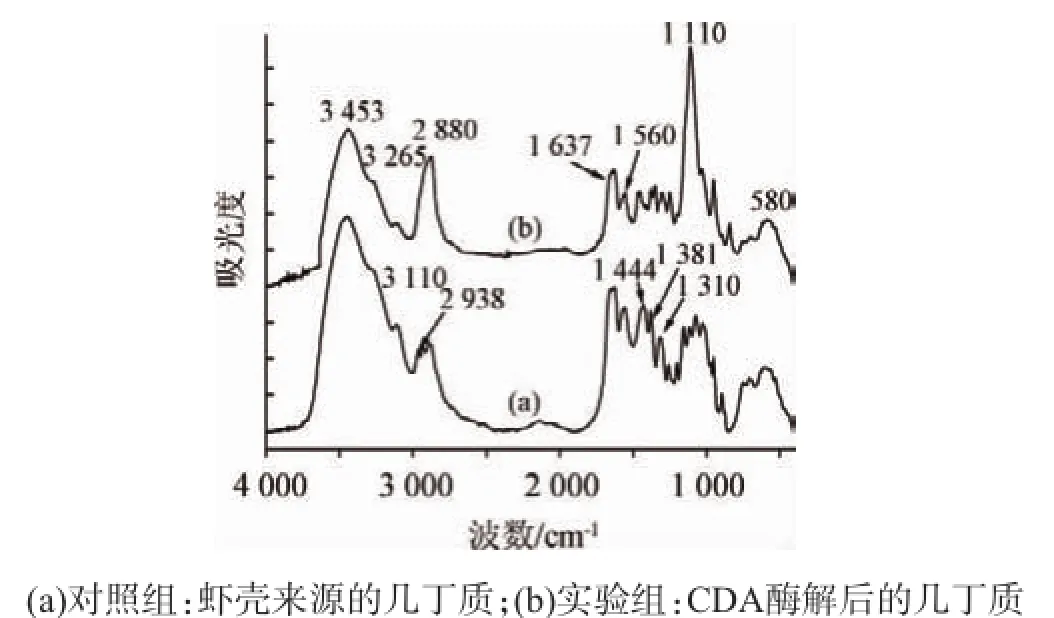
图5 几丁质傅里叶红外光谱图Fig.5 Fourier transform infrared spectrum of chitin
由图5b可知,可明显观察到3 453 cm-1、2 880 cm-1处峰形变尖锐,且波数3 453 cm-1处峰形变瘦。说明壳聚糖分子的羟基和氨基发生衍生化反应[22]。酰胺谱带位置1637cm-1、1560cm-1、1310cm-1处吸光度值明显减弱,且波数1110cm-1处振动明显增强,说明酶在该条件下对几丁质有脱乙酰作用。酰胺谱带Ⅰ在波数1637cm-1、酰胺谱带Ⅱ在波数1560cm-1、酰胺谱带Ⅲ在波数1 310 cm-1反应乙酰氨基,其吸收强度与脱乙酰度有直接关系,因此红外光谱法测定壳聚糖脱乙酰度常用此峰为测定峰。
通过对酰胺谱带Ⅰ、Ⅱ、Ⅲ可能的分析谱带和波数3 430 cm-1、2 880 cm-1等可能的参比谱带及2种基线法做脱乙酰度的相关性分析结果,选用波数1 560 cm-1处酰胺谱带Ⅱ作分析谱带,波数2 880 cm-1处作参比谱带;采用峰谷相连的基线作法。按照下式计算几丁质的脱乙酰度(degree of deacetylation,DD)[23]:

基线法作图得对照组,A1560/A2880=0.936 8;实验组,A1560/A2880=0.452 7;计算出对照组DD%=39.03%;实验组DD=78.40%。
称取0.1 g对照组几丁质,用碱量法[22]测得其脱乙酰度为37.02%,误差<10%,在允许范围内,说明红外法测定脱乙酰度结果有效。则此红外结果表明Micromonospora aurantiaca产CDA有明显的脱乙酰效果。
2.6 CDA作用于几丁质扫描电镜分析

图6 几丁质扫描电镜图Fig.6 Scanning electron microscope spectrum of chitin
由图6a可知,在×4.0 k条件下,39.03%脱乙酰度的对照样品几丁质,其紧密结构的表面,有大量细小的晶体纤维,且拥有少量的疏松纤维结构,疏松纤维表面平滑。由图6b可知,在×4.0 k条件下,78.40%脱乙酰度的几丁质表面较图6a更为疏松多孔,且大量的晶体纤维消失。由图6c可知,×8.0 k条件下,清晰可见酶解后的几丁质样品表面出现孔洞,且纤维也变得粗糙不平滑。由此表明,桔橙小单孢菌(Micromonospora aurantiaca)来源的CDA对虾壳来源的几丁质有明显的脱乙酰效果。
3 结论
通过对桔橙小单孢菌(Micromonospora aurantiaca)来源的几丁质脱乙酰酶的研究,发现在中偏碱性条件下酶活性高,最适pH值为7.0,酶的适应温度范围为40~70℃,最适酶活温度为40℃。CDA在pH 7.0,40℃,Ca2+条件下表现了最高酶活48 U/mL。且与虾壳来源的底物几丁质结合发现脱乙酰效果明显,脱乙酰度由39.03%提高到78.40%。一般N-乙酰基脱去55%以上时,可称之为壳聚糖,作为工业品的壳聚糖脱乙酰度>70%,70%~85%的是中脱乙酰度壳聚糖。实验结果表明此来源的CDA能零污染的将几丁质转化为壳聚糖,有实际应用价值,可对其进行更深入的研究。
[1]朱婉萍.甲壳素及其衍生物的研究与应用[M].杭州:浙江大学出版社,2014:34-40.
[2]范嘉龙.叶酸—壳聚糖-EGCG纳米粒的制备、结构特性及其生物活性研究[D].南京:南京农业大学,2014.
[3]徐春.壳聚糖在白葡萄酒澄清中的应用研究[J].中国酿造,2006,25(1):21-23.
[4]程建安.载万古霉素壳聚糖/甘油磷酸钠温敏水凝胶应用于骨髓炎的初步研究[D].杭州:浙江中医药大学,2016.
[5]何欣云.甲壳质的预防保健作用及其展望[C].青岛:中国甲壳资源研究开发应用学术研讨会,1997.
[6]闵婷,倪孟祥.几丁质脱乙酰酶(CDA)的研究进展[J].药物生物技术,2011,18(1):89-94.
[7]ZHANG H,YANG S,FANG J,et al.Optimization of the fermentation conditions ofRhizopus japonicusM193 for the production of chitin deacetylase and chitosan[J].Carbohyd Polym,2014,101(101):57-67.
[8]SARMIENTO K P,PANES V A,SANTOS M D.Molecular cloning and expression of chitin deacetylase 1 gene from the gills ofPenaeus monodon,(black tiger shrimp)[J].Fish Shellfish Immun,2016,55:484.
[9]PAREEK N,VIVEKANAND V,SAROJ S,et al.Purification and characterization of chitin deacetylase fromPenicillium oxalicum,SAE M-51[J]. Carbohyd Polym,2012,87(2):1091-1097.
[10]张晓敏,刘秋,刘限,等.小单孢菌科研究进展[J].西北农林科技大学学报:自然科学版,2013,41(9):175-185.
[11程元荣,郑卫.小单孢菌及其产生的次级生物活性代谢产物[J].中国抗生素杂志,2006,31(6):321-327.
[12]刘丽萍,赵祥颖,刘建军,等.一种简易、高效产几丁质脱乙酰酶菌种的筛选方法[J].食品与发酵工业,2008,34(1):65-68.
[13]应聪萍,王瑶,李永成.一株产几丁质脱乙酰酶丝状真菌的发酵条件优化研究[J].食品工业科技,2016,37(1):1-15
[14]岳洪霞.Rhodococcussp.Y104产几丁质脱乙酰酶的分离纯化[D].济南:山东轻工业学院,2010.
[15]TOKUYASU K,OHNISHIKAMEYAMA M,HAYASHI K.Purification and characterization of extracellular chitin deacetylase fromColletotrichum lindemuthianum[J].Biosci Biotechnol Biochem,2014,60 (10):1598-603.
[16]NAHAR P,GHORMADE V,DESHPANDE M V.The extracellular constitutive production of chitin deacetylase inMetarhizium anisopliae:possible edge to entomopathogenic fungi in the biological control of insect pests[J].J Invertebr Pathol,2004,85(2):80-88.
[17]KIM Y J,ZHAO Y,OH K T,et al.Enzymatic deacetylation of chitin by extracellular chitin deacetylase from a newly screenedMortierellasp. DY-52[J].J Microbiol Biotechnol,2008,18(4):759-766.
[18]ALFONSO C,NUERO O M,SANTAMAR□A F,et al.Purification of a heat-stable chitin deacetylase fromAspergillus nidulansand its role in cell wall degradation[J].Curr Microbiol,1995,30(1):49-54.
[19]SHRESTHA B,BLONDEAU K,STEVENS W F,et al.Expression of chitin deacetylase fromColletotrichum lindemuthianum,inPichia pastoris:purification and characterization[J].Protein Express Purif,2004, 38(2):196-204.
[20]MARTINOU A,KOUTSIOULIS D,BOURIOTIS V.Expression,purification,and characterization of a cobalt-activated chitin deacetylase (Cda2p)fromSaccharomyces cerevisiae[J].Protein Express Purif, 2002,24(1):111-116.
[21]WU C,CHEN Y K,TSENG S Y,et al.Determination of the degree of deacetylation of chitosan by capillary zone electrophoresis[J].Carbohyd Polym,2014,111(20):236-244.
[22]蒋挺大.甲壳素[M].北京:化学工业出版社,2003:259-262.
[23]董炎明,许聪义,汪剑炜,等.红外光谱法测定N-酰化壳聚糖的取代度[J].中国科学,2001,31(2):153-160.
Enzymatic properties of chitin deacetylase fromMicromonospora aurantiaca
WANG Yao,LI Yongcheng*
(College of Food Science and Technology,Hainan University,Haikou 570228,China)
A chitin deacetylase(CDA)-producing actinomycesMicromonospora aurantiacawas screened from the seaside mangrove shrimp farms soil, and the enzymatic properties of CDA were researched.The results of sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDS-PAGE) showed that molecular mass of CDA was 81.8 ku for a single band.The optimal pH and temperature were 7.0 and 40℃,respectively.Ca2+had promoting effect on CDA enzyme activity,whereas Cu2+,Zn2+and Mg2+showed inhibitory effect.CDA had obvious deacetylation effect on chitin from shrimp shells.The degree of deacetylation of the sample was increased from 39.03%to 78.40%by infrared spectroscopy.By scanning electron microscope,the surface of chitin samples by CDA hydrolysis became loose,porous,grooves and the crystal disappeared,which further evidenced that the CDA had good deacetylation effect and characteristics.
chitin;deacetylase;enzymatic property;deacetylation
TQ925
0254-5071(2017)02-0102-04
10.11882/j.issn.0254-5071.2017.02.022
2016-11-02
海南省自然科学基金项目(20163065)
王瑶(1992-),女,本科,研究方向为发酵工程。
*通讯作者:李永成(1968-),男,教授,博士,研究方向为微生物发酵。

