分子印迹技术及其在农药残留检测中的研究进展*
郑亚丽,顾丽莉**,张梦晓,孔光辉,彭 健,杨万明
(1.昆明理工大学 化学工程学院,云南 昆明 650500;2.云南省烟草农业科学研究院,云南 玉溪 653100)
我国是农业大国,为了保证农产品的产量和质量,做好病虫害的防治工作,农药的使用必不可少[1]。但农药残留问题严重影响人的身体健康,破坏生态平衡。所以,农药残留检测方法和技术越来越受到人们的关注。
近年来,随着人们对生态环境要求的提高和分析技术的不断发展,国内外相关部门均降低了农残的最大残留检测限,提出了更高的前处理要求,这就需要更快捷精准的检测技术。所以,研究快速、灵敏、选择性高的预处理方法具有重要的意义[2]。分子印迹是一项具备特异识别功能的新兴技术,具有成本低、易于合成、稳定性高、理化性质稳定、重复性好等优点。该技术已在农药痕量残留分析等多个领域展现了良好的应用前景[3-6]。
1 分子印迹技术
分子印迹技术(Molecular Imprinting Technology,MIT)以德国G Wuff[7]研究组1972年合成的分子印迹聚合物(Molecular Imprinted Polymers,MIPs)开始引起关注的。
1.1 MIPs的制备原理
MIPs的制备一般包括三个过程。首先,选择合适的功能单体,使功能单体与模板分子以共价或非共价作用结合;其次,加入交联剂,在引发剂的作用下引发单体进行光聚合或热聚合,使模板分子与功能单体固定在聚合物基质中;最后,用化学断裂或溶剂萃取法除去模板分子,在聚合物的网络结构中留下一个与模板分子在尺寸、形状和结构方面相匹配的三维孔穴,见图1。
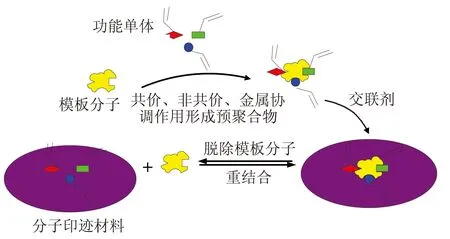
图1 分子印迹聚合物制备示意图
因为MIPs是根据模板分子“量身定做”的,因此MIPs对模板分子及其结构相似物具有较高的特异性识别能力[8]。即所得到的MIPs具有预定性、实用性和专一性等特点。其优点主要有:可重复性,成本低,易制备,物理化学稳定性高等,因而这种技术越来越受到人们的关注[9]。
1.2 结合方式及特点
共价键法、非共价键法和半共价键法是单体和印迹分子的三种主要结合方式。
共价键法最先是由Wulff[10]等人提出来的。在形成聚合物之前,由模板分子和功能单体形成可逆的共价键。然后,再把模板分子从相应的共价键处移去,以便重新结合被分析物。模板分子和功能单体之间的高度稳定性形成了相对均一的结合位点,减少了非特异性识别位点的存在。但模板和功能单体在温和条件下结合和断裂比较困难,导致模板分子难以反复利用。非共价键法由Arshady和Mosbach[11]提出。模板分子和功能单体之间是靠较弱的非共价相互作用力(如氢键、静电引力、电荷转移、范德华力等)形成的。因其步骤简单并且模板分子和许多功能单体都可以相互作用,所以它的应用最广。其缺点是,为了使该过程的平衡有利于向单体-模板复合物生成的方向移动并保持稳定,一般需要使用大量的功能单体,因此常会出现非特异性结合位点,导致MIPs的宏观特异吸附性能降低。半共价键法是由Whitcombe等[12]提出的,首先模板与功能单体以共价键结合,重新进行分子识别时是依据非共价作用方式。Taguchi等[13]以半共价印迹法合成了细胞色素-C分子印迹聚合物,相比非公价键法,该方法所制备的聚合物选择性更高。
1.3 制备方法
目前已报道的分子印迹聚合物的制备方法有很多,常见的主要有本体聚合,沉淀聚合,悬浮聚合和原位聚合等。
1.3.1 本体聚合法
本体聚合(Bulk polymerization)是将模板分子、功能单体、交联剂和引发剂按照一定的比例在惰性气体(如氮气)氛围中,于真空环境下进行热引发或者光引发形成块状模板聚合物。经粉碎、研磨、过筛后,将该聚合物微粒洗脱除去模板分子,低温干燥后即形成具有特定空间结构的MIPs。作者在Mohammad[14]等人制备方法的基础上对致孔剂的量进行了优化,使得所制备的聚合物疏松多孔且刚硬度适合。实验证明,该方法制备过程简单,条件易控,所得产物纯度高,但制备过程冗长,且MIPs产量低。
1.3.2 沉淀聚合法
Zhang[15]等以1,3正丁基苯酞(I-NBP)作为模板分子,丙烯酰胺作为功能单体,乙二醇二甲基丙烯酸酯作为交联剂,丙酮作为溶剂,通过沉淀聚合法(Precipitation polymerization)合成分子印迹聚合物。一系列吸附实验证明,该聚合物具有很好的吸附性能并且对目标分子I-NBP具有很高的选择性。Miura等[16]通过改进的沉淀聚合法得到识别性能良好的绿原酸分子印迹聚合物。之后,Miura等[17]又以4-乙烯基吡啶和甲基丙烯酰胺作为功能单体,二乙烯基苯作为交联剂,V(乙腈)∶V(甲苯)=3∶1,作为致孔剂,通过沉淀聚合法合成咖啡酸(CA)分子印迹聚合物,该MIPs对CA表现出了很高的选择性。Pardeshi等[18]用沉淀聚合法合成了没食子酸(GA)分子印迹聚合物,通过对比不同致孔剂下的扫描电子显微镜图,指出不同致孔剂在颗粒尺寸和分子识别性能上的影响,从而选择出最佳致孔剂。该方法制备的分子印迹聚合物能够有效地从余甘果中萃取GA,且回收率很高。
1.3.3 悬浮聚合法
Mayes等[19]提出的悬浮聚合法(Suspension Polymerization)是制备球形MIPs的一种常用方法,其反应体系是由单体、引发剂、分散剂和水组成的。选择全氟烃作为分散介质,因为其与一般有机溶剂都不互溶,故加入特制的聚合物表面活性剂,通过高速搅拌获得乳浊液,加入引发剂,聚合后得到了粒度范围分布窄、形态规则的MIPs微球。Sun等[20]用悬浮聚合法制备了分子印迹聚合物并做成分子印迹固相萃取(MISPE)柱来萃取人类血清和鱼组织中的局部麻醉剂苯佐卡因(BZC),结果证明,BZC可以有效地被富集,其回收率达到90%。
1.3.4 原位聚合法
原位聚合(Situ polymerization)是将预聚合液直接涂在分析过程所用的不锈钢柱子或者填充有印迹聚合物的柱子内,从而无需再对印迹聚合物进行装柱,简化了制备过程。Bai等[6]以原位聚合法合成了ART分子印迹膜,负载在石墨烯表面用于修饰玻碳电极,结果表明,该聚合物所制备的传感器不仅灵敏度和选择性高,而且再现性和重复性也好。
1.3.5 表面印迹法
表面印迹聚合(Surface-imprinting polymerization)是在基质材料表面建立的一种分子识别体系的方法,该方法是将具有识别位点的印迹聚合层接枝或包裹在载体的表面,所获得的MIPs具有溶胀系数小、传质速度快等特点,避免了模板分子包埋过深或过紧而无法完全洗脱的问题。其结合位点不易被破坏,选择性更高[21]。Luo等[22]以扑热息痛(PR)为模板分子,氧化石墨烯为载体制备了一种氧化石墨烯表面分子印迹溶胶凝胶聚合物,并用于电化学传感器以快速检测PR,结果证明该传感器具有检测迅速、选择性高、检测范围宽、检出限低等优点,从而为药物和临床领域提供了广阔的前景。
2 分子印迹技术在不同种类农药残留检测中的应用
分子印迹技术作为一种前处理手段,具有较高的选择性和较强的亲和力,能够从复杂基质中特异性识别和捕捉目标化合物,可使待测样品中的痕量农残通过分子印迹聚合物吸附得到富集,为后续分析检测提供了很大的便利。目前该技术已广泛应用到磺酰脲类、三嗪类、有机磷类以及其它种类农药的检测中,并取得了很好的效果。
2.1 磺酰脲类
磺酰脲类除草剂是目前应用最广泛的除草剂之一,因其具有较高的除草活性以及对哺乳动物具有较低的毒性,所以广泛用于多种植物中。Tang等[23]以吡嘧磺隆(PS)为模板分子,通过MISPE柱来提纯和富集水稻样品中的PS、苄嘧磺隆(BSM)、苯磺隆(TBM)、甲磺隆(MSM)和烟嘧磺隆(NS)。PS的回收率可达95.6%,TBM的回收率为48.2%。Li等[24]以噻吩磺隆为模板分子做成的核壳型印迹电化学发光传感器检测噻吩磺隆,结果表明,印迹传感器的电化学发光强度是非印迹传感器的2.7倍。Yang等[25]制备了亲水外层双功能吡嘧磺隆印迹聚合物,用于分析土壤中三种磺酰脲类除草剂的残留量,加标回收率为81%~99%,检测限小于4.8%。证明了该聚合物可用于土壤中吡嘧磺隆的有效萃取。Fu等[26]以氯磺隆(CS)为模板分子制备了CS-MISPE用于水、土壤和小麦中残留CS检测,效果良好。
2.2 三嗪类
三嗪类除草剂是一种农田杂草生长抑制剂,可对土壤、地下水等造成污染,对人类及动物不利,必须合理使用。Andrade等[27]以阿特拉津为模板分子,制备了分子印迹固相萃取小柱用于检测玉米样品中的三嗪类农残,三嗪类检测限为1.6~3.3 μg/kg,回收率为80.2%~119.1%。Zhao等[28]以扑草净为模板分子制备了单孔中空分子印迹聚合物微球(h-MIMs),该聚合物比沉淀聚合和表面聚合具有更大的比表面积和更高的结合能力,用来检测谷物中的三嗪类农残,其加标回收率的范围为(81±4)%~(96±4)%,表明该方法在食品监管检测中具有很大的潜力。Jesús等[29]以商用分子印迹小柱对环境中三嗪类及其代谢物进行前处理,在SRM模式中通过用LC-MS/MS进行分析,地下水中的检测限低至0.015 ng/L,土壤和泥土中为0.2 ng/kg。该方法得到的回收率为55%~123%,日内和日间RSD值分别为2%~4%和6%~10%。说明该分子印迹小柱对复杂基质中三嗪类及其代谢物的前处理是非常有效的。
2.3 有机磷类
有机磷类是农药中极为重要的一种化合物,可用于防治植物病虫害,不少种类有机磷农药毒性较强,在人和动物体内积累可能会抑制血液和组织中乙酰胆碱酯酶的活性,进而引起中枢神经系统中毒。Sun等[30]在甲基对硫磷印迹传感器的选择性实验中,将硒化镉二氧化硅纳米球分子印迹聚合物及相应的非分子印迹聚合物对四种有机磷农药的荧光熄灭量进行检测,得出甲基对硫磷的荧光熄灭量比率最高,荧光熄灭量的比率越高,表明硒化镉二氧化硅纳米球MIPs比NIPs材料具有更高的选择性。Wu等[31]将TiO2纳米颗粒作为催化剂用于鲁米诺流动注射电化学发光系统(CL)来检测毒死蜱(CPF),其线性范围为1.0×10-10~5.0×10-7mol/L,检测限为1.0×10-11mol/L(3δ)。CPF的流动注射电化学发光强度是三唑磷(TAP)的10倍,说明选择性很高。
2.4 其它
Huang等[32]自制了一种新的MISPE柱来分离富集饲料中的三聚氰胺,加标回收率达到95%,与NIP-SPE相比,MIP-SPE的萃取效率更高。Qu等[33]以扑草胺为模板分子制备成MISPE柱,对水、土壤及水稻样品中的扑草胺进行检测,其加标回收率分别为84.4%~87.4%,86.9%~97.1%,82.5%~94.2%,检测限分别为3.39%~6.06%,3.52%~5.82%,1.58%~6.34%。Zhao等[34]以草甘膦为模板分子制备成分子印迹化学发光传感器,在有干扰基质存在的条件下对草甘膦进行选择性实验,结果表明该分子印迹传感器对草甘膦具有很高的选择性。Hu等[35]以三唑酮为印迹分子,用SBSE-HPLC法对土壤中的三唑酮及其结构相似物进行萃取分析,得出检测限为(0.14~0.34)mg/L,加标回收率为86.7%~114.6%,该方法可用于土壤或其它复杂基质中三唑类的检测。
3 结束语
随着人们生活质量的不断提高,食品安全及环境保护问题越来越被人们重视,而农药残留问题已经成为人们关注的焦点。由于农残具有残留量低、复杂基质干扰严重等特点,所以,发展简便、快速、重复性好的样品前处理技术越来越关键。而分子印迹技术作为一种新型的分离技术,在痕量农残的分离、富集中取得了很大的进步。尽管分子印迹技术在复杂体系的分离中显示了其优越性,但仍存在以下不足需要完善。首先,分子印迹技术的作用机理研究相对肤浅。目前研究的重心在分子印迹模板制备及其应用,分子识别机理和结合位点的作用机理等关键研究不足。其次,分子印迹聚合物大多只能在有机相中进行聚合和应用,在水溶液或极性溶剂中的应用需要深入研究和扩展。最后,功能单体的可选择范围,交联剂的种类和聚合方法都有较大的局限性,对于不含酸性或碱性基团的印迹分子的提取应用有待于更多的尝试。
[1] 程立勋. 果蔬农残检测方法的研究[J].中国农业信息,2014,17:109.
[2] YU F,CHEN L,PAN L N,et al.Determination of multi-pesticide residue in tobacco using multi-walled carbon nanotubes as a reversed-dispersive solid-phase extraction sorbent[J].Journal of Separation Science,2015,38:1894-1899.
[3] HU X L,WU X,YANG F F,et al.Novel surface dummy molecularly imprinted silica as sorbent for solid-phase extraction of bisphenol A from water samples[J].Talanta,2016,148:29-36.
[4] YOLA M L,EREN T,ATAR N.A sensitive molecular imprinted electrochemical sensor based on gold nanoparticles decorated graphene oxide:application to selective determination of tyrosine in milk[J].Sensors and Actuators B:Chemical,2015,210:149-157.
[5] LI X J,WANG X J,LI L L,et al.Electrochemical sensor based on magnetic graphene oxide@ gold nanoparticles-molecular imprinted polymers for determination of dibutyl phthalate[J].Talanta,2015,131:354-360.
[6] BAI H P,WANG C Q,CHEN J,et al.A novel sensitive electrochemical sensor based on in-situ polymerized molecularly imprinted membranes at graphene modified electrode for artemisinin determination[J].Biosensors and Bioelectronics,2015,64:352-358.
[7] WULFF G,SARHAN A.The use of polymers with enzyme-analogous structures for the resolution of racemates[J].Angewandte Chemie International Edition in English,1972,11(4):341-344.
[8] KRYSCIO D R,PEPPAS N A.Critical review and perspective of macromolecularly imprinted polymers[J].Acta Biomaterialia,2012,8(2):461-473.
[9] YI L X,FANG R,CHEN G H.Molecularly imprinted solid-phase extraction in the analysis of agrochemicals[J].Journal of Chromatographic Science,2013,51(7):608-618.
[10] WUFF G,SARHAN A.The use of polymers with enzyme-analogous structures for the resolution of racemate[J].Journal of the Angewandte Chemie International Edition,1972,11(3):341-345.
[11] ARSHADY R,MOSBACH K.Synthesis of substrate-selective polymers by host-guest polymerization[J].Die Makromolekulare Chemie,1981,182(2):687-692.
[12] WHITCOMBE M J,RODRIGUEZ M E,VILLAR P,et al.A new method for the introduction of recognition site functionality into polymers prepared by molecular imprinting:synthesis and characterization of polymeric receptors for cholesterol[J].Journal of the American Chemical Society,1995,117(27):7105-7111.
[13] TAGUCHI H,SUNAYAMA H,TAKANO E,et al.Preparation of molecularly imprinted polymers for the recognition of proteins via the generation of peptide-fragment binding sites by semi-covalent imprinting and enzymatic digestion[J].Analyst,2015,140(5):1448-1452.
[14] GHOLIVAND M B,MALEKZADEH G.Computational design and synthesis of a high selective molecularly imprinted polymer for voltammetric sensing of propazine in food samples[J].Talanta,2012,89:513-520.
[15] ZHANG W,TAN N,JIA X H,et al.Synthesis,recognition characteristics and properties of l-3-n-butylphthalide molecularly imprinted polymers as sorbent for solid-phase extraction through precipitation polymerization[J].Materials Science and Engineering:C,2015,53:166-174.
[16] MIURA C,LI H,MATSUNAGA H,et al.Molecularly imprinted polymer for chlorogenic acid by modified precipitation polymerization and its application to extraction of chlorogenic acid from Eucommia ulmodies leaves[J].Journal of Pharmaceutical and Biomedical Analysis,2015,114:139-144.
[17] MIURA C,MATSUNAGA H,HAGINAKA J.Molecularly imprinted polymer for caffeic acid by precipitation polymerization and its application to extraction of caffeic acid and chlorogenic acid from Eucommia ulmodies leaves[J].Journal of Pharmaceutical and Biomedical Analysis,2016,127:32-38.
[18] PARDESHI S,DHODAPKAR R,KUMAR A.Molecularly imprinted microspheres and nanoparticles prepared using precipitation polymerisation method for selective extraction of gallic acid from Emblica officinalis[J].Food Chemistry,2014,146:385-393.
[19] MAYES A G,MOSBACH K.Molecularly imprinted polymer beads:suspension polymerization using a liquid perfluoroarbon as the dispersing phase[J].Analytical Chemistry,1996,68(21):3769-3774.
[20] SUN H,LAI J P,CHEN F,et al.Molecularly imprinted microspheres synthesized by a simple,fast,and universal suspension polymerization for selective extraction of the topical anesthetic benzocaine in human serum and fish tissues[J].Analytical and Bioanalytical Chemistry,2015,407(6):1745-1752.
[21] ZHU G F,FAN J,GAO Y B,et al.Synthesis of surface molecularly imprinted polymer and the selective solid phase extraction of imidazole from its structural analogs[J].Talanta,2011,84(4):1124-1132.
[22] LUO J,CONG J J,FANG R X,et al.One-pot synthesis of a graphene oxide coated with an imprinted sol-gel for use in electrochemical sensing of paracetamol[J].Microchimica Acta,2014,181(11/12):1257-1266.
[23] TANG K J,GUX H,LUO Q S,et al.Preparation of molecularly imprinted polymer for use as SPE adsorbent for the simultaneous determination of five sulphonylurea herbicides by HPLC[J].Food Chemistry,2014,150:106-112.
[24] LI H F,XIEC G,FUX C.Electrochemiluminescence sensor for sulfonylurea herbicide with molecular imprinting core-shell nanoparticles/chitosan composite film modified glassy carbon electrode[J].Sensors and Actuators B:Chemical,2013,181:858-866.
[25] YANG M X,ZHANGY Y,LIN S,et al.Preparationofabifunctionalpyrazosulfuron-ethylimprintedpolymer with hydrophilic external layers by reversible addition-fragmentation chain transfer polymerization and its application in the sulfonylurea residue analysis[J].Talanta,2013,114:143-151.
[26] FU X W,WU Y J,QU J R,et al.Preparation and utilization of molecularly imprinted polymer for chlorsulfuron extraction from water,soil,and wheat plant[J].Environmental Monitoring and Assessment,2012,184(7):4161-4170.
[27] ANDRADE F N,NAZARIO C E D,SANTOS-NETOJ,et al.Development of on-line molecularly imprinted solid phase extraction-liquid chromatography-mass spectrometry for triazine analysis in corn samples[J].Analytical Methods,2016,8(5):1181-1186.
[28] ZHAO Q,LI H,XU Y,et al.Determination triazine pesticides in cereal samples based on single-hole hollow molecularly imprinted microspheres[J].Journal of Chromatography A,2015,1376:26-34.
[30] SUN Q,YAO Q Q,SUN Z L,et al.Determination of parathion-methyl in vegetable by fluorescent-labeled molecular imprinted polymer[J].Chinese Journal of Chemistry,2011,29(10):2134-2140.
[31] WU J,FU X C,XIEC G,et al.TiO2nanoparticles-enhanced luminol chemiluminescence and its analytical applications in organophosphate pesticide imprinting[J].Sensors and Actuators B:Chemical,2011,160(1):511-516.
[32] HUANG H B,ZHUANG Z X,ZHOUY L,et al.Separation and enrichment of melamine in feed by a new molecularly imprinted solid-phase extraction column[J].Animal Husbandry and Feed Science,2014,6(1):10-13.
[33] QU J R,ZHANG J J,GAO Y F,et al.Synthesis and utilisation of molecular imprinting polymer for clean-up of propachlor in food and environmental media[J].Food Chemistry,2012,135(3):1148-1156.
[34] ZHAO P N,YAN M,ZHANGC C,et al.Determination of glyphosate in foodstuff by one novel chemiluminescence-molecular imprinting sensor[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2011,78(5):1482-1486.
[35] HU Y L,LI J W,LI G K.Synthesis and application of a novelmolecularly imprinted polymer-coated stirbar for microextraction of triazole fungicides in soil[J].J Sep Sci,2011,34(10):1190-1197.

