瑞舒伐他汀抑制血管平滑肌细胞表型转化的机制研究
韩庆,沈德良,王勃,张金盈
(1.郑州大学附属郑州市中心医院 心血管内科,河南 郑州 450007;2.郑州大学第一附属医院 心血管内科,河南 郑州 450052)
瑞舒伐他汀抑制血管平滑肌细胞表型转化的机制研究
韩庆1,沈德良2,王勃2,张金盈2
(1.郑州大学附属郑州市中心医院 心血管内科,河南 郑州 450007;2.郑州大学第一附属医院 心血管内科,河南 郑州 450052)
D O I:10.3969/j.i s s n.1005-8982.2017.03.006
目的研究瑞舒伐他汀是否可以抑制大鼠主动脉血管平滑肌细胞(VSM C s)表型转化及其机制。方法SD大鼠主动脉VSM C s原代细胞培养鉴定,取4~7代细胞用于实验。用不同浓度的瑞舒伐他汀干预VSM C s,W es t ern bl ot检测各组标本中骨骼肌肌动蛋白(SM-act i n)、平滑肌22α(SM-22α)、滑肌肌球蛋白重链(SMM H C)、骨桥蛋白(O PN)的表达,噻唑蓝(M TT)法检测细胞增殖情况,划痕试验观察细胞迁移情况。通过免疫组织化学法(IC C)检测SM-act i n的表达从而观察VSM C的形态。转染过表达KLF-4或空白对照质粒至离体培养的VSM C s中,用瑞舒伐他汀干预,并采用上述实验方法检测VSM C s表型转化情况。结果M TT结果显示,与对照组比较,瑞舒伐他汀组VSM C s增殖能力降低,差异有统计学意义(P<0.05)。划痕试验结果显示,与对照组比较,他汀组VSM C s迁移减少,差异有统计学意义(P<0.05)。W es t ern bl ot检测显示,与对照组比较,他汀组VSM C s中SM-22α、SM-M H C、O PN表达增多,差异有统计学意义(P<0.05)。IC C结果显示,与对照组VSM C s的细胞形态比较,他汀组VSM C s形态变细、变长。转染KLF-4过表达质粒后,与对照组比较,转染KLF-4过表达质粒可以增加VSM C s的增殖和迁移,差异有统计学意义(P<0.05),逆转他汀对VSM C s表型转化有抑制作用。结论瑞舒伐他汀通过下调KLF-4,抑制大鼠主动脉VSM C s表型转化。
动脉粥样硬化;瑞舒伐他汀;血管平滑肌细胞;表型转化
血管平滑肌细胞(vascul ar sm oot h m uscl e cel l s,VSM Cs)的增殖和迁移是动脉粥样硬化发展过程中重要的病理基础,也是造成支架植入术或冠状动脉搭桥术后冠状动脉再狭窄的重要原因[1]。最近有研究显示,血管平滑肌细胞在不同的分化阶段具有不同的细胞表型,不同表型之间的平滑肌细胞生理特性相差巨大,并且在外界因素发生变化时,VSM Cs不同表型之间可以相互转化[2]。正常血管中的VSM Cs一般是已分化的收缩型平滑肌细胞,在血管受到损伤时,一些已分化的收缩型VSM Cs可以去分化,成为分泌型细胞。收缩型VSM Cs低增殖、低分泌,特异性表达骨骼肌肌动蛋白(skel et al m uscl e act i n,SM-act i n)、平滑肌22α(sm oot h m uscl e 22α,SM-22α)、滑肌肌球蛋白重链(sm oot h m uscl e m yosi n heavy chai n, SM-M H C)等具有标志意义的特征性蛋白,分泌型VSM Cs增殖加快,细胞外基质分泌增加[3],骨桥蛋白(Ost eopont i n,OPN)、基质金属蛋白酶(m at ri x m et all oprot ei nases,M M Ps)等蛋白表达增多[4]。过去的实验结果显示,在粥样斑块中,收缩型VSM Cs减少,分泌型VSM Cs增多[5]。最近研究证实,V脉粥样SM Cs表型转化在动硬化的病理发展过程中具有重要的作用[6]。
他汀类药物通过降脂、改善内皮功能、减轻或消除炎症反应、抑制血管平滑肌增殖等作用延缓动脉粥样硬化的发生、发展[7-8]。瑞舒伐他汀可以显著减少低密度脂蛋白受体-/-小鼠主动脉内粥样硬化斑块的面积,抑制高半胱氨酸(H om ocyst ei ne,H cy)诱导的VSM Cs表达M M Ps等,破坏细胞外基质平衡的蛋白[9]。但是瑞舒伐他汀是否可以抑制VSM Cs表型转化,以及其作用机制尚未探明。本实验通过用不同浓度的瑞舒伐他汀干预VSM Cs,观察瑞舒伐他汀对 VSM Cs表型转化及对 Krüppel样因子 4(Krüppel-l i ke f act or4,KLF4)表达的影响,再通过在VSM Cs中转染过表达KLF-4质粒,观察过表达KLF-4对VSM Cs表型转化的影响,验证KLF-4是否参与他汀抑制VSM Cs表型转化的过程。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 无特定病原体级SD大鼠,雌雄不限,50 d左右,体重150~180 g(购自浙江省医学科学院实验动物中心)。
1.1.2 实验试剂 胎牛血清(美国Gi bco公司),瑞舒伐他汀钙(美国Si gm a公司),RNA提取试剂(美国Invi t rogen公司),无内毒素质粒小、大提取试剂盒、脂质体2000均购自上海英骏公司,4',6-二脒基-2- 苯 基 吲 哚(4',6-di am i di no-2-phenyl i ndol e,DAPI)(瑞士Rcohe公司),噻唑蓝[3-(4,5-di m et hyl-2-t hi azol yl)-2,5-di phenyl-2-H-t et razol i um brom i de,M TT](美国Em resco公司),兔或鼠抗兔SM-act i n、SM-22α、SM-M CH、OPN、KLF-4、β-act i n多克隆抗体均购自英国Abcam公司,辣根过氧化酶标记的山羊抗兔或者抗鼠二抗、异硫氰酸荧光素、异硫氰酸荧光素(f l uorescei n i sot hi ocyanat e,FITC)标记的山羊抗兔免疫球蛋白G均购自美国Jackson公司,蛋白免疫印迹相关试剂(江苏碧云天生物技术研究所)。
1.2 实验方法
1.2.1 VSM C原代细胞培养 采用组织贴块法培育大鼠胸主动脉VSM Cs,采用形态学观察和细胞免疫荧光检测SM A,鉴定VSM Cs。通过SM A与DAPI核染的关系鉴定VSM Cs的纯度,取第3~5代细胞用于后续实验。使用脂质体Li pof ect am i ne 2000转染,转染时使用不含胎牛血清改良伊格尔培养基培养基,在转染6 h后改换含10%胎牛血清的培养液继续培养24 h,提取细胞中的总蛋白,通过W est ren bl ot检测KLF-4的表达鉴定转染效率。
1.2.2 实验分组 实验分两部分,第一部分用以验证瑞舒伐他汀是否可以抑制KLF-4的表达及VSM Cs表型转化。VSM Cs分4组:对照组、1μm ol/L瑞舒伐他汀组、5μm ol/L瑞舒伐他汀组、20μm ol/L瑞舒伐他汀组 [瑞舒伐他汀用0.1%二甲基亚砜(di m et hyl sul f oxi de,DM SO)溶解]。第二部分用以验证瑞舒伐他汀通过下调KLF-4抑制VSM Cs表型转化。细胞分为4组:对照组、他汀组、过表达KLF-4组、他汀+过表达KLF-4组。
1.2.3 KLF-4过表达质粒构建及转染 通过Pubm ed查找KLF-4基因序列,引物根据Genebank中KLF-4m RNA序列设计引物。正向引物:5'-CGCG GATCCATGAGCAGCCACCTGGCGAGTC-3';反向引物:5'-CCGCTCGAGTCATTAAAAATGCCTCCTCATGTGT-3'。通过Pri m est ar法进行聚合酶链反应扩增KLF-4基因片段,获得的KLF-4基因片段用1%琼脂糖凝胶电泳,紫外线观察目的条带,胶回收,靶基因恢复KLF-4和质粒DNA的T4DNA连接酶相同的酶切连接,连接产物转化大肠杆菌DH 5α,涂层板,筛选重组质粒,质粒提取后测序验证。将VSM C细胞接种至6孔板,生长至50%~70%密度时,以脂质体Li pof ect am i ne 2000分别转染KLF-4或空白对照各100 pm ol,24 h后,提取总蛋白鉴定转染效率,进行后续试验。
1.2.4 W es t ern bl ot检测蛋白表达量 转染过表达KLF-4的质粒或者空白质粒的VSM Cs血清饥饿24 h同步化,用1.2.2中不同的瑞舒伐他汀干预,培养48 h后,提取各组细胞中总蛋白,二喹啉甲酸(bi ci nchoni ni c aci d,BCA)法定量蛋白,十二烷基硫酸钠-聚丙烯酰胺(sodi um dodecylsul f at e-pol yacryl am i de gel el ect ro-phoresi s,SDS-PAGE)凝胶每孔加入30μl样品,70V 30m i n进行蛋白浓聚,110V 2h进行凝胶电泳,并用孔径0.45μm聚偏氟乙烯膜250 m A 100 m i n进行转膜。转膜后经常温下三羟甲基氨基甲烷缓冲盐溶液(t ri s buf f ered sal i ne and t ween 20,TBST)洗膜3次,封闭1 h后,以1∶1 000浓度加入兔(鼠)抗人 SM-act i n一抗(或抗SM-22α、SM-M H C、OPN、KLF-4、β-act i n一抗),4℃孵育过夜,常温下TBST洗膜3次,辣根过氧化物酶标记羊抗兔(鼠)二抗孵育后增强化学发光法检测。柯达胶片暗室显影,Quant i t y one软件分析。
1.2.5 M TT法检测 VSM C s增殖 转染过表达KLF-4的质粒或者空白质粒的VSM Cs在96孔板中培养,血清饥饿24 h同步化之后,用1.2.2中不同浓度的瑞舒伐他汀干预,每组细胞设3个复孔,2个不加细胞的空白孔。细胞在各自条件下培养24、48和72 h。培养结束后,每孔加入M TT液20μl,37℃下继续孵育4~6 h,小心弃去培养上清液,每孔加入150μl DM SO溶液,震荡10 m i n,选择492 nm波长在酶联免疫检测仪测定各孔光密度(opt i cal del nsi t y,OD)值并记录。以时间为横轴,吸光值为纵轴绘制各组VSM Cs细胞生长曲线。
1.2.6 细胞划痕实验检测VSM C s迁移 转染过表达KLF-4的质粒或者空白质粒的VSM Cs在6孔板中培养,血清饥饿24 h同步化之后,用1.8 m m ol/L羟基脲作用12 h抑制细胞增殖,100μl黄色枪头垂直孔板制造细胞划痕,吸掉细胞培养液,磷酸盐缓冲溶液(phosphat e buf f er sal i ne,PBS)冲洗3次,用1.2.2中不同浓度的瑞舒伐他汀干预,在相应的培养条件下培养细胞,拍照记录0、12、24、48和72 h图片,Im age pro pl us 6.0软件分析计算细胞迁移面积,并以迁移面积与原划痕面积比值来表示各组VSM Cs迁移的多少。
1.2.7 细胞免疫荧光法检测各组SM-act i n在细胞中的分布及表达 VSM Cs按1.2.2中分组在96孔板中培养,同步化之后加入不同浓度的瑞舒伐他汀,培养48 h后,PBS洗3遍,4%多聚甲醛固定,0.25% Tri t on X 100穿破细胞膜,山羊血清室温封闭1 h,加入稀释250倍的ant i-SM A抗体,4℃过夜,PBS清洗3遍,加入结合有异硫氰酸荧光素的山羊抗兔二抗,室温孵育1 h,PBS清洗3遍,荧光显微镜拍照后图片用Iam ge pro pl us 6.0软件分析。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计量数据以均数±标准差(±s)表示,多组均比较用单因素方差分析,若方差齐则两两比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 VSMCs原代培养鉴定
组织贴块法培养SD大鼠胸主动脉VSM Cs,8d左右组织块周围有细胞爬出,2周左右细胞融合可传代。传代后细胞呈典型峰谷状排列生长,用SM-act i n细胞免疫荧光鉴定VSM C,DAPI核染后确定细胞纯度>99%。见图1。
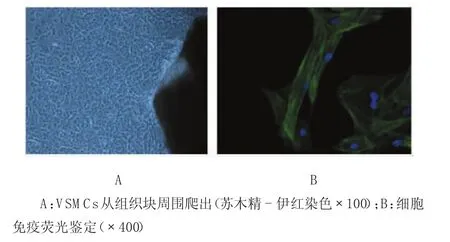
图1 VSMCs原代培养鉴定
2.2 瑞舒伐他汀抑制VSMCs表型转化
2.2.1 瑞舒伐他汀抑制VSM C s增殖和迁移 不同浓度的瑞舒伐他汀处理12 h后,各组OD值比较,差异无统计学意义(F=7.531,P=0.012)。与对照组比较,24 h后瑞舒伐他汀组OD值降低,差异有统计学意义(F=7.513,P=0.012),并与瑞舒伐他汀的浓度呈正相关,说明瑞舒伐他汀可抑制VSM Cs的增殖。各干预因素处理48 h后,与对照组比较,瑞舒伐他汀组VM SCs的迁移面积减少,差异有统计学意义(F= 15.682,P=0.001),并与瑞舒伐他汀的浓度呈正相关,说明瑞舒伐他汀可抑制VSM Cs的迁移。见图2。
2.2.2 瑞舒伐他汀抑制VSM C s形态变化 不同浓度的瑞舒伐他汀处理48 h后,各组平滑肌细胞中SM-act i n荧光形态不同,对照组中形态变圆,SM-act i n排列紊乱,失去VSM Cs原有的细胞形态。与对照组比较,瑞舒伐他汀组中VSM Cs细长呈梭形,SM-act i n排列整齐。见图3。

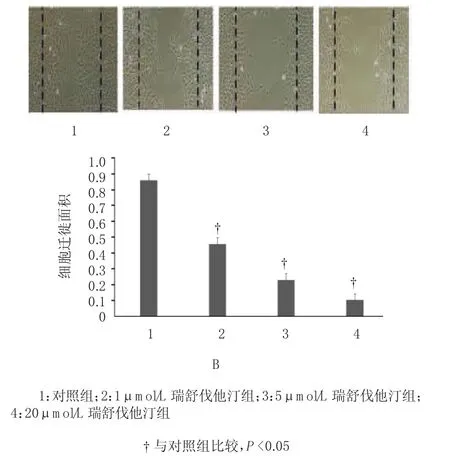
图2 瑞舒伐他汀抑制VSMCs增殖和迁移
2.2.3 瑞舒伐他汀影响VSM C s内细胞表型相关蛋白及KLF-4的表达 各组VSM Cs中SM-act i n表达量比较,差异无统计学意义(F=1.346,P=0.349)。与对照组比较,瑞舒伐他汀组VSM Cs中SM-22α和SM-M H C表达增加,差异有统计学意义(F=18.917,P=0.000),并与瑞舒伐他汀的浓度呈正相关;OPN和KLF-4的表达增加,差异有统计学意义(F=22.371,P=0.000)。见图4。

图3 瑞舒伐他汀抑制VSMCs形态变化
2.3 过表达KLF-4逆转瑞舒伐他汀对VSMCs表型转化的抑制作用
2.3.1 过表达KLF-4逆转瑞舒伐他汀对VSM C s增殖和迁移的抑制作用 与空质粒对照组比较,转染过表达KLF-4质粒组VSM Cs中KLF-4的表达增加,差异有统计学意义(F=22.838,P=0.000)。与对照组比较,瑞舒伐他汀组OD值降低,差异有统计学意义(F= 9.436,P=0.002);转染过表达KLF-4质粒后,与对照组比较,KLF-4组、瑞舒伐他汀+KLF-4组的OD值升高,差异有统计学意义(F=33.562,P=0.000),说明过表达KLF-4可以增加VSM Cs的增殖,逆转瑞舒伐他汀对VSM Cs增殖的抑制的作用。与对照组比较,瑞舒伐他汀组VSM Cs迁移面积减少,差异有统计学意义(F=18.255,P=0.000);与对照组比较,KLF-4过表达组和瑞舒伐他汀+KLF-4组VSM Cs迁移面积增加,差异有统计学意义(F=22.938,P=0.000),说明过表达KLF-4可以增加VSM Cs的迁移,逆转瑞舒伐他汀对VSM Cs迁移的抑制作用。见图5。
2.3.2 过表达KLF-4逆转瑞舒伐他汀对VSM C s形态变化的抑制作用 与对照组比较,瑞舒伐他汀组中VSM Cs细长呈梭形,SM-act i n排列整齐。转染过表达KLF-4质粒后,KLF-4组和瑞舒伐他汀+KLF-4组中VSM Cs形态变圆,SM-act i n排列紊乱,失去VSM Cs原有的细胞形态,说明过表达KLF-4可以导致VSM Cs形态变圆,逆转瑞舒伐他汀的作用。见图6。
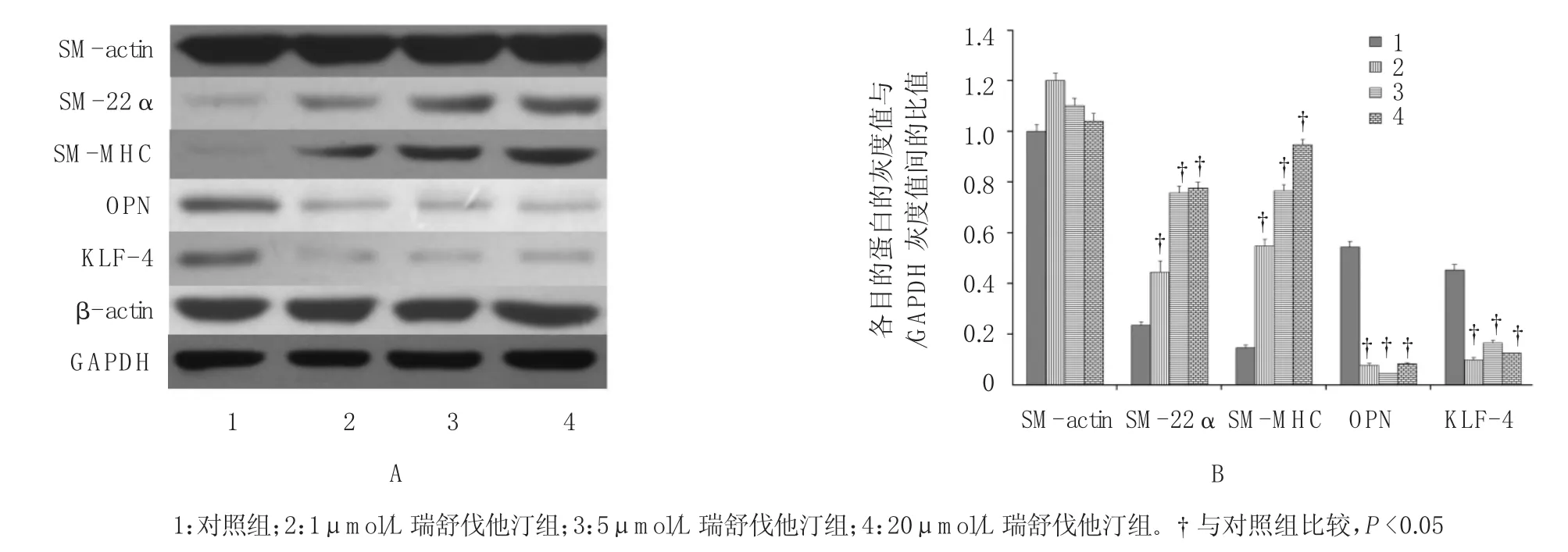
图4 Western blot检测各组VSMCs中SM-actin、SM-22α、SM-MHC、OPN及KLF-4的表达
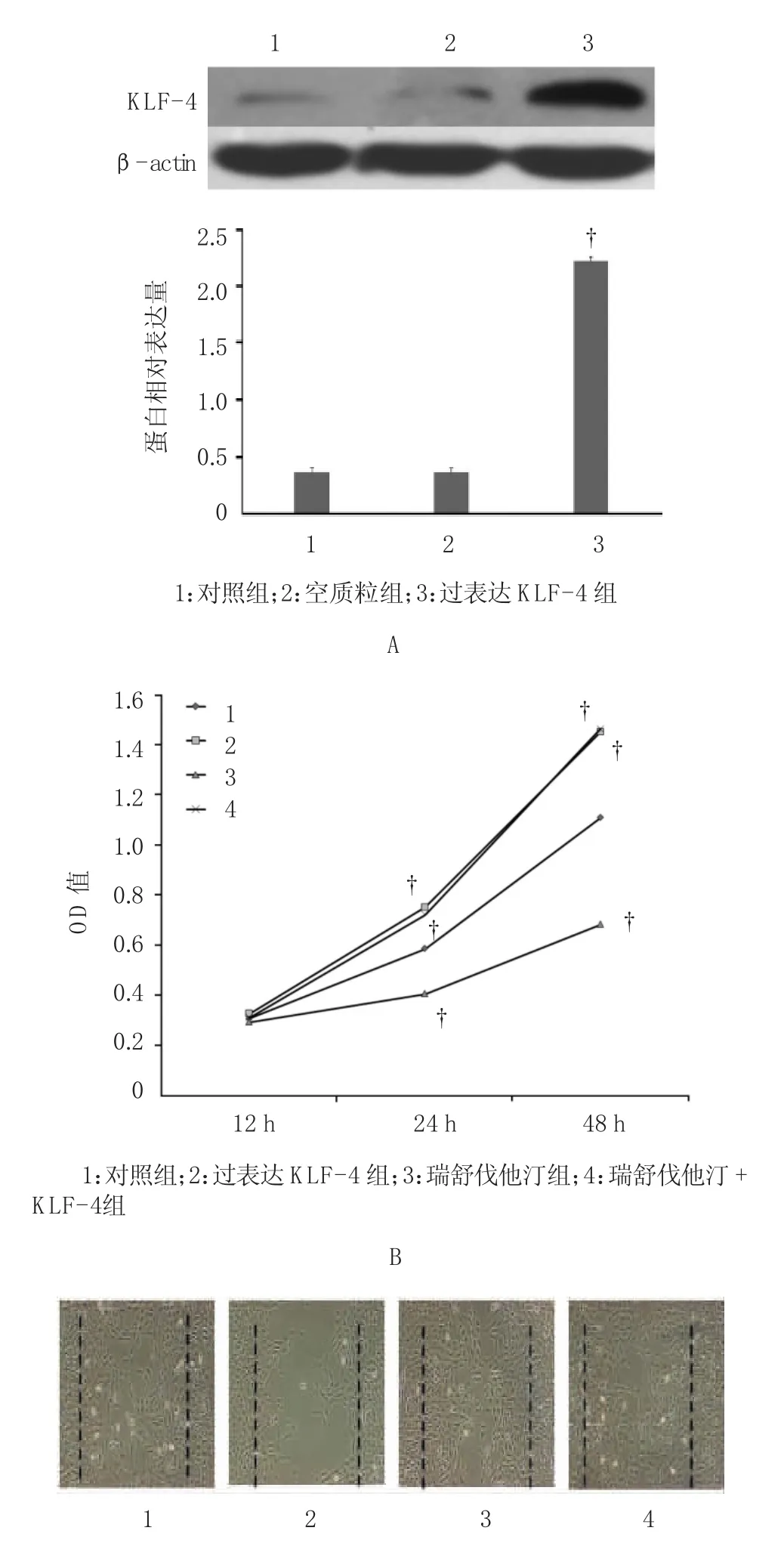
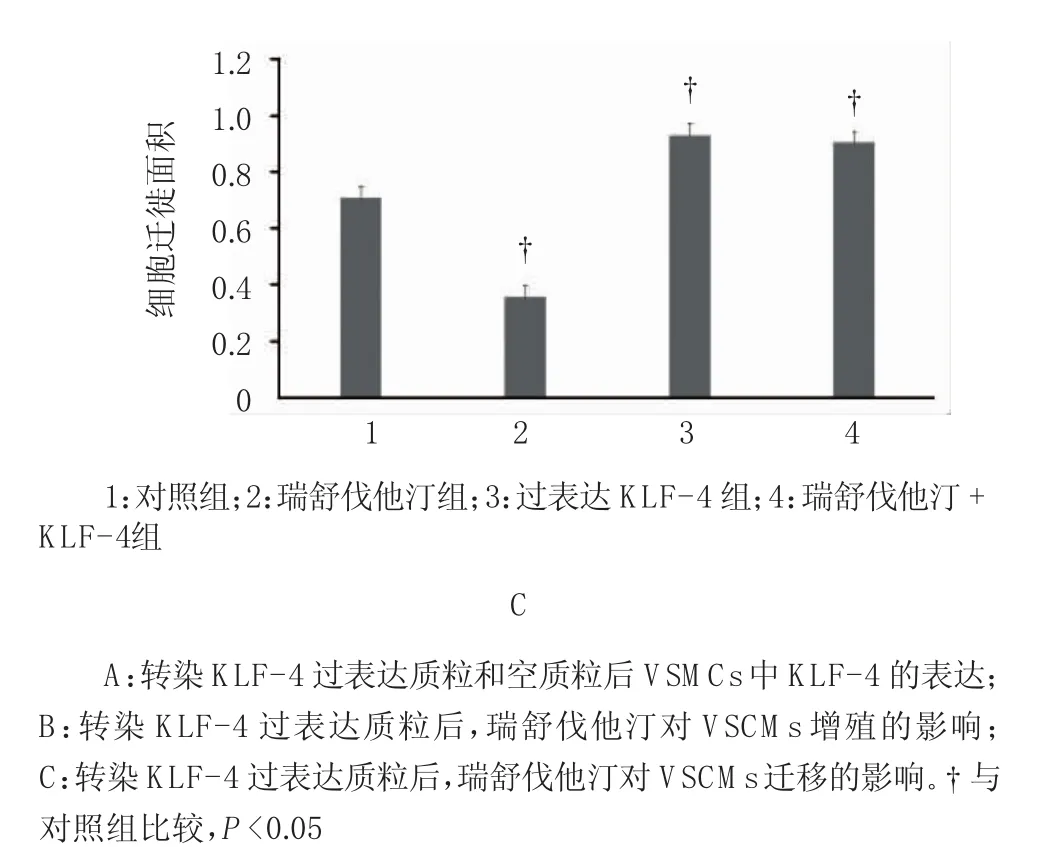
图5 过表达KLF-4逆转瑞舒伐他汀对VSMCs增殖和迁移的抑制作用
2.3.3 过表达KLF-4逆转瑞舒伐他汀对VSM C s内细胞表型相关蛋白的影响 与对照组比较,瑞舒伐他汀组SM-M H C、SM 22α表达增加,差异有统计学意义(F=31.541,P=0.000),OPN、KLF-4表达减少,差异有统计学意义(F=35.518,P=0.000);转染过表达KLF-4质粒后,与对照组比较,KLF-4组、瑞舒伐他汀+KLF-4组的SM-M H C、SM 22α表达减少,差异有统计学意义(F=5.784,P=0.032),OPN表达增加,差异有统计学意义(F=6.723,P=0.000),说明过表达KLF-4可以减少SM-M H C、SM 22α的表达,增加OPN的表达,逆转瑞舒伐他汀对VSM Cs表型转化的抑制作用。见图7。
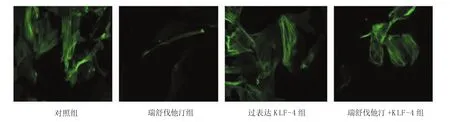
图6 过表达KLF-4逆转瑞舒伐他汀对VSMCs形态变化的抑制作用

图7 Western blot检测各组VSMCs中SM-actin、SM-22α、SM-MHC、OPN及KLF-4的表达
3 讨论
在不同的外界因素刺激下,VSM C有不同的细胞表型,具有很强的可塑性。在正常血管中膜中,VSM Cs是一种高分化细胞,细胞形态呈梭形,主要起维持血管形状和收缩血管的作用,具有低增殖、迁移慢、蛋白分泌少等特征[10]。当发生动脉粥样硬化等血管疾病时,VSM Cs可以去分化为未分化的细胞,细胞形态变圆,收缩性能下降,表现出高增殖、高迁移、高蛋白分泌等特征[11],在血管疾病的发生、发展中发挥重要的作用。
目前已经发现一大批特异性比较高,可以当作已分化成熟VSM Cs标志的蛋白,如与细胞收缩密切相关的 SM-act i n、SM-M H C、Cal poni n、SM 22α、Sm oot hel i n等蛋白,以及参与细胞骨架构成的H-cal desm on、Tel oki n、β-vi ncul i n、M et avi ncul i n、Desm i n等蛋白[3]。该蛋白在收缩型VSM Cs中高表达,其表达量随着VSM Cs的去分化而逐渐减少。相反,OPN、M M Ps、糖基质蛋白等在去分化的分泌型VSM Cs中高表达,并且表达量跟细胞的去分化程度呈正相关[4]。因此结合VSM Cs的增殖和迁移,再检测SM α-act i n、SM-M H C、 SM 22α及OPN等蛋白的表达,是近几年来国内外研究者常用的用来鉴别VSM Cs不同细胞表型的方法。
瑞舒伐他汀是一种选择性羟甲基戊二酸甲酰辅酶A还原酶抑制剂,通过减少甲羟戊酸的生成,从而抑制胆固醇的合成,进而降低血清中低密度脂蛋白的水平。最近许多研究表明,他汀类药物的疗效不仅能用其降脂作用来解释,而且具有保护血管内皮细胞、抗氧化、抗炎、抗心肌重构等作用[12]。笔者的实验结果显示,瑞舒伐他汀可以抑制VSM Cs的增殖和迁移,使VSM Cs细胞形态呈细长的梭形,增加SM-M H C、SM-22α的表达,减少OPN在VSM Cs中的表达,从而证实瑞舒伐他汀可以抑制VSM Cs表型转化,这可能也是其抗动脉粥样硬化的机制之一。同时,笔者也发现瑞舒伐他汀可以抑制VSM Cs中KLF-4的表达。
KLF-4是一种真核锌指蛋白转录因子,在细胞增殖分化、血管生成和肿瘤转移进展等多种生理、病理过程中发挥重要作用。过去的研究显示,转化生长因子-α、血小板衍生生长因子(pl at el et-deri ved growt h f act or-BB,PDGF-BB)、H cy等众多因素对VSM Cs增殖有影响[13-16]。CHENG[17]和DAVIS-DUSENBERY等[18]发现,m i croRNA-145是通过抑制 KLF-4而减少VSM Cs的表型转化。与此同时,ZH ENG等[19]的实验结果显示,在用PDGF-BB诱导VSM Cs表型转化时,KLF-4的表达升高,抑制KLF-4的表达可以抑制PDGF-BB诱导VSM Cs表型转化的作用。与上述研究结果相符,笔者通过向VSM Cs转染过表达KLF-4的质粒,发现KLF-4可以促进VSM Cs的增殖和迁移,可以逆转瑞舒伐他汀对VSM Cs表型转化的抑制作用。
本实验采用不同浓度的瑞舒伐他汀干预VSM Cs,发现瑞舒伐他汀具有抑制VSM Cs表型转化,减少KLF-4表达的作用。之后通过进一步向VSM Cs转染过表达KLF-4质粒,发现过表达KLF-4可以促进VSM Cs的增殖和迁移,逆转瑞舒伐他汀对VSM Cs表型转化的抑制作用,最终证实瑞舒伐他汀是通过下调KLF-4,抑制VSM Cs的表型转化。
[1]ROTLLA N N,W ANSCH EL A C,FERNANDEZ-H ERNANDO A, et al.Genet i c evi dence support s a m aj or rol e f or AKT1 i n vsm cs duri ng at herogenesi s[J].Ci rc Res,2015,116(11):1744-1752.
[2]OW ENS G K,KUM AR M S,W AM H OFF B R.M ol ecul ar regul at i on of vascul ar sm oot h m uscl e cel l di f f erent i at i on i n devel opm ent and di sease[J].Physi ol Rev,2004,84(3):767-801.
[3]ALEXANDER M R,OW ENS G K.Epi genet i c cont rol of sm oot h m uscl e cel l di f f erent i at i on and phenot ypi c swi t chi ng i n vascul ar devel opm ent and di sease[J].Annu Rev Physi ol,2012,74:13-40.
[4]JIANG H,LUN Y,W U X,et al.Associ at i on bet ween t he hypom et hyl at i on of ost eopont i n and i nt egri n bet a3 prom ot ers and vascul ar sm oot h m uscl e cel l di f f erent i at i on i n great saphenous vari cose vei ns[J].Int J M ol Sci,2014,15(10):18747-18761.
[5]GOM EZ D,OW ENS G K.Sm oot h m uscl e cel l phenot ypi c swi t chi ng i n at heroscl erosi s[J].Cardi ovasc Res,2012,95(2):156-164.
[6]CH ISTIAKOV D A,OREKH OV A N,BOBRYSH EV Y V.Vascul ar sm oot h m uscl e cel l i n at heroscl erosi s[J].Act a Physi ol(Oxf), 2015,214(1):33-50.
[7]KOH LI P,W ATERS D D,NEM R R,et al.Ri sk of new-onset di abet es and cardi ovascul ar ri sk reduct i on f rom hi gh-dose st at i n t herapy i n pre-di abet i cs and non-pre-di abet i cs:an anal ysi s f rom TNT and IDEAL[J].J Am Col l Cardi ol,2015,65(4):402-404.
[8]ROSENSON R S,KENT S T,BROW N T M,et al.Underut i l i zat i on of hi gh-i nt ensi t y st at i n t herapy af t er hospi t al i zat i on f or coronary heart di sease[J].J Am Col l Cardi ol,2015,65(3):270-277.
[9]SH I Y F,CH I JF,TANG W L,et al.Ef f ect s of rosuvast at i n on t he product i on and act i vat i on of m at ri x m et al l oprot ei nase-2 and m i grat i on of cul t ured rat vascul ar sm oot h m uscl e cel l s i nduced by hom ocyst ei ne[J].Journal of Zhej i ang Uni versi t y-Sci ence B, 2013,14(8):696-704.
[10]季军,潘一峰,何霞,等.超声靶向转染c-m yc基因的反义肽核酸抑制兔髂动脉平滑肌细胞增生的实验研究[J].中国现代医学杂志,2015,25(2):32-36.
[11]LIU R,LESLIE K L,M ARTIN K A.Epi genet i c regul at i on of sm oot h m uscl e cel l pl ast i ci t y[J].Bi ochi m Bi ophys Act a,2014, 24(4):567-579.
[12]TOUSOULIS D,PSARROS C,DEM OSTH ENOUS M,et al.Innat e and adapt i ve i nf l am m at i on as a t herapeut i c t arget i n vascul ar di sease:t he em ergi ng rol e of st at i ns[J].J Am Col l Cardi ol, 2014,63(23):2491-2502.
[13]ZH ENG B,H AN M,W EN JK.Rol e of Kruppel-l i ke f act or 4 i n phenot ypi c swi t chi ng and prol i f erat i on of vascul ar sm oot h m uscl e cel l s[J].IUBM B Li f e,2010,62(2):132-139.
[14]YU K,ZH ENG B,H AN M,et al.ATRA act i vat es and PDGFBB represses t he SM 22 al pha prom ot er t hrough KLF4 bi ndi ng t o,or di ssoci at i ng f rom,i t s ci s-DNA el em ent s[J].Cardi ovasc Res,2011,90(3):464-474.
[15]SIVRITAS D,BECH ER M U,EBRAH IM IAN T,et al.Ant i prol i f erat i ve ef f ect of est rogen i n vascul ar sm oot h m uscl e cel l s i s m edi at ed by Kruppel-l i ke f act or-4 and m anganese superoxi de di sm ut ase[J].Basi c Res Cardi ol,2011,106(4):563-575.
[16]GARVEY S M,SINDEN D S,SCH OPPEE BORTZ P D,et al. Cycl ospori ne up-regul at es Kruppel-l i ke f act or-4(KLF4)i n vascul ar sm oot h m uscl e cel l s and dri ves phenot ypi c m odul at i on i n vi vo[J].J Pharm acol Exp Ther,2010,333(1):34-42.
[17]CH ENG Y,LIU X,YANG J,et al.M i croRNA-145,a novel sm oot h m uscl e cel l phenot ypi c m arker and m odul at or,cont rol s vascul ar neoi nt i m al l esi on f orm at i on[J].Ci rc Res,2009,105(2):158-166.
[18]DAVIS-DUSENBERY B N,CH AN M C,RENO K E,et al. Down-regul at i on of Kruppel-l i ke f act or-4 (KLF4)by m i croRNA-143/145 i s cri t i cal f or m odul at i on of vascul ar sm oot h m uscl e cel l phenot ype by t ransf orm i ng growt h f act or-bet a and bone m orphogenet i c prot ei n 4[J].J Bi ol Chem,2011,286(32):28097-28110.
[19]ZH ENG B,H AN M,BERNIER M,et al.Kruppel-l i ke f act or 4 i nhi bi t s prol i f erat i on by pl at el et-deri ved growt h f act or recept or bet a-m edi at ed,not by ret i noi c aci d recept or al pha-m edi at ed, phosphat i dyl i nosi t ol 3-ki nase and ERK si gnal i ng i n vascul ar sm oot h m uscl e cel l s[J].J Bi olChem,2009,284(34):22773-22785.
(童颖丹 编辑)
Rosuvastatin inhibits phonotype transformation of vascular smooth muscle cells by down-regulation of KLF-4
Qing Han1,De-liang Shen2,Bo Wang2,Jin-ying Zhang2
(1.Department of Cardiology,Zhengzhou Central Hospital Affiliated to Zhengzhou University, Zhengzhou,Henan 450007,China;2.Department of Cardiology,the First Affiliated Hospital of Zhengzhou University,Zhengzhou,Henan 450052,China)
ObjectiveTo verify whether Rosuvastatin could inhibit vascular smooth muscle cell(VSMC) phonotype switch by down-regulation of KLF-4.MethodsThe primary culture and identification of SD rat VSMCs were conducted,VSMCs in the 3rd to 5th passages were used for the following experiments.After treatment with different concentrations of Rosuvastatin,MTT was used to investigate the proliferative ability of VSMCs.Transwell chambers and wound healing were employed to test the migration ability of VSMCs.IHC was used to detect the expression of SM-actin and the morphological structure of VSMCs.Western blot was used to investigate the expressions of SM-actin,SM-MHC,SM-22α,osteopontin (OPN)and KLF-4 in VSMCs. After KLF-4 was transfected into VSMCs,the metheods were used again to test the phonotype changes of the VSMCs.ResultsCompared with the control group,the migration and proliferation ability of the VSMCs were decreased in the Rosuvastatin group.The expressions of SM-actin,SM-22α and SM-MHC in the Rosuvastatin group were significantly increased(P<0.05),and the expression of OPN also increased(P<0.05).IHC showed the VSMCs in the Rosuvastatin group became thinner and longer than those of the control group.After KLF-4 was transfected into VSMCs,the proliferation and migration ability of the VSMCs increased (P<0.05).Over-expression of KLF-4 reversed the effect of Rosuvsatatin on VSMCs phonotype transformation.ConclusionsRosuvastatin inhibits VSMCs phonotype switch by down-regulation of KLF-4.
atherosclerosis;Rosuvastatin;VSMCs;phonotype switch
1005-8982(2017)03-0027-07
R 543.31
A
2016-01-26

