缺氧对细胞膜ABCA1降解的影响及其机制研究*
莫显刚,洪伟,王兰,张莉,刘大男,代陆军,蒋金,郜双林
(1.贵州医科大学附属医院 综合病房,贵州 贵阳 550004;2.贵州医科大学 医学分子生物学重点实验室,贵州 贵阳 550004;3.贵州医科大学附属医院 心内科,贵州 贵阳 550004;4.贵州医科大学附属医院 病理科,贵州 贵阳 550004)
缺氧对细胞膜ABCA1降解的影响及其机制研究*
莫显刚1,洪伟2,王兰1,张莉1,刘大男3,代陆军4,蒋金4,郜双林2
(1.贵州医科大学附属医院 综合病房,贵州 贵阳 550004;2.贵州医科大学 医学分子生物学重点实验室,贵州 贵阳 550004;3.贵州医科大学附属医院 心内科,贵州 贵阳 550004;4.贵州医科大学附属医院 病理科,贵州 贵阳 550004)
D O I:10.3969/j.i s s n.1005-8982.2017.03.003
目的探讨缺氧对细胞膜三磷酸腺苷结合盒转运体A1(ABC A1)降解的影响及其与钙蛋白酶的相关机制。方法肝X受体激动剂TO-901317刺激R AW 264.7细胞24h,实时定量聚合酶链反应检测ABC A1 m R N A表达水平。生物素标记法提取细胞膜蛋白,W es t ern bl ot检测细胞膜ABC A1蛋白水平表达。W es t ern bl ot检测在放线菌酮存在或不存在条件下,TO-901317干预的R AW 264.7细胞经过12 h缺氧(1%氧气O2)处理后细胞膜ABC A1蛋白水平,Suc-LLVY-氨基虫荧光素法检测缺氧细胞内钙蛋白酶活性。R AW 264.7细胞给予钙蛋白酶抑制剂ALLN干预,检测细胞膜ABC A1蛋白表达及钙蛋白酶活性。结果TO-901317上调ABC A1 m R N A及细胞膜蛋白水平表达。无论放线菌酮存在或不存在情况下,缺氧均能降低细胞膜ABC A1蛋白水平,升高钙蛋白酶活性。钙蛋白酶抑制剂ALLN能部分逆转缺氧诱导细胞膜ABC A1蛋白水平降低。结论缺氧可能通过增加钙蛋白酶活性,从而加速细胞膜ABC A1蛋白降解。
三磷酸腺苷结合盒转运体A1;缺氧;钙蛋白酶;放线菌酮
三磷酸腺苷结合盒转运体 A1(adenosi ne t ri phosphat e bi ndi ng casset t e t ransport er A1,ABCA1)将细胞内胆固醇排出,形成新生性高密度脂蛋白,是抗动脉粥样硬化的重要膜蛋白[1]。ABCA1基因可被肝X受体(l i ver x recept or,LXR)激动剂转录激活[2],ABCA1蛋白也可被钙蛋白酶介导蛋白降解[3]。动脉粥样硬化斑块中缺氧普遍存在[4-5],而且缺氧显著降低巨噬细胞胆固醇外排,延长缺氧时间,促进ABCA1蛋白水平下调[4],但是ABCA1基因启动子还存在缺氧反应元件,亦可被缺氧转录增强[6]。笔者前期研究也发现,缺氧诱导因子可增强钙蛋白酶表达及活性[7]。故推测缺氧可能参与钙蛋白酶介导细胞膜ABCA1降解,但鲜见相关文献报道。本研究上调巨噬细胞内源性ABCA1蛋白表达,抑制新蛋白生成,探讨缺氧对细胞膜ABCA1蛋白水平的影响。
1 材料与方法
1.1 仪器与试剂
三气培养箱(美国Therm o公司),超声破碎仪(KQ-500D A,昆山市超声仪器有限公司),Beckm an 21R型冷冻离心机(美国Beckm an公司),ABI实时荧光定量聚合酶链反应(quant i t at i ve real-t i m e pol ym erase chai n react i on,qRT-PCR)仪(9300型,美国Therm o公司),W est ern bl ot电泳仪(164-5051,美国Bi o-Rad公司),Synergy H T多检测酶标仪(美国BIOTEK公司)。RAW 264.7细胞购买于中国科学院上海细胞库,钙蛋白酶抑制剂(N-acet yl-Leu-Leu-Norl euci nal,ALLN)(美国Si gm a公司,货号:208719),ABCA1抗体(英国Abcam公司,货号:ab18180),β肌动蛋白抗体购于(英国Abcam公司,货号:ab8227),钙蛋白酶活性检测试剂盒(美国Prom ega公司,货号:G8501),LXR受体激动剂 TO-901317(美国Caym an公司,货号:71810),放线菌酮(美国Si gm a公司,货号:C7698),细胞表面蛋白提取试剂盒(美国Pi erce公司,货号:89881)。
1.2 细胞培养及实验分组
RA264.7细胞常规培养于达尔伯克必需基本培养基(dul becco's m i ni m um essent i al m edi um,DM EM)/ F12,取生长期细胞种植6孔板或75 cm2培养瓶,实验分为3步:①给予或不给予LXR受体激动剂TO-901317(1μm ol/L),分为空白对照组、二甲基亚砜(di m et hyl sul phoxi de,DM SO)组及TO-901317组,检测干预24 h前后ABCA1 m RNA及细胞膜蛋白水平;②缺氧对细胞膜ABCA1蛋白水平影响。取LXR受体激动剂干预后24 h细胞,放线菌酮(50 m m ol/l)或缺氧(1%氧气O2)共孵育12 h,分为常氧组、缺氧组、放线菌酮组+常氧组、放线菌酮+缺氧组,细胞生物素标记法提取膜蛋白,检测ABCA1含量,荧光法检测钙蛋白酶活性;③钙蛋白酶抑制剂ALLN(10μm ol/L)对ABCA1表达影响,分为常氧组、缺氧组、缺氧+ALLN组、缺氧+放线菌酮组、缺氧+放线菌酮+ALLN组,检测ABCA1含量及钙蛋白酶活性。
1.3 实验方法
1.3.1 qR T-PC R 提取总RNA,逆转录为cDNA,qRT-PCR 25μl反应体系包括SYBR Green qRTPCR反应混合物12.5μl、cDNA模板1μl、NH E-1、β肌动蛋白正反向引物各0.5μl。ABCA1正向引物:5'-GGACATGCACAAGGTCCTGA-3',反向引物:5'-CAGAAAATCCTGGAGCTTCAAA-3';β 肌动蛋白正向引物:5'-GCAGTTGGTTGGAGCAAACAT-3',反向引物:5'-AGGGACTTCCTGTAACCACT-3'。聚合酶链反应扩增条件:95℃预变性10 m i n;95℃变性30 s,58℃退火30 s,72℃拉伸30 s,共35个循环。读取样本中ABCA1和β肌动蛋白的CT值。β肌动蛋白作为内参照,目的基因相对表达量采用2-△△CT法进行计算。
1.3.2 生物素标记膜蛋白提取 严格按细胞表面蛋白提取试剂盒(美国Pi erce公司)说明书提取膜蛋白。培养细胞冷磷酸盐缓冲溶液冲洗2次,加入Sul f o-NH S-SS-Bi ot i n溶液10 m l,4℃下振荡孵育30 m i n,终止反应,刮取细胞加入50 m l离心管中,500 r/m i n离心3 m i n,去上清液。加入含蛋白抑制剂的细胞裂解液于沉淀中,转移至1.5 m l离心管,超声破碎5次,冰上继续裂解30 m i n,4℃、10 444 r/m i n离心2 m i n,上清转移至新离心管中。加入含蛋白抑制剂的细胞裂解液于1.5 m l离心管中。轻轻插入吸附柱,向柱中加入500μl Neut r Avi di n琼脂糖珠,加入上述生物素化上清,震荡室温孵育60 m i n,加入含蛋白抑制剂洗涤液离心。50 m m ol/L二硫苏糖醇的聚丙烯酰胺凝胶上样缓冲液加入吸附柱,震荡孵育60 m i n,吸附柱3 302 r/m i n离心2 m i n,收集含样本的聚丙烯酰胺凝胶上样缓冲液。
1.3.3 W es t ern bl ot检测细胞膜ABC A1蛋白 等量蛋白上样,聚丙烯酰胺凝胶电泳分离蛋白,转移到聚偏氟乙烯膜,5%脱脂牛奶封闭后孵育Ⅰ抗(抗ABCA1单抗,1∶1 000)过夜,孵育Ⅱ抗,增强化学发光显色。β肌动蛋白作为内参照。
1.3.4 钙蛋白酶活性检测 按钙蛋白酶活性检测试剂盒说明书操作步骤进行检测。已处理RAW 264.7细胞中加入无钙裂解液,取50μl蛋白上清液用来检测钙蛋白酶活性。每个样品分别加入含钙或无钙的缓冲液,再加入特异性荧光底物Suc-LLVY-氨基虫荧光素,37℃反应4 h,在Synergy H T多检测酶标仪读数(激发/发射波长为355/460 nm),其活性用含钙样品的读数减无钙样品的读数计算。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,多组比较用单因素方差分析,若方差齐组间两两比较用LSD-t检验,所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 LXR受体激动剂TO-901317对细胞ABCA1表达的影响
LXR受体激动剂TO-901317干预24 h,qRTPCR检测各组m RNA水平,经方差分析,差异有统计学意义(F=41.603,P=0.001)。DM SO组与空白对照组ABCA1 m RNA水平比较,差异无统计学意义(t= -0.166,P=0.595);TO-901317组与DSM O组ABCA1 m RNA水平比较,差异有统计学意义(t=11.343,P= 0.033),提示TO-901317组的m RNA水平高于DSM O组。W est ern bl ot检测结果显示,各组细胞膜ABCA1蛋白水平比较,经方差分析,差异有统计学意义(F= 23.340,P=0.003)。DM SO组与空白对照组细胞膜ABCA1蛋白水平比较,差异无统计学意义(t=0.250,P=0.896),而TO-901317组细胞膜ABCA1蛋白水平与DSM O组比较,差异有统计学意义(t=8.672,P= 0.044),提示TO-901317组细胞膜ABCA1水平高于DSM O组。故后续实验基于TO-901317干预后细胞进行ABCA1降解分析。见表1和图1。
表1 LXR受体激动剂对ABCA1表达的影响 (n=3±s)

表1 LXR受体激动剂对ABCA1表达的影响 (n=3±s)
注:†与DM SO组比较,P<0.05
组别ABCA1蛋白空白对照组 1.000±0.118 0.152±0.036 DM SO组 1.110±0.082 0.171±0.033 TO-901317组 8.671±1.407† 0.840±0.157†ABCA1 m RNA

图1 TO-9013177对RAW264.7细胞膜ABCA1蛋白的影响
2.2 缺氧及放线菌酮对细胞膜ABCA1蛋白及钙蛋白酶活性的影响
TO-901317干预后细胞给予放线菌酮或缺氧干预12 h,各组细胞膜ABCA1蛋白水平比较,经方差分析,差异有统计学意义(F=7.809,P=0.013)。常氧+放线菌酮组与常氧组细胞膜ABCA1蛋白水平比较,经LSD-t检验,差异无统计学意义(t=0.993,P=0.348);缺氧+放线菌酮组与缺氧组比较,经LSD-t检验,差异有统计学意义(t=-3.551,P=0.007),缺氧+放线菌组的细胞膜ABCA1蛋白水平低于缺氧组;更重要是,缺氧组与常氧组、缺氧+放线菌酮组与常氧+放线菌酮组分别进行比较,经LSD-t检验,差异有统计学差异(t=-8.797和-11.355,P=0.000),提示无论是否给予放线菌酮干预,缺氧条件下细胞膜ABCA1蛋白水平均低于常氧组。进而钙蛋白酶活性检测显示,各组钙蛋白酶活性比较,经方差分析,差异有统计学意义(F=132.619,P=0.000)。常氧+放线菌酮组与常氧组、缺氧+放线菌酮组与常氧+放线菌酮组分别进行比较,经LSD-t检验,差异无统计学意义(t= 0.603和2.104,P=0.563和0.068),提示无论常氧还是缺氧,放线菌酮不影响钙蛋白酶活性;但缺氧组与常氧组、缺氧+放线菌酮组与常氧+放线菌酮组分别进行比较,差异有统计学意义(t=24.342和22.239,P=0.000),缺氧组、缺氧+放线菌酮组钙蛋白酶活性分别高于常氧组、常氧+放线菌酮组,提示缺氧增强钙蛋白酶活性。见表2和图2。
2.3 ALLN对细胞膜ABCA1蛋白及钙蛋白酶活性的影响
给予ALLN干预后,W est ern bl ot检测ABCA1蛋白表达,各组蛋白水平比较,经方差分析,差异有统计学意义(F=64.604,P=0.000)。缺氧组与常氧组比较,经LSD-t检验,差异有统计学意义(t=-11.182,P=0.000),缺氧组的细胞膜ABCA1蛋白水平低于常氧组;缺氧+ALLN组与缺氧组比较,经LSD-t检验,差异有统计学意义(t=6.701,P=0.000),缺氧+ALLN组的细胞膜ABCA1蛋白水平高于缺氧组;缺氧+放线菌酮+ALLN组与缺氧+放线菌酮组比较,经LSD-t检验,差异有统计学意义(t=7.000,P=0.000),缺氧+放线菌酮+ALLN组ABCA1蛋白水平高于缺氧+放线菌酮组。上述结果提示,钙蛋白酶抑制剂ALLN可逆转缺氧诱导的细胞膜ABCA1蛋白水平降低。钙蛋白酶活性检测结果显示,各组钙蛋白酶活性比较,经方差分析,差异有统计学意义(F=576.793,P=0.000)。缺氧+ALLN组与缺氧组、缺氧+放线菌酮+ALLN组与缺氧+放线菌酮组分别进行比较,经LSD-t检验,差异有统计学意义(t=-29.783和-28.898,P=0.000),缺氧+ALLN组、缺氧+放线菌酮+ALLN组的钙蛋白酶活性分别低于缺氧组、缺氧+放线菌酮组,提示ALLN能抑制钙蛋白酶活性。见表3和图3。
表2 缺氧及放线菌酮对ABCA1蛋白及钙蛋白酶活性的影响 (n=3±s)

表2 缺氧及放线菌酮对ABCA1蛋白及钙蛋白酶活性的影响 (n=3±s)
注:1)与常氧组比较,P<0.05;2)与缺氧组比较,P<0.05;3)与常氧+放线菌酮组比较,P<0.05
组别常氧组ABCA1蛋白0.762±0.095钙蛋白酶活性/% 100.000±7.022缺氧组 0.313±0.0351) 326.953±17.2891)常氧+放线菌酮组 0.711±0.070 94.233±9.645缺氧+放线菌酮组 0.132±0.0181)2)3) 306.837±10.3521)2)3)

图2 缺氧及放线菌酮对RAW264.7细胞膜ABCA1蛋白的影响
表3 ALLN对ABCA1蛋白及钙蛋白酶活性的影响(n=3±s)
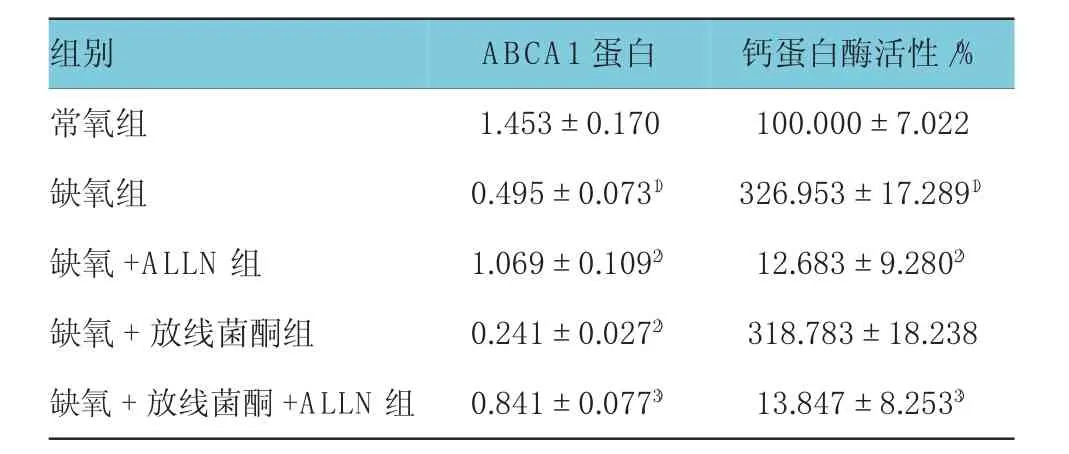
表3 ALLN对ABCA1蛋白及钙蛋白酶活性的影响(n=3±s)
注:1)与常氧组比较,P<0.05;2)与缺氧组比较,P<0.05;3)与缺氧+放线菌酮组比较,P<0.05
组别常氧组缺氧组ABCA1蛋白1.453±0.170 0.495±0.0731)钙蛋白酶活性/% 100.000±7.022 326.953±17.2891)缺氧+ALLN组 1.069±0.1092) 12.683±9.2802)缺氧+放线菌酮组 0.241±0.0272) 318.783±18.238缺氧+放线菌酮+ALLN组 0.841±0.0773) 13.847±8.2533)

图3 ALLN对细胞膜ABCA1蛋白的影响
3 讨论
缺氧导致细胞ABCA1蛋白水平降低及胆固醇外流异常[4]。本研究从ABCA1降解新角度探讨缺氧细胞ABCA1蛋白水平下降机制,结果显示,缺氧显著升高钙蛋白酶活性,降低ABCA1蛋白水平,这些效应能钙蛋白酶抑制剂部分逆转,提示钙蛋白酶介导ABCA1降解是缺氧诱导ABCA1蛋白水平降低的重要途径。
缺氧是机体重要的生理及病理生理过程。缺氧诱导因子积聚是细胞对缺氧的重要反应。研究发现,缺氧可以升高细胞内钙离子浓度,同时升高钙蛋白酶活性[7],钙蛋白酶被钙离子激活是广为接受的观点,故缺氧钙蛋白酶活性升高部分原因是钙离子升高所刺激。新近研究表明,缺氧时钙蛋白酶蛋白表达上调,可能是缺氧诱导钙蛋白酶活性升高的重要原因[8]。缺氧诱导钙蛋白酶活性升高,不仅仅是影响细胞膜上ABCA1蛋白降解,还可能降解其他蛋白,从而参与各种细胞活动及功能[8]。
本研究钙蛋白酶活性检测提示,缺氧上调钙蛋白酶活性,同时ABCA1蛋白水平降低,而且给予钙蛋白酶抑制剂,ABCA1蛋白水平回升。缺氧诱导ABCA1降解,可能至少包括钙蛋白酶介导ABCA1降解。钙蛋白酶介导ABCA1降解机制明确,但是其意义有待进一步明确,本研究发现可将缺氧诱与钙蛋白酶介导ABCA1降解联系起来。除缺氧外,还有其他重要因素或因子能升高钙蛋白酶[9-10],对进一步明确与钙蛋白酶相关ABCA1降解具有一定借鉴意义。
本实验主要研究缺氧对细胞膜上ABCA1表达的影响。笔者发现,缺氧下调细胞膜上ABCA1蛋白水平,该蛋白水平降低与既往研究ABCA1基因启动子区域拥有缺氧反应元件,并与H IF-1β相对应的ABCA1量升高不一致[6]。该m RNA水平高于膜蛋白水平的差异,可能是归因于转录后调控。首先,缺氧可能降低m RNA稳定性[11]。要形成活性膜蛋白需要从高尔基体转运至细胞膜[12],该过程可能受到缺氧调节。其次,膜蛋白更新,膜蛋白不断被降解。缺氧能否影响ABCA1 m RNA稳定性有待进一步研究。但是本研究利用LXR激动剂上调ABCA1后给予缺氧,并给予放线菌酮抑制新生蛋白产生,蛋白变化主要反映出ABCA1降解,表明缺氧加速ABCA1降解。ABCA1活性形式主要是细胞膜上ABCA1,而且有文献研究表明,钙蛋白酶在细胞膜附近被激活,可通过细胞骨架蛋白Ezri n参与进行[9]。本研究可在一定程度上解释缺氧时间短,ABCA1总蛋白无明显变化而胆固醇外流异常,而且在细胞膜ABCA1表达下降[4]。
本研究明确缺氧经钙蛋白酶途径促进ABCA1降解,但是缺氧如何促进钙蛋白酶介导ABCA1降解,以及如何调控等更详尽机制有待进一步研究。鉴于ABCA1在抗动脉粥样硬化中的独特的重要作用[13],本研究从ABCA1降解新角度,为深入探讨缺氧参与动脉粥样硬化新机制提供新思路。
[1]ORAM J F,LAW N R M,GARVIN M R,et al.ABCA1 i s t he cAM P-i nduci bl e apol i poprot ei n recept or t hat m edi at es chol est erol secret i on f rom m acrophages[J].J Bi ol Chem,2000,275:34508-34511.
[2]CH AW LA A,BOISVERT W A,LEE C H,et al.A PPAR gamm a-LXR-ABCA1 pat hway i n m acrophages i s i nvol ved i n chol est erol ef f l ux and at herogenesi s[J].M ol Cel l,2001,7:161-171.
[3]W ANG N,CH EN W,LINSEL-NITSCH KE P,et al.A PEST sequence i n ABCA1 regul at es degradat i on by cal pai n prot ease and st abi l i zat i on of ABCA1 by apoA-I[J].J Cl i n Invest,2003,111:99-107.
[4]PARATH ATH S,M ICK S L,FEIG JE,et al.H ypoxi a i s present i n m uri ne at heroscl erot i c pl aques and has m ul t i pl e adverse ef f ect s on m acrophage l i pi d m et abol i sm[J].Ci rc Res,2011,109:1141-1152.
[5]PEDERSEN S F,GRABE M,H AG A M,et al.(18)F-FDG i m agi ng of hum an at heroscl erot i c carot i d pl aques ref l ect s gene expressi on of t he key hypoxi a m arker H IF-1α[J].Am J Nucl M ed M ol Im agi ng,2013,3:384-392.
[6]UGOCSAI P,H OH ENSTATT A,PARAGH G,et al.H IF-1bet a det erm i nes ABCA1 expressi on under hypoxi a i n hum an m acrophages[J].Int J Bi ochem Cel l Bi ol,2010,42:241-252.
[7]M O X G,CH EN Q W,LI X S,et al.Suppressi on of NH E1 by sm al l i nt erf eri ng RNA i nhi bi t s H IF-1α-i nduced angi ogenesi s i n vi t ro vi a m odul at i on of cal pai n act i vi t y[J].M i crovasc Res,2011, 81:160-168.
[8]CUI W,ZH OU J,DEH NE N,et al.H ypoxi a i nduces cal pai n act i vi t y and degrades SM AD2 t o at t enuat e TGFβ si gnal i ng i n m acrophages[J].Cel l Bi osci,2015,5:36.
[9]YOUN JY,W ANG T,CAI H.An ezri n/cal pai n/PI3K/AM PK/eNOSs 1179 si gnal i ng cascade m edi at i ng VEGF-dependent endot hel i al ni t ri c oxi de product i on[J].Ci rc Res,2009,104:50-59
[10]苑聪,吴洁,姜志胜,等.胰岛素可通过cal pai n和prot easom e途径促进3T3-L1脂肪细胞三磷酸腺苷结合盒转运体A1的降解[J].中华心血管病杂志,2015,43:141-145.
[11]H OSOGAI N,FUKUH ARA A,OSH IM A K,et al.Adi pose t i ssue hypoxi a i n obesi t y and i t s i m pact on adi pocyt oki ne dysregul at i on[J].Di abet es,2007,56:901-911.
[12]NEUFELD E B,REM ALEY A T,DEM OSKY S J,et al.Cel l ul ar l ocal i zat i on and t raf f i cki ng of t he hum an abca1 t ransport er[J].J Bi ol Chem,2001,276:27584-27590.
[13]DEAN M,H AM ON Y,CH IM INI G.The hum an ATP-bi ndi ng casset t e(ABC)t ransport er superf am i l y[J].J Li pi d Res,2001,42:1007-1017.
(童颖丹 编辑)
Hypoxia enhances degradation of plasma membrane ABCA1 via increased calpain activity*
Xian-gang Mo1,Wei Hong2,Lan Wang1,Li Zhang1,Da-nan Liu3, Lu-jun Dai4,Jin Jiang4,Shuang-lin Gao2
(1.Comprehensive Ward,the Affiliated Hospital of Guizhou Medical University,Guiyang, Guizhou 550004,China;2.Key Laboratory of Medical Molecular Biology,Guizhou Medical University,Guiyang,Guizhou 550004,China;3.Department of Cardiology,4.Department of Pathology,the Affiliated Hospital of Guizhou Medical University,Guiyang, Guizhou 550004,China)
ObjectiveTo investigate the effect of hypoxia on the degradation of plasma membrane ATP binding cassette transporter A1 (ABCA1)and its calpain-related mechanism.MethodsqRT-PCR was used to detect ABCA1 mRNA level in RAW264.7 cells stimulated by liver X receptor agonist TO-901317 for 24 h. Plasma membrane protein was extracted by the biotin labeling method of surface proteins,and membrane ABCA1 protein level was determined by Western blot.Western blot was applied to detect the plasma membrane ABCA1 protein level from TO-901317-treated RAW264.7 cells after 12-h hypoxia (1%O2)treatment in the presence or absence of Cycloheximide.Furthermore,the calpain activity in the hypoxic cells was assayed by the method of Suc-LLVY-aminoluciferin.Finally,plasma membrane ABCA1 protein and calpain activity were measured in the RAW264.7 cells after intervention with calpain inhibitor ALLN.ResultsLXR agonist TO-901317 up-regulatedABCA1mRNA and membrane protein levels.Hypoxia reduced plasma membrane ABCA1 protein in the RAW264.7 cells and increased the calpain activity in the absence or presence of Cyclohex-imide.Calpain inhibitor ALLN,in part,reversed the decrease of plasma membrane ABCA1 induced by hypoxia.ConclusionsHypoxia might accelerate the degradation of plasma membrane ABCA1 via enhancement of calpain activity.
ATP binding cassette transporter A1;hypoxia;calpain;Cycloheximide
1005-8982(2017)03-0013-05
R 543.5;R 364
A
2016-02-24
国家自然科学基金(No:31260250)

