DNA纳米结构在药物载体与控制释放中的应用
张家笑, 寇 波, 怀 旭, 杭祖圣
(1.南京工程学院 材料工程学院,江苏 南京 211167; 2.华东理工大学 材料科学与工程学院,上海 200237; 3.江苏省先进结构材料与应用技术重点实验室,江苏 南京 211167)
DNA纳米结构在药物载体与控制释放中的应用
张家笑1,2, 寇 波1,3, 怀 旭1, 杭祖圣1,3
(1.南京工程学院 材料工程学院,江苏 南京 211167; 2.华东理工大学 材料科学与工程学院,上海 200237; 3.江苏省先进结构材料与应用技术重点实验室,江苏 南京 211167)
本文首先介绍了G四链体、双链结构、纳米管、折纸和立体笼状结构等DNA纳米结构用于药物载体时的载药特点;随后根据不同的刺激方式,从生物分子、pH、光和其他响应四个方面介绍了DNA纳米结构控制药物释放的途径及其利弊;进而对后续的研究提出了两点发展建议。
DNA纳米结构; 自组装; 纳米载体; 控制释放
1 引 言
自Seeman教授首次公开阐明DNA可以用来构建纳米结构以来,DNA纳米技术引起了研究者们广泛的关注,并获得了长足的发展。以DNA为基础的纳米结构在溶液中依靠碱基配对原则可以高效、精确地完成自组装[1],而纳米级的尺寸能够有效提高DNA纳米结构的药物利用率[2]。同时,由于自身固有的生物相容性和生物可降解性,DNA纳米结构往往长期积聚少、产生免疫反应小、生物毒性低。除了单独作为生物材料外,DNA纳米结构还可以方便地与其他生物友好型体系相配合。因此DNA纳米结构在药物传输与控制释放系统中具有良好的应用前景。
2 DNA纳米载体
DNA纳米结构作为药物载体在药物传输中具有非常独特的性能:能够同时承载多种药物分子,尤其像抗原、小片段干扰核糖核酸(siRNA)和适体等都无需化学修饰,特别是适体的修饰能够增加细胞摄取的选择性;对于形状、尺寸可以实现纳米尺度的控制以用于特定的药物传输;还具有生物相容性好、免疫原性低、毒性小等特点。从结构上可以将DNA纳米药物载体分为简单的G四链体结构、双链结构,以及复杂的一维纳米管结构、折纸结构和立体笼状结构等类型。
在早期的DNA纳米载体研究中,Tan等[3]以DNA的G四链体作为载体,在体外实验取得不错的效果。但是,G四链体所能承载的药物有限,通常都是那些因为药物本身的化学性质使得它们不经修饰就能插入G四链体中。随着G四链体在人体癌细胞中被发现,这些药物在人体癌细胞中的释放问题便成为不可解决的问题。此后,鲜有人再拿G四链体单独作为载体。
近几年,有人利用互补DNA链中相邻碱基对之间的凹槽来储存药物,因为单纯的互补DNA链的合成成本较低,而且这种载体体系设计很简单。例如,Tan等[4]构建的接有适体的DNA纳米“火车”,适体当作火车头,牵引着后面用交替的DNA短链储存药物的车厢。Um等[5]用茎-环状的RNA结构作为适体、DNA双链储存抗癌药物阿霉素(Dox)的体系,对前列腺癌具有非常好的疗效。但是以上的体系均以一条DNA双链为药物载体,载药量有限。如果为了提高载药量而延长DNA链复杂的生理环境会使得DNA链的稳定性大大下降。为此,Dabrowiak等[6]利用纳米金粒子(AuNP)固有的低毒性,尺寸形状易控制、表面可以连接多种有机体和配体等特点,在其表面用多条DNA双链修饰,从而缓和了DNA双链稳定性和载药量之间的矛盾。然而,与G四链体一样,这类体系承载的药物必须能插入到DNA双链中,所以承载的药物种类也十分有限。
除此之外,一维结构的DNA纳米管因为对生物膜具有更好的透过性也被作为载体。早在2008年Mao等[7]曾研究过由单一序列DNA形成的卷曲状纳米管,易被细胞摄入,并且没有表现出细胞毒性,但其结构和尺寸无法精确控制。Sleiman等[8]用三棱DNA纳米管组成大小交替的胶囊结构,当加入特定DNA链时发生链置换打开特定位置处的胶囊释放药物,这一结构有望用于基因响应的给药体系。
随着DNA折纸术的兴起,Ding等[9]用DNA折纸直接作为Dox载体,该载药纳米结构在乳腺癌细胞中表现良好,特别是对多耐药性(MDR)的癌细胞有较好效果。在DNA折纸结构的帮助下,Dox在细胞中内化作用增强,从而提高了多耐药性癌细胞中的药物积累。也可以通过DNA折纸术构造容器作为药物载体,Douglas等[10]通过DNA折纸术构造的六方形容器能够在复杂的环境下完成药物传输的工作。DNA折纸还被用来构筑纳米管载体,Bourquin等[11]用DNA折纸构筑的纳米管表面负载CpG序列后,能被细胞摄取并产生免疫响应。因为DNA折纸术是利用一条长的单链支架DNA,在数百条短链订书钉DNA链的帮助下得到特定形状的纳米结构的方法,所以反应对计量关系的精确度要求相对较低,可以得到较高的组装成功率和产率。
而用DNA构建的三维笼状结构更加紧固,细胞摄入能力强[12],在生理条件下稳定,并可以通过改变形状和尺寸以实现特定药物传输等优点,逐渐成为DNA纳米载体研究的热点。其中,DNA四面体被认为是最具实用性的DNA纳米结构,因为它可由DNA单链简单、高效的自组装。Ahn等[13]课题组就构建了这种简单的DNA正四面体给药系统(图1),可以逆转多耐药性,因为用DNA四面体承载的Dox能够有效规避耐药细胞的外排作用,高效地把Dox传到癌细胞中,改进已有DNA折纸载药系统构建较为复杂的缺点。但该系统仍然不能主动靶向癌细胞,只能通过被动内呑进入细胞。在这以后,Bermudez等在系统研究了DNA四面体作为载体在体内耐酶解、负载RNA、pH值响应解构[14]等性能的基础上,在DNA四面体上连接适体AS1411[15]提供靶向性,在不需要注射试剂的帮助下增强对靶向细胞摄入能力,同时有效抑制四面体结构降解。Anderson等[16]成功用DNA四面体制得了siRNA的体内给药系统,解决了siRNA穿膜能力差、无靶向功能、在生理环境中不稳定等siRNA药物开发中的关键问题。

图1 构建DNA四面体传输系统用于多耐药细胞:由四条单链DNA组装成四面体结构,Dox与重叠的双链DNA相互作用而吸附,然后载药四面体结构被细胞摄入后释放药物,最终导致细胞凋亡[13]Fig.1 Construction of DNA tetrahedron drug delivery system for drug-resistant cells: four single-stranded DNA assemble into tetrahedral structure, in which overlapping DNA duplexs serve as carrier due to their molecular interaction with Dox, then drug-loaded tetrahedral structure release drugs after being uptaken, eventually leading to cell apoptosis[13]
除了DNA四面体,有的人还构建了连接适体的二十面体来作为Dox的载体,通过不同外界条件定向杀死癌细胞。如Huang等[17]以五角形构建二十面体的模型为基础,嵌入适体得到六角形,并以此构建的二十面体自组装产率高达75%。同时,其表面因为适体存在而具有靶向性,整个体系可受环境的pH影响而控制释放药物。最近,Oh[18]还构建了仿生DNA纳米球,虽然在体内外都获得不错的效果,但是只能用来运输寡核苷酸,不具有普遍意义。立体笼状结构的多样性,将有效地扩大DNA纳米载体的应用范围。
作为载体,G四链体和双链结构虽然结构简单成本低,但载药量有限,载药品种少,稳定性不好,并且G四链体在癌细胞环境中的释放也存在问题。一维的纳米管对生物膜具有好的透过性,折纸结构对多耐药性的癌细胞有较好效果,立体笼状结构因为其紧密牢固的结构而呈现出更好的细胞摄入能力和体内稳定性;然而,它们的设计往往很复杂[10-11,15-17],纳米结构的构建需要消耗大量的DNA链,部分结构载药能力不大,成本较高,这些问题都将限制其在医药方面的产业化。总之,作为纳米载体,DNA纳米结构设计需要综合考虑稳定性、载药量、细胞摄入能力和构建的复杂度等因素。
3 DNA控制药物释放
DNA纳米结构不仅可以单独用作药物的载体,还可以修饰到其他载体上,通过刺激响应控制释放药物。相对于传统给药方式,药物的刺激响应控制释放具有主动靶向功能,有利于提高药物疗效、降低毒副作用,可减轻病人多次用药的痛苦,对于提高临床用药水平来说具有重大意义。由于DNA本身构象的多态性、良好的生物相容性以及稳定的物化特性,使其在刺激响应控制释放体系中成为很有吸引力的材料。
3.1 生物分子响应DNA控制释放
为了实现药物释放的时间、空间可控,比较常见的响应控制释放是以生物分子为刺激源。目前最常用的刺激源生物分子为腺苷三磷酸(ATP)。ATP是一种多功能核苷酸,在许多生物过程中起着至关重要的作用,包括肌肉收缩、细胞的新陈代谢、细胞内化合物的合成与降解和膜运输等;同时,它对于癌细胞的药物抗性也有明显的作用。因此,ATP响应型的控制释放体系对于生物有机体中的应用至关重要。ATP响应型的控制释放,通常将适体与载体连接来做控制开关。没有ATP时,适体或者以适体为基础构建的结构将药物封闭;当存在ATP时,适体与其紧密结合,导致适体结构转变直接实现药物释放[19](图2);或者在适体结构转变的基础上,加入剪切酶使得适体部分水解而间接地实现药物释放[20]。例如,Tang等[21]设计的体系通过适体和镶嵌在介孔硅纳米粒子(MSN)表面的两条单链DNA组成三明治型结构以封闭药物。加入ATP后,ATP和适体结合,导致DNA三明治型结构瓦解以释放药物。Gu等[22]则设计了ATP响应的纳米凝胶载药体系,进一步地研究其在带有肿瘤的老鼠体中的控制释放。该体系不仅能有效抑制肿瘤细胞的活性,减小肿瘤的尺寸,而且不改变老鼠的体重,不影响正常的细胞代谢,为其在临床应用中的可行性研究迈出了重要一步。

图2 适体与ATP结合导致结构改变以实现控制释放:加入ATP后,介孔硅纳米粒子(MSN)孔洞打开,释放荧光分子;移走ATP后,孔洞关闭[19]Fig.2 Aptamer combines with ATP, which resulted in structural change to achieve controlled release: in the presence of ATP, the caps on the surface of MSN are opened to release fluorescein; the caps would be closed when ATP is removed from the environment[19]
除了ATP响应控制释放以外,还有腺苷响应的体系。Song等[23]将单链DNA1修饰在MSN孔口,与DNA1部分互补的DNA2修饰在AuNP上,通过两条DNA1和DNA2的自组装,使得AuNP正好封闭MSN的孔口。在腺苷存在的条件下,DNA2与DNA1解链变性并与腺苷紧密结合,使得MSN的孔口被打开,从而释放药物。而Tan等[24]用连有适体的DNA链作交联剂,通过与水凝胶上修饰的DNA杂交形成网状结构以储存药物。当加入腺苷后,适体与腺苷结合,DNA解链导致网状结构瓦解,从而释放药物。具有细胞内信息传递作用的环磷酸鸟苷(cdGMP)分子也可用来控制释放[25],将cdGMP对应的适体楔入到DNA二十面体上,在cdGMP存在的情况下,通过链置换使得适体改变结构,从而破坏DNA二十面体结构,释放里面的药物。
3.2 pH响应DNA控制释放
肿瘤细胞能通过异常的能量代谢和对特定蛋白的自身调节,形成和维持一个不适合正常细胞生存的细胞外酸性微环境。针对肿瘤细胞的这种特点,近年来研究pH响应控制释放的人也越来越多。在这些pH响应的体系中,都充分地利用了人类DNA端粒i-motif结构的性质:在酸性条件下,端粒序列中的胞嘧啶(C)部分质子化可得到CC+碱基对,从而形成四链体结构;在碱性条件下则展开成单链结构。
Qu等最早把i-motif结构引入pH响应控制释放体系,可在碱性条件下释放药物。但是这个体系没有考虑到癌细胞外的酸性微环境。随后他们构建的新体系(图3)将i-motif序列作为颈环结构的环状部分,在中性或碱性条件下稳定,药物Dox与茎部双链结合;在酸性条件下,由于环状部分C碱基质子化形成i-motif结构,使得GCG-CGC之间的氢键遭到破坏带来Dox释放[26]。Song等[27]将DNA2设计成i-motif序列,在碱性条件下DNA2与DNA1杂交,DNA2连接的AuNP堵住MSN的孔洞;酸性条件下,DNA2形成i-motif结构,使得DNA2与DNA1的分离,AuNP离开孔洞而释放药物。Bermudez等[14]设计的四面体型DNA结构也含有i-motif序列,在碱性条件下立体结构稳定;但酸性条件下,i-motif结构的形成将导致DNA四面体结构部分瓦解,实现药物释放。Siwy等[28]构建的体系既对pH响应,又对电信号响应:不仅能像开关那样实现关闭与释放,也能像阀门那样控制药物的释放速率。
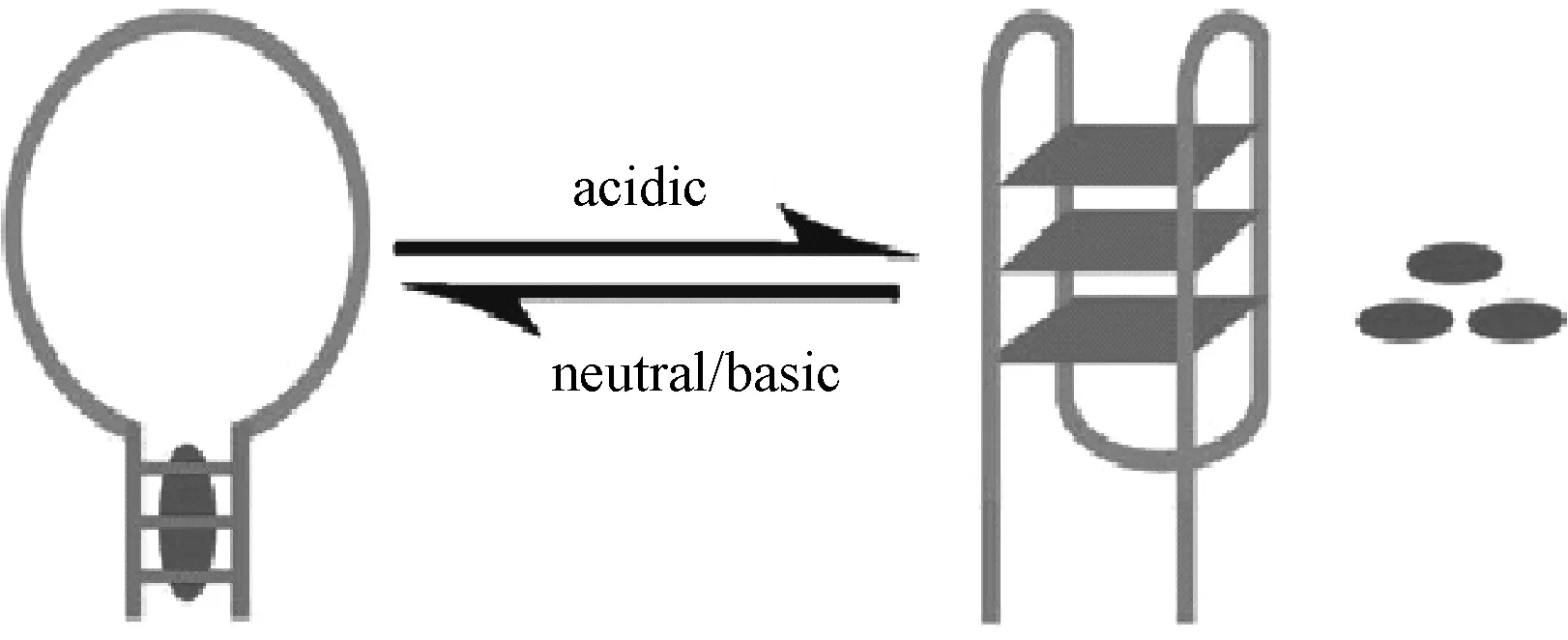
图3 富含C的茎-环发夹结构:在中性或者碱性条件下,药物嵌入发夹结构的茎位置处;随着pH的降低,i-motif结构形成,药物从茎位置处释放[26]Fig.3 A cytosine-rich hairpin DNA with stem-and-loop conformation: under neutral/base conditions, drugs are tethered at the stem of hairpin structure; as the pH value of its environment decreases, i-motif structure is formed to release drugs[26]
3.3 光响应DNA控制释放
光刺激作为一种单纯的外部刺激,不需要借助体内复杂的生理环境的变化,是一种洁净、无创、高效的刺激类型。DNA光响应波长主要在紫外光(UV)和近红外光区域,其中紫外光主要通过光致解链变性、光致断链、光致pH改变控制释放,而近红外光通过光热转换以实现控制释放。
针对光致解链变性体系,绝大多数的研究都是在DNA链中楔入偶氮苯分子实现的[29]。与文献[24]体系类似,Tan等[30]用带有偶氮苯的DNA链作为交联剂构建了体型结构,在UV照射下水凝胶溶解,以此实现药物的释放。Zhang等[31]在单链中楔入偶氮苯分子,然后将其一端接枝在MSN表面,另外一端用AuNP修饰。在UV/Vis交替照射下,通过局部解链和杂交以使AuNP封闭和打开孔口以实现控制释放。也有人用楔入偶氮苯分子的DNA双链杂交[32-33]来控制载体的孔口,通过偶氮苯的光致异构使得双链打开,从而释放药物。
将光敏分子插入DNA链中,可实现光致断链的效果。例如Qu等[34]把光敏剂卟啉衍生物插入到DNA链的四链体中,在430~440nm光照下,光敏剂将能量转移给周围的分子,生成活性氧,不仅可以导致细胞死亡,而且导致四链体以外的DNA链断裂。后者将使得用来封闭药物的四链体从MSN的表面脱离以实现药物的释放。这种协同效应将有效增强癌细胞的死亡率。Tan等[35]用光敏连接剂把分子信标(MB)和适体连接在一起,利用适体的靶向性,把MB输送到某一特定的mRNA处;在UV照射下光致断链释放MB,发挥MB在生物细胞中对mRNA的监测作用。
光致pH转变的体系往往是在体系中加入光敏物质,利用光敏物质在光照条件下发生反应而导致pH转变,从而改变DNA的结构。Liu等[36]首先把光敏物质孔雀石绿(MGCB)用于控制i-motif结构。在UV光照下MGCB解离出OH-,导致溶液体系pH突增,i-motif结构转变成无规线团状;在没有光照射时,体系pH下降,i-motif结构恢复。Wang等[37]在此基础上,将MGCB固定在MSN的纳米通道处,i-motif结构接枝在MSN的表面用来封闭孔口,在UV光照下,i-motif结构转变成单链,从而释放客体分子(图4)。
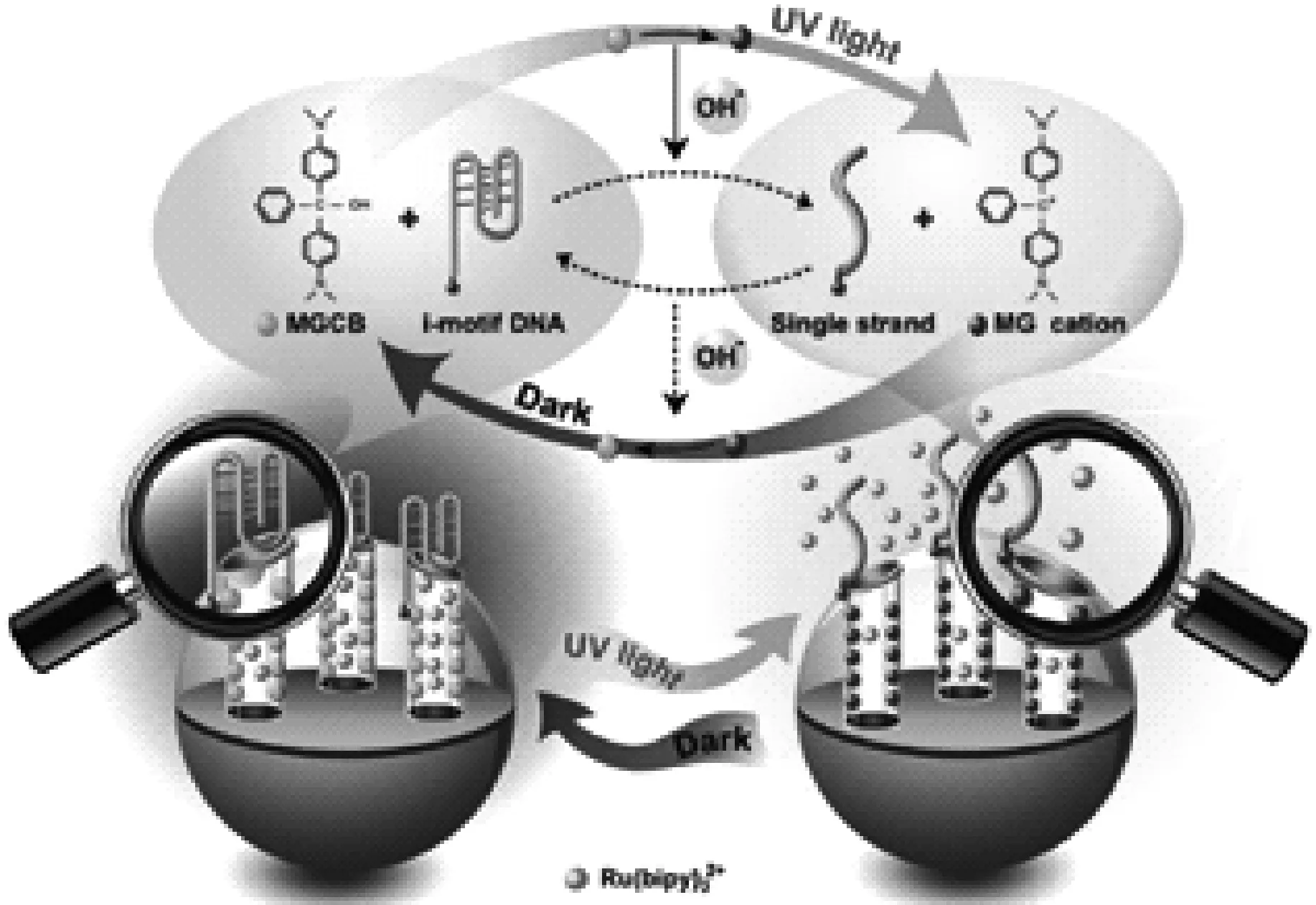
图4 i-motif 结构转变控制释放:无光照射时,DNA链呈i-motif结构以封闭药物;UV光照时,i-motif 结构瓦解形成单链状态,释放药物[37]Fig.4 Conformational switch of i-motif DNA to realize controlled release: in the absence of light, single-stranded DNA is i-motif structure with closed drugs; Upon UV-light irradiation, i-motif structure collapse to form single stranded state to release drugs[37]
除了以上UV响应释放,利用低维金属纳米粒子特殊的光热转换效应在药物载体的体系中嵌入AuNP,可以得到以近红外光(NIR)为刺激源的控制释放体系。在NIR的照射下,AuNP产生共振吸收并向周围传递热量,使得局部温度升高而导致DNA链解链或分解,由DNA链储存或封闭的药物便得以释放。Huang等[38]在AuNP表面用单层发夹结构DNA(hpDNA)修饰,hpDNA中的螺旋结构用来储存药物。在NIR的激光下,通过AuNP光热转换效应导致周围温度升高,使得螺旋结构解开以释放药物。这种体系虽然简单,但是不稳定,易被免疫系统识别,从而限制了其应用。于是Farokhzad等[39]在AuNP表面连接生物相容性较好的聚乙二醇(PEG)[40]降低免疫识别,体外和体内实验结果表明,在NIR的照射下,该体系选择性地将抗癌药物传递到靶向细胞,有效抑制癌细胞的生长。即使如此,AuNP表面连接大量的适体与PEG势必减少载药DNA链的连接,从而载药能力有限。Tan等[41]把DNA接枝到聚丙烯酰胺上,加入DNA互补链后,聚丙烯酰胺形成凝胶,可以包覆金-银纳米棒及药物。在NIR的辐射下,交联结构被破坏从而可控地释放药物。Qu等[42]将金纳米棒嵌入到介孔硅中,并在介孔硅的表面修饰DNA链,既作为适体提供靶向,又起到封闭和NIR光控释放作用,从而很好地改善了系统载药能力。
鉴于UV会对生物样品造成损伤,加上其透射能力不足,因此UV只适合体外研究,不利于临床应用。而NIR以其较强的透射能力、皮肤和组织对其吸收小、无损伤等优点,成为未来光响应控制药物释放比较理想的光源。
3.4 其他响应DNA控制释放
除了上述DNA控制释放体系外,还可以设计磁响应体系。例如Vallet-Regi等[43]在MSN里加入超顺磁性氧化铁纳米粒子,通过外加磁场,提供靶向作用;通过磁共振成像跟踪药物输送过程及其在生物体内的分布;在交变磁场的作用下,氧化铁纳米粒子吸收能量产生热能,在发挥热疗效能的同时,将热量传递给表面用来封闭药物的DNA双链,使得双链打开以释放药物。
另外还有许多DNA响应体系由于使用条件苛刻,对于有机生物体而言不太适合。例如链置换控制体系[8,44],无法解决向复杂环境的生物体中加入响应DNA序列的问题,而刺激响应链置换的发展也还不够成熟[45]。还有单纯靠升温来使DNA链打开的热响应体系[46-48],很难解决在生物体中升温的问题。以及离子响应的体系,如K+响应[49],靶向性太差;而Ag+类响应的体系[50],则会带来重离子的长期积聚。
4 结论与展望
DNA纳米结构无论是作为纳米载体还是在刺激响应控制释放系统中,都表现出良好的稳定性、可控性等优势,为其在药物治疗系统中的应用提供了无限可能。但是,该类研究起步较晚,其临床应用也需要各类研究者的共同努力来实现。笔者认为以下两个方面研究的展开,将会进一步拓宽DNA纳米结构在药物载体与控制释放系统中的应用:1)作为纳米载体,DNA纳米结构需要协调好稳定性、载药量、细胞的摄入能力和构建的复杂度等之间的矛盾;2)对于药物的刺激响应控制释放,目前绝大多数体系是单响应释放体系,未来应该考虑生物体中的复杂生理环境以及与药物配合使用。
[1] 张团红, 胡小玲, 乔吉超,等. 纳米胶囊的制备与应用进展[J]. 材料科学与工程学报, 2007, 25(1):143~146.
[2] 施维林, 马锡英. 应用DNA模版自组装CdS纳米线[J]. 材料科学与工程学报, 2008, 26(6):875~877.
[3] Wang K L, You M X, Chen Y, Han D, Zhu Z, Huang J, Williams K, Yang C Y J, Tan W H. Self-assembly of a bifunctional DNA carrier for drug delivery[J]. Angewandte Chemie, 2011, 50(27): 6098~6101.
[4] Zhu G Z, Zheng J, Song E, Donovan M, Zhang K J, Liu C, Tan W H. Self-assembled, aptamer-tethered DNA nanotrains for targeted transport of molecular drugs in cancer theranostics[J]. Proceedings of the National Academy of Sciences, 2013, 110(20): 7998~8003.
[5] Shin S W, Song W C, Kim A R, Cho S W, Kim D I, Um S H. Novel stem-loop RNA and drug-bearing DNA hybrid nanostructures specific to LNCaP prostate carcinoma[J]. Biomaterials Science, 2014, 2(1): 76~83.
[6] Alexander C M, Hamner K L, Maye M M, Dabrowiak J C. Multifunctional DNA-gold nanoparticles for targeted doxorubicin delivery[J]. Bioconjugate Chemistry, 2014, 25(7): 1261~1271.
[7] Ko S H, Liu H P, Chen Y, Mao C D. DNA nanotubes as combinatorial vehicles for cellular delivery[J]. Biomacromolecules, 2008, 9(11): 3039~3043.
[8] Lo P K, Karam P, Aldaye F A, Mclaughlin C K, Hamblin G D, Cosa G, Sleiman H F. Loading and selective release of cargo in DNA nanotubes with longitudinal variation[J]. Nature Chemistry, 2010, 2(4): 319~328.
[9] Jiang Q, Song C, Nangreave J, Liu X W, Lin L, Qiu D L, Wang G W, Zou G Z, Liang X J, Yan H, Ding B Q. DNA origami as a carrier for circumvention of drug resistance[J]. Journal of the American Chemical Society, 2012, 134(32): 13396~13403.
[10] Douglas S M, Bachelet I, Church G M. A logic-gated nanorobot for targeted transport of molecular payloads[J]. Science, 2012, 335(6070): 831~834.
[11] Schüller V J, Heidegger S, Sandholzer N, Nickels P C, Suhartha N A, Endres S, Bourquin C, Liedl T. Cellular immunostimulation by CpG-sequence-coated DNA origami structures[J]. ACS Nano, 2011, 5(12): 9696~9702.
[12] Walsh A S, Yin H F, Erben C M, Wood M J A, Turberfield A J. DNA cage delivery to mammalian cells[J]. ACS Nano, 2011, 5(7): 5427~5432.
[13] Kim K, Kim D, Lee T, Yhee J Y, Kim B, Kwon I C, Ahn D. Drug delivery by a self-assembled DNA tetrahedron for overcoming drug resistance in breast cancer cells[J]. Chemical Communications, 2013, 49(20): 2010~2012.
[14] Keum J, Bermudez H. DNA-based delivery vehicles: pH-controlled disassembly and cargo release[J]. Chemical Communications, 2012, 48(99): 12118~12120.
[15] Charoenphol P, Bermudez H. Aptamer-targeted DNA nanostructures for therapeutic delivery[J]. Molecular Pharmaceutics, 2014, 11(5): 1721~1725.
[16] Lee H, Lytton-Jean A K R, Chen Y, Love K T, Park A I, Karamiannis E D, Sehgal A, Querbes W, Zurenko C S, Jayaraman M, Peng C G, Charisse K, Borodovsky A, Manoharan M, Donahoe J S, Truelove J, Nahrendorf M, Langer R, Anderson D G. Molecularly self-assembled nucleic acid nanoparticles for targeted in vivo siRNA delivery[J]. Nature Nanotechnology, 2012, 7(6): 389~393.
[17] Chang M, Yang C S, Huang D M. Aptamer-conjugated DNA icosahedral nanoparticles as a carrier of doxorubicin for cancer therapy[J]. ACS Nano, 2011, 5(8): 6156~6163.
[18] Kim M G, Park J Y, Shim G Y, Choi H, Oh Y. Biomimetic DNA nanoballs for oligonucleotide delivery[J]. Biomaterials, 2015, 62: 155~163.
[19] Özalp V C, Pinto A, Nikulina E, Andrey C, Schäfer T. In situ monitoring of DNA-aptavalve gating function on mesoporous silica nanoparticles[J]. Particle & Particle Systems Characterization, 2014, 31(1): 161~167.
[20] Zhang Z X, Balogh D, Wang F A, Sung S Y, Nechushtai R, Willner I. Biocatalytic release of an anticancer drug from nucleic-acids-capped mesoporous SiO2 using DNA or molecular biomarkers as triggering stimuli[J]. ACS Nano, 2013, 7(10): 8455~8468.
[21] He X X, Zhao Y X, He D G, Wang K M, Xu F Z, Tang jin L. ATP-responsive controlled release system using aptamer-functionalized mesoporous silica nanoparticles[J]. Langmuir, 2012, 28(35): 12909~12915.
[22] Mo R, Jiang T Y, DiSanto R, Tai W Y, Gu Z. ATP-triggered anticancer drug delivery[J]. Nature Communications, 2014, 5(3): 3364~3364.
[23] Chen L F, Wen Y Q, Su B, Di J C, Song Y L, Jiang L. Programmable DNA switch for bioresponsive controlled release[J]. Journal of Materials Chemistry, 2011, 21(36): 13811~13816.
[24] Liu J, Liu H X, Kang H Z, Donovan M, Zhu Z, Tan W H. Aptamer-incorporated hydrogels for visual detection, controlled drug release, and targeted cancer therapy[J]. Analytical and Bioanalytical Chemistry, 2012, 402(1): 187~194.
[25] Banerjee A, Bhatia D, Saminathan A, Chakraborty S, Kar S, Krishnan Y. Controlled release of encapsulated cargo from a DNA icosahedron using a chemical trigger[J]. Angewandte Chemie, 2013, 125(27): 6992~6995.
[26] Xu C, Zhao C Q, Ren J S, Qu X Q. pH-controlled reversible drug binding and release using a cytosine-rich hairpin DNA[J]. Chemical Communications, 2011, 47(28): 8043~8045.
[27] Chen L F, Di J C, Cao C Y, Zhao Y, Ma Y, Luo J, Wen Y Q, Song W Q, Song Y L, Jiang L. A pH-driven DNA nanoswitch for responsive controlled release[J]. Chemical Communications, 2011, 47(10): 2850~2852.
[28] Buchsbaum S F, Nguyen G, Howorka S, Siwy Z S. DNA-modified polymer pores allow pH-and voltage-gated control of channel flux[J]. Journal of the American Chemical Society, 2014, 136(28): 9902~9905.
[29] 寇波, 谈玲华, 王倡春, 肖守军. 光控 DNA 可逆杂交/解链及其应用[J]. 化学进展, 2014, 26(10): 1720~1730.
[30] Kang H Z, Liu H P, Zhang X L, Yan J L, Zhu Z, Peng L, Yang H H, Kim Y, Tan W H. Photoresponsive DNA-cross-linked hydrogels for controllable release and cancer therapy[J]. Langmuir, 2010, 27(1): 399~408.
[31] Wen Y Q, Xu L P, Wang W Q, Wang D Y, Du H W, Zhang X J. Highly efficient remote controlled release system based on light-driven DNA nanomachine functionalized mesoporous silica[J]. Nanoscale, 2012, 4(15): 4473~4476.
[32] Yuan Q, Zhang Y F, Chen T, Lu D Q, Zhao Z L, Zhang X B, Li Z X, Yan C H, Tan W H. Photon-manipulated drug release from a mesoporous nanocontainer controlled by azobenzene-modified nucleic acid[J]. ACS Nano, 2012, 6(7): 6337~6344.
[33] Takenaka T, Endo M, Suzuki Y, Yang Y Y, Emura T, Hidaka K, Kato T, Miyata T, Namba K, Sugiyama H. Photoresponsive DNA nanocapsule having an open/close system for capture and release of nanomaterials[J]. Chemistry-A European Journal, 2014, 20(46): 14951~14954.
[34] Chen C, Zhou L, Geng J, Ren J S, Qu X G. Photosensitizer-incorporated quadruplex DNA-gated nanovechicles for light-triggered, targeted dual drug delivery to cancer cells[J]. Small, 2013, 9(16): 2793~2800.
[35] Qiu L P, Wu C C, You M X, Han D, Chen T, Zhu G Z, Jiang J H, Yu R Q, Tan W H. A targeted, self-delivered, and photocontrolled molecular beacon for mRNA detection in living cells[J]. Journal of the American Chemical Society, 2013, 135(35): 12952~12955.
[36] Liu H J, Xu Y, Li F Y, Yang Y, Wang W X, Song Y L, Liu D S. Light-driven conformational switch of i-motif DNA[J]. Angewandte Chemie, 2007, 46(14): 2515~2517.
[37] He D G, He X X, Wang K M, Cao J, Zhao Y X. A photon-fueled gate-like delivery system using i-motif DNA functionalized mesoporous silica nanoparticles[J]. Advanced Functional Materials, 2012, 22(22): 4704~4710.
[38] Luo Y L, Shiao Y S, Huang Y F. Release of photoactivatable drugs from plasmonic nanoparticles for targeted cancer therapy[J]. ACS Nano, 2011, 5(10): 7796~7804.
[39] Xiao Z Y, Ji C W, Shi J J, Pridgen E M, Frieder J, Wu J, Farokhzad O C. DNA self-assembly of targeted near-infrared-responsive gold nanoparticles for cancer thermos- chemotherapy[J]. Angewandte Chemie, 2012, 51(47): 11853~11857.
[40] 冯志云, 吴敏, 朱昌平,等. 聚乙二醇共价交联海藻酸钠凝胶制备及其药物缓释性能[J]. 材料科学与工程学报, 2015, 33(3):368~371.
[41] Kang H Z, Trondoli A C, Zhu G Z, Chen Y, Chang Y, Liu H P, Huang Y, Zhang X L, Tan W H. Near-infrared light-responsive core-shell nanogels for targeted drug delivery[J]. ACS Nano, 2011, 5(6): 5094~5099.
[42] Yang X J, Liu X, Liu Z, Pu F, Ren J S, Qu X G. Near-infrared light-triggered, targeted drug delivery to cancer cells by aptamer gated nanovehicles[J]. Advanced Materials, 2012, 24(21): 2890~2895.
[43] Ruiz-Hernandez E, Baeza A, Vallet-Regi M. Smart drug delivery through DNA/magnetic nanoparticle gates[J]. ACS Nano, 2011, 5(2): 1259~1266.
[44] Zhu J B, Zhang L B, Li T, Dong S J, Wang E K. Enzyme-free unlabeled DNA logic circuits based on toehold-mediated strand displacement and split G-quadruplex enhanced fluorescence[J]. Advanced Materials, 2013, 25(17): 2440~2444.
[45] Kou B, Zhang J X, Xu H, Xiao S J. Light-driven reversible strand displacement using glycerol azobenzene inserted DNA[J]. Rsc Advances, 2014, 5:5055~5058.
[46] Schlossbauer A, Warncke S, Gramlich P M E, Kecht J, Manetto A, Carell T, Bein T. A programmable DNA-based molecular valve for colloidal mesoporous silica[J]. Angewandte Chemie, 2010, 49(28): 4734~4737.
[47] Chen C, Geng J, Pu F, Yang X J, Ren J S, Qu X G. Polyvalent nucleic acid/mesoporous silica nanoparticle conjugates: dual stimuli- responsive vehicles for intracellular drug delivery[J]. Angewandte Chemie, 2011, 50(4): 882~886.
[48] Zhou S W, Du X Z, Cui F B, Zhang X F. Multi-responsive and logic controlled release of DNA-gated mesoporous silica vehicles functionalized with intercalators for multiple delivery[J]. Small, 2014, 10(5): 980~988.
[49] Wen Y Q, Xu L P, Li C B, Du H W, Chen L F, Su B, Zhang Z L, Zhang X J, Song Y L. DNA-based intelligent logic controlled release systems[J]. Chemical Communications, 2012, 48(67): 8410~8412.
[50] He D Q, He X X, Wang K M, Chen M, Cao J, Zhao Y X. Reversible stimuli-responsive controlled release using mesoporous silica nanoparticles functionalized with a smart DNA molecule-gated switch[J]. Journal of Materials Chemistry, 2012, 22(29): 14715~14721.
Applications of DNA Nanostructures in Drug Carrier and Controlled Release System
ZHANG Jiaxiao1, 2, KOU Bo1,3, HUAI Xu1, HANG Zusheng1,3
(1. School of Materials Science and Engineering, Nanjing Institute of Technology, Nanjing 211167, China; 2.School of Materials Science and Engineering, East China University of Science and Technology, Shanghai 200237, China; 3.Jiangsu Key Laboratory of Advanced Structural Materials and Application Technology, Nanjing 211167, China)
In this paper, characteristics of five different DNA nanostructures used as drug carrier are introduced. They were G-quadruplex, double-chains structure, nano-tube, Origami and Stereo cage. Then, according to different stimuli, the routes to release drug by the DNA nanostructures and their advantages and disadvantages are introduced from variable ways including biological molecules, pH, photo irradiation and other stimulations. Moreover, two suggestions for further research in DNA nanostructures in the drug carrier and controlled release system are proposed.
DNA nanostructures; self-assembly; nano-carrier; controlled release
1673-2812(2017)01-0166-07
2015-11-09;
2016-01-04
国家自然科学基金资助项目(NSFC 21603102),江苏省自然科学基金资助项目(BK20160773),南京工程学院校级科研基金资助项目(ZKJ201501),南京工程学院大学生科技创新基金资助项目(N20140208)
张家笑(1993-),男,硕士研究生,主要研究方向为DNA纳米载体。
寇 波(1982-),男,讲师,主要研究方向为DNA纳米材料光控改性,E-mail:koutianbo@hotmail.com。
R318.08;TQ460.4
A
10.14136/j.cnki.issn 1673-2812.2017.01.033

