玉米肽-锌螯合物结构表征及抗氧化活性分析
张 智,刘 慧,刘 奇,郑喜群*,曲 巍,杨可心
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.齐齐哈尔大学 黑龙江省普通高校农产品加工重点实验室,黑龙江 齐齐哈尔 161006)
玉米肽-锌螯合物结构表征及抗氧化活性分析
张 智1,刘 慧1,刘 奇1,郑喜群2,*,曲 巍1,杨可心1
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.齐齐哈尔大学 黑龙江省普通高校农产品加工重点实验室,黑龙江 齐齐哈尔 161006)
以玉米肽(corn peptide,CP)为参照研究玉米肽-锌(CP-Zn)螯合物的结构表征和体内抗氧化活性变化。采用氨基酸分析、紫外扫描、红外光谱研究结构变化;对小鼠灌胃不同剂量的CP、CP-Zn(低、中、高剂量组分别为50、150、250 mg/(kg·d)),测其血清、肝脏中丙二醛(malondialdehyde,MDA)含量,超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力,分析比较CP、CP-Zn体内抗氧化活性。结果表明:螯合前后氨基酸组成、紫外吸收光谱、红外吸收光谱存在明显变化,Zn2+与—COOH、—NH2、C=O进行了配位;CP高剂量、CP-Zn高、中剂量能显著降低小鼠血清、肝脏中MDA含量(P<0.05或P<0.01),提高SOD活力(P<0.01)、GSH-Px活力(P<0.05或P<0.01),CP-Zn抗氧化活性优于CP。由此可见,CP-Zn属于螯合物,同时具有增强CP抗氧化活性的作用。
玉米肽-锌螯合物;结构;抗氧化
蛋白生物活性肽具有多种生理功能[1],不同原料来源的蛋白活性肽由于不同的氨基酸组成和连接方式,其生理活性也多种多样[2]。其中Huang Wenhao等[3]研究表明玉米肽对高血压大鼠具有降压的作用,宋亮等[4]通过酶解玉米蛋白粉制备的ACE抑制肽,抑制率达到85.65%;在解酒功能方面Yamaguchi[5]、Yu Guocai[6]等先后做了深入研究,结果表明玉米肽中疏水性氨基酸在解酒方面具有重要作用;Li Jiangtao等[7]研究了玉米肽抗肿瘤机制,结果表明玉米肽能有效的抑制癌细胞,还可以增强小鼠的免疫系统,因此玉米肽被认为是一种安全有效的具有抗癌功能的活性肽;同时玉米肽具有抗氧化[8]、降血脂[9]、抗疲劳[10]、增强记忆力[11]、增强运动能力[12]等功能。在抗氧化方面,王子怀等[13]对肽-金属螯合物进行的综述表明,与具有抗氧化活性的金属离子螯合可提高原肽的活性,甚至优于目前广泛使用的抗氧化剂。Prasad等[14]以及俞园园[15]阐述了锌在抗氧化活性方面有着重要的作用,同时方细绢[16]、林谢凤[17]等已陆续报道肽-锌螯合可以提高抗氧化活性。螯合是一门高新技术,肽-锌螯合是Zn2+嵌合在两个肽分子中间的一种新结构形式,肽分子像“蟹钳”一样钳着Zn2+,形成稳定的螯合结构,由于肽可通过肠黏膜细胞直接进入血液[18],使Zn2+和小肽一起进入机体进而促进人体吸收[19],进而能有效提高其生物利用率[20]。肽-锌具有化学结构稳定、适口性好、副作用少、具有一定的生物学效价以及生物活性功能等优势,具有广阔的市场前景。
本实验采用Zn2+修饰玉米肽(corn peptide,CP)生成玉米肽-锌(CP-Zn)螯合物,以期提高玉米肽抗氧化活性,同时到达补充微量元素锌的作用。通过氨基酸分析、紫外扫面、傅里叶变换红外光谱对CP-Zn螯合位点初步鉴定,观察CP、CP-Zn螯合物对小鼠血清、肝脏中丙二醛(malondialdehyde,MDA)含量、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性的影响,分析比较CP、CP-Zn螯合物的抗氧化活性,为拓展玉米肽的应用范围和领域提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
玉米肽由齐齐哈尔大学食品与生物工程学院提供。
MDA试剂盒、SOD试剂盒、GSH-Px试剂盒 南京建成生物工程研究所;溴化钾(光谱纯) 天津市光复精细化工研究所;其他试剂均为国产分析纯。
1.1.2 实验动物
SPF级小鼠(合格证号:SCXK黑2013-004)6~8 周龄,18~22 g,由黑龙江省中医药大学药物评价中心提供。
1.1.3 仪器与设备
722s可见分光光度计 上海精密科学仪器有限公司;TU-1810紫外分光光度计 北京普析通用仪器有限公司;Nicolet IS10傅里叶变换红外光谱仪 美国Thermo Fisher公司;L-8800氨基酸分析仪 日本日立公司。
1.2 方法
1.2.1 CP-Zn螯合物制备
玉米肽通过Sephadex G-25分级得到肽段(平均分子质量为572 D,肽含量为75.83%),肽段与硫酸锌按质量比8∶1,在pH 6.2条件下,60 ℃水浴40 min,而后4 000 r/min离心15 min,上清液经流水透析24 h,置于烘箱60 ℃烘干,得到淡黄色针状粉末,为CP-Zn螯合物,备用。
1.2.2 CP-Zn螯合物组成成分及螯合率的测定
水分含量的测定:采用直接干燥法,参照GB 5009.3—2010《食品中水分的测定》;蛋白含量测定:采用微量凯氏定氮法,参照GB 5009.5—2010《食品中蛋白质的测定》。
含锌量测定:采用乙二胺四乙酸滴定法。将CP-Zn螯合物配制成0.2 g/mL溶液,取10 mL于锥形瓶中,加入10 mL NH3-NH4Cl缓冲溶液,滴入铬黑T指示剂,用0.01 mol/L的乙二胺四乙酸二钠滴定,溶液由紫色变为淡蓝色停止滴定,记录消耗乙二胺四乙酸二钠的体积,按式(1)计算含锌量,按式(2)计算锌的螯合率。
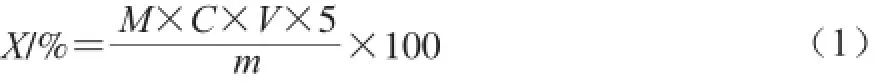
式中:X为CP-Zn螯合物含锌量/%;M为锌的摩尔质量/(g/mol);C为乙二胺四乙酸二钠的浓度/(mol/L);V为滴定乙二胺四乙酸二钠的体积/mL;m为称取CP-Zn螯合物的质量/g。

式中:Y为锌的螯合率/%;m为CP-Zn螯合物的质量/g;m’为锌的投入量/g。
1.2.3 CP-Zn螯合物结构表征分析
1.2.3.1 氨基酸组成分析
准确称取CP、CP-Zn螯合物10 mg,放入消化管中,加入12 mL 6 mol/L的HCl并充入氮气,置于120 ℃烘箱中水解10 h,用氨基酸自动分析仪测定其中氨基酸组成及含量。
1.2.3.2 紫外扫描分析
将CP以及CP-Zn螯合物配制成1.6 mg/mL的水溶液,在200~400 nm波长范围内进行紫外扫描。
1.2.3.3 傅里叶变换红外光谱分析
分别取CP及CP-Zn螯合物样品2 mg和干燥的光谱纯KBr 200 mg放入玛瑙研钵中,混合研磨均匀。将研磨完毕的粉末装入压片模具,抽气加压,使压力在60 MPa左右维持5 min。卸掉压力得到透明的薄片,放入红外光谱仪进行扫描分析,在400~4 000 cm-1范围内测定其红外吸收光谱。
1.2.4 抗氧化活性实验分组
将小鼠随机分组,各组小鼠同室分笼饲养,灌胃给药,30 d喂养,给药剂量根据《保健食品功能学评价程序和检验方法》拟定[21],具体实验安排如表1所示。
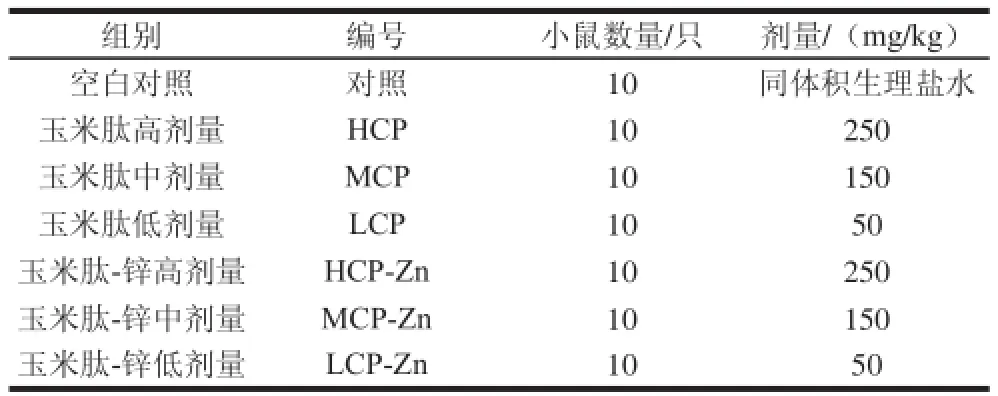
表1 抗氧化活性实验分组Table1 Grouping of mice for evaluation of in vviivvoo antioxidant activ ity
1.2.5 体内抗氧化指标测定
停药后隔日处死小鼠,眼眦取血,3 500 r/min离心15 min,取上层血清液。解剖小鼠,取肝脏用生理盐水清理干净后用吸水纸吸取水分,称取肝组织制备10%的肝组织匀浆,3 000 r/min离心10 min,取上清液。血清以及组织匀浆上清液均参照试剂盒说明书测定MDA含量、SOD活性、GSH-Px活性,用考马斯亮蓝试剂盒测定肝组织中蛋白含量。
1.3 数据统计分析
采用Excel软件整理数据,Origin 8.5软件作图,采用SPSS 19.0软件中Duncan氏多重比较检验进行,各组数据用±s表示,以P<0.05为统计学意义上的差异。
2 结果与分析
2.1 CP-Zn螯合物组成成分含量及螯合率分析

表2 CP-Zn螯合物的组成成分含量及螯合率分析Table2 Chemical composition and chelating rate of CP-Zn complex %
对CP-Zn螯合物的主要成分及螯合率分析结果如表2所示,可知组分中蛋白质及锌的含量相对较高,所占比例为83.17%;CP-Zn螯合率为76.68%,其他成分中包含灰分、脂肪、钠盐等,其中钠盐可能是由在螯合反应中调节pH值时加入NaOH或HCl所致,在后续透析纯化过程中未完全除尽。
2.2 CP-Zn螯合物结构表征分析
2.2.1 氨基酸组成分析
Zn2+与CP进行螯合时,对CP整体构象产生影响,由于氨基酸的极性和侧链基团的差异,对金属离子的亲和能力会有所不同,所以Zn2+会与对其具有较强亲和能力的氨基酸的氨基N原子和羧基O原子形成配位键。单位空间里,当Zn2+与氨基酸配位时,原有氨基酸的总量会发生变化,因此螯合前后氨基酸组分含量会有所不同。CP、CP-Zn螯合物进行氨基酸组成分析如表3所示,CP中抗氧化活性较强的氨基酸[22]占总氨基酸的7.9%,与Zn2+螯合后为9.8%,此方面与后面抗氧化活性效果相呼应;螯合前后,必需氨基酸占总氨基酸含量分别为34.06%、31.41%,变化趋势与汪婧瑜等[23]结果相似,螯合后氨基酸总量减少了5.49%,减少的部分可能由Zn2+代替,与霍健聪[24]结果相似,初步判断CP与Zn2+发生了反应。
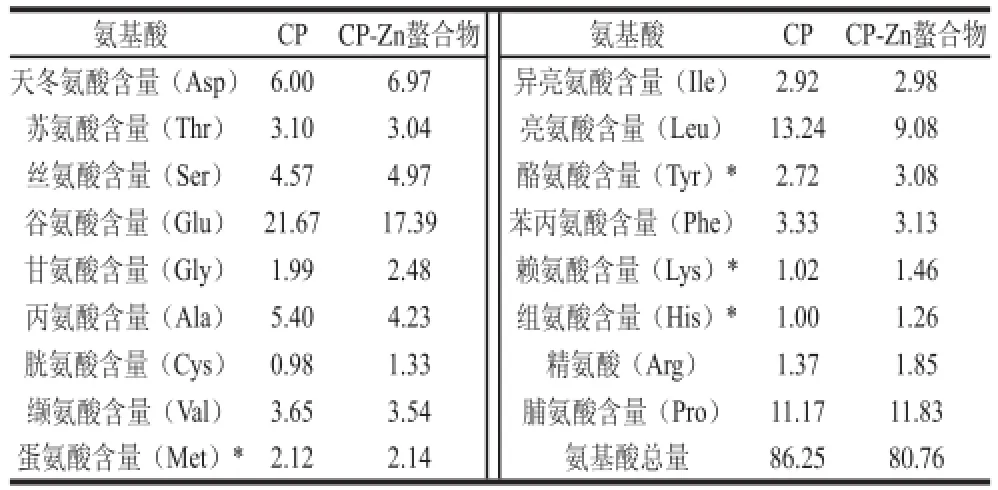
表3 CP和CP-Zn螯合物的氨基酸组成Table3 Amino acid composition of CP and CP-Zn complex %
2.2.2 紫外扫描分析
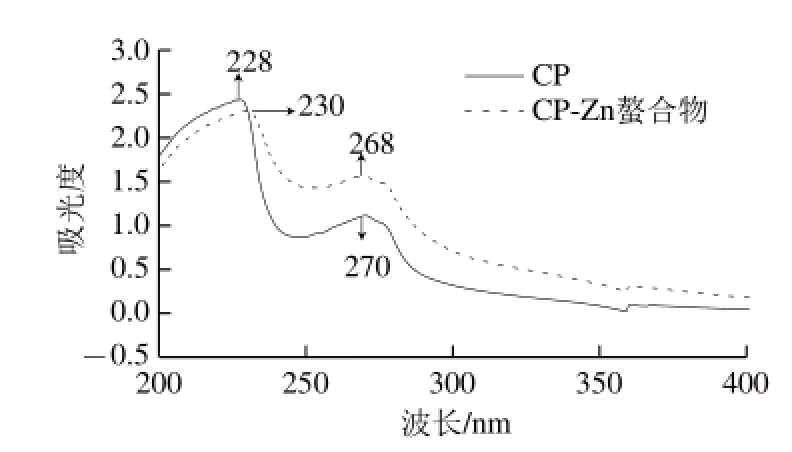
图1 紫外吸收光谱图Fig.1 UV spectra of CP and CP-Zn complexmplex
由图1可知,CP与CP-Zn螯合物同浓度的紫外吸收光谱图显示二者的吸收波长及强弱有所不同:CP在228 nm波长处的吸收峰蓝移至230 nm(CP-Zn),可能是Zn2+与羰基(C=O)产生了络合作用,影响了羰基(C=O)n→δ*的电子跃迁所导致;在270 nm波长处的吸收峰红移至268 nm,这可能是Zn2+与配体(N—C—O)络合后,影响了配体(N—C—O)δ→δ*的电子跃迁所导致。CP-Zn螯合物在250 nm波长处附近的吸收峰明显增强,而硫酸锌溶液在200~400 nm波长范围内没有吸收峰,进一步确认有螯合物的生成。
2.2.3 傅里叶变换红外光谱分析
如图2所示,CP、CP-Zn螯合物在400~4 000 cm-1红外光谱图可以看出,CP与Zn2+形成螯合物后,吸收峰位置以及强度发生了变化。CP在3 400 cm-1附近有较宽的吸收峰,同时在927.59 cm-1处有吸收峰,说明CP含—COOH结构,CP-Zn螯合物中3 400 cm-1附近吸收峰变窄,同时在927.59 cm-1处及附近无吸收峰,说明CP-Zn螯合物无裸露—COOH结构,—COOH已与Zn2+结合,这与周亮[25]结果相似;CP-Zn螯合物在3 068.67 cm-1处NH4+吸收峰消失,而1 045.23 cm-1处出现了PtNH2吸收峰,说明—NH2已与Zn2+结合;在指纹区1 655.59 cm-1处C=O吸收峰红移至1 631.48 cm-1,说明C=O也与Zn2+形成了配位反应,综上分析,CP-Zn螯合物的分子结构中,Zn2+分别在CP分子的—COOH、—NH2和C=O位置配位结合。
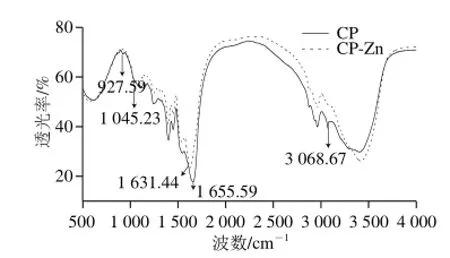
图2 傅里叶变换红外光谱图Fig.2 FT-IR spectra of CP and CP-Zn complexmplex
2.3 CP-Zn螯合物体内抗氧化指标分析
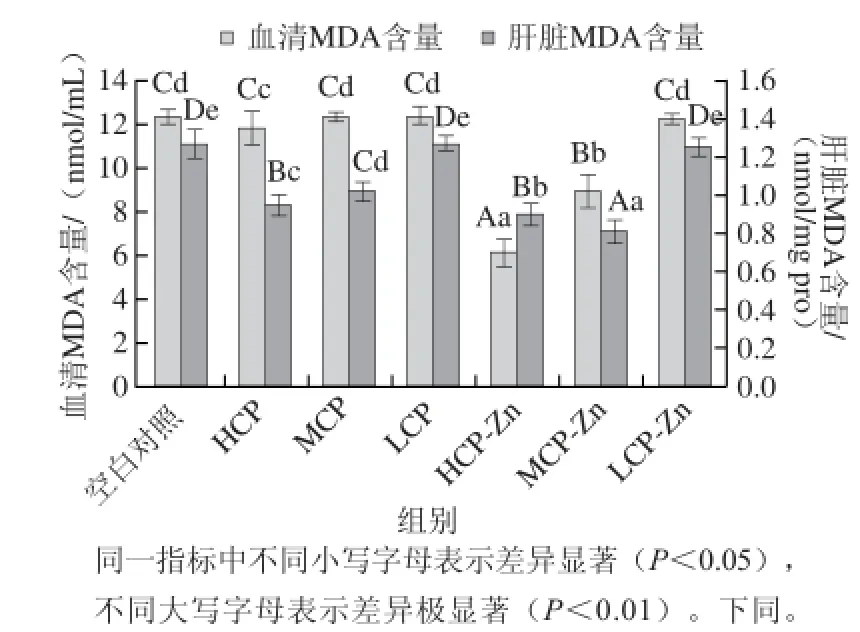
图3 小鼠血清和肝脏中MDA的含量Fig.3 MDA contents in serum and liver of mice
MDA含量是评价自由基在体内代谢的重要指标,其含量的多少直接反映了机体受自由基引发脂质过氧化损伤程度[26]。由图3可知,与空白对照组相比,在血清MDA含量中CP高剂量、CP-Zn高、中剂量组均显著降低(P<0.05或P<0.01),其中效果最较好的CP-Zn高剂量组降低了50.16%,且与其他剂量组存在极显著性差异(P<0.01);在肝脏MDA含量中,除CP-Zn低剂量、CP低剂量组外其他剂量组均显著降低(P<0.01),其中效果较好的CP-Zn中剂量组降低了36.2%,且与其他剂量组存在极显著差异(P<0.01)。整体上CP、CP-Zn均可降低血清、肝脏中MDA含量,且效果CP-Zn优于CP,说明CP可以清除机体的脂质过氧化物的能力,CP-Zn在CP基础上进一步提高此方面能力。
SOD可清除O2-·保护细胞免受损伤,其活性已经作为体内抗氧化能力的重要指标[27]。由图4可知,与空白对照组相比,CP高剂量、CP-Zn高、中剂量组血清SOD活力具有极显著性差异(P<0.01),其他剂量组无显著性差异(P>0.05);在肝脏SOD活力中,除CP中、低剂量组外其他剂量组均有显著性差异(P<0.01);其中效果最好的CP-Zn高剂量在血清、肝脏中SOD活力分别提高了73.31%、53.5%,且与其他剂量组存在极显著性差异(P<0.01)。整体分析,CP、CP-Zn螯合物均可提高机体SOD活力,效果CP-Zn螯合物优于CP,且与剂量呈正相关,说明CP具有清除机体O2-·的能力,CP-Zn螯合物可在其基础上进一步提高清除能力。
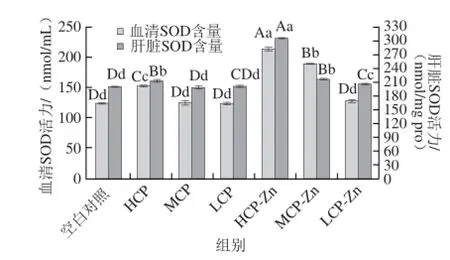
图4 小鼠血清和肝脏中SOD的活力Fig.4 SOD activity in serum and liver of mice
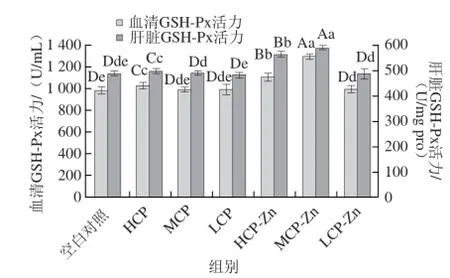
图5 小鼠血清和肝脏中GSH-Px的活力Fig.5 GSH-Px activity in serum and liver of mice
GSH-Px能清除代谢产生的有害物质,而保护细胞膜的结构和功能的完整性以及脂质过氧化的发生有一定的阻断作用,因此GSH-Px是判断抗过氧化能力的重要指标[28]。由图5可知,与空白对照组相比,在血清GSH-Px活力中除CP中、低剂量组外其他剂量组均存在显著性差异(P<0.05或P<0.01);在肝脏GSH-Px活力中,CP高剂量、CP-Zn高、中剂量存在极显著性差异(P<0.01);其中效果最好的CP-Zn中剂量在血清、肝脏中GSH-Px活力提高了31.26%、21.09%,且与其他剂量组存在极显著性差异(P<0.01)。整体分析,CP、CP-Zn螯合物均可提高机体GSH-Px活力,效果CP-Zn螯合物优于CP,说明CP具有抗过氧化能力,CP-Zn螯合物可在CP基础上进一步提高。
3 结 论
结构表征中对照CP、CP-Zn螯合物氨基酸组成、紫外吸收光谱、红外吸收光谱的变化,得出Zn2+与CP分子中的—COOH、—NH2及C=O进行了配位反应,形成CP-Zn螯合物。
体内抗氧化分析结果表明,CP高剂量、CP-Zn高、中剂量可显著降低小鼠血清、肝脏中MDA含量(P<0.05或P<0.01),提高SOD活力(P<0.01)、GSH-Px活力(P<0.05或P<0.01),CP-Zn螯合物的抗氧化效果优于CP。指标改善程度与赵会艳[29]、王可[30]等研究的玉米抗氧化肽相比,本研究的CP-Zn螯合物效果更佳;与方细娟[16]研究的肽锌中肝脏SOD指标相似。说明CP本身具有抗氧化作用,Zn2+改善了CP构象,增加了抗氧化活性强的氨基酸含量,维持了机体抗氧化还原系统平衡,激活了抗氧化酶活性,从而使CP-Zn螯合物整体抗氧化活性提高。
因为CP是小分子肽,CP-Zn螯合物中Zn2+随CP进入机体,易于吸收,即补充了必需氨基酸又提高了抗氧化活性,同时也是补锌的是一种较佳形式,因此本研究的CP-Zn螯合物为食品、医药、化妆品行业提供了一种新的功能制剂,具有一定的市场优势和前景。
[1] CASTRO D R J S, SATO H H. Biologically active peptides: processes for their generation, purification and identification and applications as natural additives in the food and pharmaceutical industries[J]. Food Research International, 2015, 74: 185-198. DOI:10.1016/ j.foodres.2015.05.013.
[2] ORTIZ-MARTINEZ M,WINKLER R, GARCÍA-LARA R. Preventive and therapeutic potential of peptides from cereals against cancer[J]. Journal of Proteomics, 2014, 111(5): 165-183. DOI:10.1016/ j.jprot.2014.03.044.
[3] HUANG Wenhao, SUN Jie, HE Hui, et al. Antihypertensive effect of corn peptides, produced by a continuous production in enzymatic membrane reactor, in spontaneously hypertensive rats[J]. Food Chemistry, 2011, 128(4): 968-973. DOI:10.1016/ j.foodchem.2011.03.127.
[4] 宋亮, 曹龙奎, 刁静静, 等. 玉米 ACE 抑制肽水解酶的筛选及酶解条件的优化[J]. 食品工业科技, 2012, 33(16): 204-208. DOI:10.13386/j.issn1002-0306.2012.16.080.
[5] YAMAGUCHI M, NISHIKIORI F, ITO M, et al. The effects of corn peptide ingestion on facilitating alcohol metabolism in healthy men[J]. Bioscience, Biotechnology, and Biochemistry, 1997, 61(9): 1474-1481. DOI:10.1271/bbb.61.1474.
[6] YU Guocai, LI Jiangtao, HE Hui, et al. Ultraf i ltration preparation of potent bioactive corn peptide as alcohol metabolism stimulator in vivo and study on its mechanism of action[J]. Journal of Food Biochemistry, 2011, 37(2): 161-167. DOI:10.1111/j.1745-4514.2011.00613.x.
[7] LI Jiangtao, ZHANG Jiuliang, HE Hui, et al. Apoptosis in human hepatoma HepG2 cells induced by corn peptides and its antitumor efficacy in H22 tumor bearing mice[J]. Food and Chemical Toxicology, 2013, 51: 297-305. DOI:10.1016/j.fct.2012.09.038.
[8] LI Hongmei, HU Xin, GUO Ping, et al. Antioxidant properties and possible mode of action of corn protein peptides and zein peptides[J]. Journal of Food Biochemistry, 2010, 34(1): 44-60. DOI:10.1111/ j.1745-4514.2009.00292.x.
[9] 刘桂. 玉米肽结合有氧运动对高脂饮食诱导的肥胖大鼠体脂、血脂及脂肪分解关键酶ATGL、LPL的影响[D]. 上海: 上海体育学院, 2014: 20-23.
[10] 昌友权. 玉米肽抗疲劳作用的实验研究[J]. 食品科学, 2004, 35(9):173-178. DOI:10.3321/j.issn:1002-6630.2004.09.040.
[11] 王新欣. 玉米源辅助增强记忆肽的活性研究与产品研制[D]. 长春:吉林大学, 2016: 41-46.
[12] 吴翊馨, 姚吴刚, 苏胜林, 等. 玉米肽对脑卒中康复患者生化指标及运动能力的影响研究[J]. 中国全科医学, 2014 (33): 3929-3931. DOI:10.3969/j.issn.1007-9572.2014.33.008.
[13] 王子怀, 胡晓, 李来好, 等. 肽-金属离子螯合物的研究进展[J]. 食品工业科技, 2014, 35(8): 359-362. DOI:10.13386/ j.issn.1002-0306.2014.08.074.
[14] PRASAD A S, BAO B, BECK F W J, et al. Antioxidant effect of zinc in humans[J]. Free Radical Biology and Medicine, 2004, 37(8): 1182-1190. DOI:10.1016/j.freeradbiomed.2004.07.007.
[15] 俞园园. 金属元素锌的抗氧化性探究[J]. 科协论坛, 2013(7): 93-94. DOI:10.3969/j.issn.1007-3973.2013.07.052.
[16] 方细娟. 罗非鱼鱼肉蛋白多肽及其锌配合物的制备与生物活性[D].广州: 广州大学, 2012: 54-57.
[17] 林谢凤. 鱼类副产物胶原肽螯合锌的制备及其性质研究[D]. 厦门:集美大学, 2015: 71-72.
[18] LISTER N, SYKES A P, BAILEY P D, et al. Dipeptide transport and hydrolysis in isolated loops of rat small intestine: effects of stereospecif i city[J]. The Journal of Physiology, 1995, 484(1): 173-182. DOI:10.1113/jphysiol.1995.sp020656.
[19] ZHU Kexue, WANG Xiaoping, GUO Xiaona. Isolation and characterization of zinc-chelating peptides from wheat germ protein hydrolysates[J]. Journal of Functional Foods, 2015, 12: 23-32. DOI:10.1016/j.jff.2014.10.030.
[20] MIQUEL E, FARRE R. Effects and future trends of casein phosphopeptides on zinc bioavailability[J]. Trends in Food Science & Technology, 2007, 18(3): 139-143. DOI:10.1016 / j.tifs.2006.11.004.
[21] 卫生部. 保健食品检验与评价技术规范[S]. 2003: 2-3.
[22] 陈冠群. 机体总抗氧化力的氨基酸和基因基础以及氧化对抗体活性及其它实验室指标的影响[D]. 大连: 大连医科大学, 2014: 12-23.
[23] 汪婧瑜, 刘学铭, 张业辉, 等. 乌鳢酶水解物螯合钙的制备及其结构分析[J]. 食品工业科技, 2016, 37(8): 206-214. DOI:10.13386/ j.issn1002-0306.2016.08.034.
[24] 霍健聪. 带鱼下脚料蛋白酶水解物亚铁螯合修饰及其抑菌机理研究[D]. 重庆: 西南大学, 2009: 113-116. DOI:10.7666/d.y1555969
[25] 周亮. 鱼鳞胶原小肽螯合锌的制备研究[D]. 武汉: 湖北工业大学, 2014: 37-38.
[26] 王楠. 丙二醛在继发性脊髓损伤中的表达及其意义[D]. 沈阳: 中国医科大学, 2010: 13-14.
[27] 王君明, 崔瑛, 王峥涛, 等. 超氧化物歧化酶参与肝损伤的研究进展[J]. 中国实验方剂学杂志, 2011, 17(7): 265-269. DOI:10.13422/ j.cnki.syfjx.2011.07.084.
[28] 王咏梅. 自由基与谷胱甘肽过氧化物酶[J]. 解放军药学学报, 2005, 21(5): 369-371. DOI:10.3969/j.issn.1008-9926.2005.05.017.
[29] 赵会燕. 玉米胚芽抗氧化肽的制备及其安全性评价研究[D]. 长春:吉林大学, 2015: 50-51.
[30] 王可. 玉米蛋白资源高效利用开发抗氧化肽的关键技术研究[D]. 长春: 吉林大学, 2014: 27-29.
Structural Characteristics and Antioxidant Activity of Corn Peptide-Zn Complex
ZHANG Zhi1, LIU Hui1, LIU Qi1, ZHENG Xiqun2,*, QU Wei1, YANG Kexin1
(1. College of Forestry, Northeast Forestry University, Harbin 150040, China; 2. Key Constructive Laboratory of Processing Agricultural Products of Heilongjiang Province Normal University, Qiqihar University, Qiqihar 161006, China)
In this work, in comparison to corn peptide (CP), we investigated the change in structural characteristics and antioxidant activity in vivo of corn peptide-Zn (CP-Zn) complex. The structures of CP and CP-Zn were investigated through amino acid analysis, ultraviolet (UV) spectroscopy and infrared spectroscopy. CP and CP-Zn (50, 150, 250 mg/(kg·d)) at different doses were administered intragastrically to mice. Two days later, malondialdehyde (MDA) content, superoxide dismutase (SOD) activity and glutathione peroxidase (GSH-Px) activity in serum and liver were measured to evaluate antioxidant activity in vivo of CP and CP-Zn. The results showed a signif i cant change in amino acid content, and UV and FT-IR spectra between CP and CP-Zn. Zn2+was coordinated with the -COOH, -NH2and C=O groups of corn peptide. Compared with the control group, high-dose CP and high- and middle-dose CP-Zn could reduce MDA level (P < 0.05 or P < 0.01), and improve SOD (P < 0.01) and GSH-Px activity (P < 0.05 or P < 0.01) in serum and liver. The antioxidant activity of CP-Zn was better than that of CP.
corn peptide-Zn complex; structure; antioxidant activity
10.7506/spkx1002-6630-201703022
TS201.2
A
1002-6630(2017)03-0131-05
张智, 刘慧, 刘奇, 等. 玉米肽-锌螯合物结构表征及抗氧化活性分析[J]. 食品科学, 2017, 38(3): 131-135. DOI:10.7506/ spkx1002-6630-201703022. http://www.spkx.net.cn
ZHANG Zhi, LIU Hui, LIU Qi, et al. Structural characteristics and antioxidant activity of corn peptide-Zn complex[J]. Food Science, 2017, 38(3): 131-135. (in Chinese with English abstract)
10.7506/spkx1002-6630-201703022. http://www.spkx.net.cn
2016-03-29
黑龙江省应用技术研究与开发计划重大项目(GA13B201)
张智(1964—),女,教授,博士,研究方向为生物转化、功能食品。E-mail:ldzhangzhi@163.com
*通信作者:郑喜群(1963—),男,教授,博士,研究方向为农产品加工及应用酶学。E-mail:zhengxiqun@126.com

