食用芒果过敏的研究进展
闫慧清,黄小龙,马兆成*
(1.贵州师范大学生命科学学院,贵州 贵阳 550001;2.华中农业大学园艺林学学院,湖北 武汉 430070)
食用芒果过敏的研究进展
闫慧清1,黄小龙1,马兆成2,*
(1.贵州师范大学生命科学学院,贵州 贵阳 550001;2.华中农业大学园艺林学学院,湖北 武汉 430070)
芒果是我国亚热带地区重要经济作物,含有多种功能性成分,然而大部分人群在接触或食用芒果后会出现不同程度的过敏临床反应。本文简单介绍食用芒果导致的过敏反应,包括接触性皮炎、口腔过敏症状、交叉过敏等,并详细阐述了芒果导致过敏现象的两种途径,以及不同过敏原物质、反应类型和发病人体的免疫途径。根据过敏原Allergome数据库(http://www.allergome.org/)分析得到芒果中所含有的9 种主要的过敏原,并对其中2 种过敏原蛋白,即抑制蛋白和几丁质酶进行了结构域的分析。通过对芒果过敏交叉反应的介绍,得到不同物种中的过敏蛋白氨基酸序列具有高度同源性,而这些同源性序列决定与免疫球蛋白E具有相同作用的表位。本文以期从分子水平上提供芒果低过敏品种培育的新途径和过敏防治的新思路。
芒果过敏;迟发型过敏;速发型过敏;抑制蛋白;几丁质酶
芒果(Mangiferaindica L.)属漆树科芒果属,为热带亚热带特产水果,具有味道鲜美、香甜可口的特点,被称为“水果之王”。芒果果肉可以作为鲜食,也可以加工成为奶昔、果酱、果汁以及腌菜类食品等,深受广大消费者的喜爱。同时,芒果的果肉具有极高的营养价值,富含除了人们所熟知的胡萝卜素、VC以及其他微量元素外,还含有多酚类、植物甾醇类、三萜类以及挥发性化合物等其他成分,因此芒果具有明目、免疫镇痛、止咳化痰、抗菌抗癌、治疗痛风等生理活性[1]。此外,芒果皮还具有抗糖尿病和治疗湿疹皮炎等其他疾病的作用,营养价值极高[2]。尽管芒果具有如此多的功效,但是大部分人群在食用芒果或者接触芒果皮后会导致不同程度的临床过敏反应,这一常见的生活现象限制了部分人群对芒果的消费。因此,本文通过介绍食用芒果产生过敏的现象、反应类型、过敏反应的途径、过敏交叉反应中的过敏原物质和芒果经不同加工方式后引起过敏反应的变化,以期为因芒果导致的过敏疾病防治提供理论依据,并从分子水平上为选育出低过敏的芒果品种、靶向治疗以及过敏的防治提供新思路和理论依据。
1 食用芒果导致的过敏
1.1 芒果食用后导致的过敏反应
芒果具有两面性,除了独特的风味和营养价值外,摄入芒果也会导致许多健康问题。在日常生活中,除了芒果中含有大量的糖分,不适合糖尿病病人食用外,在很多国家,大部分人群在接触或者食用芒果后会出现不同的过敏临床反应,如脸部及躯体皮肤轻度发红、瘙痒或皮疹。有报道指出由于患者的不同情况以及特殊的体质,在接触芒果皮、树汁液、损伤的树叶、外壳,甚至树干均会出现不同程度的症状,表现为过敏性接触性皮肤炎[3-4]。同时,部分患者在作皮肤的过敏原测试时,对于芒果皮下0.5 cm的果肉,呈现出和芒果皮一样阳性反应,表明患者不只会对芒果的果皮过敏,同时也会对芒果皮下0.5 cm的果肉过敏[5]。此外,有研究指出部分人群在食用芒果后,会出现咳嗽、气喘、呼吸困难、身体瘙痒以及腹部不舒服的症状,严重时食用芒果甚至会出现休克威胁生命[6]。当口腔接触芒果的果皮或者食用果肉时,部分人群还会表现为口腔过敏综合征(oral allergy syndrome,OAS),具体症状为在食用芒果后的几分钟内出现嘴唇、舌头还有口感的刺痛以及灼烧的感觉,同时会伴有咽部的肿胀[3]。除此之外,芒果果肉还会导致哮喘等过敏性疾病的病情加重[7],有病例报道指出,在120 名儿童支气管哮喘患者中,其中有57.1%的患者对芒果过敏[8]。因此接触芒果的果皮或者食用果肉后会产生人体过敏反应,甚至是休克等严重的临床症状,该现象即便在使用抗过敏和类固醇等药物治疗后也会持续几周。这一常见的生活现象限制了人们对芒果的消费,在一定程度上会影响到芒果产业的经济效益,因此本文对食用芒果导致过敏的研究进展做简要的总结。
1.2 过敏反应的类型
根据食用芒果后出现过敏时间和过敏反应途径的不同,将过敏反应类型分为速发型过敏和迟发型过敏。迟发型过敏一般通常为食用芒果后的48 h或者72 h会出现的症状,包含有接触性皮肤炎、眶骨膜水肿的疾病、湿疹的皮疹和水疱形成。1939年美国学者第一次报道了食用芒果导致迟发型过敏的病例[9]。该报道指出一名年轻的女性在食用芒果后发展成为严重的皮炎包括嘴唇和口腔区域的急性炎症。速发型过敏,又称为Ⅰ型过敏,表现为食用芒果30 min内现了水肿、红疹、荨麻疹和口腔过敏综合症状,还有人在食用少量的芒果后会出现眼睛和嘴的瘙痒、眼皮的肿胀、大量流汗甚至带有休克特点的胸闷[10]。1942年第一次报道了速发型过敏病例,一名患者在食用芒果后30 min内,表现出声音嘶哑、呼吸困难和哮喘[11]。这两种过敏型的疾病症状因人因地而异。在一般情况下,速发型过敏在易感病人中也会产生OAS、呼吸困难、休克等临床症状,严重的甚至能够威胁生命。有研究者针对22 个对芒果过敏的人群调查中发现其中有10 人表现出速发型过敏反应,其余的12 人为迟发型过敏反应[12],说明两种不同的过敏反应类型均有可能发生。
1.3 过敏反应的主要途径
食用芒果导致的两种过敏反应类型分别是由几种不同的过敏原物质通过不同的反应途径所引起的。所谓的过敏原物质是指能刺激机体发生过敏反应的物质,包括有小分子物质和某些蛋白质。迟发型过敏反应通常在接触敏感物质的相对较长的时间内,如48 h甚至72 h后出现皮肤的过敏反应,包括有红疹和硬结等症状。其过敏反应的过敏物质主要包括蒎烯、漆酚、Adipostatin A和柠檬烯。这些过敏原物质都是小分子物质。蒎烯和柠檬烯都存在于多种天然植物的精油中,漆酚是油状的液体,Adipostatin A是长脂肪链和酚环所组成的脂质,首次在有毒的常春藤中被发现[13]。这些物质均能够导致不同人群产生接触性过敏皮疹。这些小分子物质具有较强的化学活性,与蛋白质抗原不同。这类过敏原能够被免疫系统的细胞识别并迁移到T淋巴细胞,破坏皮肤组织。这个途径主要是通过辅助性T细胞(helper T cells,Th)类型的分化群(cluster of differentiation 4,CD4+)介导而产生的,T淋巴细胞又产生活化因子和细胞免疫杀伤破坏皮肤。具体的免疫过程是首先这些活性物质接触皮肤表层,能够与组织蛋白质结合变成免疫抗原从而激发CD4+细胞的产生[14]。当人体再次接触相同的抗原后,敏感的CD4+的Th首先能够在皮肤里面积累,然后转移到表皮后从而引起体液或者相应的细胞免疫应答反应。炎症细胞在表皮处可以释放出细胞因子从而损坏角质细胞,使得这些细胞的分离进一步导致表皮水肿或接触性皮炎等炎症的发生。
速发型的过敏反应与迟发型过敏反应途径不同。速发型过敏反应主要是通过经典的免疫球蛋白E(immunoglobulin E,IgE)与Fc段受体1(Fcε reception 1,FcεR1)的交联介导的病理反应机制[15],这种过敏反应在先前对芒果过敏原产生过敏的人群中会经常出现,同时也表现出过敏交叉反应。过敏的发生和发展包括致敏、激发和效应阶段。首先,芒果的过敏原先与特异性的B细胞产生的IgE抗体结合,随后形成的复合体再与肥大细胞和嗜碱性粒细胞的细胞表面相结合。这可以迅速导致机体处于过敏状态。如果长期不接触相同或者类似的过敏原,则此状态自动消失。否则,则进入激发状态,相同或类似的过敏原再次进入机体时,这些过敏原与B细胞能够结合形成复合体,使得肥大细胞脱颗粒活化,同时肥大细胞会释放出很多细胞因子,如组织胺、蛋白酶和酸性水解酶等,以及受到诱导后新合成的次级炎症因子,如白三烯、前列腺素和血小板激活因子等[14]。这些产生的细胞因子被运送到机体各个组织引发毛细血管扩大和通透性功能的增强从而诱发一系列的临床反应症状,如气喘、红肿和中枢神经系统等过敏反应。
通过对过敏原数据库Allergome(http://www. allergome.org/)的分析,对芒果中的能够诱发速发型过敏反应的过敏原蛋白进行搜索,其包含有抑制蛋白(Man i 3)、Bet v 1同源蛋白(Man i 14 kD)、几丁质酶类(Man I chitinase)以及其他共9 种主要的过敏蛋白,这些过敏蛋白均具有免疫学的特性(表1)。
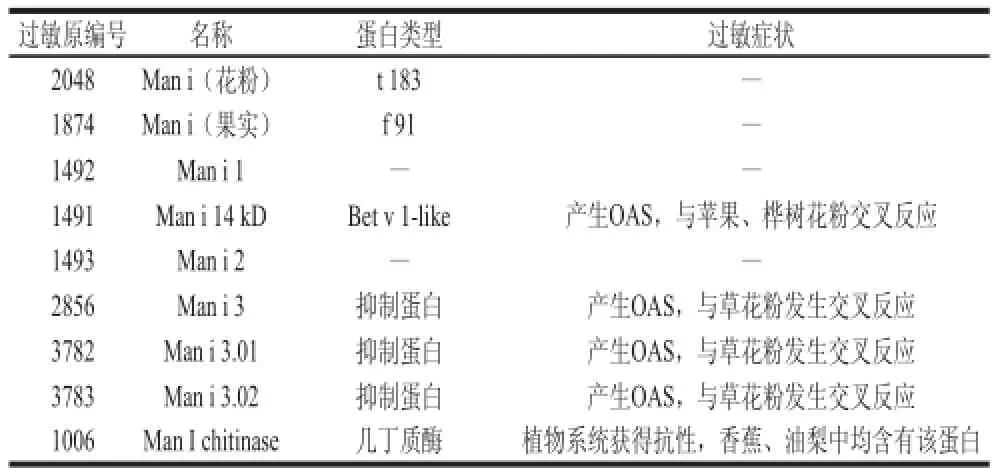
表1 芒果中9 种主要的过敏蛋白分析Table1 Analysis of nine major mango allergens
1.4 芒果过敏的交叉反应
在速发型过敏反应中,存在过敏的交叉反应,是指有患者先前接触过其他物种的过敏原,在食用芒果后也会出现过敏反应。一些患者可能会出现对同一科(如漆树科)或相同科内的不同属的果实发生过敏的症状,甚至对不同科的水果、蔬菜或者花粉发生过敏反应。这些蛋白质构成免疫交叉反应,原因在于这些过敏原蛋白具有相同的表位结构域,而这些结构域是与IgE相互作用的决定因素,如患者对芒果过敏也会对水果和蔬菜其他物种如对桦树花粉、桃(Amygdaluspersica L.)、荔枝(Litchi chinensis Sonn.)、柑橘(Citrus reticulata Blanco)等有反应[16]。在食用漆树科其他属的果实中,如阿月浑子、腰果等,也会存在过敏交叉反应。其中阿月浑子的果实中含有的蛋白质过敏原能够诱导Ⅰ型过敏性反应,而这些过敏原也存在于腰果的果实以及芒果的种子中[4,17]。
通过对能够产生过敏交叉反应的两种主要过敏原,即抑制蛋白和几丁质酶的结构域进行功能分析预测,可以得到交叉过敏发生反应的分子基础。首先通过美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)(http://www.ncbi.nlm.nih.gov/)获得抑制蛋白和几丁质酶的氨基酸序列,根据SMART(http://smart.embl-heidelberg.de)中的蛋白质家族结构域数据库分析氨基酸序列得到二级结构(表2)。芒果中含有抑制蛋白是主要的一大类过敏物质,如Man i 3和Man i 1。抑制蛋白是一种细胞溶质蛋白,其含有的结构域PROF(profilin)能够结合细胞骨架蛋白中的肌动蛋白并控制肌动蛋白的聚合(表2),还能够结合膜的多磷酸肌醇磷脂(polyphosphoinositides,PPI)和聚左旋脯氨酸,具有免疫学的特性。
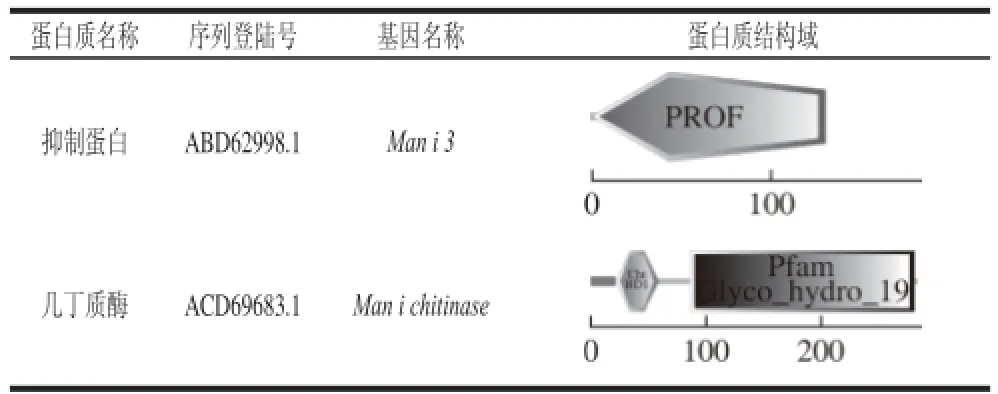
表2 SMART分析抑制蛋白和几丁质酶的结构域Table2 Domains derived from SMART of prof i lin and chitinase

图2 芒果与其他物种抑制蛋白的氨基酸序列比对Fig.2 Multiple amino acid sequence alignments of pro fi lin in mango and other species
这些抑制蛋白常存在于植物的花粉中,在蔬菜和水果中也存在。不同植物中抑制蛋白的同源性很高,具有序列高度保守性的特点。以桦树花粉为主的食物过敏交叉反应综合症[18],其免疫特性在于花粉、芒果、柑橘、荔枝、桃等水果中的过敏原具有相同的结构域[19-20],将这些水果中抑制蛋白的氨基酸序列进行同源比对。由图2可知,芒果与葡萄、桃、柑橘和荔枝的同源性较高,根据NCBI显示的结果其同源性分别是82%、89%、89%和82%,表明这些过敏蛋白的氨基酸序列具有高度同源性,相似的表位结构域具有相同免疫原性的活性[19]。这类抑制蛋白能够产生口腔过敏反应综合症,与草花粉发生交叉反应。因此,在食用或者接触同类食物中需注意,防止发生交叉过敏反应或者出现严重的症状。
除此之外,芒果中过敏原还有几丁质酶,在柑橘、荔枝等其他“热性”水果中也存在该过敏原[22]。该序列与其他物种在氨基酸序列上有较高的相似性。几丁质酶的结构包含2 个保守序列,具体的结构域如表2所示,分别是几丁质酶结合结构域(chitinase binding domain 1,ChtBD1)和Glyco_hydro_19(甲壳素结合结构域)。几丁质酶是植物对真菌和昆虫病原体的防御系统。通过限制这些蛋白质的摄入量,从而可以减少这些物质在人类食物不良反应。其中几丁质酶结构域属于糖苷水解酶家族,几丁质酶结构域可能会牵涉ChtBD127 N-乙酰绑定。甲壳素结合结构域参与认识或结合甲壳素亚基的成熟蛋白。这种酶有真菌和昆虫病原体的防御功能,摧毁其含几丁质的细胞壁[23]。几丁质酶是体内防御真菌和虫害病原菌的植物保护系统[24-25]。它的主要功能是消化包含在肠壁和角质层组织里面的几丁质[26]。有研究表明几丁质酶也是一种过敏原,与儿童的哮喘病有着密切的关系。几丁质酶的含量可以作为真菌感染血清学的检测指标,尤其是在布朗克斯儿童(Bronx children)哮喘的人群中,起着关键作用[27]。在长期的生物进化过程中,植物体本身为了更好抵御外界的环境形成了自己的防卫保护系统[28]。其中几丁质酶就是属于保护自身系统的酶,从而有效地防止外界病原性疾病。因此,植物可能会通过发挥防卫性的保护酶作用从而限制植物病原菌的侵入。然而,这些植物本身的防御系统可能包含有对人体有害的成分[29]。通过过敏症状的产生,可以有效地限制人们对芒果等“热性”水果的过度消费。而这些不良的过敏反应都是机体抗病和修复的反应,也是植物本身一种保护性防御过程。
2 芒果的不同加工方式对人体的过敏反应
不同的食物经过加工或可以降低过敏原的致敏性,或可以增强过敏原的致敏性,且因食物蛋白、加工方式和热加工类型不同而异[30]。食品加工对过敏原致敏的评价可以通过对过敏效应分子,即患者血清中IgE抗体的变化水平作为致敏性评价的标准[31-32]。芒果果实有很多不同的加工方式,如分离隔离、纯化和热处理以及酶处理等。虽然这些不同的加工方法会产生过敏症状的差异,但对芒果中的过敏性物质的变化并不明显,芒果的加工品依然能够保持导致人体产生过敏症状的活性。虽然芒果的果汁、水果沙拉以及罐装等加工品能够导致部分过敏原蛋白发生变化,但是不会丧失过敏性物质的活性[33-34],如巴氏消毒使得30 kD的过敏原蛋白变性[4]。台湾有研究者将2 个芒果品种(本地青和海顿Haden品种),分为3 个不同食用部位(果皮、皮下果肉部分和果肉),并将果肉加工成水溶性化合物和脂溶性化合物,共12 种不同的加工处理方式,通过对179 名志愿者进行皮试实验,发现食用芒果的不同部位、不同品种以及加工方式不同会导致人体过敏程度的不同[35]。此外、许多外界环境和农业的污染,如吸入猫尾草、烟曲霉素或者接触橡胶,塑料等均能够影响患者的过敏症状,使得血液中IgE的含量增加,诱发速发型过敏反应[36-37]。
3 结 语
芒果是重要的热带水果,但其对食用者引发的不良反应越来越受到人们的关注,使得研究其过敏成分显得极为重要,这样以来,便可以有效地防止严重疾病和死亡情况的发生。避免易感病人可能会导致的潜在严重临床反应。因此确定芒果果实中的过敏原,能够有助于精确地诊断和选择正确的治疗方法[38-39]。
针对人们在生活中常遇到的具体问题,以吃芒果导致人体过敏的普遍现象为研究对象,通过分子生物学的手段得到改善,具体方法有以下几种:1)利用过敏性状与简单重复序列(simple sequence repeats,SSR)标记相关性分析,确定芒果的过敏性状、遗传多样性及其亲缘关系为预防诊断提供理论依据。如SSR标记的苹果中过敏原Mal d 1.06A-SSR方法,可用于过敏原基因资源评价及低过敏性状的品种选育[40]。2)进行过敏原的分子鉴定。通过比较不同品种、不同发育时期和不同部位的基因表达,明确表达含量最高的致敏基因;利用体外重组该过敏原蛋白并纯化制备抗体,通过与过敏患者血清进行免疫杂交验证生物活性,进一步对过敏原的不同结构域所结合的表位结构进行鉴定[41]。3)构建RNAi或者敲除载体对特异过敏原基因进行干扰或抑制表达,使得过敏蛋白的含量降低。此技术已经在苹果、番茄和牛奶等食物中成功应用[42],因此可以将这一技术应用范围扩大到芒果中以降低诱发过敏反应的物质含量,从而减轻过敏反应的症状。以上的这些方法都能够为生物化学分子水平上选育出低过敏的芒果品种、靶向治疗以及交叉过敏的防治提供新的思路和理论依据。
参考文献:
[1] 顾承真, 曹建新. 芒果的化学和药理学研究进展[J]. 中成药, 2001, 33(10): 1776-1781. DOI:10.3969/j.issn.1001-1528.2011.10.035.
[2] GONDI M, BASHA S A, BHASKAR J J, et al. Anti-diabetic effect of dietary mango (Mangiferaindica L.) peel in streptozotocin-induced diabetic rats[J]. Journal of the Science of Food and Agricultrue, 2015, 95(5): 991-999. DOI:10.1002/jsfa.6778.
[3] WEINSTEIN S, BASSIRI-TEHARNI S, COHEN D E. Allergic contact dermatitis to mango flesh[J]. International Journal of Dermatology, 2004, 43(3): 195-196. DOI:10.1111/j.1365-4632.2004.01703.x.
[4] 吴序栋, 张红云, 刘志刚, 等. 芒果过敏的研究进展[J]. 中国食品卫生杂志, 2010, 22(2): 185-187.
[5] FASOLI E, RIGHETTI P. The peel and pulp of mango fruit: a proteomic samba[J]. Biochimica et Biophysica Acta, 2013, 1834(12):2539-2345. DOI:10.1016/j.bbapap.2013.09.004.
[6] SHAH A, GERA, K. Immediate hypersensitivity reaction with mango[J]. Pneumonologia Alergologia Polska, 2014, 82(5): 445-453. DOI:10.5603/PiAP.2014.0058.
[7] SAREEN R, GUPTA A, SHAH A. Immediate hypersensitivity to mango manifesting as asthma exacerbation[J]. Jornal Brasileiro de Pneumologia, 2011, 37(1): 135-138. DOI:10.1590/S1806-37132011000100020.
[8] 吕波, 张晓玲. 儿童支气管哮喘的过敏原检测[J]. 广东医学杂志, 2001, 22(1): 38-39. DOI:10.3969/j.issn.1001-9448.2001.01.018.
[9] ZAKON S. Contact dermatitis due to mango[J]. Journal of the American Medical Association, 1939, 113(4): 1808. DOI:10.1001/ jama.1939.72800450003008b.
[10] SAREEN R, SHAH A. Hypersensitivity manifestations to the fruit mango[J]. Asia Pacific Allergy, 2011, 1(1): 43-49. DOI:10.5415/ apallergy.2011.1.1.43.
[11] KAHN I. Fruit sensitivity[J]. Southern Medical Journal, 1942, 35(1):858-859.
[12] WIWANITKIT V. Mango dermatitis[J]. Indian Journal of Dermatology, 2008, 53(3): 158. DOI:10.4103/0019-5154.43215.
[13] TANAKA A, ARAI Y, KIM S, et al. Synthesis and biological evaluation of bilobol and adipostatin A[J]. Journal of Asian Natural Products Research, 2011, 13(4): 290-296. DOI:10.1080/10286020.201 1.554828.
[14] SAREEN R, SHAH A. Hypersensitivity manifestations to the fruit mango[J]. Asia Pacific Allergy, 2011, 1(1): 43-49. DOI:10.5415/ apallergy.2011.1.1.43.Epub 2011Apr 26.
[15] TSUJIMURA Y, OBATA K, MUKAI K, et al. Basophils play a pivotal role in immunoglobulin-G-mediated but not immunoglobulin-E-mediated systemic anaphylaxis[J]. Immunity, 2008, 28(4): 581-589. DOI:10.1016/j.immuni.2008.02.008.Epub 2008 Mar 13.
[16] FERNANDEZ C, FIANDOR A, MARTINEZ-GARATEA, et al. Allergy to pistachio: crossreactivity between pistachio nut and other Anacardiaceae[J]. Clinical and Experiment Allergy, 1995, 25(12):1254-1259. DOI:10.1111/j.1365-2222.1995.tb03050.x.
[17] IPPEN H. Contact allergy to Anacardiaceae. a review and case reports of poison ivy allergy in central Europe[J]. Dermatosen in Beruf Und Umwelt Occupation and Environment, 1983, 31(5): 140-148.
[18] 杨朝崴, 陈琳, 乔丽雅, 等. 水果过敏及其过敏原基因组学研究[J].果树学报, 2010, 27(2): 281-288.
[19] SONG J, ZHANG H, LIU Z, et al. Mango prof i lin: cloning, expression and cross-reactivity with birch pollen profilin Bet v 2[J]. Molecular Biology Reports, 2008, 35(2): 231-237. DOI:10.1007/s11033-007-9075-5.
[20] BUSS Z S, KUPEK E, FRODE T S. Screening for latexsensitization by questionnaire: diagnostic performance in health care workers[J]. Journal of Investiational Allergology and Clinical Immunology, 2008, 18(1): 12-16.
[21] DUQUE S, FERNANDEZ-PELLON L, RODRIGUEZ F. Mango allergy in a latex-sensitized patient[J]. Allergy, 1999, 54(9): 1004-1005. DOI:10.1034/j.1398-9995.1999.00136.x.
[22] YAN H Q, JI Q, CHEN D D, et al. A novel macromolecular extract screened from satsuma with pro-inflammatory effect[J]. Food and Function, 2014, 5(2): 295-302. DOI:10.1039/c3fo60411j.
[23] XU N, ZHANG S. Identification, expression and bioactivity of a chitotriosidase-like homolog in amphioxus: dependence of enzymatic and antifungal activities on the chitin-binding domain[J]. Molecular Immunology, 2012, 51(1): 57-65. DOI:10.1016/j.molimm.2012.02.003. Epub2012Mar16.
[24] HERMANS C, PORCO S, VANDENBUSSCHE F, et al. Dissecting the role of CHITINASE-LIKE1 in nitrate-dependent changes in root architecture[J]. Plant Physiology, 2011, 157(3): 1313-1326. DOI:10.1104/pp.111.181461.Epub2011Sep23.
[25] ZHANG J, KOPPARAPU N K, YAN Q, et al. Purification and characterisation of a novel chitinase from persimmon (Diospyros kaki) with antifungal activity[J]. Food Chemistry, 2013, 138(2/3): 1225-1232. DOI:10.1016/j.foodchem.2012.11.067.Epub2012Nov24.
[26] ZHANG D, CHEN J, YAO Q, et al. Functional analysis of two chitinase genes during the pupation and eclosion stages of the beet armyworm Spodoptera exigua by RNA interference[J]. Archives of Insect Biochemistry and Physiology, 2012, 79(4/5): 220-234. DOI:10.1002/arch.21018.
[27] GOLDMAN D L, LI X, TSIRILAKIS K, et al. Increased chitinase expression and fungal-specif i c antibodies in the bronchoalveolar lavage fl uid of asthmatic children[J]. Clinical and Experimental Allergy, 2012, 42(4): 523-530. DOI:10.1111/j.1365-2222.2011.03886.x.
[28] PROTSENKO D E, ZEMEK A, WONG B J. Temperature dependent change in equilibrium elastic modulus after thermally induced stress relaxation in porcine septalcartilage[J]. Lasers in Surgery and Medicine, 2008, 40(3): 202-210. DOI:10.1002/lsm.20611.
[29] SCHUBERT W D, GOBEL G, DIEPHOLZ M, et al. Internalins from the human pathogen Listeria monocytogenes combine three distinct folds into a contiguous internalin domain[J]. Journal of Molecular Biology, 2001, 312(4): 783-794. DOI:10.1006/jmbi.2001.4989.
[30] 匡华, 高毕远, YEVONNE V, 等. 热处理对食物致敏性的影响及其体外细胞学评价[J]. 食品与生物技术学报, 2013, 32(9): 1-7.
[31] VISSERS Y M, BLANC F, SKOV P S, et al. Effect of heating and glycation on the allergenicity of 2S albumins(Ara h 2/6)from peanut[J]. PLoS ONE, 2011, 6(8): e23998. DOI:10.1371/journal.pone.0023998.
[32] 刘一璇, 林洪, 吴丽莎, 等. 加工方式对刀额新对虾主要过敏原免疫原性的影响[J]. 水产学报, 2011, 35(6): 948-952. DOI:10.3724/ SP.J.1231.2011.17320.
[33] PASCHKE A. As pects of food processing and its effect on allergen structure[J]. Molecular Nutrition and Food Research, 2009, 53(8): 959-962. DOI:10.1002/mnfr.200800187.
[34] DUBE M, ZUNKER K, NEIDHART S, et al. Effect of technological processing on the allergenicity of mangoes (Mangifera indica L.)[J]. Journal of Agriculture and Food Chemistry, 2004, 52(12): 3938-3945. DOI:10.1021/jf030792r.
[35] ELSHABRAWY W O, ISMAIL H A, HASSANEIN K M. The impact of environmental and agricultural pollutants on the prevalence of allergic diseases in people from Qassim, KSA[J]. International Journal of Health Science (Qassim), 2014, 8(1): 21-31.
[36] CHEN H H, SUN C C. Patch testing with various mango (Mangiferaindica) extracts[J]. Clinical Research in Dermatology Open Access, 2014, 1(1): 1-3. DOI:1.0.15226/2378-1726/1/1/00104.
[37] DUQUE S, FERNÁNDEZ-PELLÓN L, RODRÍGUEZ F. Mango allergy in a latex-sensitized patient[J]. Allergy, 1999, 54(9): 1004-1005. DOI:10.1034/j.1398-9995.1999.00136.x.
[38] OKA K, SAITO F, YASUHARA T, et al. A study of crossreactionsbetween mango contact allergens and urushiol[J]. Contact Dermatitis, 2004, 51(5/6): 292-296. DOI:10.1111/j.0105-1873.2004.00451.x.
[39] WEINSTEIN S, BASSIRI-TEHRANI S, COHEN D E. Allergic contact dermatitisto mango flesh[J]. International Journal of Dermatology, 1996, 43(3): 195-196. DOI:10.1111/j.1365-4632.2004.01703.x.
[40] GAO Z S, WEG W E, MATOS C I, et al. Assessment of allelic diversity in intron-containing Mal d 1 genes and their association to apple allergenicity[J]. BMC Plant Biology, 2008(3): 221-238. DOI:10.1186/1471-2229-8-116.
[41] RENNER R, HIPLER C, TREUDLER R, et al. Identification of a 27kDa protein in patients with anaphylactic reactions to mango[J]. Journal of Investigational Allergology and Clinical Immunology, 2008, 18(6): 476-481
[42] SHIHO K, MASAHARU K, MIO M, et al. RNAi-mediated suppression of endogenous storage proteins leads to a change in localization of overexpressed cholera toxin B-subunit and the allergen protein RAG2in rice seeds[J]. Plant Cell Report, 2014, 33(1): 75-87. DOI:10.1007/s00299-013-1513-3.
Progress in Understanding Hypersensitivity Reaction after Ingestion of Mango Fruits
YAN Huiqing1, HUANG Xiaolong1, MA Zhaocheng2,*
(1. College of Life Science, Guizhou Normal University, Guiyang 550001, China; 2. College of Horticulture and Forestry Sciences, Huazhong Agricultural University, Wuhan 430070, China)
Mango is an important cash crop in the tropical area of China. Mango fl esh contains a wide range of functional components; however, consumption of mango fruits can result in hypersensitivity reactions which vary in terms of severity from person to person. This article presents a brief description of hypersensitivity reactions after eating mango fruits, such as contact dermatitis, oral allergy syndrome and cross-reactivity. Meanwhile, two distinct pathways for the development of hypersensitivity reactions after eating mango fruits are elucidated in detail, including allergens, different types of reactions and immune pathways in human body. Nine major allergen genes in mango fruits have been analyzed according to the Allergome database (http://www.allergome.org/). The structural domains of two of the major allergenic proteins, namely prof i lin and chitinase, have been determined. By evaluating the cross-reactivity of mango allergens, it was found that the amino acid sequences of allergens from different species share high homology, which determines the same IgE sensitization. This paper will provide new ideas and theoretical bases for selecting plants with reduced allergenicity and therefore preventing and treating allergic symptoms at the molecular level.
mango allergy; delayed hypersensitivity; immediate hypersensitivity; prof i lin; chitinase
10.7506/spkx1002-6630-201703048
S667.7
A
1002-6630(2017)03-0305-05
闫慧清, 黄小龙, 马兆成. 食用芒果过敏的研究进展[J]. 食品科学, 2017, 38(3): 305-309. DOI:10.7506/spkx1002-6630-201703048. http://www.spkx.net.cn
YAN Huiqing, HUANG Xiaolong, MA Zhaocheng. Progress in understanding hypersensitivity reaction after ingestion of mango fruits[J]. Food Science, 2017, 38(3): 305-309. (in Chinese with English abstract)
10.7506/spkx1002-6630-201703048. http://www.spkx.net.cn
2016-03-31
贵州师范大学博士科研启动项目(11904-0514156;11904-0514157);贵州省自然科学基金联合基金项目(黔科合LH字[2015]7772号)
闫慧清(1987—),女,讲师,博士,研究方向为园艺植物功能成分。E-mail:qingyanhui@sohu.com
*通信作者:马兆成(1981—),男,副教授,博士,研究方向为园艺植物功能成分。E-mail:mzhaocheng@gmail.com

