蚕砂提取物联合环孢菌素A对再生障碍性贫血大鼠造血祖细胞增殖的影响及其相关机制*
郭 青,蒋 文,巴点点,金润铭△
华中科技大学同济医学院附属协和医院 1儿科 2胃肠外科,武汉 430022
蚕砂提取物联合环孢菌素A对再生障碍性贫血大鼠造血祖细胞增殖的影响及其相关机制*
郭 青1,蒋 文2,巴点点1,金润铭1△
华中科技大学同济医学院附属协和医院1儿科2胃肠外科,武汉 430022
目的 探讨蚕砂提取物联合环孢菌素A(Cyclosporine A,CsA)对再生障碍性贫血(aplastic anemia,AA)大鼠模型造血祖细胞增殖的影响,及对粒系增殖分化PU.1和红系增殖分化JAK2/STAT5信号通路的影响。方法 将Wistar大鼠随机分为正常组、模型组、蚕砂组、CsA组、联合组,共5组。体外提取各组大鼠造血干细胞,定向诱导其向粒单核系、红系分化,对各组造血祖细胞集落形成单位(colony forming units,CFU)计数。提取粒单核系祖细胞总RNA和蛋白,采用实时定量PCR(real-time PCR,qPCR)和Western blot技术检测PU.1 mRNA及蛋白表达情况,提取红系祖细胞总RNA,采用qPCR技术检测细胞JAK2、STAT5、GATA1 mRNA表达情况。结果 ①各治疗组红系造血祖细胞集落形成单位(colony forming unit-erythrocyte,CFU-E)、红系爆式集落形成单位(burst forming unit-erythrocyte,BFU-E)和粒单核系造血祖细胞集落形成单位(colony forming unit-granulocyte macrophage,CFU-GM)数目较模型组均有不同程度增高,差异有统计学意义(均P<0.05);其中联合组CFU-E、BFU-E、CFU-GM升高明显(均P<0.05)。②各治疗组粒单核系细胞PU.1 mRNA和蛋白含量较模型组均有不同程度升高,其中联合组升高明显(均P<0.05)。③各治疗组红系细胞JAK2、STAT5、GATA1 mRNA表达较模型组有不同程度升高,联合组表达高于其他各干预组。结论 蚕砂提取物可能通过增加PU.1 mRNA和蛋白表达及JAK2、STAT5、GATA1 mRNA表达促进AA大鼠骨髓造血作用,且蚕砂提取物联合CsA对AA大鼠骨髓造血具有协同增效作用。
蚕砂提取物; 环孢菌素A; 再生障碍性贫血; 造血祖细胞
再生障碍性贫血(aplastic anemia,AA)是由多种原因引起的骨髓造血功能衰竭性疾病,主要发病机制为免疫机制异常、造血微环境缺陷、造血干/祖细胞数量和(或)功能缺陷以及基因水平异常,最终均导致了骨髓造血干/祖细胞数量的减少造成全血细胞减少。我国属于AA高发地区,且儿童处于再障高发年龄段[1]。据《中国药典》(2000年版)及《中药大辞典》记载:蚕砂甘温能养经络,补气血,辛温能祛风利湿、活血通络,故能补气健脾,化瘀养血。已有研究显示蚕砂提取物联合环孢菌素A(Cyclosporine A,CsA)临床治疗AA疗效满意[2],但其作用机制的研究尚少见。故本实验在整体动物实验基础上,体外培养大鼠造血祖细胞,以探究蚕砂提取物单用或联合CsA是否可促进AA大鼠骨髓造血祖细胞增殖分化,并进一步阐明其作用机制。
1 材料与方法
1.1 实验动物
清洁级Wistar大鼠68只,雌性,6~8周龄,体重180~200 g,湖北省实验动物研究中心提供,许可证编号:SCXK(鄂)2015-0018。
1.2 主要药物
5-氟尿嘧啶注射液(5-FU)(天津金耀,批号:H12020959)、白消安(东京化成工业,批号:062BO-PD)、蚕砂提取物(武汉联合药业有限公司提供,用生理盐水配成40 mg/mL),环孢菌素A口服液(国药集团川抗制药有限公司,批号:H10940044)。
1.3 主要试剂
IMDM培养液(HyClone,批号:AAE201667),胎牛血清(FBS,杭州四季青生物制品公司,批号:120309),淋巴细胞分离液(MP Biomedicals,批号:Q1553),二巯基乙醇(Amresco,批号:60-24-21),甲基纤维素(Sigma,批号:M0512),重组大鼠干细胞因子(SCF,PeproTech,批号:0110258),重组大鼠白细胞介素-3(IL-3,RnDsystems,批号:NAL0115071),重组大鼠促红细胞生成素(EPO,RnDsystems,批号:GVI0314071),重组大鼠粒细胞集落刺激因子(GM-CSF,PeproTech,批号:0902265),兔单克隆抗体PU.1(Santa Cruz,批号:B1915),β-actin单克隆抗体(Aspend,批号:AS1040),山羊抗兔IgG HRP(Aspend,批号:AS1107),SDS-PAGE凝胶制备试剂盒(武汉谷歌生物科技有限公司,批号:G2003),ECL化学发光检测试剂盒(Aspen,批号:AS1059),PU.1、JAK2、STAT5、GATA1、β-actin引物合成于天一辉远公司,逆转录试剂盒(TAKARA,批号:AK3501),SYBR实时上机试剂盒(TAKARA,批号:AK5804)
1.4 主要仪器
BC-2800Vet型全自动血细胞计数分析仪(迈瑞RR-86100146)、倒置显微镜(日本Olympus公司)、凝胶成像分析系统(美国FlourChem FC3),低温离心机(德国Eppendorf公司),稳压稳流电泳仪(北京六一仪器厂),超净台(中国苏净安泰公司),恒温CO2培养箱(日本SANYO公司),PCR仪(德国Biometra公司)。
1.5 动物模型的建立与分组
清洁级Wistar雌性大鼠68只,大鼠适应性喂养1周后按体质量随机分为正常组10只,造模组58只。造模组大鼠均腹腔注射5-FU(150 mg/kg)1次,注射第5天大鼠以白消安溶解液15 mg/kg灌胃,每周1次,连续3周,建立AA大鼠模型;正常组10只大鼠给予相同剂量及频率的生理盐水腹腔注射及灌胃[3],造模结束24 h后随机抽查10只模型大鼠外周血常规、骨髓象,检测模型是否成功。造模结束36 h后将造模组大鼠按体质量随机分为4组,每组12只,分别为模型组,胃饲生理盐水;蚕砂组,胃饲蚕砂提取物(40 mg/kg);CsA组,胃饲CsA(4.5 mg/kg);联合组,胃饲蚕砂提取物(40 mg/kg)联合CsA(4.5 mg/kg),1次/d,连续14 d。
1.6 大鼠单个核细胞悬液的分离、培养及计数
颈椎脱臼处死各组大鼠,取各只大鼠股骨用无血清IMDM培养液反复冲洗骨髓腔,将收集的细胞悬液以1∶1的比例缓慢加入淋巴细胞分离液的上层,2 000 r/min缓升缓降离心25 min,抽取中间白膜层即为骨髓单个核细胞(BMMNC),加入无血清IMDM洗涤2次,后加入适量30%FBS的IMDM培养液重悬,计数调整BMMNC到1.2×106/mL。分别采用以下2种培养体系培养,各体系均分为模型组、蚕砂组、CsA组、联合组与空白组。
粒单核系培养体系:1%甲基纤维素、含30%FBS的IMDM培养液,1%小牛血清白蛋白,10-4mol/L二巯基乙醇,100 U/mL青/链霉素溶液,50 ng/mL SCF,10 ng/mL IL-3,2 ng/mL GM-CSF,1.2×105/mL BMMNC,24孔板,每孔设12个复孔,培养粒单核系细胞。
红系培养体系:1%甲基纤维素、含30%FBS的IMDM培养液,1%小牛血清白蛋白,10-4mol/L二巯基乙醇,100 U/mL青/链霉素溶液,50 ng/mL SCF,10 ng/mL IL-3,3 U/mL EPO,1.2×105/mL BMMNC,24孔板,每孔设12个复孔,培养红系细胞。
将细胞置于5%CO2、37℃、饱和湿度的培养箱中培养。第3天计数红系造血祖细胞集落形成单位(CFU-E),大于8个细胞的细胞团为一个集落;第8天计数粒单核系造血祖细胞集落形成单位(CFU-GM),大于40个细胞的细胞团为1个集落;第10天计数红系爆式集落形成单位(BFU-E),集落可成爆花样,大于50个细胞的细胞团为1个集落。
1.7 分子生物学相关的检测指标与检测方法
于第8天提取粒单核系细胞的总RNA及蛋白,第10天提取红系细胞的总RNA,采用qPCR和Western blot方法检测各组粒单核系细胞中PU.1 mRNA和PU.1蛋白的表达,采用qPCR技术检测各组红系细胞中JAK2、STAT5、GATA1 mRNA表达,β-actin、PU.1、JAK2、STAT5、GATA1基因引物见表1。
1.8 统计学分析
2 结果
2.1 蚕砂提取物联合CsA对AA大鼠造血祖细胞数目的影响
实验过程中,模型组大鼠死亡4只、蚕砂组死亡3只、联合组死亡2只。每组随机选取6只进行统计。在光镜下红系第3天可见由8个细胞组成的细胞团,即CFU-E;红系第10天可见集落爆花样,细胞小而多,细胞间紧密相连,为BFU-E;粒系第8天可见或密集或疏散的无色细胞团,为CFU-GM。见图1。

表1 大鼠PU.1、JAK2、STAT5、GATA1 mRNA扩增引物Table 1 The primers of PU.1,JAK2,STAT5 and GATA1 mRNA in rat
与模型组相比,各治疗组CFU-GM集落数目显著增加(均P<0.01),CsA组CFU-GM集落数目显著高于蚕砂组(P<0.01),联合组CFU-GM集落数目显著增高于CsA组(P<0.01);CsA组、联合组CFU-E、BFU-E集落数目与模型组相比显著增加(均P<0.01),CsA组CFU-E、BFU-E集落数目高于蚕砂组(均P<0.01),联合组CFU-E、BFU-E集落数目高于CsA组(均P<0.05),差异有统计学意义。见表2。

A:CFU-E;B:BFU-E;C:CFU-GM图1 各类造血祖细胞集落形成单位形态(×200)Fig.1 Morphology of colony forming units of hematopoietic progenitor cells in each group(×200)


组别CFU-GM(个)CFU-E(个)BFU-E(个)模型组72.83±5.3158.17±7.4181.50±5.14蚕砂组144.83±11.05*93.50±16.88130.17±21.79CsA组320.50±23.49*#371.67±34.03*#405.33±34.53*#联合组598.00±34.15*#△△542.17±26.90*#△599.67±26.07*#△正常组1216.00±56.59*#△△743.17±19.14*#△△1362.17±61.38*#△△
与模型组比较,*P<0.01;与蚕砂组比较,#P<0.01;与CsA组比较,△P<0.05△△P<0.01
2.2 蚕砂提取物联合CsA对AA大鼠粒单系细胞PU.1 mRNA表达的影响
与正常组相比,模型组粒单系细胞PU.1 mRNA表达明显减低(P<0.01),与模型组相比,各治疗组粒单系细胞PU.1 mRNA表达显著增加(均P<0.01),CsA组、联合组粒单系细胞PU.1 mRNA表达显著高于蚕砂组(均P<0.01),联合组粒单系细胞PU.1 mRNA表达显著增高于CsA组(P<0.01),差异有统计学意义。见图2。

与模型组比较,*P<0.01;与蚕砂组比较,#P<0.01;与CsA组比较,△P<0.01图2 蚕砂提取物联合CsA对AA大鼠粒单系细胞PU.1 mRNA表达的影响Fig.2 Influence of faces bombycis extract and CsA treatment on granulocyte macrophage PU.1 mRNA of AA rat model
2.3 蚕砂提取物联合CsA对AA大鼠粒单系细胞PU.1蛋白表达的影响
与正常组相比,模型组粒单系细胞PU.1蛋白表达减低(P<0.05),与模型组相比,各治疗组粒单系细胞PU.1蛋白表达增加(均P<0.05),CsA组、联合组粒单系细胞PU.1蛋白表达高于蚕砂组(均P<0.05),联合组粒单系细胞PU.1蛋白表达增高于CsA组(P<0.05),差异有统计学意义。见图3。
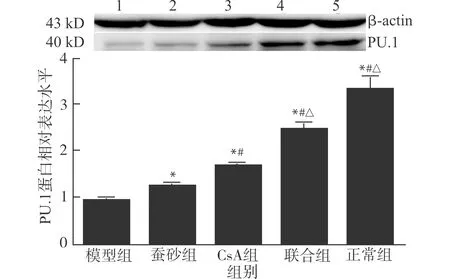
1:模型组;2:蚕砂组;3:CsA组;4:联合组;5:正常组;与模型组比较,*P<0.05;与蚕砂组比较,#P<0.05;与CsA组比较,△P<0.05图3 蚕砂提取物联合CsA对AA大鼠粒单系细胞PU.1蛋白表达的影响Fig.3 Influence of faces bombycis extract and CsA treatment on granulocyte macrophage PU.1 protein of AA rat model
2.4 蚕砂提取物联合CsA对AA大鼠红系细胞JAK2、STAT5、GATA1 mRNA表达的影响
与模型组相比,各治疗组红系细胞JAK2、STAT5、GATA1 mRNA表达有不同程度的增加,CsA组、联合组JAK2、STAT5 mRNA表达高于蚕砂组(P<0.05,P<0.01),联合组JAK2、STAT5 mRNA表达显著高于CsA组(均P<0.01),差异有统计学意义。联合组红系细胞中GATA1 mRNA表达显著高于模型组与蚕砂组。见图4。
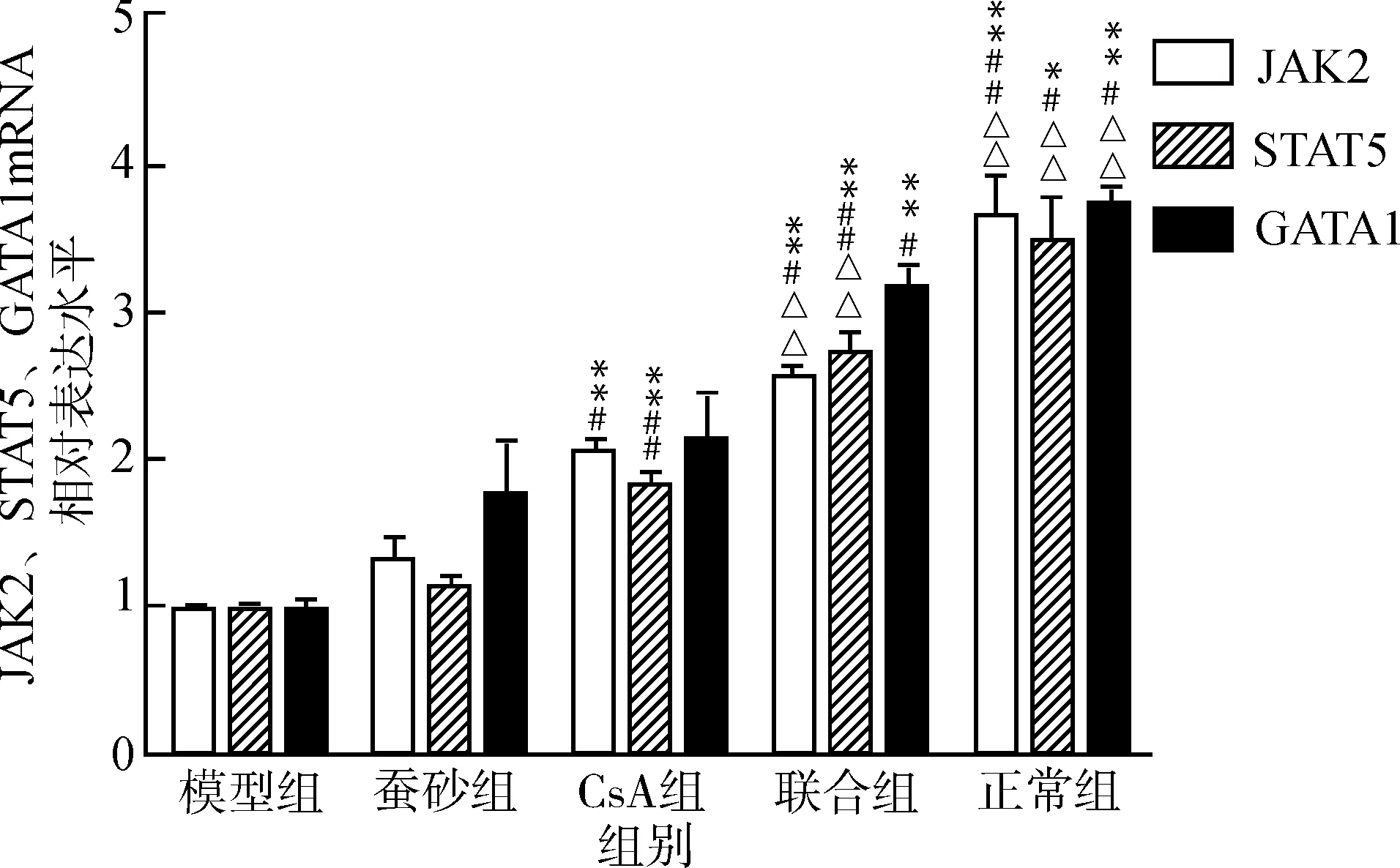
与模型组比较,*P<0.05 **P<0.01;与蚕砂组比较,#P<0.05 ##P<0.01;与CsA组比较,△△P<0.01图4 蚕砂提取物联合CsA对AA大鼠红系细胞JAK2、STAT5、GATA1 mRNA表达的影响Fig.4 Influence of faces bombycis extract and CsA treatment on erythrocyte JAK2,STAT5,GATA1 mRNA of AA rat model
3 讨论
AA是由多种病因所导致的骨髓造血功能衰竭和外周血三系下降,AA的发病机制仍未完全阐明,多数学者认为再障发病与免疫机制异常、造血微环境缺陷、造血干/祖细胞数量和(或)功能缺陷以及基因水平异常有关。其中造血干细胞通过增殖与分化形成造血祖细胞,各系造血祖细胞进一步增殖分化形成形态上可以识别的造血前体细胞,进而形成各系成熟血细胞[4]。红细胞起源于红系造血祖细胞,粒细胞和单核巨噬细胞起源于粒单核系造血祖细胞。蚕砂在我国中医的应用已有相当久远的历史,据《中国药典》(2000年版)及《中药大辞典》记载:蚕砂甘温能养经络,补气血,辛温能祛风利湿、活血通络,故能补气健脾,化瘀养血。尽管已有研究表明蚕砂提取物联合CsA可改善AA小鼠负性造血调控因子[5],但蚕砂提取物单用或联合CsA是否能促进骨髓造血干/祖细胞增殖尚未可知。故本研究首次从此方面进行探究,为有效治疗再障,减轻用药、输血等副作用提供更多选择。
PU.1是造血干细胞定向分化为粒/单核系不可缺少的特异转录因子,表达于造血祖细胞、粒细胞系、单核巨噬细胞,并且表达程度的不同决定着不同的分化方向[6].在造血分化早期PU.1上调促进多能造血干细胞向淋巴系和髓系定向祖细胞分化,在晚期PU.1上调可促进粒/巨噬系祖细胞向单核细胞分化[7]。在造血过程中,细胞因子G-CSF、EPO、干扰素以及白细胞介素类的信号转导都属于酪氨酸激酶(jauns kinase,JAK)/信号转导子和转录活化子(signal transducer and activators of transcription,STAT)信号转导通路[8]。EPO作为最重要的影响红系细胞分化成熟的细胞因子,在红系祖细胞及红系前体细胞阶段起主要作用,它与红系祖细胞表面的受体(EPOR)结合后可激活与EPOR密切相关的JAK2/STAT5信号通路,从而促进造血祖细胞向红系分化[9]。GATA1作为一种红系细胞发育分化成熟所必需的转录因子,在造血干细胞和多系祖细胞转换点被激活后,随着红系祖细胞进一步分化成熟而表达上调[10]。GATA1的靶基因非常多,调控几乎所有红系特异性基因的转录,如珠蛋白基因、红细胞生成素受体、血型糖蛋白等。
本研究通过用蚕砂提取物、CsA、蚕砂提取物联合CsA来干预AA大鼠后,提取培养各组大鼠造血祖细胞,发现模型组无论是红系或者粒单核系造血祖细胞集落均明显低于其他各组,说明本实验再障模型与理论上再障表现的骨髓造血功能减低相一致。联合组CFU-GM、CFU-E、BFU-E数目高于其他2个治疗组,差异有统计学意义。由此可从细胞水平说明,蚕砂提取物可以提高AA大鼠骨髓造血功能,蚕砂提取物联合CsA可显著促进AA大鼠的骨髓造血功能。通过探究粒单核系造血祖细胞PU.1表达情况,可表明,蚕砂提取物可通过提高PU.1的表达从而促进造血干细胞向粒单核系细胞分化,促进相应血液细胞的成熟,而联合组对PU.1提高作用更为明显,说明蚕砂提取物联合CsA可能通过增效PU.1的表达促进粒单核系造血祖细胞的生成,从而提高粒单核系细胞的增殖。通过探究JAK2/STAT5信号通路及GATA1表达发现,联合组红系造血祖细胞JAK2、STAT5、GATA1 mRNA的表达相比于其他2个治疗组明显提高,差异具有统计学意义,与各组CFU-E、BFU-E增殖情况相一致,说明蚕砂提取物联合CsA对红系造血祖细胞增殖分化起到了协同增效的效果。本研究阐明了蚕砂提取物联合CsA可促进再障骨髓造血祖细胞增殖分化,为其在儿童再障临床应用提供了有利的实验研究依据。
[1] Davies1 J K,Guinan E C.An update on the management of severe idiopathic aplastic anaemia in children[J].Br J Haematol,2007,136(4):549-564.
[2] 张学忠,徐燕丽,金娟,等.中药生血宁加环孢菌素A治疗慢性再生障碍性贫血的临床观察[J].中国中西医结合杂志,2006,12(2):142-145.
[3] 赵均铭,褚建新,丁顺利,等.5-氟尿嘧啶与白消安合用诱导建立大鼠急性再生障碍性贫血模型[J].中华血液学杂志,2001,22(4):202-203.
[4] 牛泱平,陈小红,宋必卫,等.人参二醇、三醇皂苷对小鼠骨髓造血干/祖细胞体外增殖的影响[J].中国药理学通报,2004,20(11):1316-1317.
[5] 巨君芳,魏克民.蚕砂提取物联合环孢菌素A治疗再生障碍性贫血的实验研究[J].中国中医药科技,2010,17(6):513-514.
[6] Mak K S,Funnell A P W,Pearson R C M,et al.PU.1 and haematopoietic cell fate:Dosage matters[J].Int J Cell Biol,2011,2011:808524.
[7] Tenen D G.Disruption of differentiation in human cancer:AML shows the way[J].Nat Rev Cancer,2003,3(2):89-101.
[8] Ward A C,Touw I,Yoshimura A.The Jak-Stat pathway in normal and perturbed hematopoiesis[J].Blood,2000,95(1):19-29.
[9] Broxmeyer H E,Hoggatt J,O’Leary H A,et al.Dipeptidylpeptidase 4 negatively regulates colony-stimulating factor activity and stress hematopoiesis[J].Nat Med,2012,18(12):1786-1796.
[10] Bresnick E H,Lee H Y,Fujiwara T,et al.GATA switches as developmental drivers[J].J Biochem Res Int,2010,285(41):31087-31093.
(2016-10-08 收稿)
Effect of Faeces Bombycis Extract and Cyclosporine A on Hematopoietic Progenitor Cells of Aplastic Anemia Rat Model and Its Mechanism
Guo Qing1,Jiang Wen2,Ba Diandian1etal
1DepartmentofPediatrics,2DepartmentofGastrointestinalSurgery,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
Objective To explore the effect of faeces bombycis extract combined with cyclosporine A treatment on proliferation of hematopoietic progenitor cells in aplastic anemia(AA)rat model as well as their influence on the differentiation of myeloid PU.1 and erythroid differentiation of JAK2/STAT5 signaling pathway.Methods The Wistar rats were randomly divided into five groups,model group,faeces bombycis extract group,cyclosporine A(CsA)group,combination group and normal group.Hematopoietic stem cells of rats were extractedinvitroand were directionally induced to differentiate into hematopoietic progenitor cells of granulocytes and erythrocytes.The colony forming units(CFU)formed by hematopoietic progenitor cells of each group were counted.Total mRNA and protein were extracted and the levels of PU.1 mRNA and protein were detected with real-time polymerase chain reaction(qPCR)and Western blotting.Erythroid cell mRNA was extracted and the levels of JAK2,STAT5,GATA1 mRNA were detected with qPCR.Results ① Compared with the model group,assay of colony forming unit-granulocyte macrophage(CFU-GM),assay of colony forming unit-erythrocyte(CFU-E)and burst forming unit-erythrocyte(BFU-E)in each treatment group were increased(allP<0.05),and CFU-E,BFU-E and CFU-GM in the combination group were significantly increased(allP<0.05).Compared with the model group,PU.1 mRNA and protein levels of granulocytes in each treatment group were increased in a varying degree,while those in the combination group were increased significantly as compared with the other treatment groups(allP<0.05).③ Compared with the model group,JAK2,STAT5 and GATA1 mRNA levels of erythroid cells in each treatment group were increased;and those in the combination group present a remarkable growth compared with the other treatment groups.Conclusion Faeces bombycis extract may promote bone marrow function of AA rat model through increasing the expression of PU.1,JAK2,STAT5 and GATA1 while faeces bombycis extract and cyclosporine A have a synergistic effect on bone marrow function of AA rat model.
faeces bombycis extract; cyclosporine A; aplastic anemia; hematopoietic progenitor cells
*教育部科研基金资助项目(No.20130142110069)
郭 青,女,1990年生,硕士研究生,E-mail:oppoguoqing@163.com
△通讯作者,Corresponding author,E-mail:jinrunm@qq.com
R556.5
10.3870/j.issn.1672-0741.2017.01.007

