应用PCR-RFLP方法检测优质瘦肉型种公猪的氟烷基因
唐一波,李超燕,吴细波,曹玉美(广西农垦永新畜牧集团有限公司良圻原种猪场,广西 南宁 530317)
应用PCR-RFLP方法检测优质瘦肉型种公猪的氟烷基因
唐一波,李超燕,吴细波,曹玉美
(广西农垦永新畜牧集团有限公司良圻原种猪场,广西 南宁 530317)
为构建稳定的抗应激核心猪群,进一步净化隐性氟烷基因,采用PCR-RFLP技术检测了良圻原种猪场公猪站在群公猪大约克夏、长白、杜洛克3个品种合计216头生产公猪氟烷基因分布情况,并通过直接测序法对检测结果进行验证。结果表明,在群的216头生产公猪中只检测到氟烷基因显性纯合子(HalNN),并未检测出HalNn、Halnn两种类型的个体,氟烷显性基因HalN频率和隐性基因Haln频率分别为1.00和0,并在Hal基因第16内含子上发现3个新的碱基突变位点。在生产公猪中,已实现氟烷隐性基因的剔除,为培育优质瘦肉型配套系种猪选育工作提供了有力的保障。
猪;氟烷基因;PCR-RFLP;应激综合征
氟烷基因(Halothane,Hal),又称氟烷敏感基因或兰尼定受体基因,是控制猪应激综合征的主效基因之一,当该基因的cDNA中发生C1843→T1843突变时,猪只易产生应激综合征[1](porcine stress syndrome, PSS)。PSS是指猪只在受到外界因子(如争斗、运输、高热、驱赶)的刺激时发生异常的应激反应而死亡或宰后产生PSE或DFD劣质猪肉,它给养猪业造成很大的经济损失。Haln基因在我国地方猪种检出率较低,但是在外来猪种中具有较高的检出率。由于近年来不断地引进外来猪种进行品种改良以及追求Haln对瘦肉率的遗传效益,Haln基因有呈扩散趋势[2]。国内的猪场大部分以外来猪种大约克夏猪、长白猪、杜洛克猪为主要规模化生产构架,这3个品种及其生产的三元杂种商品猪均属于高瘦肉率的猪种,与地方猪种相比更容易产生PSS。研究表明,国内的地方品种在风味及肉质品质上都要优于国外的引进品种如长白、大约克夏、杜洛克及其配套生产的三元杂种猪等,很可能在某些肉质性状的遗传标记上存在差异[3]。国内外养猪行业的竞争十分激烈,而市场对猪肉的需求逐步从数量过渡到对优质、健康猪肉的需求,因此对应激敏感基因的筛查及剔除具有重大意义。
氟烷基因型有3种,氟烷显性纯合子(HalNN)、氟烷隐性纯合子(Halnn)、杂合子(HalNn),其中Halnn型虽然在生长速度和瘦肉率方面优于HalNN,但易使猪只产生PSS,因此在育种群中作为父本的种公猪基因型应当优选HalNN型[4]。近年来,随着基因分析技术的不断进步,对氟烷基因型的检测方法也不断更新。目前应用比较广泛的检测技术有很多,包括高通量测序技术、芯片技术、时间飞行质谱技术、聚合酶链式-限制性内切酶片段长度多态技术(PCRRFLP法)等[5]。PCR-RFLP法由于便捷、准确性高,在氟烷基因检测上有较多的应用。研究显示,应用限制性内切酶Hha I进行PCR-RFLP时,当Hal基因C1843→T1843发生突变,则会导致Hha I内切酶的识别位点5'GCG↓C3'发生改变,表现为PCR产物可被限制性内切酶Hha I切成不同的带型[6]:若在凝胶上显示2个条带(493 bp+166 bp),基因型为NN;1个条带(659 bp),基因型为nn;3个条带(659 bp+493 bp+ 166 bp),则基因型为Nn。
良圻原种猪场公猪站存栏生产公猪216头,是国内首家应用空气过滤新工艺,集全国生猪品种改良、加快场内种猪遗传进展以及社会化供精任务于一体的新式公猪站,配套服务公司内部及社会客户3万余头母猪,因此公猪遗传效应的改进十分重要。为探究Haln基因在良圻原种猪场的分布情况,特对在群生产公猪、后备公猪进行氟烷敏感基因的检测,及时发现并淘汰公猪群体中携带Haln基因的个体,以期育成一个无Haln基因的抗应激种猪群体,生产优质、健康的猪肉。
1 材料与方法
1.1 试验时间与地点
试验于2015年9月至2016年2月在广西农垦永新畜牧集团有限公司良圻原种猪场兽医技术中心进行。
1.2 材料
216头试验种猪均来自广西农垦永新畜牧集团有限公司良圻原种猪场公猪站的生产公猪,其中大约克夏公猪68头,长白公猪72头,杜洛克公猪76头。用耳号钳剪取一小块耳组织(约0.5 g),放于装有1 mL 75%乙醇的1.5 mL离心管中,在-20℃条件下保存备用。
1.3 DNA的提取
参照基因组DNA抽提试剂盒说明提取样品DNA,DNA样品于-20℃保存。
1.4 引物设计与合成[1]
根据相关的文献报道,经DNA Star软件分析,设计出一对合适的引物并由上海生工合成。
上游引物序列为:5'-TCCAGTTTGCCACAGGTC CTACCA-3',下游引物序列为:5'-ATTCACCGGAGT GGAGTCTCTGAG-3'。
1.5 PCR扩增体系及产物检测
PCR反应体系总体积为20 μL,包括上、下游引物各0.5 μL,Taq酶8μL,DNA模板1μL,ddH2O10μL。反应条件为:94℃预变性5 min;94℃变性45 s,64℃退火40 s,72℃延伸1 min,共35个循环;72℃延伸7 min后,4℃保存备用。扩增产物用1.5%琼脂糖凝胶电泳进行检测,预期扩增片段659 bp。
1.6 RFLP分析
酶切总反应体系20 μL:PCR产物10 μL,ddH2O 8 μL,限制性内切酶Hha I 2 μL,37℃水浴恒温过夜。酶切产物用1.5%琼脂糖凝胶电泳进行检测。
1.7 测序分析
在进行RFLP检测分析基因型个体后,随机抽取5个样本,将PCR产物送英俊生物有限公司进行双向测序分析。
2 结果与分析
2.1 猪Hal基因的PCR扩增
样品经过35个循环的PCR扩增后,取5 μL扩增产物进行1.5%琼脂糖凝胶电泳分析,结果如图1所示。从图1可知,在659 bp处出现单一的特异性条带,与目的片段大小相符,可用于后续试验。
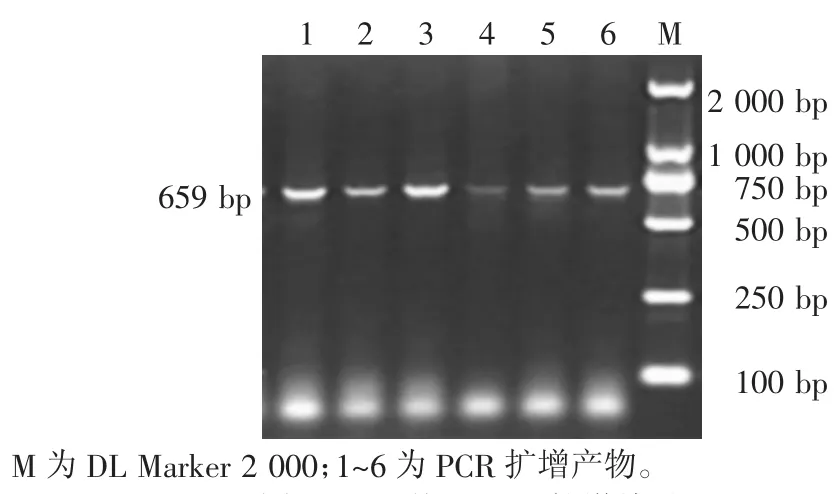
图1 Hal基因PCR扩增结果
2.2 猪Hal基因的酶切反应结果
对扩增的PCR产物用限制性内切酶Hha I进行消化,酶切结果用1.5%琼脂糖凝胶电泳检测,结果见图2。从表1可知,在216个样本中仅检测出HalNN基因型,没有检出Halnn型及HalNn型个体。

图2 HhaⅠ酶切结果

表1 Hal基因的基因型频率和等位基因频率分布
2.3 测序结果
对已进行RFLP检测的基因型样本随机抽取5份进行测序验证及序列比对,结果见图3。测序结果显示,未发现个体在Hal基因CDS的1 843位点处HhaI酶切位点C→T产生碱基变异,仅出现了碱基C的单一峰,证明了本研究中RFLP检测结果的可靠性。
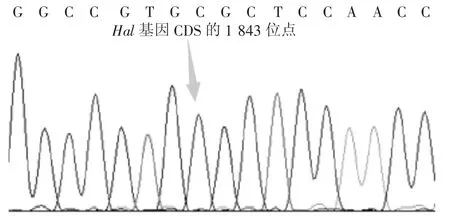
图3 Hal基因测序结果
在本研究中未发现C1843→T1843位点的突变,但是却在5个样品中都发现了新的3处未报道的碱基突变位点。从图4和5可以发现,在Hal基因第16内含子上的18 280、18 359、18 361处分别存在一处新的突变位点,分别导致基因产生G→C、T→C、A→G的变异。虽然这些突变处于内含子上,不直接参与基因的编辑,但是内含子对基因的转录具有某种调控作用,使机体的基因表达发生改变。DNA上的内含子可以转录到前体RNA中,Hal基因中内含子16上产生的突变,是否导致其合成的蛋白质结构及功能改变,从而影响猪只的生长性能及肉质性状,还需进一步分析。

图4 Hal基因第16内含子18 280位点测序结果

图5 Hal基因第16内含子18 359和18 361位点测序结果
3 讨论
RFLP(RestrictionFragment Length Polymorphism,限制性内切酶片段长度多态性)是为第一代分子生物学标记,与PCR技术相结合的PCR-RFLP技术具有操作便捷、稳定性高、针对性强等特点[7],可以直接在酶切后的电泳图谱中进行基因特定位点的分型及多态性检测,近年来广泛运用于动物遗传育种工作研究中。
影响猪肉品质的因素主要有饲养环境、营养水平、屠宰条件及遗传因素,其中遗传因素起到至关重要的作用。Hal基因作为影响猪肉品质的基因之一,被广泛的应用于分子标记辅助育种当中。研究结果表明,Hal基因具有多效性[8-9]。Hal基因一方面是调控猪只产生PSS的主效基因之一,是产生PSE或DFD劣质猪肉主要因子;另一方面,Hal基因杂合子对猪的胴体性状、瘦肉率、日增重等经济性能有一定的增效作用,同时在肉色、pH和失水率等性状上,各基因型也存在显著或极显著的差异[4]。
研究表明,Halnn型母猪与HalNN、HalNn型相比,产仔数、产活仔数、断奶仔猪重等繁殖性能显著降低[10]。在常规的选种选育中,很容易将Hal基因杂合子猪在生长性能上的表现出来的优势作为主要选留依据进行留种,从而使Haln基因频率在群体里增加、扩散。因此,在育种过程中,应对核心群种猪进行氟烷基因的检测,淘汰种猪群中的Halnn、HalNn型个体。
2007年伍少钦等[11]采用PCR-RFLP方法对良圻原种猪场第二种猪场核心群112头种猪进行检测,发现良圻原种猪场第二种猪场的核心群中携带隐性氟烷基因Haln的个体存在几率很小。本次试验检测结果未发现C1843→T1843位点的突变,Hal基因检测全为NN个体,HalN频率为1.00,Haln频率为0,说明良圻原种猪场公猪站的生产公猪携带Haln基因的几率很小,具备开展优质瘦肉型抗应激种猪配套系构建的条件。在Hal基因第16内含子上发现3处新的碱基突变位点,这些位点碱基的替换是否可能影响生产公猪的生长、繁殖性能,是我们下一步研究Hal基因作用、应用于生产实践中的方向。在接下来的育种工作中应当重视氟烷隐性基因的净化工作,持续的对氟烷基因进行检测,及时发现并淘汰育种群中的Haln基因,培育出健康优质抗应激配套系猪群。
[1] Fujii J,Otsu K,Zorzato F,et al.Science[J],1991,253(5018): 448-451.
[2]王荣梅,苏荣胜.畜牧兽医科技信息[J],2006(4):10-12.
[3] 耿忠诚,袁子国,刘德贵,等.黑龙江畜牧兽医[J],2006(11):19-22.
[4]张建军.福建畜牧兽医[J],2016,38(1):17-19.
[5]王彦平,王怀中,姜运良,等.山东农业科学[J],2016(8):128-133.
[6] 严雪瑜,黄云,严小东,等.湖北农业科学[J],2012,51(18):4144-4146.
[7]刘云芳,剡根强,王新峰.内蒙古畜牧科学[J],2002(2):17-19.
[8]付言峰,李克励,林皓,等.家畜生态学报[J],2010(5):13-16.
[9]于海峰.养殖技术顾问[J],2012(5):245-246.
[10]蒋思文,熊远著,邓彦昌.中国畜牧杂志[J],1997(2):9-10,21.
[11]伍少钦,唐荣福,吴志君,等.广西畜牧兽医[J],2007(5):214-216.
(编辑:富春妮)
Detection of the Halothane Gene in Breeder Boars of High-Quality Lean-Type Pig with Using PCR-RFLP
TANG Yibo,LI Chaoyan,WU Xibo,CAO Yumei
(Guangxi State Farms Yongxin Livestock Husbandry Group Co.,Ltd.,Nanning 530317,China)
In order to build stable core swinery against stress and purify recessive halothane gene in boar station of Liangqi original seed farm,allele frequency distribution of 216 pigs was examined using PCR-RFLP, and then was identified using sanger sequencing.The experimental pigs were Yorkshire,Landrace and Duroc, and were in semen collection stage.The results showed that there was only dominant homozygote(HalNN)and no heterozygote(HalNn)and recessive homozygote(Halnn)in experimental pigs,and the allele frequency of HalNand Halnwas 1.00 and 0,respectively.Moreover,we found 3 novel mutant site in 16th intron.Therefore,the recessive allele of halothane was cleaned to provide powerful guarantee for selective breeding high-quality lean-type boars.
pig;halothane gene;PCR-RFLP;stress syndrome
S828
A
1002-1957(2017)01-0060-03
2016-12-15
重大专项计划—优质瘦肉型配套系种猪选育与产业化示范(桂科重14121003-2-3)
唐一波(1987-),男,广西贺州人,助理畜牧师,硕士,主要从事动物遗传育种与繁殖工作.E-mail:tang09284217@163.com

