酵母细胞壁多糖对哺乳母猪繁殖性能影响的研究
何 健,王亚超,李元凤,敖 翔(.西南科技大学生命科学与工程学院,四川 绵阳 600;.四川铁骑力士集团冯光德实验室,绵阳 6006)
酵母细胞壁多糖对哺乳母猪繁殖性能影响的研究
何 健1,王亚超1,李元凤1,敖 翔2
(1.西南科技大学生命科学与工程学院,四川 绵阳 621010;2.四川铁骑力士集团冯光德实验室,绵阳 621006)
为了研究酵母细胞壁多糖对哺乳母猪繁殖性能的影响,选取妊娠85 d体重、胎次(2~3胎)及预产期相近的长白和大白母猪96头,随机分为3组,每组32个重复,每个重复1头母猪,分别饲喂添加有0、0.2%和0.4%酵母细胞壁多糖的饲粮。试验结果表明,0.4%酵母细胞壁多糖组泌乳母猪产程比对照组小幅度缩短(P>0.05);0.2%酵母细胞壁多糖组和0.4%酵母细胞壁多糖组断奶窝重比对照组分别极显著提高18.0%和25.2%,断奶个体重比对照组分别提高13.98%(P<0.05)和17.91%(P<0.01);而0.2%酵母细胞壁多糖组和0.4%酵母细胞壁多糖组产仔数、产活仔数、合格仔猪数(初生重≥0.85 kg的健康仔猪)、断奶至发情间隔、胎盘重、仔猪初生窝重、初生个体重和断奶仔猪数与对照组相比,差异不显著(P>0.05)。初乳中脂肪、蛋白质、乳糖各组差异不显著(P>0.05),而0.4%酵母细胞壁多糖组非脂类比对照组显著提高7.4%(P<0.05),全乳固体比对照组极显著提高10.64%(P<0.01);常乳中脂肪、蛋白质、乳糖、非脂类、全乳固体各组差异均不显著(P>0.05)。0.2%酵母细胞壁多糖组和0.4%酵母细胞壁多糖组母猪血清谷丙转氨酶活性、谷草转氨酶活性、总胆固醇及甘油三酯含量与对照组相比均降低,而母猪血清总蛋白、白蛋白、球蛋白含量以及白细胞数、红细胞数和血小板数均提高,但对血液中碱性磷酸酶、葡萄糖含量以及红细胞压积各组差异不显著(P>0.05)。0.2%酵母细胞壁多糖组和0.4%酵母细胞壁多糖组哺乳仔猪血清谷丙转氨酶、谷草转氨酶活性与对照组相比降低,总蛋白(21日龄除外)、白蛋白、球蛋白含量,以及碱性磷酸酶活性各组差异不显著。综上,在母猪妊娠后期及泌乳期饲粮中添加酵母细胞壁多糖能提高母猪的繁殖性能和泌乳性能,改善血清理化指标,但对乳成分无较大影响。从生产和经济性考虑,以酵母细胞壁多糖0.2%添加量为宜。
酵母细胞壁多糖;母猪;仔猪;繁殖性能
酵母细胞壁多糖(yeast culture wall,YCW)是一种源于酵母的天然高效免疫增强剂,其主要功效成分为甘露寡糖和β-1,3/1,6葡聚糖。β-葡聚糖能激发非特异性和特异性免疫反应,激活T细胞、B细胞、巨噬细胞和自然杀伤细胞(Cross等,2001)[1],提高动物的抗病力,并提高生产性能(刘影等,2003;李志清等,2004)[2-3]。甘露寡糖一方面可黏附到细菌细胞表面,阻止细菌黏附到肠上皮细胞(Finucane等,1999;Spring等,2000)[4-5],提高动物抗细菌感染能力;另一方面,甘露寡糖通过引发直接的抗体反应来增强免疫力。目前许多试验研究表明,在妊娠期与哺乳期均添加一定量的酵母细胞壁多糖对提高仔猪断奶窝重有良好效果(Kim等,2008)[6]。在妊娠母猪饲粮中添加0.1%和0.2%的酵母细胞壁多糖,有效提高了母猪的采食量、健仔率和仔猪断奶窝重(邢宝松等,2004;吴永绍等,2011)[7-8]。但上述有关酵母细胞壁多糖对哺乳母猪繁殖性能影响的研究不够全面系统,本研究就酵母细胞壁多糖对哺乳母猪繁殖性能影响做较为全面的研究,为以后的深入研究提供参考。
1 材料与方法
1.1 酵母细胞壁多糖来源
本次试验所用酵母细胞壁多糖是由安琪酵母股份有限公司提供。
1.2 试验仪器
背膘仪:美国运高生产,型号:AC0127SH;乳成分分析仪,由福特公司生产,型号:FT-120;电子台秤:中国凯丰集团生产,型号TCS-100;全自动动物血液细胞分析仪:普朗医疗生产,型号XFA6130;自动生化分析仪:BECKMAN COULTER生产,型号:unicel DXC800。
1.3 试验时间与地点
本试验于2014年7月初至10月中旬在绵阳市三台灵兴种猪场进行。
1.4 试验设计
选取妊娠85 d体重、胎次(2~3胎)及预产期相近的长白和大白母猪96头,随机分为3组,每组32个重复,每个重复1头母猪,分别饲喂添加酵母细胞壁多糖为0、0.2%、0.4%的饲粮(表1)。妊娠期间限制饲喂,分娩当天禁止采食,之后自由采食。采用乳头式自动饮水器自由饮水,妊娠舍和厂房温度保持在25℃左右,每天对猪舍用2%氢氧化钠水溶液喷雾消毒。母猪于分娩前2~3 d转入产房,分娩前用温热水擦拭母猪外阴部及乳腺。整个饲喂周期为妊娠85 d至21 d断奶后开始发情为止。

表1 基础饲粮配方与营养水平
1.5 饲养管理
试验母猪按该场饲喂时间正常饲喂,每天饲喂两次,时间为6:00和15:00。试验期间执行正常免疫程序。仔猪21日龄断奶,出生后第3天对其进行补铁、剪耳号等,对公猪去势。
1.6 测定指标及方法
1.6.1 母猪生产性能 产程(第1头仔猪产出到最后一只仔猪产出的时间)、产仔数、产活仔数、合格仔猪数(除去畸形、体重低于0.85 kg的仔猪后剩余仔猪数)、死胎、木乃伊胎、胎盘重(将排出的所有胎盘收集称重)、产后背膘厚和断奶背膘厚(母猪产后第2天和断奶第2天自然站立时的P2背膘厚)、断奶至发情间隔。
1.6.2 仔猪生长性能 初生窝重、初生个体重、断奶仔猪数、断奶窝重、断奶个体重。
1.6.3 乳成分 初乳:母猪产后12 h以内的乳汁。取样时间集中在母猪羊水破后到产仔完毕之间,操作人员戴无菌橡胶手套用纱布蘸温热水擦拭母猪乳腺后采样,每头母猪采初乳30 mL装入灭菌采乳管中,放入4℃冰箱中保存。常乳:泌乳第14天,用采初乳的操作方法,采集30 mL常乳装入灭菌采乳管中,放入4℃冰箱中保存。检测乳成分,包括脂肪、蛋白质、乳糖、非脂类和全乳固体。
1.6.4 血清理化指标 母猪(每个重复1头母猪)分娩后第7天、第14天、第21天以及仔猪(每个重复4头仔猪)7日龄、14日龄、21日龄时分别抽取前腔静脉血5 mL,其中3 mL装在促凝管内放在冰箱内低温保存当天送检进行血清总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、葡萄糖(GLU)、甘油三酯(TG)、总胆固醇含量(TC)及谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)活性等生化项目分析,另外2 mL装在EDTA抗凝管内立即用全自动动物血液细胞分析仪进行红细胞(RBC)、白细胞(WBC)、血小板(PLT)、红细胞压积(HCT)等血液生理指标分析。
1.7 统计分析
采用Excel 2007进行数据整理,用SPSS 19.0统计软件对数据进行单因素方差分析和多重比较,结果用平均数±标准差表示。
2 试验结果
2.1 母猪繁殖性能
由表2可知,0.2%酵母细胞壁多糖组和0.4%酵母细胞壁多糖组母猪产程、产仔数、产活仔数、合格仔猪数、胎盘重与对照组无显著性差异(P>0.05)。母猪产后背膘厚对照组与0.4%酵母细胞壁多糖组无显著差异(P>0.05),0.2%酵母细胞壁多糖组与对照组差异显著(P<0.05),0.2%酵母细胞壁多糖组与0.4%酵母细胞壁多糖组差异极显著(P<0.01)。母猪断奶背膘厚0.4%酵母细胞壁多糖组与对照组和0.2%酵母细胞壁多糖组差异显著(P<0.05),对照组与0.2%酵母细胞壁多糖组差异不显著(P>0.05)。然而,母猪产后背膘厚与断奶背膘厚之差对照组为4.42 mm,0.2%酵母细胞壁多糖组为2.79 mm,0.4%酵母细胞壁多糖组为2.94 mm。母猪断奶至发情间隔,两个试验组与对照组差异不显著(P>0.05),而0.2%酵母细胞壁多糖组显著短于0.4%酵母细胞壁多糖组,说明0.2%酵母细胞壁多糖更有利于缩短母猪断奶至发情间隔。
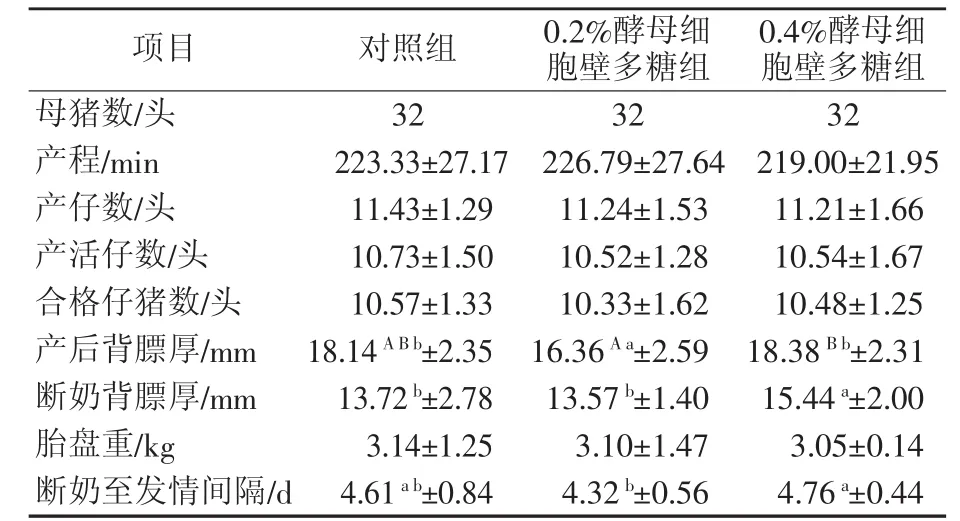
表2 酵母细胞壁多糖对母猪繁殖性能的影响
2.2 仔猪生长性能
由表3可知,初生窝重、初生个体重、断奶仔猪数各组差异不显著(P>0.05)。断奶窝重,两个试验组与对照组差异极显著(P<0.01)。断奶个体重,对照组与0.2%酵母细胞壁多糖组差异显著(P<0.05),与0.4%酵母细胞壁多糖组差异极显著(P<0.01)。
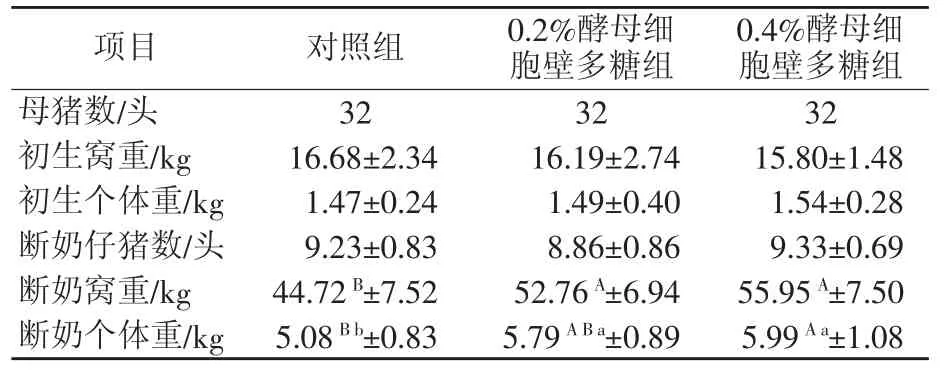
表3 酵母细胞壁多糖对仔猪生长性能的影响
2.3 乳成分
由表4可知,初乳中脂肪、蛋白质、乳糖各组差异不显著(P>0.05)。非脂类,0.2%酵母细胞壁多糖组和对照组均与0.4%酵母细胞壁多糖组差异显著(P<0.05);全乳固体,0.2%酵母细胞壁多糖组和对照组均与0.4%酵母细胞壁多糖组差异极显著(P<0.01)。说明在妊娠后期母猪饲粮中添加0.4%酵母细胞壁多糖对初乳中脂肪、蛋白质及乳糖无显著影响,但对初乳中非脂类有显著影响,对全乳固体有极显著影响。

表4 酵母细胞壁多糖对泌乳母猪初乳成分的影响
由表5可知,常乳脂肪、蛋白质、乳糖、非脂类以及全乳固体各组差异不显著(P>0.05),说明在妊娠后期饲粮中分别添加0.2%酵母细胞壁多糖和0.4%酵母细胞壁多糖对常乳脂肪、蛋白质、乳糖、非脂类以及全乳固体无显著影响。

表5 酵母细胞壁多糖对泌乳母猪常乳成分的影响
2.4 酵母细胞壁多糖对母猪血液指标的影响
2.4.1 酵母细胞壁多糖对母猪血清代谢酶活性的影响 由表6可知,谷丙转氨酶活性,分娩第7天,两个试验组极显著低于对照组(P<0.01);分娩第14天,0.4%酵母细胞壁多糖组极显著低于对照组(P<0.01),0.2%酵母细胞壁多糖组显著低于对照组(P<0.05);分娩第21天,0.4%酵母细胞壁多糖组显著低于对照组和0.2%酵母细胞壁多糖组(P<0.05),0.2%酵母细胞壁多糖组与对照组差异不显著(P>0.05)。谷草转氨酶活性,分娩第7天、第14天,两个试验组均极显著低于对照组(P<0.01);分娩第21天,0.4%酵母细胞壁多糖组极显著低于对照组(P<0.01),0.2%酵母细胞壁多糖组显著低于对照组(P<0.05)。碱性磷酸酶活性,分娩第7天、第14天、第21天各组差异不显著(P>0.05)。

表6 酵母细胞壁多糖对母猪血清代谢酶活性的影响
2.4.2 酵母细胞壁多糖对母猪血清生化指标的影响 由表7可知,总蛋白含量,分娩第7天,两个试验组显著高于对照组(P<0.05);分娩第14天,0.2%酵母细胞壁多糖组极显著高于对照组(P<0.01),0.4%酵母细胞壁多糖组与对照组差异不显著(P>0.05);分娩第21天,两个试验组均极显著高于对照组(P<0.01)。白蛋白含量,分娩第7天,0.4%酵母细胞壁多糖组极显著高于对照组(P<0.01),0.2%酵母细胞壁多糖组与对照组、0.4%酵母细胞壁多糖组差异不显著(P>0.05);分娩第14天、第21天,两个试验组均极显著高于对照组(P<0.01)。球蛋白含量,分娩第7天,0.2%酵母细胞壁多糖组极显著高于对照组(P<0.01),0.4%酵母细胞壁多糖组显著高于对照组(P<0.05);分娩第14天,0.2%酵母细胞壁多糖组极显著高于对照组(P<0.01)、显著高于0.4%酵母细胞壁多糖组(P<0.05),而0.4%酵母细胞壁多糖组与对照组差异不显著(P>0.05);分娩第21天,两个试验组均显著高于对照组(P<0.05)。

表7 酵母细胞壁多糖对母猪血清生化指标的影响
2.4.3 酵母细胞壁多糖对母猪血糖、血脂组分的影响 由表8可知,葡萄糖含量,各组差异不显著(P>0.05)。总胆固醇含量,分娩第7天,0.4%酵母细胞壁多糖组显著低于对照组(P<0.05),0.2%酵母细胞壁多糖组与对照组差异不显著(P>0.05);分娩第14天,两个试验组均显著低于对照组(P<0.05);分娩第21天,两个试验组均极显著低于对照组(P<0.01)。甘油三酯含量,分娩第7天、第21天,0.4%酵母细胞壁多糖组极显著低于对照组(P<0.01),0.2%酵母细胞壁多糖组显著低于对照组(P<0.05);分娩第14天,两个试验组均极显著低于对照组(P<0.01)。

表8 酵母细胞壁多糖对母猪血糖、血脂组分的影响
2.4.4 酵母细胞壁多糖对母猪全血指标的影响 由表9可知,白细胞含量,0.4%酵母细胞壁多糖组在分娩第7天、第14天及第21天时均显著高于对照组(P<0.05),0.2%酵母细胞壁多糖组在分娩第14天、第21天时也显著高于对照组(P<0.05)。红细胞含量,分娩第7天,两个试验组均显著高于对照组(P<0.05);分娩第14天,两个试验组相对于对照组均有提高的趋势,但差异不显著;分娩第21天,0.4%酵母细胞壁多糖组显著高于对照组(P<0.05),而0.2%酵母细胞壁多糖组与对照组差异不显著。血小板含量,分娩第7天、第14天,0.4%酵母细胞壁多糖组显著高于对照组(P<0.05),而0.2%酵母细胞壁多糖组与对照组差异不显著(P>0.05);分娩第21天,0.2%酵母细胞壁多糖组显著高于对照组(P<0.05),而0.4%酵母细胞壁多糖组与对照组差异不显著(P>0.05)。红细胞压积,各组差异不显著(P>0.05)。

表9 酵母细胞壁多糖对母猪全血指标的影响
2.5 酵母细胞壁多糖对哺乳仔猪血液指标的影响
2.5.1 酵母细胞壁多糖对仔猪血清代谢酶活性的影响 由表10可知,仔猪7日龄,0.2%酵母细胞壁多糖组血清谷丙转氨酶(ALT)、谷草转氨酶(AST)活性极显著低于对照组(P<0.01),而碱性磷酸酶(ALP)活性高于对照组,但差异不显著(P>0.05);0.4%酵母细胞壁多糖组相对于对照组3个指标差异均不显著(P>0.05);两个试验组相比,0.2%酵母细胞壁多糖组血清谷丙转氨酶(ALT)活性和谷草转氨酶(AST)活性均显著低于0.4%酵母细胞壁多糖组(P<0.05),碱性磷酸酶(ALP)活性两组差异不显著(P>0.05)。
仔猪14日龄,0.2%酵母细胞壁多糖组血清谷丙转氨酶(ALT)、谷草转氨酶(AST)活性极显著低于对照组(P<0.01),碱性磷酸酶(ALP)活性与对照组相比差异不显著(P>0.05);0.4%酵母细胞壁多糖组谷丙转氨酶(ALT)、谷草转氨酶(AST)活性极显著低于对照组(P<0.01),碱性磷酸酶(ALP)活性与对照组相比差异不显著(P>0.05);两个试验组相比,0.2%酵母细胞壁多糖组血清谷丙转氨酶(ALT)活性极显著高于0.4%酵母细胞壁多糖组(P<0.01),谷草转氨酶(AST)活性极显著低于0.4%酵母细胞壁多糖组(P<0.01),碱性磷酸酶(ALP)活性两组差异不显著(P>0.05)。
仔猪21日龄,0.2%酵母细胞壁多糖组血清谷丙转氨酶(ALT)活性极显著低于对照组(P<0.01),谷草转氨酶(AST)活性显著低于对照组(P<0.05),碱性磷酸酶(ALP)活性低于对照组,但差异不显著(P>0.05);0.4%酵母细胞壁多糖组血清谷丙转氨酶(ALT)活性极显著低于对照组(P<0.01),谷草转氨酶(AST)、碱性磷酸酶(ALP)活性与对照组差异不显著(P>0.05);两个试验组相比,0.2%酵母细胞壁多糖组血清谷丙转氨酶(ALT)活性极显著高于0.4%酵母细胞壁多糖组(P<0.01),谷草转氨酶(AST)显著低于0.4%酵母细胞壁多糖组,碱性磷酸酶(ALP)活性两组差异不显著(P>0.05)。

表10 酵母细胞壁多糖对仔猪血清代谢酶活性的影响
2.5.2 酵母细胞壁多糖对仔猪血清生化指标的影响 由表11可知,仔猪7日龄,0.2%酵母细胞壁多糖组血清总蛋白(TP)、白蛋白(ALB)含量高于对照组,但差异不显著(P>0.05);球蛋白(GLB)含量低于对照组,但差异不显著(P>0.05)。0.4%酵母细胞壁多糖组总蛋白(TP)、白蛋白(ALB)含量低于对照组,但差异不显著(P>0.05);球蛋白(GLB)含量高于对照组,但差异不显著(P>0.05)。两个试验组相比,3个指标均差异不显著(P>0.05)。
仔猪14日龄,0.2%酵母细胞壁多糖组和0.4%酵母细胞壁多糖组血清总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)含量高于对照组,但差异不显著(P>0.05)。两个试验组间各指标均差异不显著(P>0.05)。
仔猪21日龄,0.2%酵母细胞壁多糖组和0.4%酵母细胞壁多糖组血清总蛋白(TP)含量极显著高于对照组(P<0.01);白蛋白(ALB)、球蛋白(GLB)含量高于对照组,但差异不显著(P>0.05)。两个试验组间各指标均差异不显著(P>0.05)。
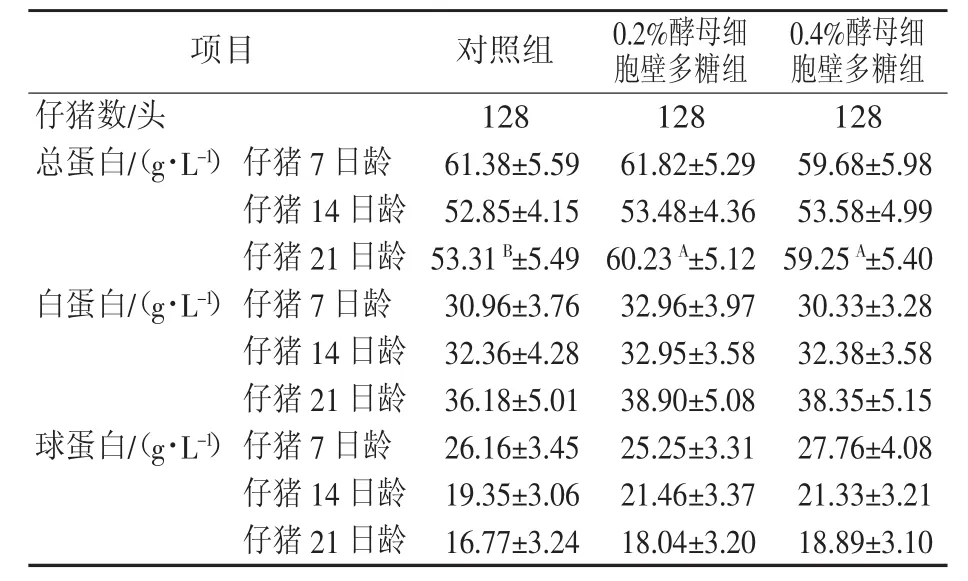
表11 酵母细胞壁多糖对仔猪血清生化指标的影响
2.5.3 酵母细胞壁多糖对仔猪血清血糖、血脂含量的影响 由表12可知,仔猪7日龄,0.2%酵母细胞壁多糖组血清葡萄糖(GLU)含量显著低于对照组(P<0.05),总胆固醇(TC)、甘油三酯(TG)含量低于对照组,但差异不显著(P>0.05);0.4%酵母细胞壁多糖组各指标均高于对照组,但差异不显著(P>0.05)。两个试验组相比,0.2%酵母细胞壁多糖组血清葡萄糖(GLU)含量显著低于对照组(P<0.05),总胆固醇(TC)、甘油三酯(TG)含量低于0.4%酵母细胞壁多糖组,但差异不显著(P>0.05)。
仔猪14日龄,0.2%酵母细胞壁多糖组血清葡萄糖(GLU)含量低于对照组,但差异不显著(P>0.05);总胆固醇(TC)含量极显著高于对照组(P<0.01);甘油三酯(TG)含量高于对照组,但差异不显著(P>0.05)。0.4%酵母细胞壁多糖组血清葡萄糖(GLU)、总胆固醇(TC)含量显著高于对照组(P<0.05),甘油三酯(TG)含量高于对照组,但差异不显著(P>0.05)。两个试验组相比,0.2%酵母细胞壁多糖组血清葡萄糖(GLU)含量显著低于0.4%酵母细胞壁多糖组(P<0.05),总胆固醇(TC)含量显著高于0.4%酵母细胞壁多糖组(P<0.05),甘油三酯(TG)含量高于0.4%酵母细胞壁多糖组,但差异不显著(P>0.05)。
仔猪21日龄,0.2%酵母细胞壁多糖组血清3个指标与对照组均差异不显著(P>0.05)。0.4%酵母细胞壁多糖组血清葡萄糖(GLU)含量显著高于对照组(P<0.05),总胆固醇(TC)含量、甘油三酯(TG)含量均高于对照组,但差异不显著(P>0.05)。两个试验组相比,0.2%酵母细胞壁多糖组血清葡萄糖(GLU)含量极显著低于0.4%酵母细胞壁多糖组(P<0.01),总胆固醇(TC)、甘油三酯(TG)含量两个试验组差异不显著(P>0.05)。

表12 酵母细胞壁多糖对仔猪血清血糖、血脂含量的影响
3 分析与讨论
酵母细胞壁多糖是一种在特定工艺条件下由纯培养的酵母经自溶和外源酶催化水解、分离、喷雾干燥而成。酵母细胞壁多糖对于改善动物的生产性能和降低养殖成本有着十分积极的意义(张丽等,2014)[9],具体表现在:1)改善饲料风味,增加饲料营养成分,促进养分的转化和吸收,从而促进动物生长;2)促进动物消化道微生态体系健康发展;3)调节机体免疫功能,提高生产性能。
3.1 酵母细胞壁多糖对泌乳母猪繁殖性能的影响
从本试验结果可知,产后背膘厚,0.2%酵母细胞壁多糖组比对照组薄1.78 mm(P<0.05),比0.4%酵母细胞壁多糖组背膘厚薄2.02 mm(P<0.01)。断奶背膘厚,对照组与0.2%酵母细胞壁多糖组差异不显著(P>0.05),0.2%酵母细胞壁多糖组和对照组与0.4%酵母细胞壁多糖组差异显著(P<0.05)。产后背膘厚与断奶背膘厚之差,对照组为4.42 mm,0.2%酵母细胞壁多糖组为2.79 mm,0.4%酵母细胞壁多糖组为2.94 mm。从以上对比可以知道,虽然0.2%酵母细胞壁多糖组产后背膘厚比对照组和0.4%酵母细胞壁多糖组低,但是断奶后背膘厚0.2%酵母细胞壁多糖组与对照组相差不大,而对照组与0.4%酵母细胞壁多糖组差异显著(P<0.05),说明酵母细胞壁多糖在母猪泌乳期可以防止母猪严重掉膘,这也有利于断奶后母猪体况的恢复,还有利于提高母猪的繁殖性能。关于母猪哺乳期的背膘损失对下一胎产活仔数影响的研究发现,母猪高背膘损失(>5.6 mm)与母猪低背膘损失(<0.5 mm)相比,产活仔数差异显著(李海涛等,2009)[10]。从本试验结果可知,0.4%酵母细胞壁多糖组断奶至发情间隔与对照组差异不显著,但比0.2%酵母细胞壁多糖组缩短0.44 d,差异极显著,这与相关试验结果一致(Jang等,2013)[11]。
3.2 酵母细胞壁多糖对仔猪生长性能的影响
从表3可知,母猪饲粮中添加酵母细胞壁多糖对仔猪断奶窝重有极显著影响,从对照组与0.2%酵母细胞壁多糖组和0.4%酵母细胞壁多糖组的对比中可以看出,断奶窝重是随着酵母细胞壁多糖的增加而增加,从而也导致了平均断奶重也随之增加(Shen等,2011)[12]。这也间接说明了酵母细胞壁多糖有利于母猪对饲粮中营养成分的吸收和利用,饲料吸收利用率随之提高,从而提高母猪的泌乳性能。有研究表明,酵母细胞壁多糖可通过甘露寡糖特异结合含有甘露寡糖受体的Ⅰ型菌毛的致病菌(如大肠杆菌和沙门氏菌等),避免或降低这类致病菌黏附肠道上皮细胞进入机体诱发疾病(Kogan等,2007;Newman等,2001)[13-14],酵母细胞壁多糖也可通过维持或改善肠道结构的完整性,增强黏膜免疫力和抗感染能力(Davis等,2004;Delos等,2007;Oswald等,2006;Santtine等,2001;Zhao等,2012)[15-19],从而提高了仔猪存活率和抗病力。
3.3 酵母细胞壁多糖对泌乳母猪乳成分的影响
以往就酵母细胞壁多糖在反刍动物上的研究较多,在奶牛饲粮中添加酵母活性物150 g/d的试验结果显示,试验组的乳脂和乳蛋白率相比对照组提高0.23%和0.37%(宋丽华等,2005)[20],每天在每头泌乳中期荷斯坦奶牛饲粮中添加酵母培养物120g/d,42 d后产奶量显著提高12.8%,乳蛋白率、乳糖率、乳非脂固形物率和乳密度分别极显著提高8.2%、6.8%、7.9%和11.7%(张连忠,2011)[21]。本试验就酵母细胞壁多糖对泌乳母猪乳成分的影响做了探究,结果表明,对照组与试验组在乳脂率上差异不显著(P>0.05),但两个试验组乳脂率相比对照组有所增加,0.2%酵母细胞壁多糖组和0.4%酵母细胞壁多糖组初乳乳脂率分别提高0.13个百分点和0.58个百分点,常乳乳脂率分别提高0.02个百分点和0.57个百分点。研究发现,酵母培养物能促进纤维素细菌的生长,从而提高了纤维降解率,进而提高了乳脂率(Shi等,2010)[22]。蛋白质、乳糖是哺乳仔猪能量需要的物质之一,就本试验结果中初乳和常乳蛋白质和乳糖的含量来看,酵母细胞壁多糖的不同添加量均对其无显著影响(P>0.05)。非脂类物质主要包括糖类、矿物质、色素和水溶性维生素以及酶类、细胞等。初乳中非脂类物质的含量,0.4%酵母细胞壁多糖组比对照组高7.36%,差异显著(P<0.05),这说明饲粮中添加0.4%酵母细胞壁多糖可以提高初乳中非脂类物质的含量,但其对常乳的影响不大。0.4%酵母细胞壁多糖组初乳中全乳固体物质(乳汁中的干物质)与对照组相比提高极显著10.64%,而常乳中两组差异不显著,说明0.4%酵母细胞壁多糖能极显著提高初乳中全乳固体的含量,而乳汁中营养成分的提高能有效加快哺乳仔猪的生长。
3.4 酵母细胞壁多糖对母猪血液指标的影响
3.4.1 酵母细胞壁多糖对母猪血清代谢酶活性的影响 谷丙转氨酶与谷草转氨酶的含量与肝功能的健康状况存在重要联系,它们参加动物肝细胞内的氨基酸代谢,大部分存在身体各个组织中,只有当组织细胞被破坏时才大量进入血液中,引起血清中此类酶含量升高。从本试验结果可以看出,在猪饲粮中添加酵母细胞壁多糖可显著降低母猪分娩初期血清代谢酶活性(P<0.05),这与酵母细胞壁多糖在雏鸡上的研究结果一致(张连忠,2011)[21],表明在猪饲粮中添加酵母细胞壁多糖也可对肝脏为主的组织细胞有一定的保护作用。
3.4.2 酵母细胞壁多糖对母猪血清生化指标的影响 血清蛋白质具有维持血液正常胶体渗透压和pH、运输多种代谢产物、调节多种被运输物质的生理作用、以及解除其毒性、免疫作用以及营养作用等多种功能(李晶,2012)[23]。血清总蛋白、白蛋白、球蛋白浓度是衡量蛋白质营养的重要指标之一。肝功能受损害时,蛋白质合成减少,以白蛋白下降最为显著(蒲吉常等,1993)[24]。动物血清中球蛋白含量提高可提高动物的免疫力(韩爱云等,2007)[25]。本试验结果表明,在饲粮中添加酵母细胞壁多糖可提高母猪血液血清总蛋白、白蛋白、球蛋白含量,这与相关的研究结果是一致的(张连忠,2011)[21]。
3.4.3 酵母细胞壁多糖对母猪血糖、血脂组分的影响 血清总胆固醇和甘油三酯含量是反映体脂代谢的重要生化指标,两者的浓度与血糖浓度有一定关系,而血糖浓度受采食行为影响较大。动物体内的血糖含量与采食行为能相互作用(郑晞等,2006)[26]。本研究表明,饲粮中添加0.4%酵母细胞壁多糖可极显著降低母猪血液中甘油三酯的含量(P<0.01),显著或极显著降低总胆固醇含量,添加0.2%酵母细胞壁多糖也可降低母猪血液中总胆固醇及甘油三酯含量,说明酵母细胞壁多糖可在一定程度上阻止胆固醇在血清中的沉积,加速胆固醇的分解代谢,益于母猪健康。
3.4.4 酵母细胞壁多糖对母猪全血指标的影响 通过血液各项生理生化指标的变化可以对机体发生的各种病理变化及时作出判断。血液中白细胞数、红细胞数和血小板数的变化均源于机体相应的生理变化(全炳昭等,1995)[27],红细胞和白细胞在机体免疫中起着重要的作用(张玉生等,2000)[28],而且红细胞还可以增加动物机体运动机能,有利于肉质提高(李慕等,2000)[29];血小板可以止血和促进血液凝固;红细胞压积是判断贫血的标志。本试验结果表明,在猪饲粮中添加酵母细胞壁多糖可提高母猪血液中白细胞、红细胞与血小板含量。对仔猪的相关研究结果表明,断奶后仔猪红细胞计数0.25%XP(益康XP,一种酵母代谢物)组和对照组分别极显著高于0.5% XP组(P<0.01),42日龄即断奶后第10天0.5%XP组显著高于对照组(P<0.05),且也可一定程度提高血液中白细胞与血小板含量(汪晓娟等,2008)[30],与本试验结果相符。
3.5 酵母细胞壁多糖对哺乳仔猪血液指标的影响
研究表明,饲粮中添加0.2%酵母细胞壁多糖可降低谷草转氨酶和谷丙转氨酶的活性,谷丙转氨酶和谷草转氨酶主要是动物肝细胞内参与氨基酸代谢的主要酶,正常时分布于肝细胞和其他组织细胞内,酵母细胞壁多糖对以肝脏为主的组织细胞具有一定的保护作用(张连忠,2011)[21]。本试验血清总蛋白、白蛋白、球蛋白含量有提高的趋势,21日龄总蛋白极显著提高,这可能是由于酵母细胞壁多糖提高了饲料蛋白质转化率,哺乳仔猪蛋白质代谢良好,蛋白质合成增加,提高机体氮吸收和沉积,进而使血清总蛋白含量升高。与相关的研究结果比较一致(杨越,2014;王玲等,2007;周淑芹等,2004)[31-33]。添加酵母细胞壁多糖对哺乳仔猪血清甘油三酯和总胆固醇含量降低作用不明显,且7日龄时降低,14、21日龄时反而提高,与相关研究结果相一致(肖曼等,2013)[34]。这可能与哺乳仔猪本身营养要求和生理特性有关。
4 结论
本试验结果表明,在妊娠85 d至21天断奶母猪饲粮中添加0.2%、0.4%酵母细胞壁多糖可以提高母猪的繁殖性能,一定程度上缩短断奶至发情间隔,提高母猪泌乳能力,也能提高初乳中全乳固体和非脂类的含量,从而提高断奶仔猪的体重;同时可降低母猪血清代谢酶活性,总胆固醇及甘油三酯含量,保护母猪体内以肝脏为主的组织细胞,一定程度上阻止胆固醇在血清中的沉积,加速胆固醇的分解代谢。可提高母猪血清总蛋白、白蛋白、球蛋白含量以及白细胞数、红细胞数和血小板数,故在可一定程度上提高动物的免疫力。也能提高哺乳仔猪营养物质表观代谢率,改善血清生理生化指标。综合得出,酵母细胞壁多糖以添加0.2%和0.4%为宜,从经济性考虑以0.2%为佳。
[1] Cross G G,Jennings H J,Whitfiedld D M,et al.Immunostimulant oxidized β-glucan conjugates[J].International Immunupharmacology,2001,1(3):539-550.
[2]刘影,呙于明,袁建敏,等.β-1,3/1,6-葡聚糖对肉仔鸡生产性能和免疫功能的影响[J].中国农业大学学报,2003,8(1):91-94.
[3]李志清,呙于明,袁建敏,等.β葡聚糖对肉仔鸡生产性能及免疫功能的影响[J].中国家禽,2004,26(9):22-24.
[4] Finucane M C,Dawson K A,Spring P,et al.The effect of mannan oligosaccharide on the composition of the microflora in turkey poults[J].Poutry Sci,1999,78(Suppl.1):77.
[5] Spring P,Wenk C,DawsonK A,et al.The effects of dietary mannanoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the coca of Salmonella challenged broiler chicks[J].Poultry Science,2000,79:205-211.
[6] Kim S W,Brandhern M,Frland M,et al.Effects of yeast culture supplementation to gestation and diets on growth of nursing piglets[J].Asian-australas Journal of Animal Science, 2008,21(7):1011-1014.
[7]邢宝松,王修启,张兆敏,等.酵母培养物对母猪繁殖性能的影响[J].粮食与饲料工业,2004(11):37-38.
[8]吴永绍,刘桂武,覃小荣,等.酵母培养物对母猪生产性能的影响[J].养猪,2011(2):17-18.
[9]张丽,丁宏标.酵母培养物对畜禽益生效果的研究进展[J].饲料工业,2014,35(22):7-10.
[10]李海涛,王希彪,狄生伟,等.母猪不同时期背膘厚度与繁殖性能关系的研究[J].黑龙江畜牧兽医,2009(11):64-65.
[11]Jang Y D,Kang K W,Piao L G,et al.Effects of live yeast supplementation to gestation and lactation diets on reproductive performance,immunological parameters and milk composition in sows[J].Livestock Science,2013,152(2-3):167-173.
[12]Shen Y B,Carroll J A,Yoon I,et al.Effects of supplementing Saccharo cerevisiae fermentation product in sow diets on performance of sows and nursing piglets[J].Journal of Animal Science,2011,89:2462-2471.
[13]Kogan G,Kocher A.Role of yeast cell wall polysaccharides in pig nutrition and health protection[J].Livestock Science,2007, 109(1):161-165.
[14]Newman K E,Newman M C.Evaluation of mannanoligosaccharides on the microflora and immunoglobulinstatus of sows and piglet performance[J].Journal of Animal Science,2001,79(1): 189.
[15]Davis M E,Maxwell C V,Erf G F,et al.Dietary supplementation with phosphorylated mannans improves growth response and modulates immune function of weanling pigs[J].Journal of Animal Science,2004,82(6):1882-1891.
[16]DeLos Santos F S,Donoghue A M,Farnell M B,et al.Gastrointestinal maturation is accelerated in turkey poults supplemented with a mannanoligosac charide yeast extract (Alphamune)[J].Poultry Science,2007,86(5):921-930.
[17]Oswald I P.Role of intestinal epithelial cells in the innate immune defence of the pig intestine[J].Veterinary Research,2006,37(3):359-368.
[18]Santtine E,Maiorka A,Macari M,et al.Performance and intestinal mucosa development of broiler chickens fed diets containing saccharomyces cerevisiae cell wall[J].The Journal of Applied Poultry Research,2001,10(3):236-244.
[19]Zhao P Y,Jung J H,Kim I H.Effect of mannan oligosaccharides and fructan on growth performance,nutrient digestibility,blood profile,and diarrhea score in weanling pigs[J].Journal of Animal Science,2012,90(3):833-839.
[20]宋丽华,刘大程,周振峰.酵母活性物对奶牛产奶量及乳成分的影响[J].中国畜牧兽医,2006,33(5):14-15.
[21]张连忠.饲料中添加酵母培养物对雏鸡血清生化指标的影响[J].动物医学进展,2011(4):122-126.
[22]Shi F H,Wu H,Wu Z M.Effects of Bovikalc Bolus on Prevention of Postpartum Hypocalcaemia[J].China Dairy Cattle,2010, 8:15-17.
[23]李晶.血清总蛋白测定方法及临床意义[J].中国现代药物应用,2012(9):28-29.
[24]蒲吉常.双缩脲法测定血清总蛋白脂血的干扰及排除方法[J].陕西医学检验,1993,8(1):50.
[25]韩爱云,张国强,黄仁禄,等.二氢杨梅素对肉仔鸡血液生化指标及生长性能的影响[J].中国兽医杂志,2007,43(11):19-21.
[26]郑晞,宋俊宏.内源性调控对猪采食量的影响[J].中国饲料,2006(7):27-28.
[27]全炳昭,邵莹.运输性应激对商品猪影响的研究—对血液生理生化指数影响的试验观察[J].江西畜牧兽医杂志,1995(4):18-21.
[28]张玉生,柳巨雄,刘娜,等主编.动物生理学[M].第1版.吉林人民出版社,2000:30-35.
[29]李慕,贺祥瑞,陈树宁,等.“军牧1号”白猪血液生理生化指标及其与体尺性状的相关分析[J].吉林农业大学学报,2000,22(3):96-99.
[30]汪晓娟,杨联,付金龙,等.添加酵母培养物对仔猪断奶前后血液生理指标的影响[J].甘肃畜牧兽医,2008(5):19-21.
[31]杨越.益康XP替代抗生素对断奶仔猪生长性能和血清生化指标的影响[J].黑龙江畜牧兽医,2014(5):85-87.
[32]王玲,蒲万霞,扎西英派,等.酵母活性物质对断乳仔猪红细胞免疫功能的影响[J].动物医学进展,2007,28(8):9-12.
[33]周淑芹,孙文志.酵母培养物对肉仔鸡免疫和生产性能影响的研究[J].饲料工业,2004,25(11):38-40.
[34]肖曼,高振华,李兴华,等.酵母培养物对肉仔鸡生产性能、营养物质表观代谢率及血清生化指标的影响 [J].河南农业科学,2013,42(8):115-118.
(编辑:富春妮)
中国大型奶牛养殖场威胁生态
【法新社黑龙江甘南12月26日电】一堆堆粪便堆积在玉米地里,数千头奶牛的排泄物散发着难闻的气味—在今天的中国,这是一杯牛奶的代价。
随着近14亿消费者克服数世纪以来的文化障碍,开始接受这种白色液体,大型奶牛养殖场正在这个亚洲大国迅速发展。
在中国,经济繁荣和政府支持让乳制品行业成为一个年销售额达到400亿美元的行业,实现了从小规模生产到拥有1万头奶牛的超大型奶牛养殖场的转变—产生的牛粪也比以前多得多。
黑龙江省甘南县的农民任向军(音)说:“牛粪的臭味在夏天非常重。”他指着一条从一家大型奶牛养殖场灰色砖墙下流出的绿色污水沟说:“你看,就这样直接从养殖场流出来了。”
在邻近的村庄,一名女子说:“这里的牛粪堆得像小山一样。我们没有得到一点好处,只有污染和噪音。”
由于人们财富的增长和对健康需求的增加,自2000年以来,中国乳制品行业实现了平均每年超过12%的增长。但2008年的毒奶粉丑闻动摇了中国人对国内乳制品行业的信心。这场危机被归咎于小型奶牛养殖场为使蛋白质含量达标而在产品中添加化工原料。
此后,中国政府下令建设大型乳制品生产企业。北京一家主要投资乳制品行业的投资公司的负责人戴维·马洪说:“他们认为,如果有了大型奶牛养殖场,就能更好地监管。”
新西兰等国也有大型奶牛养殖场,但很少有一个养殖场有超过3 000头牛。
据中国国家媒体报道,截至2014年,养牛量在1万头及以上的养殖场有56家,约占全球总数的80%。但这也给很多地方带来了污染的问题。据估计,3 500头牛一年就能产生10万吨液体排泄物和粪便。管理部门要求养殖场将牛的排泄物转化为肥料,但规定经常得不到遵守。
马洪说:“中国正在学习如何经营奶牛养殖场,但经验的缺乏导致了这些问题。”
甘南县的居民说,官员们从奶牛养殖场受益,却对排污者坐视不管。但官方态度也许已经开始转变。中国奶业协会副会长杨利国曾表示:“规模越大,对环境的污染和生态安全问题就越大。”
马洪说,中国进行了“真正的反思”。
将大量动物圈养在一起可能会增加患布鲁氏菌病等疾病的风险。这些疾病可能传染给人类。
王大力(音)曾在甘南的奶牛养殖场负责清理牛粪,他在2012年患上了布鲁氏菌病。由于几乎没有间歇的关节疼痛,他现在已不能工作。
王大力说,他的病就是养殖场卫生条件差造成的。
(转自参考消息[N],2016-12-28)
S816.7
A
1002-1957(2017)01-0017-08
2016-12-11
何 健(1964-),男,重庆荣昌人,副教授,博士,主要从事猪的营养研究工作.E-mail:904606344@qq.com

