Toll样受体4/NF—κB信号通路在依达拉奉影响单肺通气患者炎性细胞因子中的作用
李恩琪++++++帅训军++++++闫战秋++++++艾登斌++++++侯念果
[摘要] 目的 探讨Toll样受体4(TLR4)/NF-κB信号通路在依达拉奉影响单肺通气患者炎性细胞因子中的作用。 方法 选择青岛市市立医院2015年12月~2016年5月择期行肺叶切除术的肺癌患者40例,采用随机数字表法将其分为对照组(n=20)和依达拉奉组(n=20),两组均按咪唑安定0.03 mg/kg,芬太尼3 μg/kg,维库溴铵0.1 mg/kg,吸入8%七氟醚常规麻醉诱导。诱导后,依达拉奉组给予依达拉奉0.5 mg/kg加入氯化钠注射液100 mL静脉滴注;对照组给予等量氯化钠注射液静脉滴注。两组分别于麻醉诱导后(T0),单肺通气即刻(T1),单肺通气后60 min(T2),肺组织离体即刻(T3),膨肺后30 min(T4),术后120 min(T5)采集静脉血,ELISA法檢测血浆IL-6、IL-10的浓度。分别于T1、T3时刻切取肺癌周边的正常肺组织,Western blot法检测肺组织TLR4、细胞核NF-κB P65蛋白的表达水平。 结果 与T0比较,两组患者IL-6、IL-10血浆浓度以及IL-6/IL-10比值于T2~T5时刻均明显上升(P<0.05)。与T1比较,两组患者肺组织TLR4、细胞核NF-κB P65蛋白的表达水平于T3时刻明显上升(P<0.05)。与对照组比较,依达拉奉组患者IL-6血浆浓度以及IL-6/IL-10比值于T2~T5时刻均显著降低(P<0.05),肺组织TLR4、细胞核NF-κB P65蛋白的表达水平于T3时刻显著降低(P<0.05)。 结论 TLR4/NF-κB信号通路参与了依达拉奉抑制单肺通气患者炎性反应的过程,能抑制促炎性细胞因子的生成和释放,维持促炎/抗炎性细胞因子的相对平衡。
[关键词] Toll样受体4;NF-κB;依达拉奉;单肺通气;细胞因子
[中图分类号] R563 [文献标识码] A [文章编号] 1673-7210(2016)11(b)-0004-04
[Abstract] Objective To investigate the role of TLR4/NF-κB signal pathway in edaravone affect cytokines in patients undergoing one lung ventilation(OLV). Methods Fourty lung cancer patients undergoing elective lung resection in Qingdao Municipal Hospital from December 2015 to May 2016, were randomly divided into control group (group C, n=20) and edaravone group (group E, n=20). Anesthesia was induced with midazolam 0.03 mg/kg, fentanyl 3 μg/kg, vecuronium bromide 0.1 mg/kg and 8% sevoflurane. After induction of anesthesia, group E received edaravone 0.5 mg/kg(diluted in sodium chloride injection 100 mL), and the patients in group C were received with the same amount of sodium chloride injection. Venous blood sample were taken after anesthesia induction(T0),immediately after onset of OLV(T1),at 60 min of OLV(T2), lung tissue in vitro instantly(T3), 30 min after lungs were inflated(T4) and at 120 min after surgery(T5) for determination of IL-6 and IL-10 levels by ELISA. The specimens of normal lung tissues around the lung cancer were obtained at T1 and T3. Using Western blot, the expression level of TLR4,NF-κB P65 in lung tissues were measured. Results Compared with T0, plasma IL-6, IL-10 concentration and the ratio of IL-6/IL-10 were all significantly higher at T2-5 (P < 0.05) in two groups. Compared with T1, the expression of TLR4, NF-κB P65 in lung tissues were significantly higher at T3 (P < 0.05). Compared with group C, plasma IL-6 concentration and the ratio of IL-6/IL-10 at T2-5 were significantly lower in group E than those in group C (P < 0.05), the expression of TLR4, NF-κB P65 in lung tissues were significantly lower at T3 in group E than those in group C (P < 0.05). Conclusion TLR4/NF-κB pathway is involved in edaravone inhibiting inflammatory response in patients undergoing OLV, which can reduce the expression and release of proinflammatory cytokines, and maintain the balance between inflammatory factors.
[Key words] TLR4; NF-κB; Edaravone; One lung ventilation; Proinflammatory cytokines
单肺通气已被广泛应用在胸科手术中,可为外科提供相对静止的术野,有利于术者操作,但术中单肺通气及手术操作可导致机体多种促炎性细胞因子释放而触发全身炎症反应,严重影响患者的预后[1-2]。依达拉奉是一种新型的氧自由基清除剂,可抑制机体炎性反应过程、维持促炎性细胞因子/抗炎性细胞因子的相对平衡[3]。Toll样受体4(TLR4)是一种模式识别受体,当与配体结合时,激活信号转导通路,引起炎性细胞因子的大量表达与释放[4-5]。依达拉奉抑制炎性反应的机制是否与TLR4/NF-κB通路有关尚有待研究。本文研究TLR4/NF-κB信号通路在依达拉奉抑制单肺通气患者炎性反应中的作用,旨在探讨依达拉奉抗炎性反应的机制。
1 资料与方法
1.1 一般资料
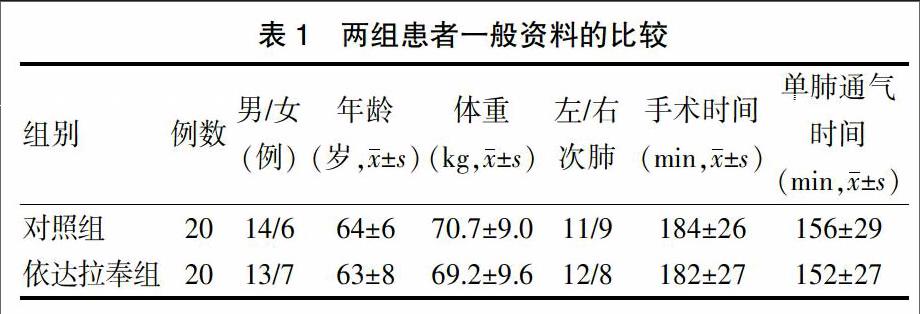
选择青岛市市立医院2015年12月~2016年5月择期行肺叶切除术的肺癌患者40例,本次研究经医院伦理委员会批准,患者签署知情同意书。采用随机数字表法将患者分为依达拉奉组和对照组,每组20例。
入选标准:ASAⅠ级或Ⅱ级;年龄49~75岁,体重55~86 kg;术前无严重的心、肺功能障碍,肝、肾功能未见异常,无免疫、内分泌、神经以及精神系统等疾病;近期无感染。
排除标准:术中单肺通气失败;无法维持氧合;术中持续的血流动力学不稳。
两组患者在性别比例、年龄、体重、手术时间以及单肺通气时间等方面比较,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 麻醉方法
麻醉诱导:患者入手术室开放外周静脉通路,常规监测患者心率(HR),无创血压(BP),心电图(ECG),脉搏血氧饱和度(SpO2),行全身麻醉,静脉依次注射咪唑安定0.03 mg/kg、芬太尼3 μg/kg,高流量(新鲜气流量8~10 L/min)吸入8%七氟醚,待意识消失后将新鲜气流量降至2 L/min、七氟醚呼气末浓度降至2%,静脉注射维库溴铵0.1 mg/kg,3 min后插入双腔支气管导管。两组患者均用纤维支气管镜确定双腔管导管的位置。诱导后,对患者进行桡动脉和中心静脉穿刺置管,测定平均动脉压(MAP)和中心静脉压(CVP),以便观察患者血流动力学方面的变化。依达拉奉组给予依达拉奉(商品名:必存,江苏先声药业有限公司,批号:80-130103)0.5 mg/kg加入氯化钠注射液100 mL,30 min内静脉滴注完毕;对照组给予等量氯化钠注射液。
麻醉维持:两组患者均间断静脉注射维库溴铵0.04~0.08 mg/kg、芬太尼0.05~0.1 mg,七氟醚呼气末浓度维持在1.7%~2.8%。单肺通气时双腔管非通气侧与大气相通,呼吸参数调整为8~10 ml/kg,呼吸频率为12~14次/min,维持呼气末二氧化碳分压(PetCO2)在35~40 mmHg。
术毕,待患者意识恢复,吞咽及咳嗽反射活跃,潮气量及每分通气量恢复正常,拔出双腔气管导管,安全送往恢复室观察。
1.3 观察指标
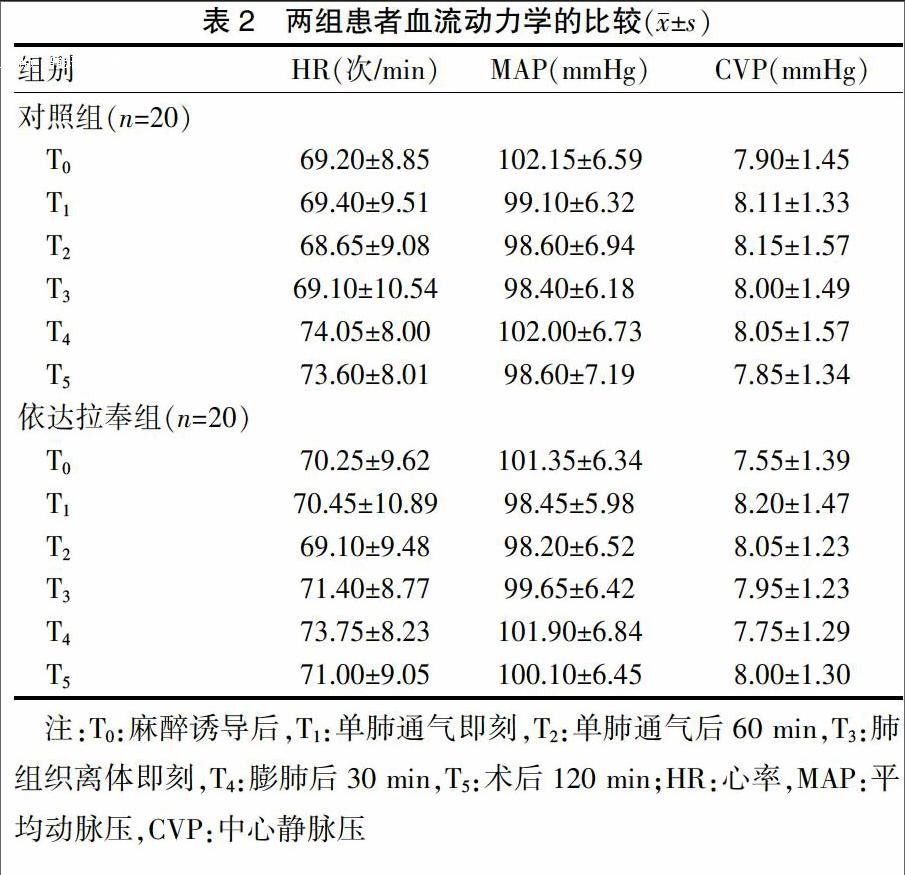
1.3.1 术中指标 应用Datex-Ohmeda AS/3多功能监测仪(Datex-Ohmeda公司,美国)监测HR、ECG、SpO2、BP、PETCO2、七氟醚呼气末浓度和气道阻力。观察记录两组患者的手术时间、单肺通气时间以及麻醉诱导后(T0),单肺通气即刻(T1),单肺通气后60 min(T2),肺组织离体即刻(T3),膨肺后30 min(T4),术后120 min(T5)的HR、MAP和CVP。
1.3.2 ELISA法检测血浆IL-6、IL-10的浓度 两组患者分别在T0~T5时刻抽取静脉血,严格按照试剂盒使用说明测定血浆IL-6、IL-10的浓度,并计算IL-6/IL-10比值。
1.3.3 Western blot法检测肺组织TLR4蛋白、细胞核NF-κB蛋白 于T1时刻在预切除的肺叶上距肿瘤边缘>5 cm处取第一块肺组织,肺叶离体时在第一块取材临近部位再取第二块肺组织,-80℃保存待检[6]。取肺组织切成细小的碎片,加入组织/细胞裂解液,用玻璃匀浆器匀浆,离心后取上清,即为肺组织蛋白;严格按照核蛋白提取试剂盒提取肺组织核蛋白。BCA法检测蛋白浓度,加入样本孔中,经SDS-PAGE电泳分离蛋白,转移至PVDF膜上,封闭后加入兔抗人TLR4一抗、兔抗人NF-κB P65一抗,兔抗人β-action,4℃孵育过夜,洗涤后加入辣根过氧化酶标记的山羊抗兔二抗,孵育,加入化学发光试剂,曝光后显影,定影,分析目标条带灰度值与β-action的灰度值的比值,以反应蛋白表达水平。
1.4 统计学处理
采用SPSS 17.0统计软件对数据进行分析,计量资料以均数±标准差(x±s)表示,组内比较采用重复测量设计的方差分析,组间比较采用独立样本t检验。计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血流动力学的比较
两组患者围术期的血流动力学平稳,T0~T5时点的HR、MAP、CVP比较,差异无统计学意义(P>0.05),组间比较差异无统计学意义(P>0.05)。见表2。
2.2 两组患者血浆IL-6、IL-10浓度及IL-6/IL-10比值的比较
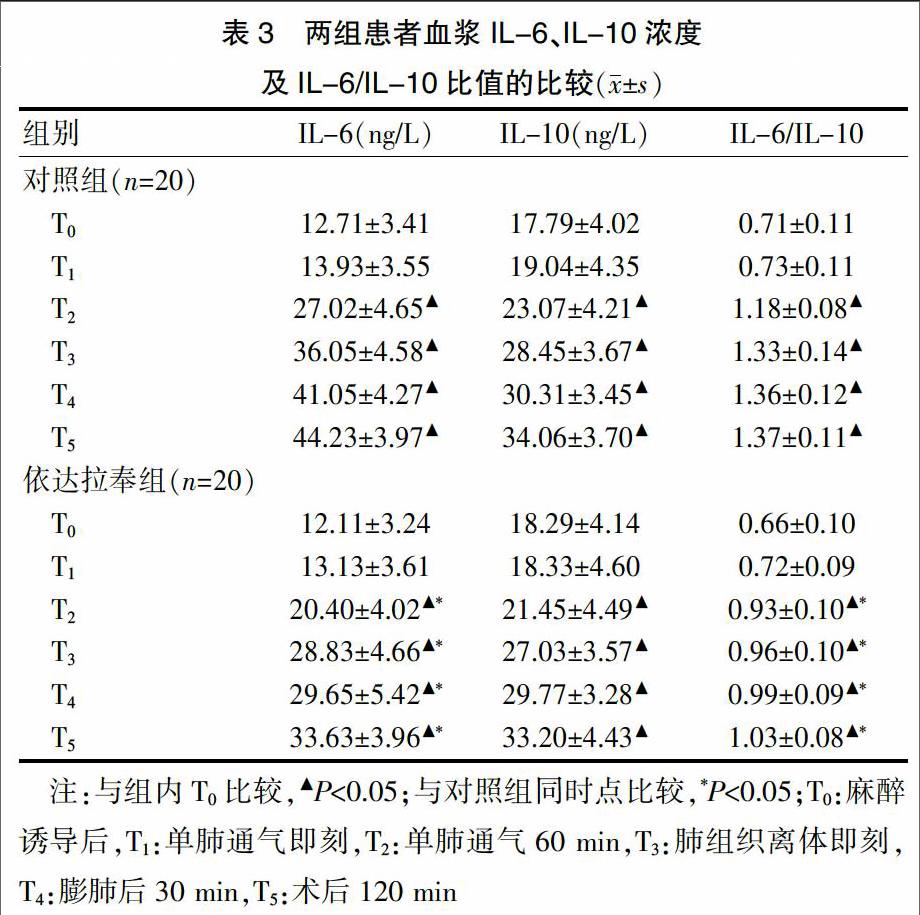
与T0时点比较,两组患者血浆IL-6、IL-10浓度以及IL-6/IL-10比值于T2~T5時刻明显上升(P<0.05)。与对照组比较,依达拉奉组患者血浆IL-6浓度以及IL-6/IL-10比值于T2~T5时刻显著降低(P<0.05)。见表3。
2.3 兩组患者TLR4和NF-κB P65蛋白表达的比较
与T1比较,两组患者肺组织TLR4、细胞核NF-κB P65蛋白的表达水平于T3时刻明显上升(P<0.05)。与对照组比较,依达拉奉组肺组织TLR4、细胞核NF-κB P65蛋白的表达水平于T3时刻显著降低(P<0.05)。见表4。
3 讨论
单肺通气已被广泛用于胸外科手术,为手术提供良好术野。但单肺通气属非生理状态,开胸侧肺完全萎陷,萎陷肺组织血流减少、肺泡组织缺氧和通气/血流比例失调,手术操作、机械通气也会造成肺组织损伤,膨肺时缺血再灌注进一步加重机体炎性细胞因子失衡进而促发全身炎性反应[7-9],从而严重影响患者预后。所以,有效抑制单肺通气患者过度炎性反应至关重要。
依达拉奉是一种新型氧自由基清除剂,可以抑制脂质自由基生成,并抑制促炎性细胞因子表达[10]。IL-6是机体炎症反应早期应答因子,其水平急剧上升可反映促炎性因子大量激活,而IL-10是机体重要的抗炎性细胞因子,能负性调节炎性应答反应[11-12]。IL-6/IL-10比值可大致反映机体促炎/抗炎性细胞因子相对平衡,预测患者预后,比值升高提示预后不佳。本研究结果表明,依达拉奉组在T2~T5时刻,IL-6血浆浓度和IL-6/IL-10比值显著低于对照组,提示依达拉奉可有效抑制促炎性细胞因子生成,维持促炎/抗炎性因子相对平衡,与相关研究结果一致[1]。
TLR4是机体固有免疫反应的重要组成部分,是一种细胞表面信号传导跨膜受体,在人体内分布广泛,几乎表达于所有的细胞系[13-14]。单肺通气时引起的病理变化导致内源性配体与TLR4结合[15-16],最终激活NF-κB,NF-κB是由P50亚基和P65亚基组成的异源二聚体,激活后与抑制蛋白分离,转入细胞核内,P65末端含有反式激活结构域,有激活基因转录功能,调节机体炎症反应基因表达,从而促进TNF-α、IL-6等促炎性细胞因子表达与释放[17-20]。本研究结果显示,依达拉奉组肺组织TLR4、细胞核内NF-κB P65蛋白表达水平显著低于对照组,与促炎性细胞因子IL-6血浆浓度和IL-6/IL-10比值变化相一致,提示依达拉奉可通过抑制TLR4/NF-κB信号转导途径而减少促炎性细胞因子生成,从而抑制过度炎症反应,维持促炎/抗炎性细胞因子相对平衡。
综上所述,TLR4/NF-κB信号通路参与依达拉奉抑制单肺通气患者促炎性细胞因子的生成和释放,维持了促炎/抗炎性细胞因子相对平衡。
[参考文献]
[1] 帅训军,于洋,艾登斌,等.不同麻醉下依达拉奉对开胸手术单肺通气患者炎性反应的影响[J].中华麻醉学杂志,2010,30(1):113-115.
[2] Sugasawa Y,Yamaguchi K,Kumakura S,et al. The effect of one-lung ventilation upon pulmonary inflammatory responses during lung resection [J]. J Anesth,2011,25(2):170-177.
[3] Tajima S,Soda M,Bando M,et al.Preventive effects of edaravone,a free radical scavenger,on lipopolysaccharide-induced lung injury in mice [J]. Respirology,2008,13(5):646-653.
[4] Connor AJ,Laskin JD,Laskin DL. Ozone-induced lung injury and sterile inflammation. Role of toll-like receptor 4 [J]. Exp Mol Pathol,2012,92(2):229-235.
[5] Hu R,Xu H,Jiang H,et al.The role of TLR4 in the pathogenesis of indirect acute lung injury [J]. Front Biosci (Landmark Ed),2013,18(1):1244-1255.
[6] 郭琼梅,周长浩,陈欢,等.右美托咪定对单肺通气患者血浆IL-8、IL-10及肺组织AQP1表达的影响[J].临床麻醉学杂志,2016,32(3):245-247.
[7] Della Rocca G,Coccia C. Acute lung injury in thoracic surgery [J]. Curr Opin Anaesthesiol,2013,26(1):40-46.
[8] Lohser J,Slinger P. Lung Injury After One-Lung Ventilation:A Review of the Pathophysiologic Mechanisms Affecting the Ventilated and the Collapsed Lung [J]. Anesth Analg,2015,121(2):302-318.
[9] Yu J,Li R. Effects of dexmedetomidine preconditioning attenuating remote lung injury of lower limb ischemia-reperfusion [J]. Zhonghua Yi Xue Za Zhi,2014,94(44):3510-3514.
[10] Wu Z,Ming Y,Zhang Z,et al. Edaravone rescues the lung by inhibiting lipid peroxidation and pro-inflammatory cytokines in a rat model [J]. Chin Med J (Engl),2014,127(5):968-970.
[11] Van Der Wal S,Vaneker M,Steegers M,et al. Lidocaine increases the anti-inflammatory cytokine IL-10 following mechanical ventilation in healthy mice [J]. Acta Anaesthesiol Scand,2015,59(1):47-55.
[12] Gao W,Liu D,Li D,et al. Effect of Therapeutic Hypercapnia on Inflammatory Responses to One-lung Ventilation in Lobectomy Patients [J]. Anesthesiology,2015,122(6):1235-1252.
[13] Imai Y,Kuba K,Neely GG,et al. Identification of oxidative stress and Toll-like receptor 4 signaling as a key pathway of acute lung injury [J]. Cell,2008,133(2):235-249.
[14] Zanotti G,Casiraghi M,Abano JB,et al. Novel critical role of Toll-like receptor 4 in lung ischemia-reperfusion injury and edema [J]. Am J Physiol Lung Cell Mol Physiol,2009,297(1):L52-L63.
[15] Wu Y,Liu Y,Huang H,et al. Dexmedetomidine inhibits inflammatory reaction in lung tissues of septic rats by suppressing TLR4/NF-κB pathway [J]. Mediators Inflamm,2013,2013:562154.
[16] Feng G,Sun B,Li TZ. Daidzein attenuates lipopolysaccharide-induced acute lung injury via toll-like receptor 4/NF-kappaB pathway [J].Int Immunopharmacol,2015,26(2):392-400.
[17] Müller JM,Ziegler-Heitbrock HW,Baeuerle PA. Nuclear factor kappa B,a mediator of lipopolysaccharide effects [J]. Immunobiology,1993,187(3-5):233-256.
[18] Schuliga M.NF-kappaB Signaling in Chronic Inflammatory Airway Disease [J]. Biomolecules,2015,5(3):1266-1283.
[19] You Z,Feng D,Xu H,et al. Nuclear factor-kappa B mediates one-lung ventilation-induced acute lung injury in rabbits [J]. J Invest Surg,2012,25(2):78-85.
[20] 王媛媛,曹建,陳勤,等.依达拉奉对肺泡Ⅱ型上皮细胞NF-κB和IL-6,IL-8表达及凋亡的影响[J].中国医药导报,2014,11(7):8-12.

