基于微流控芯片的细胞排列和迁移的实验研究*
白国花, 谭秋林
(中北大学 电子测试技术重点实验室, 山西 太原 030051)
基于微流控芯片的细胞排列和迁移的实验研究*
白国花, 谭秋林
(中北大学 电子测试技术重点实验室, 山西 太原 030051)
由于细胞的异质性, 细胞的排列和迁移往往是研究者实现各种细胞复杂电操作首要解决的基本问题. 利用具有平行电极的微流控芯片, 对单一的食管鳞癌KYSE180细胞的迁移运动进行了研究; 借助具有变间距的平行电极的微流控芯片, 研究了两种混合细胞血癌NB4细胞和酵母菌细胞的迁移规律, 并通过COMSOL Multiphysics仿真软件分析了不同细胞的迁移运动随电极宽度和电极间隔宽度的变化而变化的规律. 实验结果表明, 细胞的迁移运动受制于电极加载信号的电场频率和细胞缓冲液的电导率两个关键因素; 混合细胞的迁移实验研究表明在上述条件下细胞分离的最佳频率容易获得, 这为基于复杂芯片结构的细胞分选实验奠定了基础。
细胞排列; 细胞迁移; 平行电极; 微流控芯片; 混合细胞; 细胞电操作
运用介电泳(DEP)效应, 在微流控芯片上对细胞进行电操作, 是一种低成本、 低损伤、 高效率和易操作的细胞操作方法, 最近几年, 相关研究文献较多[1-7]. 人们往往选用较为复杂的电极结构, 利用介电泳的方法对细胞实施多种电操作, 比如, 拉伸、 旋转、 融合和分选等[3-4,6-7]. 实现细胞拉伸功能, 用尖对尖等电极结构, 首先电极需捕获细胞, 使细胞发生正向介电泳效应[5]. 旋转细胞, 往往选用四电极结构, 使细胞发生负向介电泳, 定位在四电极中心, 再实现旋转[6]; 细胞电融合时, 细胞需在正向介电泳力的作用下, 定向迁移到电极处, 并排队等待瞬时高压脉冲的击穿融合[7]. 因此, 基于正负介电泳效应的细胞的排列和迁移是细胞各种复杂电操作关键的第一步.
但是由于细胞的异质性, 任何一篇文献的细胞介电泳实验的参数, 不能直接应用在新的细胞介电泳实验中. 大多数细胞电操作文献[1-7], 只是报道他们用到了DEP方法, 给出Pohl的DEP经典公式[8], 以及DEP相关参数具体值, 但很少报道这些参数是如何确定的. 另外发现, 在研究者刚刚开展微流控电操作实验时, 两种介电泳现象, 往往只能出现其中的一种, 或者是正向介电泳, 或者是负向介电泳. 如何用科学的方法操控细胞的迁移, 而不是依靠其随机出现, 是我们需要思考的问题. 有时, 电极结构较为复杂时, 细胞的正负介电泳现象, 迟迟不能清晰地出现, 合适的实验条件迟迟不能确定, 进而阻碍了拉伸、 旋转和分选等复杂细胞电操作的快速实现.
本文为了研究微流控细胞电操作系统的本质, 借助具有平行电极的微流控芯片的优势, 对基于平行电极的微流控芯片的食管鳞癌KYSE180细胞的迁移规律进行了研究. 这种具有平行结构电极的微流控芯片, 细胞的DEP迁移现象非常直观方便, 不受电极结构因素的影响, 能快速地获得不同细胞正负介电泳效应的最佳实验条件, 容易发现决定细胞迁移运动的关键性因素. 在此基础上, 对于复杂结构的电极, 各种细胞的DEP实验就很容易实现, 例如, 本文的四电极结构的酵母菌细胞的迁移实验. 另外, 本文除了研究平行电极的微流控芯片的单一细胞的迁移规律, 也研究了基于变间距平行电极的微流控芯片的两种混合细胞血癌NB4细胞和酵母菌细胞的迁移规律, 借助COMSOL Multiphysics软件, 以间距为20 μm和40 μm平行电极的微流控芯片的内部电场的分布为例进行仿真, 分析了不同细胞的迁移随电极宽度和电极间隔宽度的变化而变化的规律. 这个基于平行电极的微流控芯片的混合细胞的迁移实验, 对于复杂电极结构的细胞分选实验尤其有重要的参考价值.
1 材料和平台
实验中用到的细胞为食管鳞癌KYSE180细胞、 血癌NB4细胞和酵母菌细胞. 前两种细胞平时需保存在二氧化碳培养箱中培养(37 ℃, 体积分数为5% CO2). 细胞缓冲液为磷酸盐缓冲液和去离子水的混和溶液,或糖水. 这里的糖水主要成分为8.5%的蔗糖, 0.3%葡萄糖和20 mg/L的氯化钙[9]. 微流控芯片是细胞电操作的关键平台, 在学校的超净室自制了微流控芯片. 微流控芯片的制作, 主要包括三大部分: 电极的制作、 微通道的制作和最后的键合. 芯片的工艺流程如图 1(a) 所示, 具体制作参见文献[10]; 制得的微流控芯片如图 1(b) 所示.
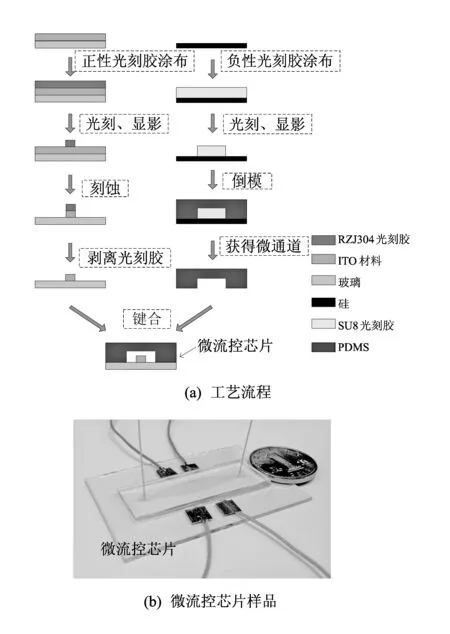
图 1 微流控芯片的工艺流程和样品Fig.1 Fabrication process of microfluidic chip and a microfluidic chip sample
为了开展细胞电操作的研究, 需搭建如图 2 所示的平台. 实验平台主要包括: 信号发生器, 光学显微镜, 注射微泵, 计算机和微流控芯片. 实验过程中, 自制的微流控芯片放在光学显微镜的载物台上, 芯片上的电极连接在信号发生器的输出引脚上, 注射微泵的两个泵分别负责细胞缓冲液的注入和废液的排出, 两个泵通过毛细管分别连接在微流控通道上的输入和输出口.

图 2 细胞电操作的实验平台Fig.2 Experimental flatform for cell electro-manipulation
2 实验方法
细胞在微流控芯片上的排列和迁移, 主要应用了介电泳原理. 细胞在介电泳力的作用下, 可以做有规律的定向运动. 根据文献[8], 细胞由于感应, 受到非均匀电场的作用,受到的介电泳力为
(1)

式中:r为细胞的半径;εm为细胞缓冲液的相对介电常数;Erms是电场强度的均方根值;fCM(ω)是克劳斯因子; Re[fCM(ω)]为克劳斯因子的实部. 克劳斯因子的表达式为
(2)

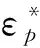
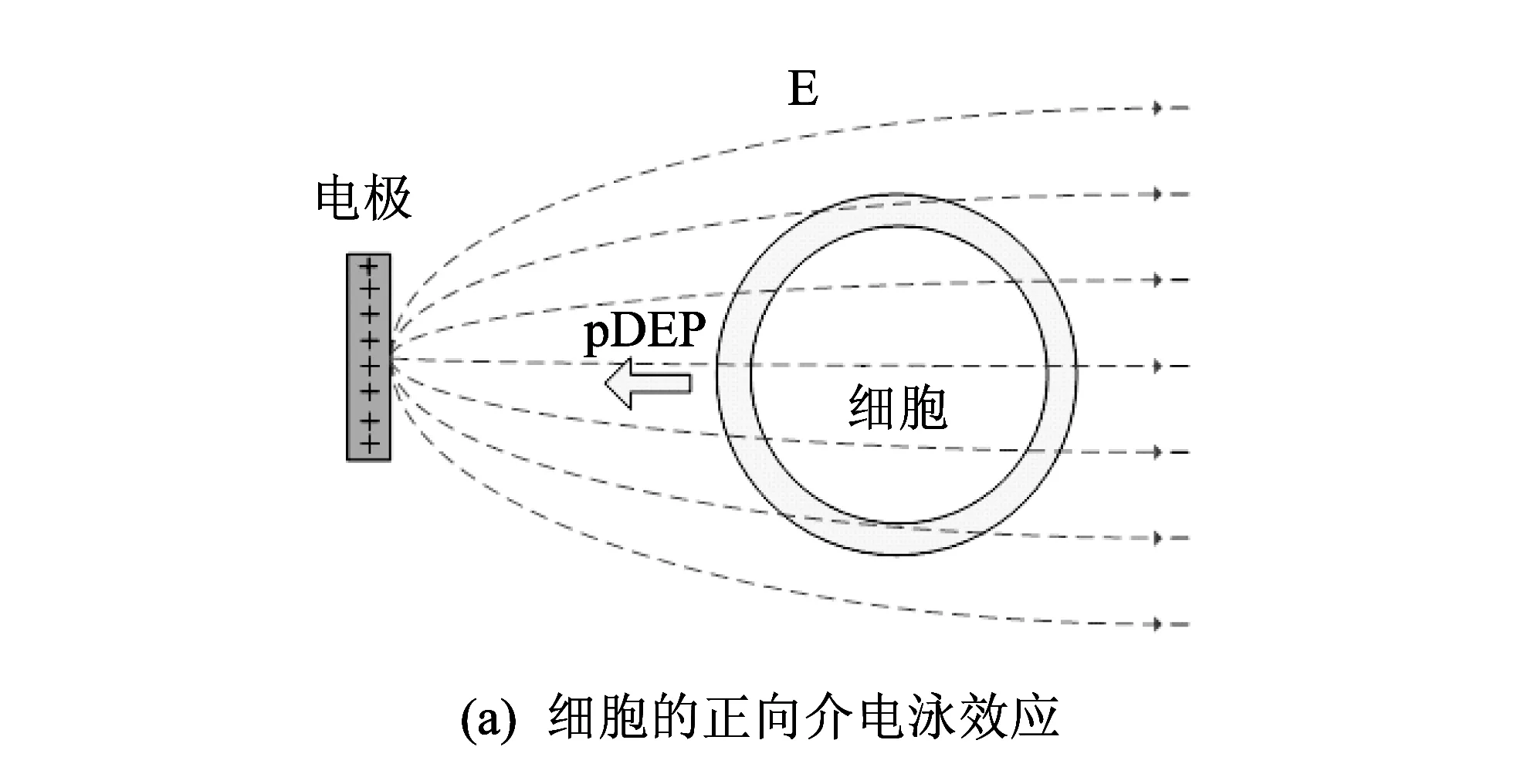
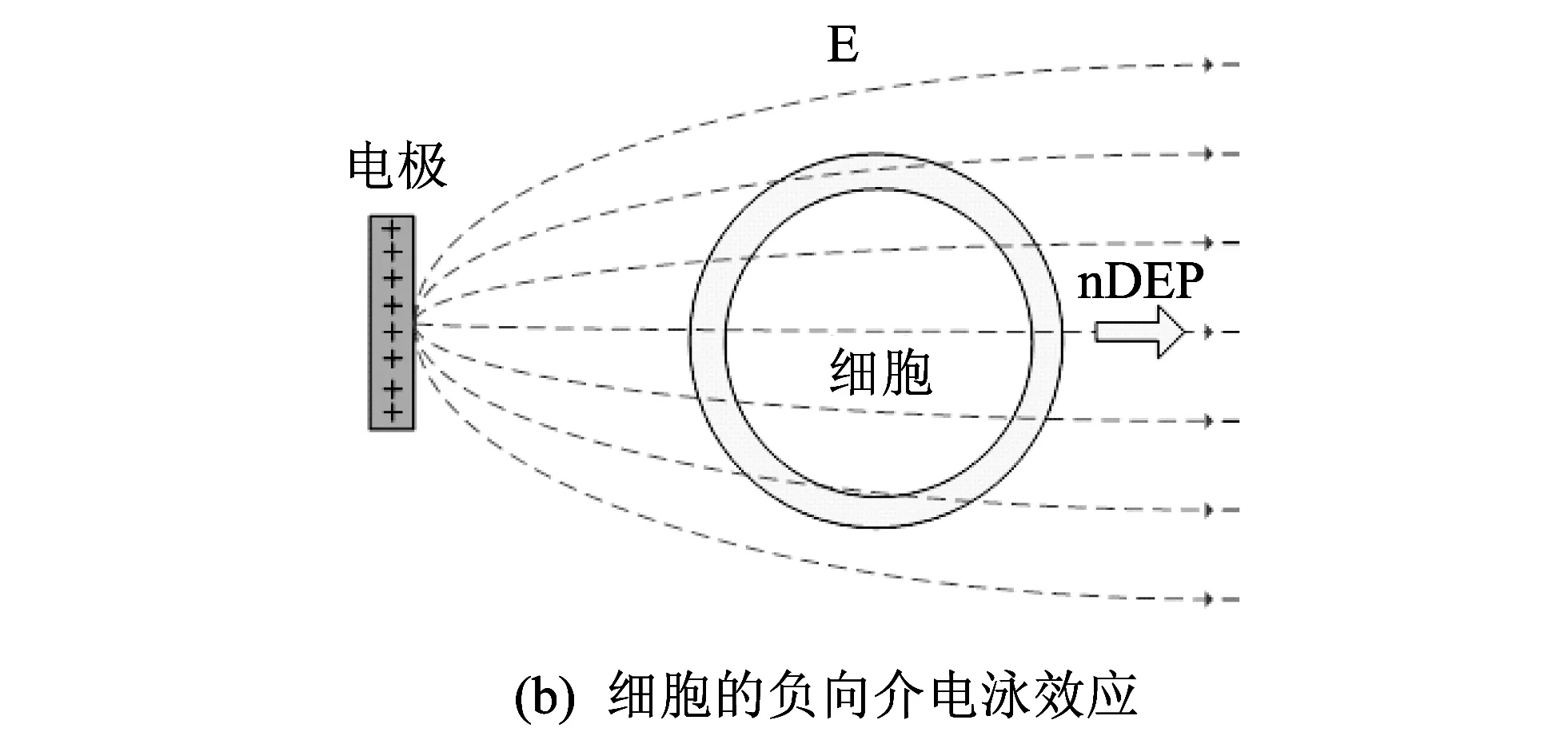
图 3 细胞介电泳效应的示意图Fig.3 DEP effects diagram of a cell
3 实验及结果分析
3.1 单一细胞的迁移实验
首先利用具有变间距的平行电极的微流控芯片做食管鳞癌KYSE180细胞的介电泳迁移实验. 实验中, 两平行电极分别接在信号发生器的两个输出端上, 给两电极提供一个适当的正弦信号, 观察细胞的迁移规律, 电气连接示意图如图 4(a) 所示. 结果表明, 细胞缓冲液的电导率为1.65 μS/cm, 电压为7Vpp,当电场的频率为10 MHz时,观察到KYSE180细胞被吸附在电极的边缘,细胞发生正向介电泳效应,如图 4(b) 所示,KYSE180细胞沿电极边缘排列;当电场的频率为900 kHz时,观察到KYSE180细胞离开电极边缘, 细胞发生负向介电泳效应, 如图 4(c) 所示.
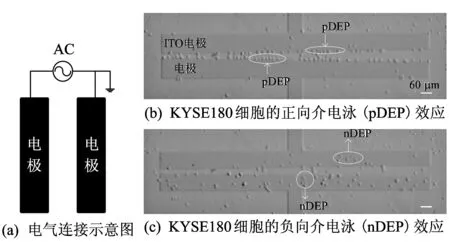
图 4 基于平行电极的KYSE180细胞的排列和迁移实验Fig.4 Patterning and transportation of KYSE180 cells based on parallel electrodes
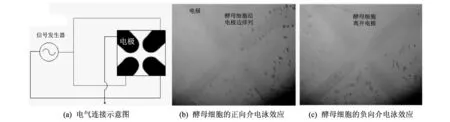
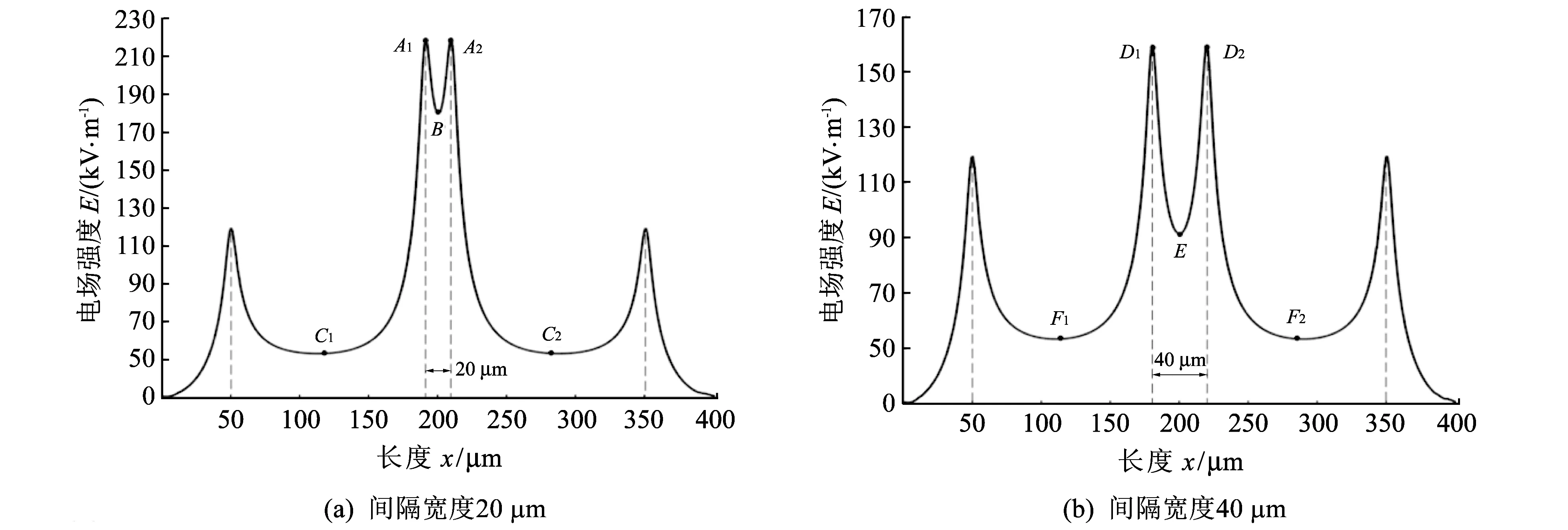
经过多次独立实验, 发现对于这样的微流控细胞电操作系统而言, 当细胞缓冲液的电导率为1.65 μS/cm, 并且电场频率范围在950 kHz 对于观察到的KYSE180细胞的迁移现象, 经过分析, 得到如图 5 所示的曲线关系. 图 5 克劳斯因子的实部Re[K(f)]与电场频率f以及 细胞缓冲液电导率σe之间的关系曲线Fig.5 Real part of the Clausius-Mossotti factor, Re[K(f)] versus frequency, f, at different values of σe, for KYSE180 cells 图 5 显示了克劳斯因子的实部Re[K(f)]与电场频率f以及细胞缓冲液的电导率σe之间的关系. 注意, Re[K(f)]和前面提到的Re[fCM(ω)]意义相同, 都是克劳斯因子的实部. 图 5 中细胞缓冲液的电导率分为以下3种:A:σe=1.65 μS/cm,B:σe=2.44 μS/cm,C:σe=3.75 μS/cm;f0为临界频率. Re[K(f0)]=0时对应的电场频率f0, 称为细胞发生正负介电泳效应的临界频率[11]. 细胞介电泳效应的克劳斯因子的实部Re[K(f)]的范围为[-0.5,1][11], 并且当Re[K(f)]∈(0,1]时, 细胞表现为正向介电泳效应, 而Re[K(f)]∈[-0.5,0)时, 细胞表现为负向介电泳效应. 从图 5 中发现, 在细胞缓冲液的电导率较低的情况下(例如,A:σe=1.65 μS/cm), 细胞会在电场的操控下, 做有规律的迁移运动; 如果明确了细胞缓冲液的临界频率, 就可以科学地操控细胞的运动; 当调节电场频率小于临界频率时, 细胞就会发生负向介电泳, 表现为细胞离开电极; 电场频率大于临界频率时, 细胞就会发生正向介电泳, 表现为细胞被电极吸住. 如果细胞缓冲液的电导率较高时, 细胞或者无DEP现象(例如,B:σe=2.44 μS/cm), 不受电场的操控, 或者只发生负向介电泳效应(例如,C:σe=3.75 μS/cm). KYSE180细胞在电场中的迁移规律, 与MacQueen等人报道的数值仿真结果一致[11]. 可见, 利用平行电极的微流控芯片做细胞的介电泳迁移实验, 非常直观方便. 细胞发生正向介电泳时, 细胞向电极边缘方向运动, 最终停止在电极边缘处; 细胞发生负向介电泳时, 细胞离开电极边缘, 向电场强度弱的方向运动. 利用平行电极做实验, 能快速的获得不同细胞正负介电泳效应的最佳实验条件, 容易发现操控细胞迁移的科学规律, 可以快速深入地把握微流控细胞电操作系统的本质, 发现细胞的迁移规律主要受制于电极加载信号的电场频率和细胞缓冲液的电导率这两个重要因素. 因此, 有了平行电极的微流控芯片的细胞介电泳迁移实验的经验, 对于复杂结构的电极, 再做各种细胞的介电泳实验很容易. 如图 6 所示, 用四电极结构很容易实现酵母细胞的排列和迁移实验. 图6(a)为四电极的电气连接示意图. 这里, 酵母细胞悬浮在磷酸盐缓冲液和去离子水的混和溶液中, 当混和溶液的电导率为50 μS/cm, 正弦信号的电压为8Vpp, 电场的频率为2 MHz时, 酵母细胞表现为正向介电泳现象, 酵母细胞沿四电极边缘排列, 如图6(b)所示; 当电场的频率为5 kHz时, 酵母细胞表现为负向介电泳现象, 酵母细胞离开四个电极, 如图6(c)所示. 四电极结构是实现细胞电旋转、 电拉伸的经典结构[12], 细胞的介电泳实验是其基础. 总之, 细胞的介电泳迁移实验是实现细胞其它复杂电操作, 诸如, 拉伸、 分选、 旋转和融合等功能的基础. 掌握了细胞的DEP迁移规律, 可以加快细胞其它复杂电操作实验成功的步伐. 图 6 基于四电极结构的酵母细胞的排列和迁移实验Fig.6 Patterning and transportation of yeast cells based on quadrupole-structure electrodes 3.2 混合细胞的迁移实验 这里, 利用具有变间距平行电极的微流控芯片做混合细胞的迁移实验. 此平行电极的间距宽度分别为20, 40, 60, 80和100 μm. 混合细胞由酵母菌细胞和NB4细胞构成. 实验中, 酵母菌和NB4细胞混合悬浮在PBS溶液里, PBS的电导率大约为10 mS/cm, 电场的频率为15 kHz, 电压为5Vpp. 在这样的实验条件下, 两种细胞均表现为负向介电泳效应, 它们均分布在电极间隔中心或电极表面, 这些均为电场强度较弱的地方, 如图7所示. 另外, 发现一些有趣的实验现象, 其中100 μm 和80 μm电极间隔的中心, 酵母菌和NB4细胞都存在, 如图7(a)和7(b)所示; 60 μm和40 μm 电极间隔的中心, 只有酵母菌细胞存在, 如图7(c)和7(d)所示; 20 μm电极间隔的中心, 没有任何细胞存在, 如图7(e)所示. (a) 电极间隔宽度为100 μm时, 两种细胞的迁移情形; (b) 电极间隔宽度为80 μm时, 两种细胞的迁移情形; (c) 电极间隔宽度为60 μm时, 两种细胞的迁移情形; (d) 电极间隔宽度为40 μm时, 两种细胞的迁移情形; (e) 电极间隔宽度为20 μm时, 两种细胞的迁移情形 图 7 基于变间距的平行电极的两种混合细胞的排列和迁移实验Fig.7 Patterning and transportation of two kinds of mixed cells based on the parallel electrodes with different gaps 对平行电极施加幅值为5Vpp和频率为15 kHz的交流正弦信号, 进行COMSOL仿真, 得到电极间隔宽度为20 μm和40 μm的电极上方4 μm处的电场强度的分布规律, 如图 8 所示. 观察仿真结果, 发现电场强度的最大值在电极边缘处, 例如图8(a)中的A1和A2点处, 图8(b)的D1和D2点处; 最小值在电极表面附近, 例如图8(a)中的C1和C2点处, 图8(b)中的F1和F2点处; 发现不同间隔的电极, 电极间隔中心的电场强度普遍比电极面附近的电场强度高, 例如, 图8(a)中的B点处的电场强度高于C1或C2点处的电场强度, 图8(b)中的E点处的电场强度高于F1或F2点处的电场强度; 并且随着电极间隔宽度的增大, 电极间隔中心的电场强度大小越来越接近电极面附近的电场强度, 例如, 图8(a)中, 电极间隔为20 μm,B和C1(或C2)两点处的电场强度大约相差 1.3×105V/m; 图8(b)中, 电极间隔为40 μm,E和F1(或F2)两点处的电场强度大约相差 0.4×105V/m. 借此仿真结果, 可以解释图7中的细胞迁移现象. 在上述的实验条件下, 两种细胞均表现为负向介电泳效应. 当电极间隔宽度为20 μm时, 间隔中心处电场强度相对较高, 以致两种细胞均无法留存, 而向电场强度更低的电极表面附近运动, 如图7(e)所示. 对于间隔宽度为40 μm和60 μm 的电极, 看到只有酵母菌细胞存在于电极间隔中心, 而没有NB4细胞. 因为NB4细胞的粒径比酵母菌的大, 根据介电泳力的表达式, 所以NB4细胞受到的介电泳力更大, NB4细胞会向电场强度更低的方向运动, 即电极表面处, 如图7(c) 和7(d)所示. 对于间隔宽度为80 μm和100 μm 的电极, 电极间隔中心的电场强度和电极表面附近的电场强度, 几乎差得不多, 电场强度都比较低, 所以可看到电极间隔中心和电极表面处均有两种细胞的分布,如图7(a)和7(b)所示. 这种实验就比较条件下, 电极间隔中心只存在NB4细胞的情况, 没有观察到, 因为不可能发生. 这个基于平行电极的微流控芯片的混合细胞的迁移实验, 对于细胞的分选实验, 有重要的参考价值. 这是做细胞分选实验的研究者往往容易忽视的一个问题. 首先用平行电极观察各种细胞的介电泳现象非常直观方便, 很容易找到细胞分离的最佳频率. 例如, 两种细胞的临界频率构成的一个频率范围, 即为两种细胞分离的最佳频率. 之后, 再用复杂的具有分选功能的电极结构做细胞分选实验就比较容易成功. 图 8 微流控芯片内部的平行电极上方4 μm处电场强度的COMSOL仿真结果Fig.8 COMSOL simulation about the electric field distribution at 4 μm above the electrodes in the microfluidic chip 细胞的排列和迁移, 是微流控平台上细胞复杂电操作的第一步, 往往也是需要首先解决的问题. 本文充分挖掘具有平行电极的微流控芯片的优势, 对带有电极的整个微流控系统进行研究, 通过实验现象发现细胞的排列和迁移运动, 主要受制于电极上加载的信号的电场频率和细胞缓冲液的电导率. 另外, 论文对更复杂的情况进行了研究, 即变间距平行电极和混合细胞的情况, 通过实验和COMSOL仿真软件, 研究了不同细胞的迁移规律. 该混合细胞实验对于基于复杂电极结构的细胞分选实验意义重大. 因此, 对细胞的排列和迁移规律的深刻认识, 为实现细胞的其他多种功能的电操作, 诸如, 拉伸、 分选、 旋转和融合等, 奠定了基础, 加快了复杂实验成功的步伐. [1]Gagnon Z R. Cellular dielectrophoresis: applications to the characterization, manipulation, separation and patterning of cells[J]. Electrophoresis, 2011, 32(18): 2466-2487. [2]Hyunjin P, Dongil K, Kwang-Seok Y. Single-cell manipulation on microfluidic chip by dielectrophoretic actuation and impedance detection[J]. Sensors and Actuators B: Chemical, 2010, 150(1): 167-173. [3]Saurin P, Daniel S, Pallavi V, et al. Microfluidic separation of live and dead yeast cells using reservoir-based dielectrophoresis[J]. Biomicrofluidics, 2012, 6(3): 034102-034113. [4]Guido I, Jaeger M S, Duschl C. Dielectrophoretic stretching of cells allows for characterization of their mechanical properties[J]. European Biophysics Journal, 2011, 40(3): 281-288. [5]Chen J, Abdelgawad M, Yu L, et al. Electrodeformation for single cell mechanical characterization[J]. Journal of Micromechanics and Microengineering, 2011, 21(5): 054012. [6]Ren Yukun, Wu Hongchi, Feng Guojing, et al. Effects of chip geometries on dielectrophoresis and electrorotation investigation[J]. Chinese Journal of Mechanical Engineering, 2014, 27(1): 103-110. [7]Yang Jun, Zhao Liping, Yin Zhengqin, et al. Chip-Based Cell Electrofusion[J]. Advanced Engineering Materials, 2010, 12(9): B398-B405. [8]Pohl H A. Dielectrophoresis: the behavior of neutral matter in nonuniform electric fields[M]. Cambridge: Cambridge university press, 1978. [9]Puttaswamy S V, Sivashankar S, Chen R J, et al. Enhanced cell viability and cell adhesion using low conductivity medium for negative dielectrophoretic cell patterning[J]. Biotechnology journal, 2010, 5(10): 1005-1015. [10]Zhang Yang, Zhang Xiaofei, Bai Guohua, et al. Preparation and Experimental Study on Dielectrophoresis-Based Microfluidic Chip for Cell Patterning[J]. Chinese Journal of Analytical Chemistry, 2014, 42(11): 1568-1573. [11]MacQueen L A, Buschmann M D, Wertheimer M R. Gene delivery by electroporation after dielectrophoretic positioning of cells in a non-uniform electric field[J]. Bioelectrochemistry, 2008, 72(2): 141-148. [12]Urbano R L, Clyne A M. An inverted dielectrophoretic device for analysis of attached single cell mechanics[J]. Lab on a Chip, 2016, 16(3): 561-573. Experimental Research of Cell Patterning and Transportation Based on the Microfluidic Chip BAI Guo-hua, TAN Qiu-lin (Science and Technology on Electronic Test and Measurement Laboratory,North University of China, Taiyuan 030051, China) Due to cellular heterogeneity, cell patterning and transportation are usually the basic problems that need to be solved before other sophisticated cell electro-manipulations. A microfluidic chip with the parallel electrodes was used to investigate the transportation of human esophageal squamous carcinoma KYSE180 cells; through a microfluidic chip based on the parallel electrodes with different gaps, the transportations of the mixed cells of leukemia NB4 cells and yeast cells were studied; the transportation movement of the two kinds of cells vary along with the changes of the width of electrodes and the gap-width of electrodes was found through COMSOL Multiphysics. The experimental results illustrate that the frequency of the E-field from the signal applied to the electrodes and the conductivity of cell suspension decide cell transportation; the study of transportation experiments of the mixed cells show that the optimal frequency of cell sorting can be acquired easily under the above conditions and establishes the foundation for cell sorting based on complicated chip-structures. cell patterning; cell transportation; parallel electrodesv; microfluidic chip; mixed cells; cell electro-manipulations 1673-3193(2017)01-0087-06 2016-04-29 山西省青年拔尖支持计划项目; 山西省百人计划项目 白国花(1980-), 女, 博士生, 主要从事MEMS技术和生物工程的研究. TN405 A 10.3969/j.issn.1673-3193.2017.01.016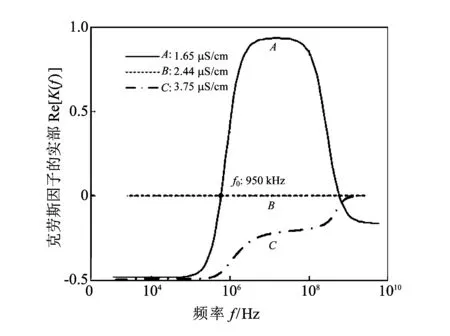

4 结 论

