Preparation of EGFRvⅢ-targeted high molecular polymer nanoparticles with liquid perfluorocarbon and its targeting ability evaluation in vitro
, , , , ,
LIU Xujie1, WANG Zhigang4, PENG Zhiping1*(1.Department of Radiological Medicine, Chongqing Medical University, Chongqing 400016, China;2.Department of Ultrasound, Chongqing Maternity and Child Care Center, Chongqing 400010, China;3.Department of Electrocardiography, Chongqing Zhongshan Hospital, Chongqing 400013, China;4.Institute of Ultrasound Imaging, Chongqing Medical University, Chongqing 400010, China)
·基础与实验研究·
Preparation of EGFRvⅢ-targeted high molecular polymer nanoparticles with liquid perfluorocarbon and its targeting ability evaluation in vitro
HEYanqiong1,LIUShuang2,JINGShen1,HEYujia1,ZHANGNa3,
LIUXujie1,WANGZhigang4,PENGZhiping1*(1.DepartmentofRadiologicalMedicine,ChongqingMedicalUniversity,Chongqing400016,China;2.DepartmentofUltrasound,ChongqingMaternityandChildCareCenter,Chongqing400010,China;3.DepartmentofElectrocardiography,ChongqingZhongshanHospital,Chongqing400013,China;4.InstituteofUltrasoundImaging,ChongqingMedicalUniversity,Chongqing400010,China)
Objective To prepare an epidermal growth factor receptor variant Ⅲ (EGFRvⅢ)-targeted high molecular polymer nanoparticles with liquid perfluorocarbon, in order to evaluate its physical properties and targeting ability in vitro. Methods The specificity of EGFRvⅢ monoclonal antibody (4G1) was confirmed by Western Blot and flow cytometry (FACS). The nanoparticles of macromolecule material with liquid fluorocarbon (P-NPs) were prepared by a double emulsion solvent evaporation method. The properties and distribution of P-NPs were observed by light microscope and scanning electron microscope, and its size and potential were determined by laser particle size instrument. The P-NPs were conjugated with 4G1 by EDC/NHS to prepare a targeted ultrasound contrast agent (P-NPs-4G1), which binding rate was detected by FACS. The ultrasound imaging was observed the transition performances after irradiation by low intensity focused ultrasound (LIFU). The targeting ability of P-NPs-4G1 was evaluated by FACS and confocal microscope in vitro. Results The average size and Zeta of P-NPs-4G1 were (563.8+60.3)nm and (-32.4±3.37)mV. The binding rate of P-NPs-4G1 were (97.37±1.57)%. After irradiation by LIFU in vitro, the imaging effect of P-NPs-4G1 was enhanced; P-NPs-4G1 can bind to F98npEGFRvⅢcells (EGFR-/EGFRvⅢ+), while could not bind to F98EGFRcells (EGFR+/EGFRvⅢ-). Conclusion P-NPs-4G1 prepared in this study, can specificity bind to EGFRvⅢ positive tumor cells. After irradiation by LIFU, the imaging effect of P-NPs-4G1 is enhanced in vitro.
Ultrasonic; Contrast media; Epidermal growth factor receptor variant Ⅲ; Liquid fluorocarbon; Nanoparticles
表皮生长因子受体突变体Ⅲ(epidermal growth factor receptor variant Ⅲ, EGFRvⅢ)是表皮生长因子受体(epidermal growth factor receptor, EGFR)最常见的一种缺失突变体,由于编码EGFR的外显子2-7缺失,导致外显子1和8融合并在结合位点产生一个新的甘氨酸,其表达产物可在不依赖配体的情况下激活酪氨酸激酶产生自体磷酸化,并激活下游信号传导通路产生级联反应,引起细胞的恶性转化和肿瘤发生[1]。研究[2]发现,EGFRvⅢ在40%~50%的胶质母细胞瘤中高表达,在乳腺癌、肾癌、卵巢癌、子宫颈癌和前列腺癌中也普遍表达[3-4]。目前认为EGFRvⅢ仅表达于肿瘤组织,在正常组织中不表达,且肿瘤恶性程度越高,其表达水平也越高。因此,肿瘤EGFRvⅢ表达的检测,是恶性肿瘤诊断和靶向治疗的理想靶点[5]。本研究旨在以EGFRvⅢ为靶点,制备靶向EGFRvⅢ包裹液态氟碳的高分子纳米球(P-NPs-4G1),并在EGFRvⅢ阳性表达细胞株上验证P-NPs-4G1体外靶向结合能力,以期为表达EGFRvⅢ的肿瘤提供一种有效的超声分子影像学检测手段。
1 材料与方法
1.1材料
1.1.1 细胞株 大鼠胶质瘤细胞F98EGFR(EGFR+/EGFRvⅢ-)、F98npEGFRvⅢ(EGFR-/EGFRvⅢ+),购自美国ATCC细胞库。
1.1.2 试剂 聚乳酸羟基乙酸共聚物(PLGA,聚合比50∶50,岱罡生物科技有限公司);液态全氟戊烷(PFP,百灵威科技有限公司);聚乙烯醇(PVA,Sigma-Aldrich);NHS/EDC(Sigma-Aldrich);抗EGFRvⅢ单克隆抗体:4G1(北京大学医学部同位素研究中心惠赠);抗β-actin单克隆抗体(ImmunoWay);DyLight488-山羊抗鼠IgG(Abbkine);DiI(碧云天生物科技有限公司);异丙醇、二氯甲烷(川东化工有限公司)。
1.1.3 仪器及耗材 声震仪(Sonic);高速分散均质机(XHF-D);Olympus TH4-200倒置荧光显微镜;激光粒径测量仪(ZEN3600,Malvern);低强度聚焦超声(low-intensity focused ultrasound, LIFU)治疗仪(重庆医科大学超声分子影像学研究所);扫描电子显微镜(JSM-7800F);激光共聚焦扫描显微镜(Leica TCSSP5 II);超声诊断仪(MyLab90,Esaote);
1.2方法
1.2.1 细胞培养及4G1抗体靶向特异性的验证 采用DMEM完全培养基培养F98EGFR和F98npEGFRvⅢ细胞,取对数期细胞,0.05%胰酶消化后离心,加入适量RIPA裂解液,提取细胞蛋白,BCA法进行蛋白定量。取蛋白质样品(20 μg总蛋白量/泳道)加入适量上样缓冲液,100℃煮沸5 min,8% SDS-PAGE电泳后转印至聚偏二氟乙烯(Polyvinylidenefluoride, PVDF)膜上,5%脱脂牛奶室温封闭2 h,按1∶500(抗体:工作液)加入4G1,4℃孵育过夜,TBST洗涤多次。按1∶1 000加入辣根过氧化物酶标记的二抗,室温孵育1 h,TBST洗涤数次。ECL发光试剂显色于X胶片。采用ImageLab凝胶图像分析系统扫描胶片,以内参的面积灰度值与实验组比较进行半定量分析。另取对数期细胞,0.05%胰酶消化后计数,取2.0×106个细胞,实验组加入6 μg 4G1,对照组加入等量IgG抗体,室温孵育1 h,PBS洗涤离心3次(1 000 rpm,3 min),按1∶1 000加入DyLight 488-山羊抗鼠二抗,室温孵育30 min,PBS洗涤离心3次后重悬,进行流式细胞术检测。
1.2.2P-NPs及P-NPs-4G1的制备及性质检测 称取50 mg PLGA和适量DiI溶解于2 ml二氯甲烷中,充分溶解后加入适量PFP,置于冰浴中,声震仪声振3 min;加入8 ml 4% PVA溶液,均质机均质5 min,在磁力搅拌器上挥发二氯甲烷3~5 h,双蒸水洗涤离心2次(9 000 rpm,5 min),制得DiI标记的P-NPs,4℃冰箱保存;取适量DiI标记的P-NPs用MES缓冲液(0.1 mol/L,pH 5.5)重悬,加入适量的EDC/NHS(质量比EDC∶NHS=1∶3),4℃、150 rpm摇床上孵育2 h,双蒸水洗涤离心2次去除未反应的EDC/NHS,用MES缓冲液(0.1 mol/L,pH 8.0)重悬至适宜浓度,加入60 μl 4G1,4℃、150 rpm摇床上孵育过夜,双蒸水洗涤离心多次后制得DiI标记的P-NPs-4G1。光镜及扫描电镜观察形态及分布;Malvern激光粒径测量仪检测粒径和Zeta电位。取500 μl DiI标记的P-NPs-4G1,加入5 μl DyLight 488-山羊抗鼠二抗,4℃孵育1 h,洗涤离心2次后PBS重悬,流式细胞术测定二者连接率,共聚焦显微镜检测P-NPs与4G1的连接情况。
1.2.3 P-NPs-4G1体外相变实验 将适宜浓度的P-NPs-4G1滴在放有载玻片的加热板上,设置加热板温度,在光镜下连续、动态观察P-NPs-4G1随加热板温度升高而发生相变的情况。另取适量P-NPs-4G1置于凝胶模块中,LIFU辐照3 min(功率7 W),超声诊断仪(机械指数0.7)记录LIFU辐照前后P-NPs-4G1在B模式及造影模式下的显像图。
1.2.4 P-NPs-4G1体外靶向结合实验 取对数期生长的F98EGFR及F98npEGFRvⅢ细胞,0.05%胰酶消化后计数,取1.5×103个细胞接种至共聚焦培养皿,待细胞完全贴壁后,加入500 μl浓度为1 mg/ml DiI标记的P-NPs-4G1共孵育1 h,4%多聚甲醛固定20 min,DAPI染核10 min,共聚焦显微镜观察DiI标记的P-NPs-4G1与细胞结合情况;另取1.5×106个细胞,加入等量DiI标记的P-NPs-4G1,室温孵育2 h,PBS洗涤离心(5000 rpm,3 min)2次后重悬,流式细胞术检测P-NPs-4G1与细胞特异性结合情况。
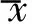
2 结果
2.1 4G1的靶向特异性 Western Blot结果显示:4G1可特异性地与EGFRvⅢ蛋白结合出现免疫印迹条带,而不与野生型EGFR蛋白结合;流式细胞术检测示:4G1可与F98npEGFRvⅢ细胞特异性结合,而不与F98EGFR细胞结合。见图1。
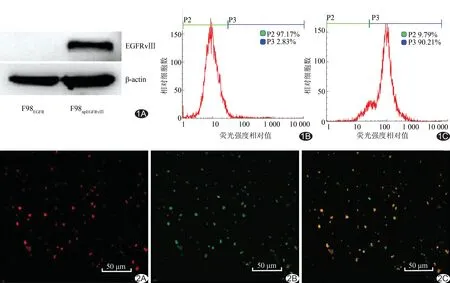
图1 4G1的靶向特异性检测 A.Western Blot结果; B.F98EGFR细胞靶向性; C.F98npEGFRvⅢ细胞靶向性 (P2:未与4G1结合的细胞所占比例;P3:与4G1结合细胞所占比例) 图2 共聚焦显微镜观察4G1与P-NPs的连接 A.P-NPs-4G1外壳呈红色; B.连接荧光二抗后P-NPs-4G1呈绿色; C.融合后呈黄色

图3 流式细胞术测4G1与P-NPs连接率 (P2:未连接4G1的P-NPs所占比例;P3:连接4G1的P-NPs所占比例) 图4 光学显微镜和扫描电镜下的P-NPs-4G1的形态特征 A. 光学显微镜观察(×600); B.扫描电镜观察(×10 000)
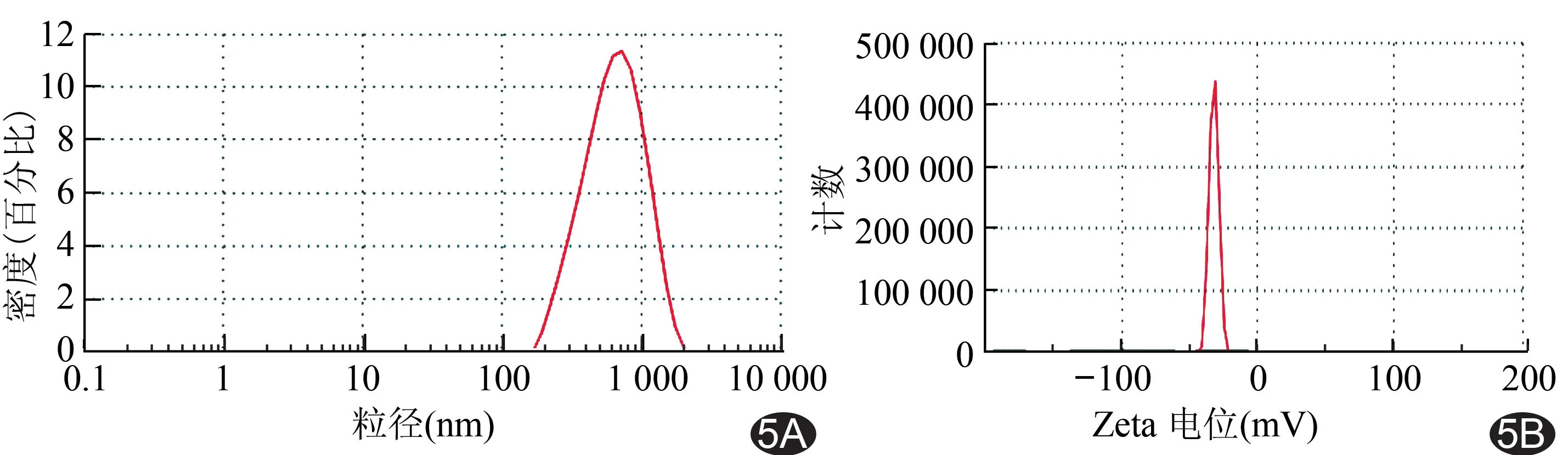
图5 激光粒径仪检测P-NPs-4G1粒径和电位 A.粒径; B.Zeta电位
2.2 4G1与P-NPs耦联情况 共聚焦显微镜下可见P-NPs-4G1外壳呈红色,连接荧光二抗后的P-NPs-4G1呈绿色,融合通道下两种荧光叠加呈黄色,表明4G1成功连接到P-NPs表面;流式细胞术测得4G1与P-NPs的连接率为(97.37±1.57)%。见图2、3。
2.3 P-NPs-4G1的基本特征 光学显微镜观察P-NPs-4G1形态规则,分散良好;扫描电镜下见P-NPs-4G1呈球形或类球形,表面光滑,形态规则;P-NPs-4G1粒径为(563.8±60.3)nm,Zeta电位电位为(-32.4±3.37)mV。见图4、5。
2.4 P-NPs-4G1体外相变 光学显微镜下连续动态观察加热板上P-NPs相变情况,加热板温度为43.8℃时,开始有微气泡产生,温度升高至70℃,微气泡产生增多并聚集,持续6~8 min后,微气泡开始出现破裂。采用超声诊断仪采集P-NPs-4G1在B模式及造影模式下的初始状态和LIFU辐照相变后的图像:LIFU辐照后造影模式下显像效果显著增强,通过灰度分析软件比较相变前后超声图像的平均回声强度,差异有统计学意义(P<0.05)。见图6、7。
2.5 P-NPs-4G1的体外靶向能力 激光共聚焦显微镜下观察P-NPs-4G1与肿瘤细胞的靶向结合能力显示:F98npEGFRvⅢ细胞周围可见大量P-NPs-4G1聚集,而F98EGFR细胞周围无P-NPs-4G1聚集;流式细胞术测得P-NPs-4G1与F98npEGFRvⅢ细胞特异性结合率达(94.68±1.06)%,而不与F98EGFR细胞特异性结合。见图8、9。

图6 光学显微镜观察热相变(×10) A.加热前; B.43.6℃时,P-NPs开始相变产生微气泡(箭); C.温度升高至70℃,相变P-NPs增多聚集并破裂(箭)
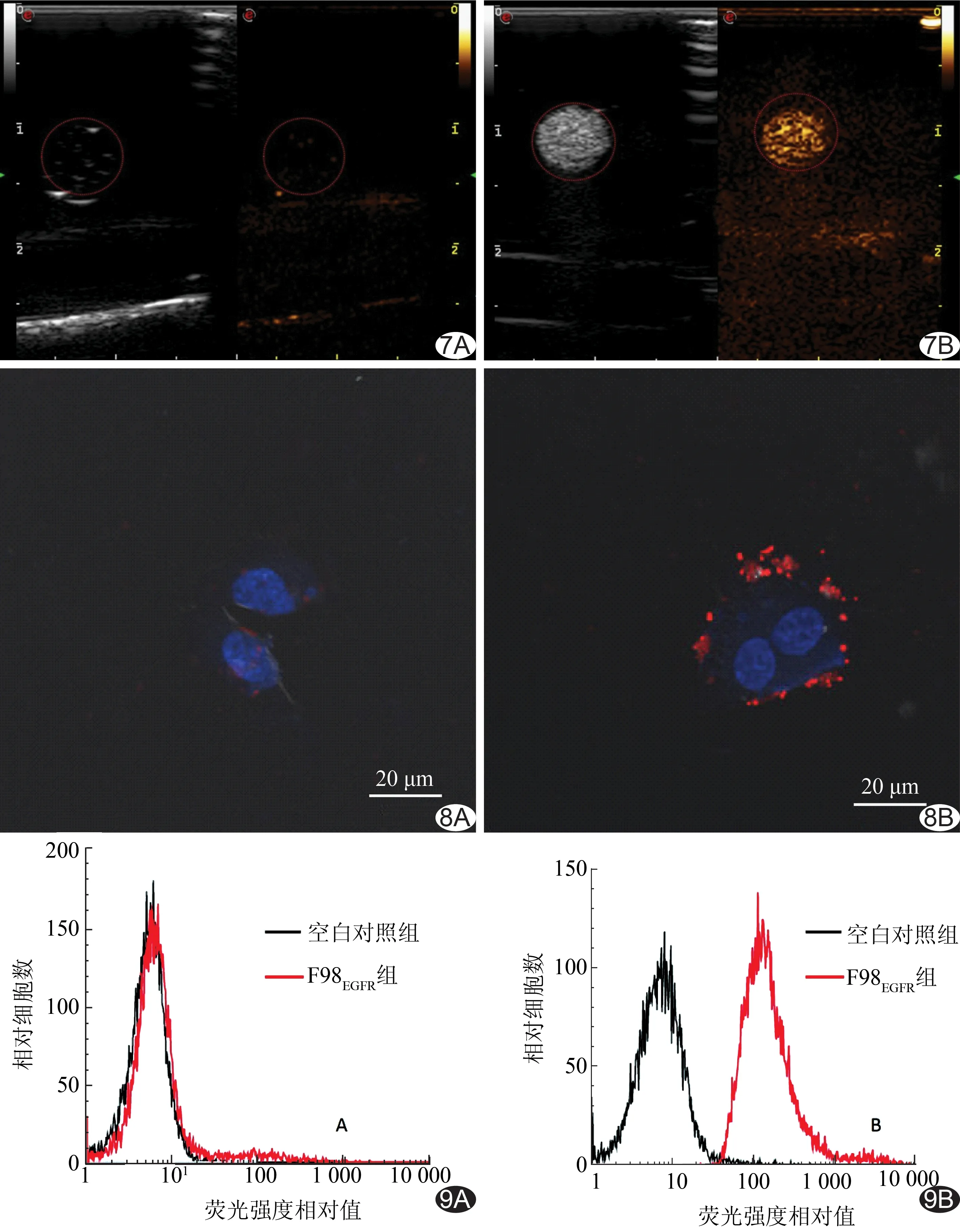
图7 超声诊断仪采集图像 A.P-NPs-4G1辐照前显像图; B.P-NPs-4G1经LIFU辐照后显像图 图8 共聚焦显微镜观察P-NPs-4G1与细胞的靶向结合 A.P-NPs-4G1与F98EGFR细胞未结合; B.P-NPs-4G1与F98npEGFRvⅢ细胞特异性结合 图9 流式细胞术检测P-NPs-4G1与细胞的结合 A.P-NPs-4G1与F98EGFR; B.P-NPs-4G1与F98npEGFRvⅢ
3 讨论
EGFR及其介导的信号通路在肿瘤的发生发展中有重要作用。但EGFR的表达不稳定,常出现基因扩增或重排而导致基因突变,使肿瘤细胞表面的抗原表型发生改变。其中EGFRvⅢ是最常见的突变体之一。EGFRvⅢ的表达可影响肿瘤的多种生物学特性,包括肿瘤细胞的增殖能力、侵袭和迁移能力、致瘤能力等,且均与肿瘤的发生发展密切相关。EGFRvⅢ的表达可促进肿瘤细胞的增殖,抑制肿瘤细胞的凋亡,导致肿瘤细胞侵袭迁移能力及致瘤性明显增强[6]。肿瘤组织表达EGFRvⅢ后其抗辐射的能力也增强,因此肿瘤患者常出现术后放化疗抵抗,使EGFRvⅢ阳性肿瘤的治疗成为一个难题[7]。此外,EGFRvⅢ表达与恶性肿瘤的预后也密切相关:对术后生存期超过1年的胶质母细胞瘤患者,肿瘤组织中EGFRvⅢ阳性表达率越高则其复发率越高、预后也越差[8]。因此,对肿瘤EGFRvⅢ表达的检测,有助于肿瘤的诊断及诊断后制定合理的个体化治疗方案和药物选择。目前,针对EGFRvⅢ的检测手段主要有免疫组化、MR、核医学显像等[9],由于免疫组化是一种有创检测,MR和核医学显像目前还处于实验阶段且价格昂贵,同时核医学显像还存在辐射等不足。因此,需有一种简便、易行、经济、无创、安全、高效的检测手段。
靶向超声分子影像学技术简便易行,可动态、实时、重复地对靶组织进行观察并多次成像[10-12],同时又可设计多模态、单靶点、多靶点等多种不同超声分子探针,成为近年来国内外超声相关领域研究的热点[13-14]。目前,靶向超声分子造影剂的成膜材料主要有磷脂和纳米高分子材料两类。其中,有研究[15]已将不同显像分子、特殊基团和靶向药物等与纳米材料连接,制备出具有多功能的纳米粒。高分子液态氟碳纳米粒是纳米生物医学领域最具代表性的纳米粒之一,PLGA包裹的液态氟碳纳米粒除具有理化性质稳定、体内可降解、降解产物安全无毒等优点[16],还可自由穿过血管内皮间隙到达肿瘤组织周围,并可在一定条件下发生液气相转变,形成微气泡以增强超声显像效果,从而实现肿瘤细胞甚至亚细胞水平的靶向超声分子显像[17-18]。
本研究采用表面带有大量羧基的PLGA-COOH材料为外壳包裹液态氟碳,制成液态氟碳纳米粒(P-NPs),可与表面带有氨基的单克隆抗体等生物活性物质通过共价键耦联。所用4G1(北京大学同位素研究中心研制并已申请专利)是一种抗EGFRvⅢ的单克隆抗体,本研究证实4G1对EGFRvⅢ具有良好的靶向性,可与EGFRvⅢ表达阳性的肿瘤细胞特异性结合。本研究通过EDC/NHS将4G1与P-NPs耦联制得P-NPs-4G1,发现其在体外可与EGFRvⅢ阳性肿瘤细胞特异性结合,声热作用下能发生液气相转变,进而进行靶向超声分子显像,为后期EGFRvⅢ阳性肿瘤体内靶向超声分子显像,以及靶向载药治疗均奠定了良好的基础。今后将通过裸鼠肿瘤模型对P-NPs-4G1体内靶向超声分子显像进行研究。
综上所述,本研究成功制备的P-NPs-4G1靶向超声造影剂,可特异性地与EGFRvⅢ阳性肿瘤细胞相结合,体外声致相变后可显著增强超声显像效果,有望成为一种用于EGFRvⅢ阳性肿瘤检测的新型靶向超声造影剂。
[1] Chandramohan V, Bao X, Keir ST, et al. Construction of an immunotoxin, D2C7-(scdsFv)-PE38KDEL, targeting EGFRwt and EGFRvIII for brain tumor therapy. Clin Cancer Res, 2013,19(17):4717-4727.
[2] Del Vecchio CA, Giacomini CP, Vogel H, et al. EGFRvIII gene rearrangement is an early event in glioblastoma tumorigenesis and expression defines a hierarchy modulated by epigenetic mechanisms. Oncogene, 2013,32(21):2670-2681.
[3] Malecki M, Szybalski W. Isolation of single, intact chromosomes from single, selected ovarian cancer cells for in situ hybridization and sequencing. Gene, 2012,493(1):132-139.
[4] Zhang W, Zhu H, Liu X, et al. Epidermal growth factor receptor is a prognosis predictor in patients with esophageal squamous cell carcinoma. Ann Thorac Surg, 2014,98(2):513-519.
[5] Lowenstein PR, Castro MG. The value of EGFRvIII as the target for glioma vaccines. Am Soc Clin Oncol Educ Book, 2014:42-50.
[6] Congdon KL, Gedeon PC, Suryadevara CM, et al. Epidermal growth factor receptor and variant III targeted immunotherapy. Neuro Oncol, 2014,16(Suppl 8):viii20-25.
[7] Roth P, Weller M. Challenges to targeting epidermal growth factor receptor in glioblastoma: Escape mechanisms and combinatorial treatment strategies. Neuro Oncol, 2014,16(Suppl 8):viii14-19.
[8] Eskilsson E, Rosland GV, Talasila KM, et al. EGFRvⅢ mutations can emerge as late and heterogenous events in glioblastoma development and promote angiogenesis through Src activation. Neuro Oncol, 2016,18(12):1644-1655.
[9] Ma T, Sun X, Cui L, et al. Molecular imaging reveals trastuzumab-induced epidermal growth factor receptor downregulation in vivo. J Nucl Med, 2014,55(6):1002-1007.
[10] Unnikrishnan S, Klibanov AL. Microbubbles as ultrasound contrast agents for molecular imaging: Preparation and application. AJR Am J Roentgenol, 2012,199(2):292-299.
[11] 肖洋,冉海涛,夏琼,等.靶向VEGFR2光声/超声双模态造影剂的制备及体外寻靶实验研究.中国介入影像与治疗学,2015,12(9):554-558.
[12] 许丽,李凤华.纳米靶向超声造影剂的研究进展.中国医学影像技术,2015,31(12):1931-1934.
[13] Appel AA, Anastasio MA, Larson JC, et al. Imaging challenges in biomaterials and tissue engineering. Biomaterials, 2013,34(28): 6615-6630.
[14] 孙阳, 王志刚.多功能超声造影剂分子显像与治疗研究进展. 中国超声医学杂志,2012,28(1):84-86.
[15] Beck-Broichsitter M, Dalla-Bona AC, Kissel T, et al. Polymer nanoparticle-based controlled pulmonary drug delivery. Methods Molecul Biol, 2014,1141:133-145.
[16] Laudien J, Gross-Heitfeld C, Mayer C, et al. Perfluorodecalin-filled poly(n-butyl-cyanoacrylate) nanocapsules as potential artificial oxygen carriers. J Nanosci Nanotechnol, 2015,15(8):5637-5648.
[17] 周航,黄晓玲,过源,等.链霉亲和素化载紫杉醇相变型PLGA纳米粒的制备及体外超声显影.中国介入影像与治疗学,2016,13(9):571-575.
[18] 张斌,冉海涛,王志刚,等.“适配子-PLGA纳米粒”靶向超声/光声相变造影剂的制备.中国医学影像技术,2014,30(11):1609-1613.
国家自然科学基金青年科学基金(81501520)、国家自然科学基金重庆科学技术基金(cstc2015jcyjA10021)。
何燕琼(1991—),女,四川南部人,在读硕士。研究方向:肿瘤放射治疗的生物效应。E-mail: joanheyq0706@hotmail.com
彭志平,重庆医科大学放射医学教研室,400016。E-mail: pzp888@aliyun.com
2016-08-28
2016-11-11
靶向EGFRvⅢ包裹液态氟碳的高分子纳米球的制备及其体外靶向能力的评价
何燕琼1,刘 双2,景 珅1,何雨佳1,张 娜3,刘旭杰1,王志刚4,彭志平1*
(1.重庆医科大学放射医学教研室,重庆 400016;2.重庆市妇幼保健院超声科,重庆 400010;3.重庆市人民医院中山院区心电图室,重庆 400013;4.重庆医科大学超声影像学研究所,重庆 400010)
超声学;造影剂;表皮细胞生长因子受体突变体Ⅲ;液态氟碳;纳米球
TB559
A
1672-8475(2017)01-0039-06
目的 制备靶向表皮细胞生长因子受体突变体Ⅲ(EGFRvⅢ)并包裹液态氟碳高分子纳米球,评价其性质和体外靶向结合能力。方法 采用Western Blot和流式细胞术验证抗EGFRvⅢ单克隆抗体(4G1)的特异性;双乳化溶剂挥发法制备包裹液态氟碳的高分子纳米球(P-NPs),光镜和扫描电镜观察其形态及分布;激光粒径仪检测其粒径及电位;碳二亚胺法耦联4G1制备P-NPs-4G1,流式细胞术观察二者连接情况;超声观察其体外经低强度聚焦超声(LIFU)致相变后的表现;流式细胞术和共聚焦显微镜检测P-NPs-4G1体外靶向结合能力。结果 P-NPs-4G1粒径为(563.8±60.3)nm,Zeta电位为(-32.4±3.37)mV;4G1与P-NPs的连接率为(97.37±1.57)%;P-NPs-4G1在体外经LIFU辐照后可增强其显像效果;体外靶向实验证实P-NPs-4G1可与F98npEGFRvⅢ(EGFR-/EGFRvⅢ+)细胞特异性结合,且不与F98EGFR(EGFR+/EGFRvⅢ-)细胞结合。结论 本研究成功制备P-NPs-4G1,经体外LIFU辐照后可显著增强超声显像效果,同时可与F98npEGFRvⅢ细胞特异性结合。
10.13929/j.1672-8475.201608036
- 中国介入影像与治疗学的其它文章
- Conservative treatment of graft infection after endovascular repair of aortoiliac aneurysm
- Sorafenib administration combined with TACE in treatment of unresectable hepatocellular carcinoma
- Short-term and long-term efficacy of HIFU ablation for diffuse and focal adenomyosis
- Measurement of thymus in normal fetuses using two- and three-dimensional ultrasound
- Ultrasonography in diagnosis of right hand deficiency and right upper limb most deficiency in fetuses: Two cases report 超声诊断胎儿右手缺如及右上肢大部分缺如2例
- Ultrasound in diagnosis of hydatidiform mole coexisting with live fetuses