DEAE-琼脂糖LB膜的制备与表征
李雯露, 孔英俊, 康跻耀, 高建萍, 张贵锋, 王明林
(1. 山东农业大学 食品科学与工程学院, 泰安 271018;2. 中国科学院 过程工程研究所 生化工程国家重点实验室, 北京 100190)
DEAE-琼脂糖LB膜的制备与表征
李雯露1, 孔英俊2, 康跻耀2, 高建萍2, 张贵锋2, 王明林1
(1. 山东农业大学 食品科学与工程学院, 泰安 271018;2. 中国科学院 过程工程研究所 生化工程国家重点实验室, 北京 100190)
由于单分子膜性能独特,受到关注度越来越高,利用LB膜技术制备了二乙氨乙基(DEAE)-琼脂糖单分子层。分析其表面压(π)-面积(A)曲线,崩溃压较高,成膜过程明显。研究浓度对DEAE-琼脂糖成膜情况的影响,确定最佳成膜浓度为0.5 mg/mL。考察配基密度与表面电势的关系,其表面电势随着配基密度的增加而增大。采用原子力显微镜(AFM)和布鲁斯特角显微镜(BAM)对制备的LB膜进行了表征,得出表面膜的表面平整、紧密,厚度约为7.9 nm。DEAE-琼脂糖LB膜制备成功,为以后LB膜技术的广泛应用提供了一种新的材料。
DEAE-琼脂糖;LB膜;原子力显微镜;布鲁斯特角显微镜;表面电势
近年来,随着分子技术的不断发展,人们对分子水平材料的关注度越来越高,这就包括单分子膜制备技术。单分子膜应用十分广泛,如传感器、检测器、非线性光学器件的制备以及生物薄膜的简化模拟等。利用单分子膜在分子水平对材料进行制备和研究,已经成为最近的热门课题。
常用的制备单分子膜方法主要有分子自组装和Langmuir-Blodgett(LB)膜技术两种。分子自组装是构膜分子通过分子间及其与基底材料间的物化作用而自发形成的一种热力学稳定、排列规则的单层(或多层)分子膜[1]。张一芳等[2]在金电极表面自组装 1,6-己二硫醇(HDT)单分子膜,通过纳米金与巯基间的金硫键(Au-S)作用组装一层金纳米颗粒构建传感界面,作为电化学免疫传感器用于瘦肉精——克伦特罗(CL)的检测。马翠翠[3]研究了基于紫外光降解自组装单分子层的纸芯片及其应用。LB膜技术是在室温条件下,将两亲性分子在气液界面上施加横向压力使其有序排列,最后将单分子薄膜转移到特定固体基底表面的薄膜制备技术[4]。Zou等[5]利用LB膜技术制备了纳米金颗粒和聚苯胺单分子薄膜作为化学传感器,用于尿酸和肾上腺素的检测。Lee等[6]制备了基于钯纳米颗粒的单壁碳纳米管LB膜,作为一种氢气传感器。白烨[7]利用LB膜技术制备带有功能性基团的寡聚对苯撑乙烯(OPV) 制备单分子层薄膜,为开发有机光电分子器件奠定了一定的基础。相对于分子自组装来说,LB膜技术的优点在于制备的单分子层膜厚度可控制到分子级甚至纳米级,成膜物分子排列取向可控,成膜条件简单,不需要破坏成膜材料的结构,转移方式简便,利于后续修饰或偶联等[8-10]。
多糖类物质作为一种生物大分子,其研究应用一直是人们关注的热点[11-12]。在医药领域中,改性后纳米纤维素可以应用于疏水性药物的传递[13],改性后的羟乙基纤维素(HEC)与透明质酸(HA)结合应用于研究异甘草素的透皮给药[14],改性后的琼脂糖可以用于抗癌药物实验[15]。在生化领域中,改性后的DEAE-琼脂糖可以作为一种层析分离介质的重要基质,具有硫酸根含量低、凝胶强度高、电内渗低等性能[16-17],广泛应用于凝胶电泳、层析分离和免疫学研究等方面[18]。DEAE-琼脂糖作为一种生物高分子化合物,适用于单分子膜的制备[19],可以为单分子层膜的发展应用提供一种新型材料。本研究拟制备改性的DEAE-琼脂糖LB膜,优化铺展溶剂,测定其面积-表面压曲线,确定最佳成膜浓度,研究不同配基密度对表面电势的影响,利用AFM、BAM对其进行表征,建立DEAE-琼脂糖LB膜的制备方法,为单分子层研究提供新的资源。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
琼脂糖购自普洛麦格(北京)生物技术有限公司,单晶硅片(晶向为 N[100])购自北京中科科仪技术发展有限责任公司,其他试剂均为市售分析纯。
1.1.2 仪器
LB膜分析仪KN 2002,瑞典百欧林科技有限公司;原子力显微镜(AFM),Fast Scan with ScanAsyst,瑞典百欧林科技有限公司;小型布鲁斯特角显微镜(BAM),瑞典百欧林科技有限公司。
在各功率一定时,随着臭氧发生器出气流量的增大,臭氧的浓度随之减小,这主要是由于流量越小时,氧气在臭氧发生器里的停留时间就越久,有利于臭氧的产生,并且各曲线呈现出斜率相似的趋势,说明氧气的浓度与氧气在臭氧发生器的停留时间基本成正相关,但同时应考虑流量越小时,相同功率下反应器内的温度比更大的出气流量有所增高,会促进臭氧分解,因此,建议出气流量不低于30Nm3/h。与此同时,臭氧的产量却随着流量的增大而增大,这主要是由于出气流量在臭氧产量中所占比重更大,同时由于臭氧浓度与出气流量的变化曲线均为线性,因此,各臭氧产量随流量变化的曲线也呈现出线性关系。
1.2 实验方法
1.2.1 DEAE-琼脂糖制备
将1 g琼脂糖粉加入到50 mL水中,加热搅拌使其全部溶解。取6 mL热溶液于三角瓶中,加入等体积14%的NaOH溶液,同时加入1 mg NaBH4, 50℃摇床碱化40 min后加入2.06 g DEAE继续反应1 h,反应结束后,35℃透析至中性,冻干。
1.2.2 硅片的处理
将1 cm×1 cm的硅片用乙醇、丙酮和超纯水分别超声波清洗各5 min,以除去硅片表面的有机杂质和水溶性杂质。将清洗好的硅片浸泡在新配制“Piranha”溶液(98%硫酸与30%的H2O2体积配比7∶3)中2 h,温度为90℃,使硅片表面产生硅羟基端,然后用大量超纯水超声波清洗[20]。
1.2.3 LB膜制备
在室温下,亚相为超纯水,滴加300 μL DEAE-琼脂糖溶液(正丁醇,0.5 mg/mL),挥发1.5 h,压膜速率为5 mm/min。
1.2.4 LB膜提拉
1.2.5 原子力显微镜
沉积在硅片上的薄膜用原子力显微镜间接接触模式进行检测,范围由大到小进行扫描,图像由NanoScope Analysis软件进行处理。
2 结果与讨论
2.1 铺展溶剂的筛选
通过性质比较、实验测试,筛选不同的铺展溶剂,最终选取正丁醇为铺展溶剂。铺展溶剂的作用是使亚相上的分子随着铺展溶剂在亚相表面的扩展挥发,分子均匀分布在亚相表面。铺展溶剂应具有良好的挥发性和不溶于亚相这两个特性。常用的铺展溶剂有氯仿、甲醇等。然而,由于琼脂糖DEAE化之后增加了亲水性,不溶于氯仿等常用铺展溶剂,经过筛选后使用正丁醇作为铺展溶剂。正丁醇能溶解DEAE-琼脂糖,同时难溶于水,挥发性较好,符合铺展溶剂所需条件。考虑到正丁醇的挥发性远远不如氯仿等溶液,按照制备LB膜的方法仅在亚相上滴加正丁醇,获得其面积-表面压曲线,并与滴加DEAE-琼脂糖-正丁醇溶液的进行比较,结果见图1。从图1中可以看出,与DEAE-琼脂糖溶液的表面压-面积曲线相比,正丁醇在相同时间内表面压变化非常小,可以忽略不计,因而,正丁醇是一种适合DEAE-琼脂糖的铺展溶剂,经挥发后可使DEAE-琼脂糖均匀分布在亚相表面。
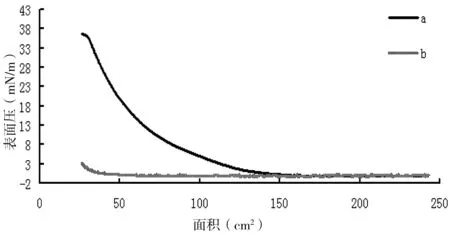
图1面积-表面压图像Fig 1 Surface pressure/area isotherm graph
a: 滴加DEAE-琼脂糖-正丁醇溶液;b:只滴加正丁醇 (a: DEAE-Agarosen-butyl alcohol solution; b:n-butyl alcohol)
2.2 朗格缪尔膜成膜过程
2.2.1 朗格缪尔膜表面压-面积图像

图2 DEAE-琼脂糖LB膜的表面压-面积曲线(0.5 mg/mL,300 μL)Fig 2 Surface pressure/area isotherm graph of DEAE-agarose (0.5 mg/mL,300 μL)
利用LB膜分析仪研究了DEAE-琼脂糖LB膜成膜面积-表面压图像,得出DEAE-琼脂糖LB膜的表面压-面积曲线(图2)。结果表明DEAE-琼脂糖LB膜制备成功。一般来说,朗格缪尔膜的形成过程中会出现气态、液态和固态这3种形态,成膜之后再压缩则会出现崩溃。从图2中可以看出,在DEAE琼脂糖成膜过程中,a点DEAE-琼脂糖溶液刚刚被滴加在亚相表面上,此时DEAE-琼脂糖分子间距较远,在亚相表面呈分散状态铺散开来,每个分子所占面积较大,分子呈气相状态,表面压几乎为零。经过一定的挥发时间后,滑障从b点开始缓缓压缩,随着滑障的压缩分子之间距离逐渐变小,每个分子所占面积随之变小,表面压开始缓缓上升,呈液相状态。滑障压缩一段时间后,DEAE-琼脂糖间距变得相对较小,开始由液态向固态转变,到达途中的c点。此时继续压缩,DEAE-琼脂糖分子间距快速减小,分子之间排列紧密,每个分子所占平均面积很小,表面压上升较快,基本形成固相状态的单分子膜。此时继续压缩,固相状态保持到d点时到达其崩溃压力,分子间距到达最小值,表面压升至最高,再压缩则会破坏所形成的固相单分子层,出现瞬间崩溃。经分析看出,DEAE-琼脂糖LB膜的成膜过程与其他材料成膜过程符合,是标准的朗格缪尔膜成膜过程,可为后续实验铺垫一定的基础。
2.2.2 不同浓度DEAE-琼脂糖朗格缪尔膜制备

图3 不同浓度DEAE-琼脂糖表面压-面积曲线Fig 3 Surface pressure/area isotherm graph of different concentrations
a:0.15 mg/mL;b:0.5 mg/mL;c:1.0 mg/mL
利用LB膜仪制备了不同浓度的DEAE-琼脂糖单分子膜,研究了其性质,图3为不同浓度DEAE-琼脂糖表面压-面积图像,结果表明成膜的最佳浓度为0.5 mg/mL。浓度为影响成膜条件的一个重要参数,通过对图像结果分析得知DEAE-琼脂糖朗格缪尔膜稳定性随着溶液浓度的增加先变大后减小。从图3中可以看出,溶液浓度为0.15 mg/mL时,表面压不断上升,没有达到稳定的固相状态,这种情况下没有形成可提拉的固相膜。直至浓度增加到0.5 mg/mL时,出现相对稳定的表面压,约为35~37 mN/m,在此区域内单分子膜为固相状态,性质稳定,易于将其提拉到基片上。之后再增加溶液浓度到1.0 mg/mL,相对稳定的固相区域没有出现,不能形成稳定可提拉的条件。对于此结果的产生可能有以下原因:当溶液的浓度很低时,在滴加量相同的条件下,所滴加在亚相上的分子数量较少,压缩到最后,分子间距变小,但由于分子数量有限,每个分子所占面积相对较大;提高溶液的浓度到一定范围,滴加在亚相上的分子数量变多,随着滑障的压缩分子之间不断靠拢,形成稳定的单分子层固相区域,再压缩直到分子间距到达临界状态,不能承受滑障压力,出现断裂堆层,固相区域瓦解崩溃,表面压迅速下降;此后再提高溶液的浓度,亚相上的分子数量过多,分子之间分散不完全,在压缩过程中可能出现堆层现象,不能形成稳定的固相区域。据此分析,制备DEAE-琼脂糖LB膜最佳浓度为0.5 mg/mL。
2.2.3 BAM结果
利用BAM研究了DEAE-琼脂糖单分子膜的成膜过程,图4为表面压为0 mN/m和34 mN/m的BAM图像结果。通过对BAM图像的观测,可以看出其成膜过程,确定其是否成膜。图4-a为DEAE-琼脂糖刚滴加在亚相上的BAM图像,分子被平铺在亚相表面,相对分散,呈气相状态,此时布鲁斯特角的折射不受表面分子影像,图像颜色较深,看不出分子的具体形态。待其挥发一定时间后,随着滑障的持续压缩,DEAE-琼脂糖由分散状态到聚集成膜,最后在亚相上形成相对稳定的固相区域。图4-b为固相状态下的DEAE-琼脂糖单分子膜,可以看出此时分子之间排列紧密,分子间距较小,已经形成固相状态。由于分子在亚相表面紧密排列形成了单分子层,改变了布鲁斯特角的折射,使得图像的颜色变浅。通过对表面压为0 mN/m和34 mN/m的BAM图像对比可以看出, DEAE-琼脂糖分子由一开始的分散状态到达最后稳定的固相状态,成功形成了稳定的便于提拉的单分子层。
2.3 DEAE琼脂糖朗格缪尔膜表面电势
利用表面电势分析仪研究了不同配基密度对LB膜表面电势的影响,图5为不同配基密度DEAE-琼脂糖LB膜表面电势图像。结果表明随着配基密度的增加其表面电势不断增加,LB膜性质越稳定。

图4 表面压为0 mN/m和34 mN/m的BAM图像Fig 4 BAM images ( 0 mN/m and 34 mN/m)
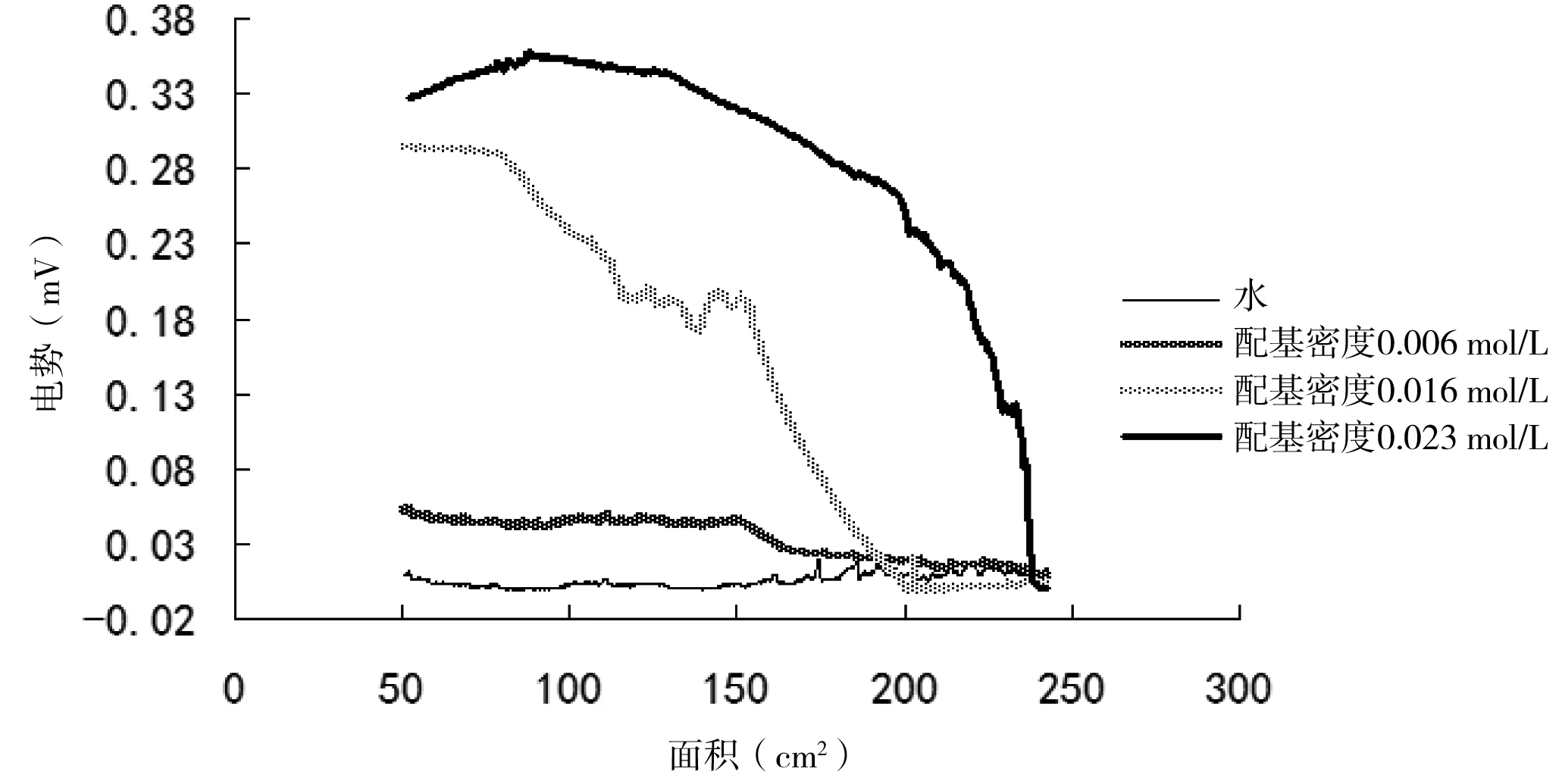
图5 不同配基密度DEAE-琼脂糖LB膜表面电势Fig 5 Surface potential image under different ligand densities
表面电势的测定可以看出不溶膜是否均匀以及其性质是否稳定。亚相表面有不性溶膜的存在,这便会引起水面上电势的变化,因而固-液表面成膜前后有电势差ΔV生成。成膜分子刚滴加在亚相上时,分子之间间隔相对较大,表面电势相对较小;随着划障的不断压缩,分子越来越聚集,每个分子带有一定的电荷数,相同检测面积下表面电势随着分子的增多逐渐增大;之后亚相上的分子被压缩到一定程度时会形成稳定的单分子层,此时分子之间距离非常小,且趋于稳定状态,电势差不发生很大变化。从图5可以看出,在配基密度非常小的时候,每个分子所带的电荷数较小,在压缩过程中产生的电势差非常小,基本可以忽略不计。但将配基密度增大,随着滑障的压缩,DEAE琼脂糖单分子层排列越紧密,产生了一定的电势差,在到达固相区域后相对稳定。随着配基密度的增加,DEAE-琼脂糖所带的配基增多,每个分子所带的电荷数增多,随着滑障压缩到一定区域,在相同检测面积下总的分子量不变但电荷数增多,使得电势差变大,进而表面电势变大。随着配基密度的增大,单分子膜性质越来越稳定。
2.4 LB膜的AFM表征
利用AFM对DEAE-琼脂糖LB膜性质进行研究。图6为空白硅片与DEAE-琼脂糖LB膜的AFM 3D图像,结果表明制备的DEAE-琼脂糖LB膜性质较好。从AFM图像中可以直观看出其表面形貌,如若其表面相对平坦,无孔存在,厚度相对均匀,则可表明其制备成功。图6-a为空白硅片的AFM图像,硅片清洗后表面洁净,观测不到杂质存在。除此之外,空白硅片表面平整,厚度约为1.3 nm,可以作为DEAE-琼脂糖LB膜提拉的基片。采用垂直提拉法将DEAE-琼脂糖LB膜转移到干净硅片上,进行AFM检测,扫描范围由大到小。通过图6-b可以看出,转移到硅片上的单分子层呈平铺状态,分子分散均匀,膜的表面相对平坦,观察不到有孔存在,厚度相对均匀。通过空白硅片的高度约为1.3 nm,膜沉积后的硅片高度为9.2 nm,可以估算出DEAE-琼脂糖LB膜的厚度约为7.9 nm。这与之前报道的纳米微晶纤维素LB膜的厚度是7.2 nm相符合[21]。通过软件测得DEAE-琼脂糖LB膜表面粗糙度Ra(轮廓算术平均偏差)为2 nm,表明膜的表面虽不完全平坦,但相对均匀。通过以上分析可以得出,DEAE-琼脂糖LB膜制备成功,性质稳定并且被成功转移到硅片上。

图6 空白硅片(2 μm×2 μm)与DEAE琼脂糖LB膜 (6 μm×6 μm)AFM 3D图像Fig 6 AFM 3D images of blank silicon wafer(2 μm×2 μm)and DEAE-agarose LB film(6 μm×6 μm)
3 结论
DEAE-琼脂糖作为一种新型LB膜材料,可应用于生物大分子性能研究、药物制剂改良、新型生物功能器件研发等多个方面。为了制备新型的DEAE-琼脂糖LB膜,筛选了正丁醇作为铺展溶剂,使得琼脂糖能够在亚相上铺展,具备形成LB膜的基本条件;发现DEAE-琼脂糖朗格缪尔膜成膜过程与标准成膜过程相符合;确定了DEAE-琼脂糖朗格缪尔膜的最佳成膜浓度为0.5 mg/mL。采用BAM观测,可以看出分子之间排列紧密,形成一层不溶性薄膜;发现随着DEAE配基密度的增加,其表面电势逐渐增加。将DEAE-琼脂糖LB膜提拉到硅片上利用AFM对其进行表征,观察到分子之间排列紧密,表面粗糙度Ra为2 nm,估算出其厚度约为7.9 nm。以上结果表明,成功制备出性质稳定的DEAE-琼脂糖LB膜。
[1]张俊苓, 杨 芳, 郑文杰, 等.自组装单分子膜及其表征方法[J]. 化学进展, 2005, 17(2):203-208.
[2]张一芳. 基于纳米材料的生物传感技术在食品安全中的应用[D]. 长沙:湖南大学, 2011.
[3]马翠翠. 基于紫外光降解自组装单分子层的纸芯片研制及其应用研究[D]. 杭州:浙江大学, 2013.
[4]齐 平. 卟啉LB膜的制备和性能研究[D]. 长春:吉林大学, 2013.
[5]ZOU L, LI Y, CAO S, et al. Gold nanoparticles/polyaniline Langmuir-Blodgett Film modified glassy carbon electrode as voltammetric sensor for detection of epinephrine and uric acid[J]. Talanta, 2013, 117: 333-337.
[6]LEE J H, KANG W S, NAJEEB C K, et al. A hydrogen gas sensor using single-walled carbon nanotube Langmuir Blodgett films decorated with palladium nanoparticles[J]. Sensors and Actuators B: Chemical, 2013, 188:169-175.
[7]白 桦. 运用LB技术构筑有机半导体超薄膜[D]. 甘肃:兰州大学, 2009.
[8]GURFIDAN L, OZMEN M, ATACAN K, et al. Preparation and characterization of calix[6]arene Langmuir-Blodgett thin film[J]. Thin Solid Films, 2012, 520(19): 6238-6242.
[9]PARK Y H, JANGA J I, KIM K H, et al. Preparation and characterization of electroconductive poly(thiophene-co-pyrrolylundecanoic acid) Langmuir Blodgett films[J]. Thin Solid Films, 2005, 489(1-2): 215-220.
[10]CHEN Q, XU S, LIANG X, et al. Network structure of collagen layers absorbed on LB film[J]. Journal of Colloid and Interface Science, 2007, 316(1): 1-9.
[11]汪建中, 李艳如, 龚华锐. 平菇菌粗多糖的抗氧化活性研究[J]. 生物学杂志, 2014, 31(1):15-19.
[12]安晓娟, 冯 琳, 宋红平, 等. 淫羊藿多糖的分离纯化及结构初步分析[J]. 生物学杂志, 2012, 29(3):39-41.
[13]QING W X, WANG Y, WANG Y Y, et al. The modified nanocrystalline cellulose for hydrophobic drug delivery[J]. Applied Surface Science, 2016, 366:404-409.
[14]KONG B J, KIM A, PARK S N, et al. Properties and in vitro drug release of hyaluronic acid-hydroxyethyl cellulose hydrogels for transdermal delivery of isoliquiritigenin[J]. Carbohydrate Polymers, 2016, 147:473-481.
[15]TANG Y D, LIU J M, CHEN Y. Agarose multi-wells for tumour spheroid formation and anti-cancer drug test[J]. Microelectronic Engineering, 2016, 158:41-45.
[16]李 龙. 龙须菜琼脂糖的提取技术研究[D]. 福州:福建农林大学, 2013.
[17]吴 钢. 低熔点琼脂糖的改性与制备技术研究[D]. 福州:福建农林大学, 2014.
[18]苏永昌, 李 龙, 刘淑集, 等. 响应面法优化琼脂糖的DEAE-纤维素法提取工艺[J]. 食品工业科技, 2014, 35 (24):234-238.
[19]IFUKU S, NAKAI S, KAMITAKAHARA H, et al. Preparation and characterization of monolayer and multilayer Langmuir-Blodgett films of a series of 6-O-alkylcelluloses[J]. Biomacromolecules, 2005, 6 (4): 2067-2073.
[20]杨小雁. 离子交换配基密度对蛋白质吸附行为的影响[D]. 泰安:山东农业大学, 2015.
[21]HABIBI Y, FOULON L, AGUIé-BéGHIN V, et al. Langmuir-Blodgett films of cellulose nanocrystals: preparation and characterization[J]. Journal of Colloid and Interface Science, 2007, 316(2):388-397.
Preparation and characterization of DEAE-agarose Langmuir-Blodgett films
LI Wen-lu1, KONG Ying-jun2, KANG Ji-yao2, GAO Jian-ping2,ZHANG Gui-feng2, WANG Ming-lin1
(1. College of Food Science and Engineering, Shandong Agricultural University, Taian 271018;2. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, CAS, Beijing 100190, China)
Diethylaminoethyl(DEAE)-Agarose was studied for preparing monolayers based on the Langmuir-Blodgett(LB) film technology. A high collapse pressure and a standard film forming process were found in the surface pressure (π)-area (A) isotherm of DEAE-Agarose. The effect of DEAE-Agarose concentration on the film formation showed that 0.5 mg/mL was the best. The surface potential increased with rise of the ligand density. DEAE-Agarose LB films were characterized with Brewster angle microscopy (BAM) and atomic force microscope (AFM) after being transferred onto silicon surface. The morphology of the film was pretty compact, well structured, and relatively smooth. The thickness was about 7.9 nm and the roughness was about 2 nm. This result indicated that the DEAE-Agarose LB film was successfully prepared and could be an novel material for the fabrication of LB films.
DEAE-Agarose; Langmuir-Blodgett film; atomic force microscope; Brewster angle microscopy; surface potential
2016-04-19;
2016-05-25
国家自然科学基金(21306205);广东省自然科学基金(2014A030312013)
李雯露,硕士,研究方向为蛋白层析研究,E-mail:18510556639@163.com
张贵锋,博士,项目研究员,研究方向为蛋白分析检验,E-mail:gfzhang@ipe.ac.cn;王明林,博士,教授,研究方向为蛋白研究,E-mail:mlwang@sdau.edu.cn
S245.9; TB383.2
B
2095-1736(2017)01-0089-05
doi∶10.3969/j.issn.2095-1736.2017.01.089

