姜黄素对脑缺血再灌注损伤大鼠PI3K/AKT/mTOR的影响*
兰 晶,潘敬芳
(宜昌市中心人民医院/三峡大学第一临床医学院神经内科,宜昌湖北 443000)
姜黄素对脑缺血再灌注损伤大鼠PI3K/AKT/mTOR的影响*
兰 晶,潘敬芳
(宜昌市中心人民医院/三峡大学第一临床医学院神经内科,宜昌湖北 443000)
目的 探讨姜黄素对大鼠脑缺血再灌注损伤的作用及机制。方法 通过线栓法构建大鼠脑缺血再灌注损伤模型。评估姜黄素对大鼠脑梗死范围、脑含水量、神经症状、脑组织病理形态,以及磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(AKT)、磷酸化蛋白激酶B(p-AKT)、雷帕霉素靶蛋白(mTOR)、丙二醛(MDA)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、超氧化物歧化酶(SOD)、B细胞淋巴因子2(Bcl-2)、Bcl-2相关X蛋白(Bax)、半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)、活化性半胱胺酸天冬氨酸蛋白水解酶3(Cleavage-Caspase-3)的表达影响。结果 姜黄素对脑缺血再灌注损伤有保护作用,其可以减轻大鼠神经症状和脑组织病理形态的改变,以及脑梗死面积和脑含水量。此外,姜黄素还可以减轻MDA、Bax、Cleavage-Caspase-3、促炎症细胞因子IL-6、MCP-1和TNF-α的表达,增加PI3K、p-AKT、mTOR、Bcl-2、Caspase-3、CAT、GPX与SOD表达。结论 姜黄素预处理对脑缺血再灌注有明显保护作用,该作用可能与激活PI3K/AKT/mTOR信号通路激活而抑制炎症,凋亡和氧化应激相关。
姜黄素;脑缺血;再灌注损伤;炎症;凋亡;氧化应激;PI3K/AKT/mTOR
脑缺血再灌注损伤是脑血供中断后,重新恢复大脑血供导致脑损伤反而加重的临床危象,是人类致死和致残的重要原因,仅次于心脏疾病和癌症。因此,减轻脑缺血再灌注损伤具有重要的临床现实意义。其发病机制复杂,具体机制尚不清楚[1-3]。目前研究显示其发病机制可能为脑供血中断,导致脑组织细胞缺血、缺氧,诱发炎症、细胞凋亡和氧化自由基的产生,而恢复血供后进一步诱发炎症级联反应、细胞凋亡及氧自由基,因此抑制炎症、凋亡和氧化应激是减轻脑缺血再灌注损伤的有效途径[1-3]。姜黄素(curcumin)是从姜科姜黄属植物如姜黄、莪术、郁金的干燥根茎中提取的一种天然有效成分,最近研究发现其有抗氧化、抗凋亡和抗炎的活性[4-8],而炎症、细胞凋亡和氧化应激是脑缺血再灌注损伤的重要致病机制[1-3]。本实验利用大鼠构建脑缺血再灌注损伤模型,探讨姜黄素对脑缺血再灌注损伤后的作用及其潜在机制。
1 材料与方法
1.1 材料 姜黄素(Sigma公司,USA)经HPLC鉴定纯度超过99%,用含6%(体积分数)的乙醇和6%(体积分数)聚乙二醇稀释,水合氯醛(Google生物)。磷脂酰肌醇3-激酶(PI3Ks,CST公司,USA),磷酸化蛋白激酶B(p-AKT,CST公司,USA),蛋白激酶B(AKT,CST公司,USA),雷帕霉素靶蛋白(mTOR,CST公司,USA),B细胞淋巴因子2(Bcl-2,CST公司,USA),Bcl-2相关X蛋白(Bax,CST公司,USA),半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3,CST公司,USA),活化性半胱胺酸天冬氨酸蛋白水解酶3(Cleavage-Caspase-3,CST公司,USA),三氨基甲烷(TRIzol)试剂(Invitrogen公司,USA),逆转录试剂盒(GeneCopoeia公司,USA),双链嵌合荧光染色SYBR green(Takara公司,Japan),实时聚合酶链反应(RT-PCR)引物(擎科生物技术有限公司,订单号SY14032221),苏木素-伊红染色(HE)试剂由三峡大学中心实验室配制。紫外分光光度计(Thermo fisher)、逆转录仪(eppendorf)、RT-PCR仪(BIO-RAD IQ5)、显微镜(Olympus BX51)及成像系统(HITMAS-30)均为潍坊医学院提供。SD大鼠购自北京华福康实验动物中心,SPF级,质量合格证号420131024,饲养于三峡大学动物实验中心,许可证号SYXK(20130145),设施使用证明号00134727。
1.2 方法
1.2.1 动物模型的建立与分组 50只健康雄性SD大鼠,2月龄,体质量250~280克。适应性喂养1周后,状态良好,分为假手术组(Sham组),模型组(IRI组)和姜黄素组(Cur组),每组10只。Cur组术前30 min给予姜黄素25、50、100 mg/kg腹腔注射,剂量参考文献[9]。Sham组和IRI组则给予等体积腹腔注射生理盐水,Sham组只分离动脉不插线;模型组和Cur组方法建立大脑中动脉闭塞再灌注(middle cerebral artery occlusion,MCAO)模型,具体方法参考文献[9],手术过程顺利,无死亡动物,术后各组单笼喂养,自由进食、饮水。
1.2.2 神经症状评分、脑梗死范围及脑含水量测定 大鼠脑缺血再灌注24 h后,按文献[9]制订的5分制标准进行评分。0分:正常,无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向外侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失。大鼠脑缺血再灌注损伤24 h后,快速断头取脑,-20 ℃速冻30 min,去除嗅球、小脑和低位脑干,脑组织从额极向后做连续冠状切成5片,将脑片置入37 ℃ 2,3,5-三苯基氯化四氮唑(TTC)染料中温浴 30 min。染色结果白色为梗死灶,红色为正常脑组织。数码相机拍照,应用图像分析系统测量脑梗死面积并计算脑梗死体积占大脑总体积的百分比。大鼠脑缺血再灌注损伤 24 h 后将大鼠断头,去掉嗅球、小脑和低位脑干,称取大脑湿质量,107 ℃烘烤72 h后称取干质量。脑含水量(%)= (湿质量-干质量)/湿质量×100%。
1.2.3 脑组织病理组织学检查 脑组织置于4%多聚甲醛液4 ℃后固定1周。依次脱水、透明、浸蜡及包埋,行厚 8 μm 冠状切片,常规HE染色、封片,光镜下观察,损伤评分参考文献[9]。
1.2.4 Western blot检测 取脑组织于精微天平称质量,按照每50 mg组织中加入1 mL RIPA裂解液(以1∶50加入50×cocktail),检测脑组织PI3K(1∶2 000),p-AKT(1∶1 000),AKT(1∶1 000),mTOR(1∶500),Bax(1∶500),BCL-2(1∶500),Caspase-3(1∶500),Cleavage-Caspase-3(1∶500),β-actin(1∶3 000)表达,具体方法参考文献[10]。
1.2.5 RT-PCR检测脑组织中巨噬细胞炎症因子1(MCP-1)、白细胞介素6(IL-6)和肿瘤坏死因子(TNF-α)的mRNA表达 称取适量脑组织,置入1.5 mL EP管中,利用 TRIzol 法提取总 RNA,紫外分光光度计测定RNA水平。采用 TaqMan Reverse Transcription Reagents 试剂盒, 将mRNA反转录成cDNA。取反转录产物采用 Power SYBR Green PCR Master Mix 试剂盒进行RT-PCR反应。PCR以β-actin为内参,具体方法参考文献[9]。取缺血侧大脑皮层,所用特异性引物为擎科生物技术有限公司合成。TNF-α引物大小为75 bp,上游引物:5′-GCC TCG TCT CAT AGA CAA GAT GGT-3′;下游引物:5′-GAA GGC AGC CCT GGT AAC C-3′。MCP-1引物大小为143 bp,上游引物:5′-TCT CGC CCA GGG AGT GCA AAG AGA G-3′;下游引物:5′-TAT CGC CAA GGG AAC ATC TCG AAG CG-3′。IL-6引物大小为84 bp,上游引物:5′-CTG CAA GAG ACT TCC ATC CAG-3′;下游引物5′-AGT GGT ATA GAC AGG TCT GTT GG-3′。β-actin引物大小为610 bp,上游引物:5′-AGA GGG AAA TCG TGC GTG AC-3′;下游引物:5′-CAA TAG TGA TGA CCT GGC CGT-3′。扩增条件为:95 ℃(10 min)→95 ℃(10 s)→60 ℃(1 min)×40个循环,利用图像分析仪器上进行扫描分析,将IL-6、MCP-1和TNF-α基因扩增产物的密度与β-actin基因扩增产物的密度之比作为IL-6、MCP-1和TNF-α基因表达值。
1.2.6 酶联免疫吸附测定(ELISA)检测血清中IL-6、MCP-1和TNF-α表达水平 按照ELISA试剂盒说明书操作步骤检测血清中IL-6、MCP-1和TNF-α表达水平。
1.2.7 测定脑组织匀浆中指标水平 按照ELISA试剂盒说明书测定脑组织匀浆中脑组织中丙二醛(MDA)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)和超氧化物歧化酶(SOD)水平,具体步骤按试剂盒说明书进行。

2 结 果
2.1 姜黄素对大鼠神经症状,脑梗面积和脑含水量的影响 与Sham组相比,IRI组神经行为缺陷,脑梗死面积和脑含水量均明显增加(P<0.05),而Cur(低、中、高剂量)组与IRI组相比,神经行为缺陷,脑梗死面积和脑含水量均明显降低(P<0.05),见表1。姜黄素100mg/kg可得到最佳保护效果。

表1 姜黄素对脑梗死、脑水肿和神经功能缺损的影响
a:P<0.05,与Sham组比较;b:P<0.05,与IRI组比较。
2.2 姜黄素对脑组织病理结构的影响 与Sham组相比,IRI组神经元细胞损伤,固缩核和神经元染色均明显增加(P<0.05),其损伤评分分别为IRI组(4.0±0.5)分,而Sham组(0.5±0.5)分。与IRI组相比,Cur组神经元细胞损伤,固缩核和神经元染色均明显降低(P<0.05),其损伤评分为(1.5±0.5)分,见图1。

*:P<0.05,与Sham组比较;#:P<0.05,与IRI组比较。
图1 姜黄素预处理对脑组织病理结构的影响(×400)
2.3 姜黄素对PI3K、AKT、p-AKT、m-TOR蛋白表达的影响 与Sham组相比,IRI组PI3K,p-AKT和mTOR表达均明显增高(P<0.05),但AKT表达差异无统计学意义(P>0.05)。与IRI组相比,Cur组PI3K,p-AKT和mTOR表达均进一步增加(P<0.05), 而AKT表达差异无统计学意义(P>0.05),见图2、表2。
2.4 姜黄素对脑组织促炎症细胞因子IL-6、MCP-1和TNF-αmRNA的表达影响 与Sham组相比,IRI组促炎症细胞因子IL-6、MCP-1和TNF-αmRNA表达水平均明显增高(P<0.05) ,而Cur组与IRI组相比,促炎症细胞因子IL-6、MCP-1和TNF-αmRNA表达水平均明显降低(P<0.05),见表3。
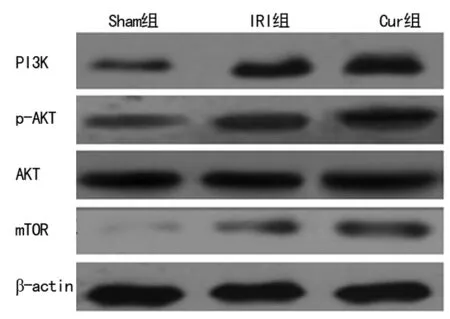
图2 WB检测姜黄素预处理对PI3K、p-AKT、AKT和mTOR 蛋白表达的影响

组别PI3K/β-actinp-AKT/AKTmTOR/β-actinSham组0.12±0.030.16±0.030.07±0.02IRI组0.41±0.03a0.55±0.03a0.36±0.04aCur组0.78±0.04ab0.87±0.04ab0.54±0.04ab
a:P<0.05,与Sham组比较;b:P<0.05,与IRI组比较。

表3 姜黄素对IL-6 、MCP-1和TNF-α mRNA表达水平的影响
a:P<0.05,与Sham组比较;b:P<0.05,与IRI组比较。
2.5 姜黄素对血清中促炎症细胞因子IL-6、MCP-1和TNF-α的表达影响 与Sham组相比,IRI组促炎症细胞因子IL-6、MCP-1和TNF-α表达水平均明显增高(P<0.05),而Cur组与IRI组相比,促炎症细胞因子IL-6水平增高,MCP-1和TNF-α表达水平均明显降低(P<0.05),见表4。

表4 姜黄素对血清中IL-6 、MCP-1和TNF-α表达影响
a:P<0.05,与Sham组比较;b:P<0.05,与IRI组比较。
2.6 姜黄素对CAT、GPx、SOD和MDA表达影响 与Sham组相比,IRI组CAT、GPx和SOD表达明显降低(P<0.05),而MDA表达增高(P<0.05);Cur组与IRI组相比,CAT、GPx和SOD的表达均明显增高(P<0.05),而MDA表达降低(P<0.05),见表5。
2.7 姜黄素对脑组织Caspase3、Cleavage-Caspase-3、Bax和BCL-2表达影响 与Sham组相比,IRI组Cleavage-Caspase-3和Bax表达明显增高(P<0.05),而Caspase-3和Bcl-2表达明显降低(P<0.05)。Cur组与IRI组相比,Cleavage-Caspase-3和Bax表达明显降低(P<0.05),而Caspase-3和Bcl-2表达明显增高(P<0.05),见图3、表6。

表5 姜黄素对CAT、GPx、SOD和MDA表达影响
a:P<0.05,与Sham组比较;b:P<0.05,与IRI组比较。

图3 WB检测姜黄素预处理对Cleavage-Caspase-3、Caspase-3、Bax和Bcl-2蛋白表达的影响

组别Caspase-3/β-actinCleavage-Caspase-3/β-actinBax/β-actinBcl-2/β-actinSham组0.83±0.050.12±0.030.13±0.020.57±0.04IRI组0.45±0.03a0.55±0.04a0.68±0.05a0.25±0.02aCur组0.62±0.03b0.23±0.04b0.33±0.04b0.42±0.03b
a:P<0.05,与Sham组比较;b:P<0.05,与IRI组比较。
3 讨 论
脑缺血再灌注损伤既往常好发于脑外,休克等过程中的危重症,但随着心脏体外大循环手术,心脏移植等多种心血管外科手术的广泛开展,其发病率越发增高,已成为诱发脑梗的重要原因,目前已经严重威胁到人类的身心健康[1-3]。目前尚无有效的干预手段,因而要寻找新的药物减轻脑缺血再灌注损伤至关重要。既往研究提示脑缺血再灌注损伤的发病机制涉及炎症、凋亡、氧化应激、坏死、自噬等[1-3]。本研究发现脑缺血再灌注损伤可上调促炎症细胞因子IL-6、MCP-1和TNF-α表达,增加促凋亡蛋白Cleavage-Caspase-3Bax和促氧化应激产物MDA表达,减少抗凋亡蛋白Caspase-3和Bcl-2表达,以及下调抗氧化应激产物CAT,GPx和SOD表达,这与既往研究结果一致,进一步证实了炎症、凋亡和氧化应激在脑缺血再灌注损伤中扮演重要角色[1-3],因此,抑制炎症,凋亡和氧化应激是减轻脑缺血再灌注损伤的有效途径。
姜黄素是从姜科植物中提取的一种小相对分子质量的多酚类物质,是姜黄的主要活性成分,大约占姜黄的2%~8%。既往大量研究表明,姜黄素具有清除自由基、抗氧化、抗真菌、抗炎、抗凋亡、抗癌,以及改善心血管系统等生物学活性[4-8]。对心脏、肝脏等器官缺血再灌注损伤具有保护作用,但对脑缺血再灌注损伤的作用及机制尚不清楚[10-12]。本研究发现姜黄素对脑缺血再灌注损伤有保护作用,可减少促炎症细胞因子IL-6、MCP-1和TNF-α表达,下调促凋亡蛋白Cleavage-Caspase-3和Bax及促氧化应激产物MDA的表达,而增加凋亡蛋白Caspase-3和Bcl-2,上调抗氧化应激产物CAT,GPx和SOD的表达。这显示姜黄素可通过抗炎、抗凋亡和抗氧化应激途径而减轻脑缺血再灌注损伤。但姜黄素在脑缺血再灌注损伤中抑制炎症,凋亡和氧化应激的具体机制不清。
mTOR是一种进化上相对保守的丝氨酸/苏氨酸蛋白激酶,是AKT下游的一个重要靶点,可通过磷酸化其下游的靶蛋白,参与基因的转录和蛋白的表达, 进而影响炎症、氧化应激、自噬、凋亡等生物学活动[13]。其激活途径为细胞内外因子通过受体酪氨酸激酶激活PI3K,活化的PI3K在PDK1的协同下磷酸化AKT。活化的AKT磷酸化TSC2, 而磷酸化的TSC2可通过负向调节使Rheb从TSC1/TSC2复合物中解聚,从而使Rheb活性增强,进而激活mTOR[12-14]。本研究发现脑缺血再灌注损伤可增加PI3K、p-AKT和mTOR的表达,而姜黄素可进一步增加PI3K、p-AKT和mTOR的表达,这提示姜黄素可进一步增加PI3K/AKT/mTOR信号途径的活性,其调节为正向调节。
综上所述,姜黄素可通过进一步促进PI3K/AKT/mTOR信号通路激活而减轻炎症、凋亡和氧化应激,进而减轻脑缺血再灌注损伤。但是姜黄素是直接作用于PI3K信号分子还是通过调节其上游激酶和(或)信号分子而间接发挥作用仍不清楚,除PI3K/AKT/mTOR信号通路外,是否还有其他信号通路涉及姜黄素抑制炎症、凋亡和氧化应激,尚需进一步更深入的研究。
[1]LiuJ,LiJ,YangY,etal.Neuronalapoptosisincerebralischemia/reperfusionareafollowingelectricalstimulationoffastigialnucleus[J].NeuralRegenRes,2014,9(7):727-734.
[2]ZhangX,YanH,YuanY,etal.Cerebralischemia-reperfusion-inducedautophagyprotectsagainstneuronalinjurybymitochondrialclearance[J].Autophagy,2013,9(9):1321-1333.
[3]GaoHJ,LiuPF,LiPW,etal.Ligustrazinemonomeragainstcerebralischemia/reperfusioninjury[J].NeuralRegenRes,2015,10(5):832-840.
[4]GibelliniL,BianchiniE,DeBiasiS,etal.Naturalcompoundsmodulatingmitochondrialfunctions[J].EvidBasedComplementAlternatMed,2015:527209.
[5]FiorentiniD,ZamboninL,DallaSegaFV,etal.Polyphenolsasmodulatorsofaquaporinfamilyinhealthanddisease[J].OxidMedCellLongev,2015:196914.
[6]MahmoodK,ZiaKM,ZuberM,etal.Recentdevelopmentsincurcuminandcurcuminbasedpolymericmaterialsforbiomedicalapplications:areview[J].IntJBiolMacromol,2015,81(15):877-890.
[7]GhoshS,BanerjeeS,SilPC.Thebeneficialroleofcurcuminoninflammation,diabetesandneurodegenerativedisease:arecentupdate[J].FoodChemToxicol,2015(83):111-124.
[8]ShanmugamMK,RaneG,KanchiMM,etal.Themultifacetedroleofcurcuminincancerpreventionandtreatment[J].Molecules,2015,20(2):2728-2769.
[9]LiuL,ZhangW,WangL,etal.Curcuminpreventscerebralischemiareperfusioninjuryviaincreaseofmitochondrialbiogenesis[J].NeurochemRes,2014,39(7):1322-1331.
[10]LiW,WuM,TangL,etal.Novelcurcuminanalogue14pprotectsagainstmyocardialischemiareperfusioninjurythroughNrf2-activatinganti-oxidativeactivity[J].ToxicolApplPharmacol,2015,282(2):175-183.
[11]FanZ,JingH,YaoJ,etal.Theprotectiveeffectsofcurcuminonexperimentalacuteliverlesioninducedbyintestinalischemia-reperfusionthroughinhibitingthepathwayofNF-κBinaratmodel[J].OxidMedCellLongev,2014:191624.
[12]WuNC,WangJJ.Curcuminattenuatesliverwarmischemiaandreperfusion-inducedcombinedrestrictiveandobstructivelungdiseasebyreducingmatrixmetalloprotease9activity[J].TransplantProc,2014,46(4):1135-1138.
[13]BockaertJ,MarinP.mTORinbrainphysiologyandpathologies[J].PhysiolRev,2015,95(4):1157-1187.
[14]LataczA,RussellJA,OconE,etal.mTORpathway-novelmodulatorofastrocyteactivity[J].FoliaBiol(Krakow),2015,63(2):95-105.
Effect of curcumin on PI3K/AKT /mTOR in rats with cerebral ischemia-reperfusion injury*
LanJin,PanJingfang
(DepartmentofNeurology,YichangMunicipalCentralPeople′sHospital/FirstCollegeofClinicalMedicalScience,ThreeGorgesUniversity,Yichang,Hubei443000,China)
Objective To explore the effect and mechanism of curcumin on rat cerebral ischemia reperfusion injury.Methods The rat model of cerebral ischemia reperfusion injury was constructed by the suture-occluded method.The effects of curcumin on cerebral infarction range,cerebral water content,neurological symptoms,cerebral histopathological morphology and expressions of PI3K,AKT,p-AKT,m-TOR,MDA,CAT,GPX,SOD,Bcl-2,Bax,Caspase-3 and Cleavage-Caspase-3 were evaluated.Results Curcumin had the protective effect on cerebral ischemia reperfusion injury,could alleviate the neurological symptoms,decreased the cerebral tissue pathological morphological changes and cerebral water content,in addition,which could alleviate the expressions of MDA,Bax,Cleavage-Caspase-3,IL-6,MCP-1 and TNF-α and increased the expressions of PI3K,p-AKT,mTOR,Bcl-2,Caspase-3,CAT,GPX and SOD.Conclusion The curcumin pretreatment has the significantly protective effect on cerebral ischemia-reperfusion injury,which may be associated with activating PI3K/AKT /mTOR signal pathway,while suppressing inflammation,apoptosis and oxidative stress.
curcumin;brain ischemia;reperfusion injury;inflammation;apoptosis;oxidative stress;PI3K/AKT/mTOR
��·基础研究
10.3969/j.issn.1671-8348.2017.01.006
湖北省宜昌市科技基金资助项目(A11301-05)。
兰晶(1979-),主治医师,硕士,从事脑缺血再灌注损伤方面研究。
R285.5
A
1671-8348(2017)01-0036-04
2016-07-18
2016-09-08)

