小鼠垂体中叶素对异丙肾上腺素诱导的小鼠心脏肥大的保护作用研究*
曾 慧,吴 丹,王 雪,陈华黎,傅 荣,蒋 维△
(1.四川省人民医院感染内科,成都 610071;2.四川大学华西医院分子医学研究中心,成都 610041)
小鼠垂体中叶素对异丙肾上腺素诱导的小鼠心脏肥大的保护作用研究*
曾 慧1,2,吴 丹2,王 雪2,陈华黎2,傅 荣1,蒋 维2△
(1.四川省人民医院感染内科,成都 610071;2.四川大学华西医院分子医学研究中心,成都 610041)
目的 利用异丙肾上腺素(ISO)诱导的小鼠心脏肥大模型研究小鼠垂体中叶素(IMD)拮抗心脏肥大的药理学作用和机制。方法 建立小剂量ISO皮下注射诱导心脏肥大的小鼠模型,研究IMD给药后的小鼠血流动力学指标和心质量/体质量比,然后利用心脏组织切片评价心肌细胞横截面积、凋亡和纤维化。采用荧光实时定量PCR法检测心脏组织的心钠素(ANP)、脑钠肽(BNP)、内源性IMD及其受体系统的mRNA表达水平。结果 与ISO诱导的小鼠心脏肥大模型组相比较,腹腔注射IMD治疗明显降低ISO处理所增加的心质量/体质量比和心肌细胞横截面积、心脏肥大标志物ANP及BNP的mRNA水平,以及心肌细胞凋亡率和心肌组织纤维化率。同时,改善心脏功能,左室压力、等容收缩期左心室内压力上升的最大和下降的最小速率、每搏排血量、心输出量和射血分数明显增加,而左心室舒张末期压力显著降低。此外,ISO处理明显诱导心脏组织内源性IMD及其受体的表达。结论 ISO诱导心脏组织内源性IMD及其受体的表达,外源性给与IMD治疗可能通过ISO活化的IMD受体系统实现其拮抗心脏肥大的药理学保护作用。
异丙肾上腺素;心脏扩大;垂体;垂体中叶素;Intermedin受体系统
心脏肥大是心脏对各种病理性肥大刺激的代偿反应,许多心血管疾病如高血压、瓣膜病、心肌梗死和先天性心脏病等都伴有心脏肥大,因此心脏肥大是心脏病发病和死亡的重要危险因素[1-2]。心脏肥大发生机制极其复杂[1-3],其中,心肌组织局部旁/自分泌网络的失衡和内源性细胞因子活化是其主要特征,这些活化的心血管活性因子对维持心肌功能具有重要的作用,对肥大刺激具有防御作用[4-5]。目前,研究和开发这些自分泌/旁分泌因子的药理激动剂或拮抗剂是当前心脏肥大疾病防治的重要手段和方向[4-6]。
垂体中叶素(intermedin,IMD)是降钙素基因相关肽(calcitonin gene-related peptide,CGRP)家族新成员,广泛分布于心血管系统,是外周循环重要的生理调节因子,可舒张体、肺循环血管,增强心肌收缩力,增加肾血流和钠盐排出[7-8]。多种心血管疾病状态下,内源性IMD及其受体水平明显增加,以旁/自分泌形式保护器官损伤[7]。CGRP家族成员CGPR和肾上腺髓质素(adrenomedullin,ADM)具有明显拮抗心脏肥大的药理学效应[7-9]。IMD的生物学效应和ADM相似,并与CGRP和ADM共用相同的受体系统,即由降钙素受体样受体(calcitonin receptor like receptor,CRLR)与受体活化修饰蛋白(receptor activity modifying proteins,RAMPs)共同构成的受体复合体[9]。已有报道表明,IMD可保护心肌细胞拮抗氧化应激[7]和促肥大因子血管紧张素Ⅱ的刺激[8],提示作为一个内源性反应调节肽,IMD具有很强的心血管系统保护作用[7-9]。但目前尚不清楚IMD能否拮抗交感神经递质活化肾上腺素受体所诱导的心脏肥大疾病[7-8]。
本研究拟利用小剂量盐酸异丙肾上腺素(isoproterenol,ISO)持续给药建立心脏肥大模型,研究心肌组织的内源性IMD及其受体系统在肥大过程中的变化,给予外源性IMD保护心脏肥大的药理学作用及机制,为临床心脏肥大疾病的防治提供新的理论依据和治疗策略。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性 C57小鼠27只,8周龄,体质量18~22 g,购自四川大学实验动物中心,置于符合标准温度、空气和照明等条件的清洁级动物房进行饲养。
1.1.2 主要试剂 小鼠IMD 肽段(IMD8-47)的结构如下:

其中,N-末端的第3和第8位半胱氨酸残基之间由二硫键连接,C-末端为酰胺化的酪氨酸。实验用IMD8-47由上海闪晶生物技术公司采用Fmoc/PyBOP固相合成方法,使用同时性多重固相肽合成仪(PSSM-8型多肽合成仪,岛津,日本东京)合成。
DMEM细胞培养基(dulbecco′s modified eagle′s medium,DMEM)购自Gibco公司;胎牛血清购自Hyclone公司;ISO、胰蛋白酶购自Sigma公司;总RNA抽提试剂TRIZOL购自Invitrogen公司;M-MLV 逆转录酶(M-MLV reverse transcriptase)购自Promega公司;实时荧光定量PCR(Real-time PCR)试剂盒购自Takara公司。兔抗小鼠IMD抗血清购自北京爱迪博生物科技有限公司;辣根过氧化物标记二抗(山羊抗兔)购自北京中杉公司;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记凋亡测定[terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL]试剂盒购自罗氏公司;其他试剂均为国产分析纯级。
1.2 方法
1.2.1 ISO诱导的心脏肥大小鼠模型的建立及药物处理 雄性C57小鼠分为3组,每组9只:对照组、ISO造模组(ISO组)及IMD治疗组(IMD-ISO组,腹腔注射IMD治疗的ISO模型小鼠)。小鼠正常进食,ISO组每天背部皮下注射5 mg/kg ISO 1次,连续7 d;IMD-ISO组在每次背部皮下注射5 mg/kg ISO前2 h及给予ISO后2、4、8 h分别腹腔注射200 nmol/kg IMD,连续7 d;对照组背部皮下注射等容积的生理盐水,连续7 d。正常饲养1周,每天记录小鼠体质量。
1.2.2 PV-LOOP检测心脏功能 小鼠腹腔注射戊巴比妥钠(45 mg/kg)进行麻醉,固定于37 ℃恒温电热板上;行气管插管,连接小动物呼吸机(Harvard),保持呼吸频率120次/分钟,通气体积每次0.5 mL;于2~3肋间剪开肋间肌肉,暴露心尖,左心室插入压力-容积感受器探头(加拿大Scisense.公司),以iWorx型生理多导仪(美国iWorx/CB Sciences.公司)记录左心室压力(left ventricle pressure,LVP)-容积曲线及相关参数,包括小鼠LVP、左心室容积(left ventricle volume,LVV)、左心室收缩(left ventricle end-systolic pressure,LVESP)和舒张末期压力(Left ventricle end-diastolic pressure,LVEDP)、等容收缩期左心室内压力上升的最大/最小速率(maximal and minimal value of the first derivative of LV pressure,dP/dtmax and dp/dtmin)、左心室收缩(end-systolic volume,ESV)和舒张末期容积(end-diastolic volume,EDV)、每搏排血量 (stroke volume, SV)、心输出量(cardiac output,CO)、射血分数(ejection fraction,EF)、每搏功(stroke work,SW)、动脉弹回性(arterial elasticity,AE)和心率(heart rate,HR)。心功能测定完成后,肝素抗凝,小鼠腹腔下腔静脉取血,离心后分离血浆置-80 ℃低温冰箱待测,心脏取出后分为3个部分,心尖部分提取mRNA,中间部分置于Carnoy′s液固定约6~8 h,进一步进行组织学检查。
1.2.3 心脏组织苏木素-伊红(HE)染色及心肌细胞横截面积的测量 心脏组织经固定、脱水和石蜡包埋,切成4 μmol/L的切片,脱蜡后进行HE染色。每个心脏切片拍摄3~5张高倍镜照片,选取核圆位于中央的心肌纤维横截面约30个,测量面积,计算平均值。每个处理组检测9例。
1.2.4 心脏组织细胞凋亡染色(TUNEL染色法) 取4 μmol/L心肌组织石蜡切片脱蜡至水,3% H2O2阻断内源性过氧化物酶,蛋白酶K孵育后按照试剂说明书进行TUNEL染色,4,6-联脒-2-苯基吲哚二盐酸盐 (4′,6-diamidino-2-phenylindole, DAPI)负染细胞核,呈蓝色。荧光显微镜下照相,染为红色的细胞核即指示凋亡的心肌细胞。选取至少5个非重叠的400倍高倍镜视野,计数凋亡心肌细胞数量和视野里的心肌细胞总数,心肌细胞凋亡率=凋亡心肌细胞数量/心肌细胞总数×100%。
1.2.5 心脏组织纤维化染色(Masson染色) 取4 μmol/L心脏组织石蜡切片脱蜡至水,按照Masson染色试剂盒说明书,用丽春红酸性品红染液染色,磷钼酸水溶液分化,苯胺蓝染色后再用磷钼酸水溶液分化,最后二甲苯透明、封片。取不同处理组心脏的同一部位进行普通光镜镜检,400倍高倍镜下照相,利用Image Pro Plus 6.0图像分析软件计算染成蓝色的胶原纤维面积占整个心肌组织面积的百分率。
1.2.6 心脏组织IMD的免疫组织化学染色 取4 μmol/L心脏组织石蜡切片脱蜡至水,3%H2O2封闭内源性过氧化物酶,正常兔血清封闭,然后与IMD抗血清共孵育。二抗处理后进行二氨基联苯胺(DAB)显色。棕黄色为IMD免疫化学阳性染色。光镜下选取至少5个非重叠的400倍高倍镜视野照相。利用Image J图像分析软件检测心肌组织IMD阳性染色的灰度值。
1.2.7 Real-time PCR检测心脏心钠素(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)、内源性IMD及其受体的mRNA表达 TRIZOL试剂盒提取心脏组织的总RNA,用逆转录酶和通用引物 oligo (dT),以 RNA 为模板反转录合成 cDNA 的第1链。再以 cDNA 为模板,参照试剂盒说明书利用不同目的基因的引物(表1)进行Real-time PCR实验。PCR反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 60 s,共40个循环。采集荧光信号,制作融解曲线。目的基因的相对表达率(RQ)采用△△Ct计算方法,即RQ=2-△△Ct。

2 结 果
2.1IMD处理对小鼠大体状况的影响ISO组与对照组相比较,活动减少,毛发凌乱无光泽,心质量/体质量显著增加(P<0.01);IMD-ISO组与ISO组相比较,小鼠的活动明显增加,毛发有光泽,心质量/体质量显著降低(P<0.01),见图1。ISO组与对照组比较,心脏肥大标志物ANP和BNP的mRNA水平也显著增加(P<0.01)。IMD-ISO组与ISO组比较,ANP和BNP的mRNA水平也显著降低(P<0.05),见图2。

表1 Real-time PCR扩增所用的引物序列

图1 对照组、ISO组和IMD-ISO组小鼠心质量/体质量比值

图2 小鼠心脏组织ANP和BNP基因的mRNA表达与GAPDH基因mRNA表达的比值柱状图
2.2IMD处理对小鼠心肌细胞横截面的影响 心脏组织经固定后切片,HE染色后测量心肌纤维横截面积。与对照组小鼠心脏相比较,ISO组小鼠的心脏横截面积显著增加93.0%(P<0.01)。与ISO组相比较,IMD-ISO组小鼠的心脏横截面积显著减小23.0%(P<0.01),见图3。
2.3IMD处理对小鼠心肌细胞凋亡的影响 心脏组织切片经TUNEL染色,评价心肌细胞凋亡的情况。与对照组小鼠相比较,ISO组小鼠心脏的凋亡指数显著增加9.4倍(P<0.01)。IMD-ISO组小鼠的心肌细胞凋亡指数比ISO组显著减少40.0%(P<0.05),见图4。
2.4IMD处理对小鼠心脏组织纤维化的影响 心脏组织切片经Masson染色评价纤维化情况,纤维组织呈蓝色染色。ISO组小鼠心脏的纤维化与对照组比较明显增加,纤维化率增加13.1倍(P<0.01)。IMD-ISO组小鼠的心脏纤维化程度明显低于ISO组,显著减少44.6%(P<0.05),见图5。

A:心脏冠状面切片HE染色的代表性图片(×400),红色为胞质,蓝色为胞核;B:ImageJ软件评价心肌细胞横截面的柱状图。
图3 小鼠心脏组织HE染色
2.5IMD处理对小鼠心脏功能的影响 用PVLOOP评价心脏的功能,观察到与对照组相比较,ISO组小鼠的心脏功能出现明显的障碍,LVP、dP/dtmax、dp/dtmin、SV、CO和EF值明显降低,而LVEDP显著增加(表2)。与ISO组相比较,腹腔注射IMD干预后,IMD-ISO组小鼠的心脏功能明显改善,LVP、dP/dtmax、dp/dtmin、SV、CO和EF明显增加,而LVEDP显著降低,见表2。
2.6ISO处理诱导心脏组织内源性IMD及其受体的表达上调 与对照组小鼠相比较,ISO组小鼠心脏组织的IMD及RAMP3mRNA水平分别显著上调28.0倍和11.4倍(P<0.01);CRLR和RAMP1mRNA表达水平分别上调46.6%和131.6%(P<0.05);而RAMP2mRNA表达差异无统计学意义(P>0.05),见图6。

A:心脏冠状面切片TUNEL染色的代表性图片(×400),红色为TUNEL阳性凋亡胞核,蓝色为胞核;B:心肌细胞凋亡率柱状图。
图4 心脏组织心肌细胞凋亡检测
2.7ISO处理诱导心脏组织内源性IMD的蛋白表达上调 用IMD抗血清检测IMD蛋白在心脏组织的蛋白表达,观察到ISO组小鼠心脏的内源性IMD表达明显强于对照组 (P<0.01),见图7。

A:心脏冠状面切片Masson染色的代表性图片(×400),蓝色为纤维化组织,红色为细胞质,黑色为细胞核;B:ImageProplus6.0图像分析软件计算胶原纤维面积占整个心肌组织面积的百分率柱状图。
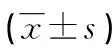
图5 小鼠心脏组织的纤维化表2 ISO造模后1周用PV-LOOP检测C57小鼠心功能指标
a:P<0.05,b:P<0.01,与对照组比较;c:P<0.05,d:P<0.01,与ISO组比较。

图6 小鼠心脏组织IMD及其受体系统基因的mRNA表达与GAPDH基因mRNA表达的比值柱状图

A:IMD抗血清免疫组化染色代表性图(×400),棕褐色为心肌组织的IMD阳性染色,深蓝色点为胞核;B:IMD阳性染色的光密度值柱状图。
图7 内源性IMD蛋白在心脏中的表达
3 讨 论
CGRP家族与心脏肥大疾病有密切的关系[5,7-8]。Tsuruda等[10]报道该家族的另一个成员肾上腺素质素具有拮抗心肌肥大的作用。IMD与ADM的基因核苷酸和多肽氨基酸序列具有较高的同源性[9],近来在主动脉弓缩窄的小鼠[11]和腹主动脉缩窄的大鼠[12]心脏肥大模型中被证实具有拮抗压力过载诱导的心肌肥大的作用[7]。
本研究采用背部皮下注射小剂量ISO激动心肌肾上腺素β1受体,模拟交感神经兴奋导致的心肌肥大病变,观察到ISO处理后,小鼠的心质量/体质量比和心肌细胞横截面积明显增加,心肌的肥大标志物ANP和BNP的mRNA表达水平上调,提示成功建立了心脏肥大模型。ISO诱导心脏发生肥大的同时,会促进大量心肌细胞发生凋亡,并刺激成纤维细胞等间质细胞增殖,造成纤维化病变[13-14]。进一步利用心脏组织切片进行染色,观察到ISO处理诱导心肌细胞凋亡和心肌组织纤维化均明显增加。另外,检测小鼠的心功能,发现ISO处理明显损伤小鼠的心功能,特别是收缩功能发生明显障碍,射血相关参数均显著降低。
IMD分散表达于正常心脏和血管,尤其是内皮细胞[7-9],其作用为扩张血管、调节局部血流、增强心肌收缩力[7-8]。近期报道IMD及其受体水平在充血性心力衰竭、高血压、慢性缺氧性肺动脉高压及长期抑制一氧化氮合酶等情况下会增加[7]。IMD肽在病理状态的上调提示IMD可能是对抗器官损伤起重要保护作用的内源性自/旁分泌因子[7,8,15]。本研究采用腹腔注射IMD的方式治疗ISO诱导的小鼠心脏肥大病变,观察到与ISO组相比较,IMD治疗后小鼠的心质量/体质量比和心肌细胞横截面积均明显降低,心肌肥大标志物ANP和BNP的mRNA表达水平下降,心肌细胞凋亡和心脏纤维化病变均明显改善,表明IMD具有很强的心肌细胞保护作用,可有效拮抗心脏肥大和纤维化。此外,IMD治疗还明显改善ISO诱导的左心室收缩功能障碍,射血相关参数均明显增加,提示IMD还具有保护心脏功能的作用。
IMD与ADM分享同一家族受体复合物,由CRLR分别与3种RAMPs之一结合组成[7-9]。RAMPs作为CRLR运输的伴侣蛋白,在不同类型细胞中与CRLR共同表达时表现出与CRLR不同程度的亲和力[9,16]。有研究认为,IMD与CRLR/RAMP1和CRLR/RAMP3受体复合物的亲和力较强,而与CRLR/RAMP2受体复合物的亲和力较弱[9],故IMD被认为是CRLR/RAMP1和CRLR/RAMP3受体复合物的特异性激动剂[9,16]。IMD可通过蛋白激酶C和蛋白激酶A依赖的机制迅速增强心肌细胞收缩力[7-8],通过cGMP依赖的途径舒张大鼠肺动脉环[7]。本研究检测了心脏内源性IMD及其受体系统的mRNA和蛋白质的表达水平,观察到ISO明显刺激心脏组织的内源性IMD的转录和蛋白表达,显著增加CRLR、RAMP1和RAMP3的mRNA表达水平,但不影响RAMP2的转录。这些结果表明,ISO诱导的内源性IMD及其受体复合物CRLR/RAMP1和CRLR/RAMP3的表达增加,可能是心脏发生肥大病变时活化内源性保护通路的代偿性适应反应之一,进而增强内源性IMD及其受体介导的信号转导。此外,ISO刺激上调IMD的受体复合物后,外源性给予的IMD也可以通过活化的受体复合物增强其拮抗心脏肥大和心肌细胞损伤的作用。
本研究结果表明心脏肥大刺激因素ISO上调内源性保护因子IMD及其受体系统的表达,外源性给予的IMD也可能通过受ISO刺激所活化的IMD受体系统,实现其抑制心肌细胞肥大、心肌纤维化和凋亡、改善心功能的药理作用。
[1]GuptaS,DasB,SenS.Cardiachypertrophy:mechanismsandtherapeuticopportunities[J].AntioxidRedoxSignal,2007,9(6):623-652.
[2]HouJ,KangYJ.Regressionofpathologicalcardiachypertrophy:signalingpathwaysandtherapeutictargets[J].PharmacolTher,2012,135(3):337-354.
[3]SelvetellaG,LemboG.Mechanismsofcardiachypertrophy[J].HeartFailClin,2005,1(2):263-273.
[4]AccorneroF,vanBerloJH,BenardMJ,etal.Placentalgrowthfactorregulatescardiacadaptationandhypertrophythroughaparacrinemechanism[J].CircRes,2011,109(3):272-280.
[5]NishikimiT,MatsuokaH.Cardiacadrenomedullin:itsroleincardiachypertrophyandheartfailure[J].CurrMedChemCardiovascHematolAgents,2005,3(3):231-242.
[6]BarrySP,DavidsonSM,TownsendPA.Molecularregulationofcardiachypertrophy[J].IntJBiochemCellBiol,2008,40(10):2023-2039.
[7]BellD,McdermottBJ.Intermedin(adrenomedullin-2):anovelcounter-regulatorypeptideinthecardiovascularandrenalsystems[J].BrJPharmacol,2008,153Suppl1:S247-262.
[8]HongY,HayDL,QuirionR,etal.Thepharmacologyofadrenomedullin2/intermedin[J].BrJPharmacol,2012,166(1):110-120.
[9]ChangCL,RohJ,HsuSY.Intermedin,anovelcalcitoninfamilypeptidethatexistsinteleostsaswellasinmammals:acomparisonwithothercalcitonin/intermedinfamilypeptidesinvertebrates[J].Peptides,2004,25(10):1633-1642.
[10]TsurudaT,JougasakiM,BoerrigterG,etal.Ventricularadrenomedullinisassociatedwithmyocytehypertrophyinhumantransplantedheart[J].RegulPept,2003,112(1/3):161-166.
[11]ChenH,WangX,TongM,etal.Intermedinsuppressespressureoverloadcardiachypertrophythroughactivationofautophagy[J].PLoSOne,2013,8(5):e64757.
[12]LuWW,ZhaoL,ZhangJS,etal.Intermedin1-53protectsagainstcardiachypertrophybyinhibitingendoplasmicreticulumstressviaactivatingAMP-activatedproteinkinase[J].JHypertens,2015,33(8):1676-1687.
[13]TakakiM.Cardiacmechanoenergeticsforunderstandingisoproterenol-inducedratheartfailure[J].Pathophysiology,2012,19(3):163-170.
[14]HeatherLC,CatchpoleAF,StuckeyDJ,etal.Isoproterenolinducesinvivofunctionalandmetabolicabnormalities:similartothosefoundintheinfarctedratheart[J].JPhysiolPharmacol,2009,60(3):31-39.
[15]KatoJ,TsurudaT,KitamuraK,etal.Adrenomedullin:apossibleautocrineorparacrinehormoneinthecardiacventricles[J].HypertensRes,2003,26Suppl:S113-119.
[16]BarwellJ,WoottenD,SimmsJ,etal.RAMPsandCGRPreceptors[J].AdvExpMedBiol,2012(744):13-24.
Study on protective effects of mouse intermedin against isoproterenol induced cardiomegaly*
ZengHui1,2,WuDan2,WangXue2,ChenHuali2,FuRong1,JiangWei2△
(1.DepartmentofInfectiousDiseases,SichuanProvincialPeople′sHospital,Chengdu,Sichuan610071,China;2.MolecularMedicineResearchCenter,WestChinaHospital,SichuanUniversity,Chengdu,Sichuan610041,China)
Objective To investigate the pharmacological effect and mechanism of mouse intermedin (IMD) for antagonizing cardiac hypertrophy by using isoproterenol (ISO) induced mouse cardiomegaly model.Methods The mouse cardiomegaly model was constructed by small dose of ISO subcutaneous injection.The mouse blood dynamic indexes and heart weight /body weight ratio were investigated.Then the cardiomyocyte cross-sectional area,apoptosis and cardiac tissue fibrosis were evaluated by using the cardiac tissue section.ANP,BNP,mRNA expression levels of endogenous IMD and its receptors system in cardiac tissues were detected by using real time fluorescence PCR method.Results Compared with the ISO induced mouse cardomegaly model group,the intraperitoneal injection of IMD significantly decreased the heart weight/ body weight ratio and cardiomyocyte cross-sectional area increased by ISO treatment,cardiomegaly marker ANP and BNP mRNA level,cardiomyocyte apoptosis and cardiomyocyte fibrosis,improved the cardiac function,left ventricular pressure,maximal and minimal rate of LV pressure increase and decrease during the isovolumetric contraction phase,stroke volume,cardiac output and ejection fraction,but significantly decreased the left ventricle end-diastolic pressure.In addition,the ISO treatment significantly induced the expressions of endogenous IMD and its receptors in heart tissues.Conclusion ISO induces the expressions of endogenous IMD and its receptors in cardiac tissues,and exogenous IMD supplementation therapy realizes the pharmacological protective effect for antagonizing cardiomegaly by ISO activated IMD receptor system.
isoproterenol;cardiomegaly;pituitary gland;intermedin;intermedin receptor system
� 著·
10.3969/j.issn.1671-8348.2017.01.003
国家自然科学基金面上项目(31071001,31271226)。
曾慧(1977-),主管护师,本科,主要从事心血管药理学及护理管理方面研究。△
R963
A
1671-8348(2017)01-0024-05
2016-07-18
2016-09-06)

