白细胞介素2联合顺铂治疗恶性胸腔积液有效性及安全性的Meta分析*
孙永苹,汪成琼,陈 玲,李娜娜,姚新生,肖 政△
(1.遵义医学院附属医院遵义医学院循证医学中心/循证医学教育部网上合作研究中心遵义医学院分中心,贵州遵义 563003;2.遵义医学院附属医院呼吸内科/遵义医学院附属医院重大传染性疾病循证与转化研究中心,贵州遵义 563003;3.遵义医学院珠海校区循证医学教研组,广东珠海 519100;4.遵义医学院免疫教研室,贵州遵义 563003)
白细胞介素2联合顺铂治疗恶性胸腔积液有效性及安全性的Meta分析*
孙永苹1,3,汪成琼1,2,陈 玲2,李娜娜2,姚新生4,肖 政1,2△
(1.遵义医学院附属医院遵义医学院循证医学中心/循证医学教育部网上合作研究中心遵义医学院分中心,贵州遵义 563003;2.遵义医学院附属医院呼吸内科/遵义医学院附属医院重大传染性疾病循证与转化研究中心,贵州遵义 563003;3.遵义医学院珠海校区循证医学教研组,广东珠海 519100;4.遵义医学院免疫教研室,贵州遵义 563003)
目的 系统评价白细胞介素2联合顺铂治疗恶性胸腔积液的有效性及安全性,为临床治疗策略提供依据。方法 系统检索中国生物医学文献数据库(BM)、中国学术期刊
白细胞介素2;顺铂;胸腔积液,恶性;Meta分析
1.2 方法
1.2.1 纳入与排除标准 纳入标准如下,(1) 研究对象:恶性胸腔积液(符合病理组织及细胞学诊断标准,原发性恶性肿瘤不限)。(2)研究设计为随机对照试验(RCT),且文献提供足够的数据信息可进行Meta分析。(3) 试验组:IL-2联合顺铂;对照组:顺铂。用药路径为胸腔闭式引流排尽胸液后,腔内注射。(4)研究主要结局指标:近期疗效指标,根据WHO标准近期疗效分为完全缓解(CR)、部分缓解(PR),计算客观有效率(ORR=CR+PR);次要结局指标:不良反应指标,按照WHO抗癌药物毒性反应评价标准,评价发热、骨髓抑制、白细胞减少症及胸痛等。排除标准:(1)重复文献;(2)无关文献;(3)普通综述;(4)报道信息不准确;(5)统计数据无法应用者。
1.2.2 纳入研究的方法学质量评价 采用Cochrane 系统评价员手册5.1.0 针对RCT的偏倚风险评估工具评价纳入研究的方法学质量。指标为:(1)随机序列的产生;(2)分配方案的隐藏;(3)盲法(对患者及结果测评者);(4)数据结果完整性;(5)选择性报道结果;(6)其他偏倚来源评价。由两名评价员独立筛选并评价文献,筛选与评价过程中产生的分歧通过双方讨论或者与第三方讨论解决。
1.2.3 资料提取 依据PICO原则(P:研究对象,I:干预措施,C:研究对照,O:研究结果)设计资料提取表格,提取纳入研究基本情况(作者、发表时间、患者来源、病例数、试验组、对照组及研究设计),研究结果包括近期疗效及不良反应等指标。
1.3 统计学处理 采用RevMan5.3进行Meta分析,连续变量用均数差(MD)或标准化均数差(SMD),二分类变量采用相对危险度(RR)及其95%CI进行描述。各研究间异质性检验采用χ2检验,若不存在异质性或异质性较小(I2≤50%,P≥0.1),采用固定效应模型计算合并效应量;如异质性检验结果显示各研究间存在异质性(P<0.1,I2>50%),分别采用固定效应模型交替随机效应模型进行Meta分析,其结果的一致性好,说明无明显异质性来源,则采用随机效应模型进行合并分析。合并研究超过10个,采用漏斗图分析发表偏移。以P<0.05为差异有统计学意义。
2 结 果
2.1 检索与筛选结果 共检索到文献4 523篇。阅读题目排除重复文献2 206篇;阅读摘要排除会议摘要67篇,综述16篇,书籍7篇,无关文献1 911篇;阅读全文后排除不符合纳入标准文献282篇,最后纳入34个RCT,见图1。
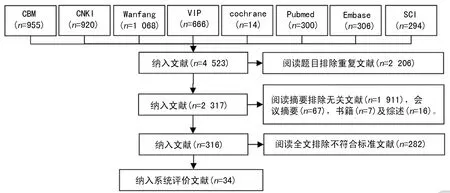
图1 文献检索及筛选结果
2.2 纳入研究基本特征 纳入来自20个省市的34个研究,2 037例恶性胸腔积液患者,IL-2联合顺铂1 090例组,顺铂组947例;男1 160例,女762例,年龄18~82岁,绝大多数患者为中、老男性。IL-2最大剂量为400万IU,最小为20万IU,常用方法为每周100~200万IU/次,用3次;顺铂最大剂量为100 mg,最小为40 mg,60~80 mg为常用剂量,用法与对应的试验组一致;用药途径均为胸腔注射;34个研究报道近期疗效,30个研究报道IL-2联合顺铂治疗的不良反应,见表1。结果表明IL-2联合顺铂用药方案复杂,机构间差异大,常用方案为每周100~200万IU次,用3次。
2.3 纳入研究方法质量特征 纳入34个研究,仅5个描述随机序列的产生方式,1个研究无分配方案隐藏,其余研究的分配方案隐藏,所有研究的盲法实施、其他偏倚来源均未进行描述;34个研究数据结果均完整,且无选择性报道结果,见表2。
2.4 近期疗效评价 依据WHO近期疗效评价标准,本研究计算ORR,对IL-2联合顺铂恶性胸腔积液近期疗效进行评价。纳入34个研究,2 037例患者,IL-2联合顺铂组1 090例,顺铂组947例,研究间同质性好(I2=0%),固定效应模型分析结果显示ORR在两组间差异有统计学意义[RR=1.45,95%CI(1.36~1.54),P<0.01],IL-2联合顺铂组的客观有效率优于单纯顺铂组,见图2。
2.5 安全性评价 纳入30个研究,依据纳入研究特征,本研究采用发热、白细胞减少、骨髓抑制及胸痛评价IL-2联合顺铂治疗恶性胸腔积液的安全性。(1)发热。纳入25个研究,1 436例患者,IL-2联合顺铂组759例,顺铂组677例,研究间异质性较高(I2=65%),采用随机效应模型分析结果显示发热率在两组间差异有统计学意义[RR=2.37,95%CI(1.53~3.66),P<0.05],IL-2联合顺铂组的发热率高于单纯顺铂组。(2)白细胞减少症。纳入10个研究,614例患者,IL-2联合顺铂组335例,顺铂组279例,研究间同质性好(I2=0%),固定效应模型分析结果显示白细胞减少症发生率在两组间差异无统计学意义[RR=0.81,95%CI(0.61~1.07)],IL-2联合顺铂组的白细胞减少症发生率与顺铂组相当。(3)骨髓抑制。纳入6个研究,288例患者,IL-2联合顺铂组153例,顺铂组135例,研究间同质性好(I2=0%),固定效应模型分析结果显示骨髓抑制发生率在两组间差异无统计学意义[RR=0.83,95%CI(0.62~1.11)],IL-2联合顺铂组的骨髓抑制发生率与顺铂组相当。(4)胸痛。纳入13个研究,834例患者,IL-2联合顺铂组429例,顺铂组405例,研究间同质性好(I2=0%),采用固定效应模型分析结果显示胸痛发生率在两组间差异无统计学意义[RR=1.04,95%CI(0.84~1.29)],IL-2联合顺铂组的胸痛发生率与顺铂组相当,见表3、图3。

表1 纳入研究基本特征
E:试验组;C:对照组;M:男性;F:女性;研究对象:恶性胸腔积液;Ca:恶性肿瘤;混合:肺癌、乳腺癌、恶性淋巴瘤、卵巢癌、胸膜间皮瘤及鼻咽癌等;IL-2*:IL-2用法(万IU)/次/时间,次数);DDP*:顺铂用法,用药方案与试验组一致;O1:客观有效率(ORR);O2:不良反应,包括发热、骨髓抑制、白细胞减少症及胸痛等。-:无数据。

表2 纳入研究的方法学质量特征
①:数据结果完整性;②:选择性报道结果;③:其他偏倚来源评价;不详:文中仅描述“随机”,未详细描述随机方法;不清楚:文中为对此项进行描述;否;明确或者随机方法易导致隐藏暴露,或未实施盲法。

表3 两组毒性反应的Meta分析
n1:试验组事件数;t1:试验组总病例数;n2:对照组事件数;t2:对照组总病例数;R:随机效应模型;F:固定效应模型。

图2 两组客观有效率比较的Meta分析

图3 毒性反应分析

A:ORR;B:发热率;C:白细胞减少症;D:胸痛。
图4 发表偏倚分析
2.6 发表偏移及异质性分析 ORR、发热、白细胞减少及胸痛的Meta分析纳入研究均大于或等于10个,漏斗图分析其发表偏移(图4)。比较ORR的漏斗图显示33个研究集中与倒漏斗顶部,且较对称,表明该研究发表偏移可能较小;比较发热率的漏斗图显示21个研究分布于倒漏斗内,两侧不对称,4个位于漏斗左侧外,表明该研究可能发表偏移,低估发热率;比较白细胞减少的漏斗图显示10个研究分布于倒漏斗内,两侧基本对称,表明该研究发表偏移可能性较小;比较胸痛的漏斗图显示13个研究分布于倒漏斗内,两侧基本对称,表明该研究发表偏移可能性较小。表明纳入研究对白细胞减少、胸痛等报道比较客观,而可能高估或低估ORR和发热率,但排除高估或低估研究前后结果稳定性较好。异质性分析结果表明发热率的Meta分析合并异质性较高,采用两种模型计算结果相差不大,提示该结果稳定性较好。
3 讨 论
本研究纳入2000~2014年20个省市的34个RCT研究,2 037例恶性胸腔积液患者,男1 160例,女762例,年龄跨度为18~82岁;用药途径均为所有病例在局部麻醉下胸腔穿刺引流,抽尽胸腔积液后同时或序贯注射IL-2和顺铂。系统分析用药方案表明IL-2常用剂量为100~200万IU/次,顺铂为60~80 mg/次,1次/周,用3周,但IL-2用量及疗程机构间差异大,提示IL-2联合顺铂治疗恶性胸腔积液有待规范化。纳入34个研究报道近期疗效,Meta分析表明IL-2联合顺铂组的客观有效率优于单独使用顺铂组,表明IL-2辅助顺铂化疗能改善恶性胸腔积液患者的临床近期疗效。国外研究表明胸腔注射IL-2治疗恶性胸腔积液能发挥重要的抗瘤作用。IL-2为免疫应答启动的关键细胞因子,能活化非特异性或特异性免疫,研究已证实经IL-2活化的LAK细胞或协同活化的CIK细胞能有效杀伤各种恶性肿瘤细胞,并在临床治疗中显示出良好疗效[39-40]。同时也有研究表明T细胞及NK等恶性胸腔积液中重要抗瘤成分,因此认为胸腔注射IL-2能活化胸腔积液中特异性及非特异性淋巴细胞而发挥抗瘤作用[41]。纳入33个研究报道发热、白细胞减少、骨髓抑制及胸痛等不良反应,Meta分析表明IL-2联合顺铂组患者的发热率显著高于单纯顺铂组,但存在发表偏移,可能低估发热。其余不良反应在两组间无显著差异,研究报道比较客观。研究提示发热为IL-2治疗重要不良反应,但尚不能认为IL-2能改善骨髓抑制(白细胞减少)等不良反应。本次Meta分析严格设置纳入研究对象、干预措施及研究设计,最大可能地排除Meta分析合并的临床异质性,而Meta分析合并不同研究间的发热率具有异质性,采用随机效应模型合并分析表明,与固定效应模型相比,其结果一致性较好,因此本研究结果可靠。近20年来,免疫治疗技术飞速发展,已形成抗体、免疫细胞、肿瘤疫苗及基因治疗共存的良好局面,后三者的技术平台要求为普通医疗机构望尘莫及,且经济花费较高。以此,便能理解IL-2单独或联合化疗恶性胸腔积液的现实治疗价值。综上表明IL-2联合顺铂治疗恶性胸腔积液客观有效率优于单独使用顺铂,但存在发热等不良反应。
纳入研究整体质量一般,纳入研究随机分配方案及盲法实施等描述不清楚,影响研究结果可信度。大部分Meta分析合并指标的同质性好,仅患者发热率的比较异质性较高,排除临床异质性后,随机效应模型交替固定效应模型分析表明Meta分析结果稳定性较好,科学性较好,结果可靠。纳入研究对ORR、白细胞减少、胸痛等报道比较客观,而可能低估IL-2联合顺铂治疗患者的发热率。综合分析表明本次Meta分析虽然纳入研究质量不高,但是结果稳定及科学性较好,结果可靠。
综上所述,本研究表明IL-2联合顺铂治疗恶性胸腔积液的客观有效率优于单独使用顺铂,但存发热等不良反应。但IL-2联合顺铂治疗存在机构差异,IL-2的剂量及疗程差异较大;纳入研究证据质量一般。因此建议临床慎用,同时设计高质量、规范的随机对照试验或真实世界研究探索IL-2安全有效的剂量及疗程,以规范用药,提高疗效降低风险。
[1]Egan AM,Mcphillips D,Sarkar S,et al.Malignant pleural effusion[J].QJM,2014,107(3):179-184.
[2]邵彬,余靖,邸立军,等.乳腺癌恶性胸腔积液的临床特征及预后因素分析[J].肿瘤防治研究,2013,40(4):381-387.
[3]李向南,张国俊.恶性胸腔积液治疗进展[J].肿瘤基础与临床,2015,28(1):84-86.
[4]Kato M,Saji S,Miya K,et al.Cancer therapy by IL-2 or TNF[J].Biotherapy,2000,14(1):5-7.
[5]谢长生,潘磊,陈培丰.顺铂联合IL-2治疗57例恶性胸腔积液临床观察[J].肿瘤学杂志,2010,16(6):503-504.
[6]徐成,张再军,胡月珍,等.胸腔置管白介素-2联合顺铂治疗恶性胸腔积液的临床观察[J].肿瘤预防与治疗,2010,23(3):211-213.
[7]朱江,林飞英.重组人白细胞介素-2联合顺铂治疗癌性胸腔积液的临床研究[J].中国中西医结合急救杂志,2010,17(5):314-315.
[8]高红.腔内注射白细胞介素-2,顺铂治疗肺癌合并胸腔积液[J].临床肿瘤学杂志,2000,5(1):43-44.
[9]杨秀枝,杨如玺.白介素-2、顺铂联合腔内注射治疗恶性胸腔积液[J].中国肺癌杂志,2001,4(5):391.
[10]赵军,王彦文,孙桂明,等.胸腔闭式引流后序贯注入顺铂与IL-2治疗恶性胸腔积液[J].肿瘤研究与临床,2003,15(2):132-133.
[11]徐姝丽,刘洁,李君东.顺铂联合白细胞介素2腔内治疗恶性胸腔积液[J].肿瘤学杂志,2003,9(1):61.
[12]宋卓,毕洪霞,石寒冰,等.胸腔内注入顺铂和白细胞介素-2联合治疗恶性胸腔积液[J].现代医学,2004,32(4):259-261.
[13]李秋芬,李艳萍,冯晓丽.白介素-2联合顺铂胸腔灌注治疗恶性胸腔积液50例[J].山东医药,2005,45(26):87.
[14]夏永明,田炳如,陈幼芬.顺铂联合白细胞介素-2腔内化疗治疗恶性胸腔积液[J].现代实用医学,2005,17(9):563-564.
[15]舒进忠,肖静,杨连秀.顺铂与白细胞介素-2联合治疗恶性胸腔积液68例临床疗效观察[J].遵义医学院学报,2005,28(1):70-71.
[16]吴洁清,姚卫华.新型白细胞介素-2联合顺铂治疗恶性胸腔积液疗效观察[J].中国煤炭工业医学杂志,2005,8(6):584-585.
[17]王艳俊,蒋飞虎,许凝,等.白介素2联合顺铂治疗恶性胸腔积液临床观察[J].癌症进展,2005,3(4):401-402.
[18]张馨,徐公斌,孙禄,等.IL-2及(或)DDP治疗癌性胸腔积液72例疗效分析[J].中国厂矿医学,2006,19(6):511-512.
[19]李德琼.白细胞介素-2联合顺铂治疗恶性胸腔积液的短期疗效[J].西部医学,2006,18(4):437.
[20]张荣生.顺铂联合白细胞介素-2治疗恶性胸腔积液32例[J].大理学院学报,2006,5(4):16-17.
[21]徐文颖.顺铂、长铂与白介素2治疗癌性胸腔积液疗效比较[J].中国误诊学杂志,2006,6(15):2898-2899.
[22]李原.白介素-2联合顺铂治疗恶性胸腔积液临床观察[J].实用医技杂志,2007,14(1):86-87.
[23]杨茁,任亚娟,徐灵彬.白细胞介素-2联合顺铂治疗恶性胸腔积液的疗效观察[J].现代肿瘤医学,2007,15(11):1605-1607.
[24]刘占伟,卞丹阳,申国宏,等.白细胞介素-2联合顺铂治疗肺癌所致恶性胸腔积液[J].武警医学院学报,2007,16(4):437-438.
[25]侯岐生,廉少英.白介素-2联合顺铂治疗恶性胸腔积液的疗效观察[J].山西职工医学院学报,2008,18(1):37-38.
[26]张凤秋.白介素-2联合顺铂治疗肺癌转移性胸腔积液疗效分析[J].中国误诊学杂志,2008,8(22):5344-5345.
[27]朱早君.顺铂联合白介素-2治疗恶性胸腔积液疗效观察[J].中国实用医药,2008,3(32):27-28.
[28]刘素娟,刘武杰,薄克平.胸腔置管引流联合灌注IL-2及顺铂治疗恶性胸腔积液[J].中国厂矿医学,2008,21(4):405-406.
[29]黄晓霞,段凤英.72例胸腔内注入顺铂联合白介素2治疗恶性胸腔积液疗效对比[J].国际呼吸杂志,2009,29(11):669-671.[30]薛海英.白介素-2联合顺铂局部治疗恶性胸腔积液临床观察[J].中国医药导报,2009,6(1):57-58.
[31]岳顺,周磊磊,秦晓冰.经导管持续闭式引流联合大剂量IL-2和顺铂治疗肺癌恶性胸腔积液疗效观察[J].临床肺科杂志,2009,14(11):1465-1466.
[32]纪荣浪,汪庆华,林镇慧,等.顺铂联合白介素-2治疗恶性胸腔积液的疗效观察[J].海南医学院学报,2009,15(2):154-155,157.
[33]王峻峰,袁挺,唐明星,等.白细胞介素-2联合顺铂经中心静脉导管治疗恶性胸腔积液41例临床分析[J].中国煤炭工业医学杂志,2010,13(4):540-541.
[34]皮家新.顺铂联合白介素-2治疗恶性胸腔积液的疗效观察[J].实用癌症杂志,2011,26(5):512.
[35]邱艳,周晓蕾,吴志强,等.顺铂联合白介素-2治疗恶性胸腔积液的疗效观察[J].河南医学研究,2011,20(3):283-285.
[36]戴明,竺家琍,朱海骋.置管引流并注入白介素-2联合顺铂治疗恶性胸腔积液疗效分析[J].实用癌症杂志,2011,26(2):181-183.
[37]赫丽杰,于秋菊,王梓瑛.人重组白介素2联合顺铂治疗恶性胸腔积液的临床疗效观察[J].中国药师,2014,17(10):1698-1699.
[38]江海兵,汪征兵,徐大林.置管引流灌注白介素-2联合顺铂治疗恶性胸腔积液临床疗效观察[J].安徽医学,2014,35(7):943-945.
[39]MesianoG,TodorovicM,GammaitoniL,etal.Cytokine-inducedkiller(CIK)cellsasfeasibleandeffectiveadoptiveimmunotherapyforthetreatmentofsolidtumors[J].ExpertOpinBiolTher,2012,12(6):673-684.
[40]YawenZ,RunmeiL,FengW,etal.Ameta-analysisofadoptiveimmunotherapycombinedwithchemo/Radiotherapyinthetreatmentofnon-smallcelllungcancer[J].ChinJCancerBio,2013,20(4):461-467.
[41]ZhuYX,ChenC,HuangJA.TheexpressionofPD-1onCD8+Tcellsinmalignantpleuraleffusionoflungcanceranditsbiologicalsignificance[J].Tumor,2010,30(9):778-781.
Effectiveness and safety of interleukin-2 plus cisplatin for treating malignant pleural effusion:a meta analysis*
SunYongping1,3,WangChengqiong1,2,ChenLing2,LiNana2,YaoXinsheng4,XiaoZheng1,2△
(1.Evidence-BasedMedicineCenter,AffiliatedHospitalofZunyiMedicalCollege/BranchCenterofZunyiMedicalCollege,MOEVirtualResearchCenterofEvidence-BasedMedicine,Zunyi,Guizhou563003,China;2.DepartmentRespiratoryMedicine/CenterforEvidence-BasedandTranslationalMedicineofMajorInfectiousDiseases,AffiliatedHospitalofZunyiMedicalCollege,Zunyi,Guizhou563003,China;3.TeachingandResearchGroupofEvidenceBasedMedicine,ZhuhaiCampusofZunyiMedicalCollege,Zhuhai,Guangdong519100,China;4.TeachingandResearchingSectionofImmunology,ZunyiMedicalCollege,Zunyi,Guizhou563003,China)
Objective To systematically evaluate the effectiveness and safety of interleukin-2 plus cisplatin for treating malignant pleural effusion(MPE) to provide a basis for clinical treatment strategy.Methods CBM,CNKI,VIP,Wanfang,Pubmed,Embase,Cochrane library clinical trial registration database were systematically retrieved.The randomized controlled trial(RCT) quality assessment criteria of Cochrane collaboration network was adopted for including the study quality.The data were extracted by meta analysis.Results (1) Thirty-four RCT involving 2 037 MPE patients were included,the quality of included RCT was ordinary;(2)compared with simple cisplatin,the merged RR values and their 95%CIof meta-analysis for ORR,fever,were 1.45 (1.36-1.54),2.37(1.53-3.66),respectively,the differences between the two groups were statistically significant(P<0.05).The mergedRRvalues and their 95%CIof meta-analysis for leukopenia,myelosuppression and thoracalgia were 0.81(0.61-1.07),0.83(0.62-1.11) and 1.04(0.84-1.29) respectively,the differences between two groups were not statistically significant(P>0.05).Conclusion This study indicates that IL-2 plus cisplatin can significantly improve the clinical curative effect in the patients with MPE,but has the adverse reactions of fever,etc.and the quality of included RCT is general.
interleukin-2;cisplatin;pleural effusion,malignant;meta analysis
2016年度重庆市出版专项资金资助项目
�证医学·
10.3969/j.issn.1671-8348.2017.01.020
遵义医学院博士启动基金(F-617);贵州省哲学社会科学规划基金(14GZYB58);贵州省第五批科技创新人才团队项目[黔科合(2012)4011]。
孙永苹(1980-),讲师,硕士,主要从事免疫技术评价与管理方面研究。△
E-mail:zy426f@163.com。
R
A
1671-8348(2017)01-0084-06
1 资料与方法
策略 电子检索国内外主要数据库:中国生物医学文献数据库(CBM)、中国学术期刊网络出版总库(CNKI)、维普(VIP)、万方数据库、ISI、Pubmed、Embase(搜索日期从建库至2015年7月20日)及Cochrane library临床试验注册数据库(2015年7期)。中文关键词:白细胞介素2、IL2、ILⅡ、欣吉尔、金路康、辛洛尔、英路因、新德路生、英特康欣、白介2、长生安、TCGF、白介素2、胸腔积液及胸水及胸腔积水;英文检索词:Interleukin-2,Ontak,IL-2,TCGF,Interleukine 2,Lymphocyte Mitogenic Factor,T Cell Growth Factor,T Cell Stimulating Factor,Thymocyte stimulating Factor,Interleukin Ⅱ,Ro236019,RU 49637,hydrothorax,Pleural Effusion[Mesh]及Pleural Effusions。检索方式:由两名检索员独立采用主题词与自由词相结合计算机辅以手工检索数据,根据检索结果修正完善,尽可能地全面收集符合纳入标准的文献,无语种限制。
2016-07-22
2016-09-27)
总库(CNKI)、维普(VIP)、万方、ISI、Pubmed、Embase及Cochranelibrary临床试验注册数据库,采用Cochrane协作网RCT质量评价标准评价纳入研究质量,Meta分析提取数据。结果 (1)纳入34个RCT,2 037例恶性胸腔积液患者,纳入研究质量一般;(2)与单独使用顺铂比较,Meta分析合并相对危险度(RR)值:ORR[RR=1.45,95%CI(1.36~1.54),P<0.01]及发热[RR=2.37,95%CI(1.53~3.66),P<0.05]比较差异有统计学意义;白细胞减少症[RR=0.81,95%CI(0.61~1.07),P=0.14];骨髓抑制[RR=0.83,95%CI(0.62~1.11),P=0.21]及胸痛[RR=1.04,95%CI(0.84~1.29),P=0.69]在两组间差异无统计学意义。结论 本研究表明IL-2联合顺铂能显著改善恶性胸腔积液患者近期疗效,但存发热等不良反应,纳入研究质量一般。
恶性胸腔积液(malignant pleural effusion,MPE)是肺癌、乳腺癌等恶性肿瘤的常见晚期并发症,其临床症状严重,常伴癌性胸膜转移,预后极差[1-2]。传统手术及化疗方法复杂多样,常因并发症严重及药物不良反应多而失败,致临床决策困难[3]。大量研究证实白细胞介素(IL)-2及其活化的杀伤细胞(LAK或CIK)等具有良好抗肿瘤活性,被广泛应用各种抗瘤治疗[4]。在我国IL-2常被单独或联合化疗药治疗恶性胸腔积液,相关研究样本量小,其疗效及安全性在各研究报道中存在差异,致临床决策困难[5-7]。因此本研究系统评价IL-2联合顺铂治疗恶性胸腔积液的有效性及安全性,为科学制订恶性胸腔积液治疗策略提供依据。

