解读2015年WHO肺、胸膜、胸腺及心脏肿瘤分类(肺)
方三高,许春伟,肖华亮,李晟磊,陈 岗
(1.第三军医大学大坪医院野战外科研究所病理科,重庆 400042;2.中国人民解放军第三○七医院病理科,北京 100071;3.郑州大学第一附属医院病理科,郑州 450052;4.上海中山医院病理科,上海 200032)
解读2015年WHO肺、胸膜、胸腺及心脏肿瘤分类(肺)
方三高1,许春伟2,肖华亮1,李晟磊3,陈 岗4
(1.第三军医大学大坪医院野战外科研究所病理科,重庆 400042;2.中国人民解放军第三○七医院病理科,北京 100071;3.郑州大学第一附属医院病理科,郑州 450052;4.上海中山医院病理科,上海 200032)
肺肿瘤;WHO;分类

方三高
2015年3月,国际癌症研究机构(International Agency for Research on Cancer,IARC)第4版《WHO肺、胸膜、胸腺和心脏肿瘤分类》[1](简称新版)正式出版,与2004年第3版[2](简称旧版)相比,新版与时俱进,肺肿瘤分类并非形态学一家独大,而是博采众长,除了采纳2011年国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)、美国胸科学会(American Thoracic Society,ATS)和欧洲呼吸学会(European Respiratory Society,ERS)肺腺癌国际多学科分类(International Multidisciplinary Classification of Lung adenocarcinoma)[3],还收录了该领域其他研究成果[4-5],在出版层面开启了WHO精准医学(precision medicine,PM)[6]及多学科团队合作(multidisciplinary team,MDT)[7]的新时代,新版将腺癌排在首位,顶层设计(top-down design),分层管理(stratification management),体现了组织学类型、分子标志物与临床特征之间的新关联,诊断可重复性(reproducibility)与临床一致性(consistency)更强,更有利于临床实践、调查研究及科学试验。本文通过学习与解读,重点介绍新增内容。
1 肺肿瘤分类(classification)
基于发病率及重要性,新版在“上皮性肿瘤”项下恶性者以腺癌居首,替代旧版的鳞状细胞癌;而在“间叶性肿瘤”中良性者以肺错构瘤开头排序,详见表1。新版采用2011年IASLC/ATS/ERS国际多学科分类,该分类根据“推荐等级评估、制订与评价(grades of recommendation,assessment,development,and evaluation,GRADE)”体系,由内科(肿瘤)医师、放射医师、胸外科医师、病理学家及分子生物学家共同参与,成立核心专家组,相当于MDT,对关键问题提出推荐意见,通过证据强度与质量进行分级,使用统一的专业术语及诊断标准,采用全面组织学分型(comprehensive histologic subtyping,CHS),用半定量分析法评估所有大于或等于5%的组织学亚型,而非旧版所称的大于或等于10%,按照主要病理类型,将旧版笼统地归为腺癌混合亚型进一步划分为5个常见变异型(varians)[1,3]。新版摒弃了国际多学科分类“为主”的列表式风格,而采用WHO惯用的平铺方式,分节叙述,以最多、最典型成分排头,直接诊断,如将国际多学科分类的“附壁为主型腺癌(lepidic predominant adenocarcinomas,LPA)”改称为“附壁型腺癌(lepidic adenocarcinomas)”,但在具体定义及叙述时,仍沿用2011年IASLC/ATS/ERS术语,称之为变异型(variant),未及时修正。事实上,作为具有独立ICD-O编码的病种或实体(entity),应称之为类型(type)。由于国际多学科分类亚型罗列,名称繁杂,可能对临床产生不便,有的临床医生甚至不乏嘲讽或调侃之辞,认为国际多学科分类是病理医生在显微镜下的“自娱自乐(enjoy himself)”,但详细的病理类型及其亚型恰好说明肿瘤形态的多样性及异质性。新版承上启下,开拓创新,在浸润性腺癌与侵袭前病变之间设立微浸润性腺癌(minimally invasive adenocarcinoma,MIA)作为过渡,体现了分层管理。表2列举了2011年IASLC/ATS/ERS国际多学科分类及新旧版腺癌分类目录,以便查询与对照。
2 肺癌淋巴结分站(Stationing)
恶性肿瘤通常经淋巴或血行途径扩散,淋巴扩散引起受累的同侧和对侧肺门和(或)纵隔淋巴结肿大,而血源性转移最常发生在脑、肾上腺、肝、骨及肺,后者又叫肺内肺癌转移,不要误认为多发性癌。对肺而言,肿瘤沿胸膜表面转移是另一种扩散途径,预后较差,目前恶性胸腔积液被描述成M1a期,其他远处转移定义为M1b。此外,肺腺癌日益公认的侵袭模式还包括气道源性(aerogenous),即经气体间隙扩散(spread through air-space,STAS)[8],有人译为“沿肺泡间隔转移”,指肿瘤细胞突破边界,进入周围的肺实质间隙,由微乳头簇(micropapillary clusters)、实性巢(solid nests)和(或)单个细胞(single cells)组成,常见于微乳头状腺癌(micropapillary adenocarcinoma)或实体型腺癌,其独特的浸润模式,可导致肿瘤复发率增加,预后较差[9]。
淋巴结累及具有重要预后及治疗意义,必须用最精准的方法来明确,为此,IASLC提出了多学科淋巴结图谱,包括淋巴结站点(stations)到分区(zones)用于预后分析的区域,可利用影像学、代谢及介入技术进行解剖程度评估。CT与PET在评估转移扩散局部范围中发挥了重要作用[10]。微创内镜和微创手术如超声支气管镜引导下经支气管针吸活检(endobronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)[11]、食管镜超声引导下针吸活检(esophageal endoscopic ultrasound needle aspiration,EUS-NA)及各种纵隔镜和经颈部纵隔淋巴结廓清术,是纵隔淋巴结N分期的重要手段,但要避免经穿刺针道将正常或炎性增生黏膜混入“淋巴结”活检组织,造成误诊。

表1 WHO肺肿瘤分类ab

续表1 WHO肺肿瘤分类ab

续表1 WHO肺肿瘤分类ab
a:形态学代码来自肿瘤学国际疾病分类(ICD-O)编码。生物学行为编码:0代表良性,1代表不确定、交界性或生物学行为未定,2代表原位癌/上皮内瘤变Ⅲ级,3代表恶性。b:鉴于对一些疾病认识的变化,对先前的WHO肿瘤组织学分类进行了一些修订。*:新增ICD-O编码,由IARC/WHO委员会批准。▲:译者所加,为新增病种。
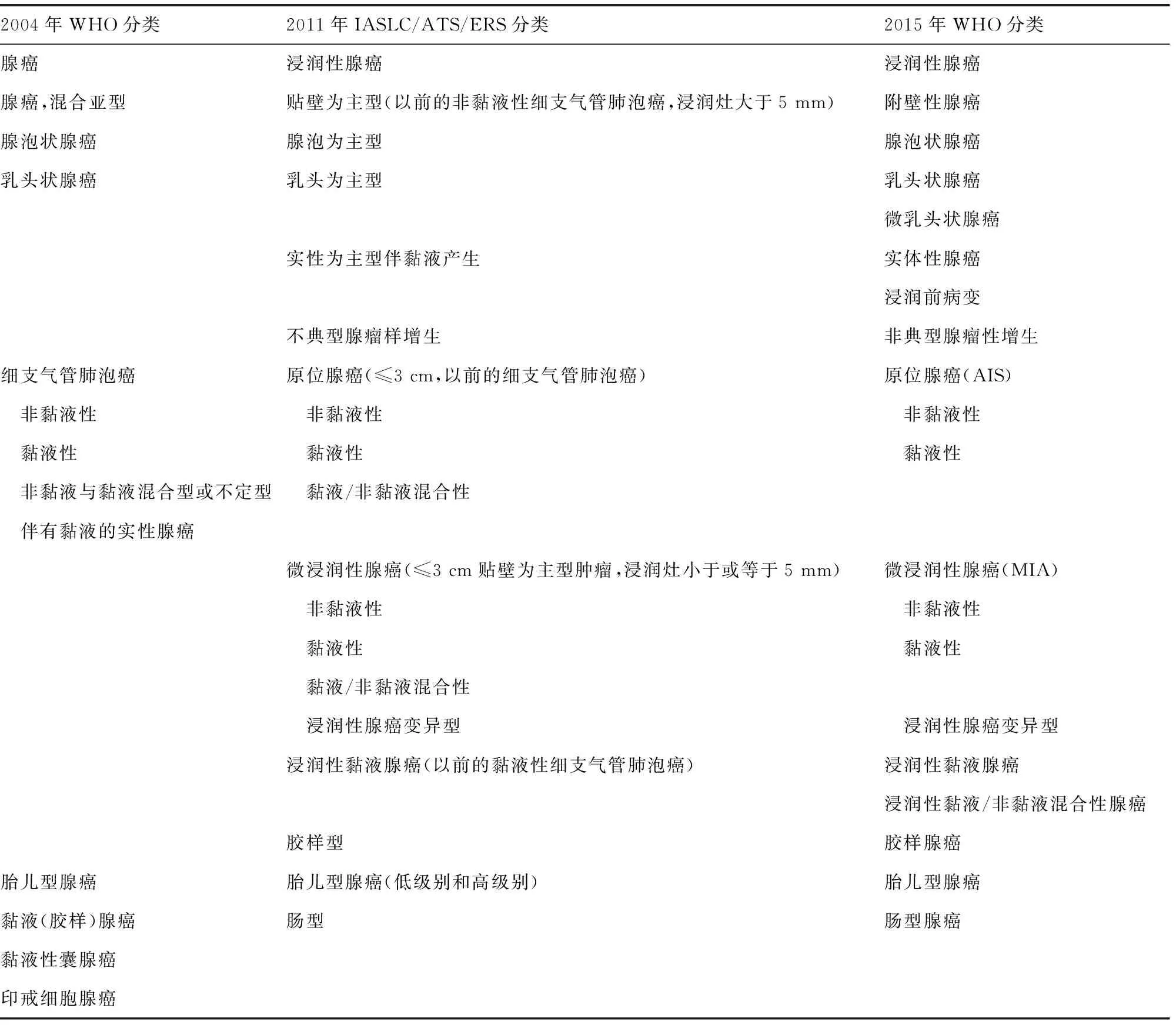
表2 肺腺癌2011年IASLC/ATS/ERS分类与WHO新旧版分类对照

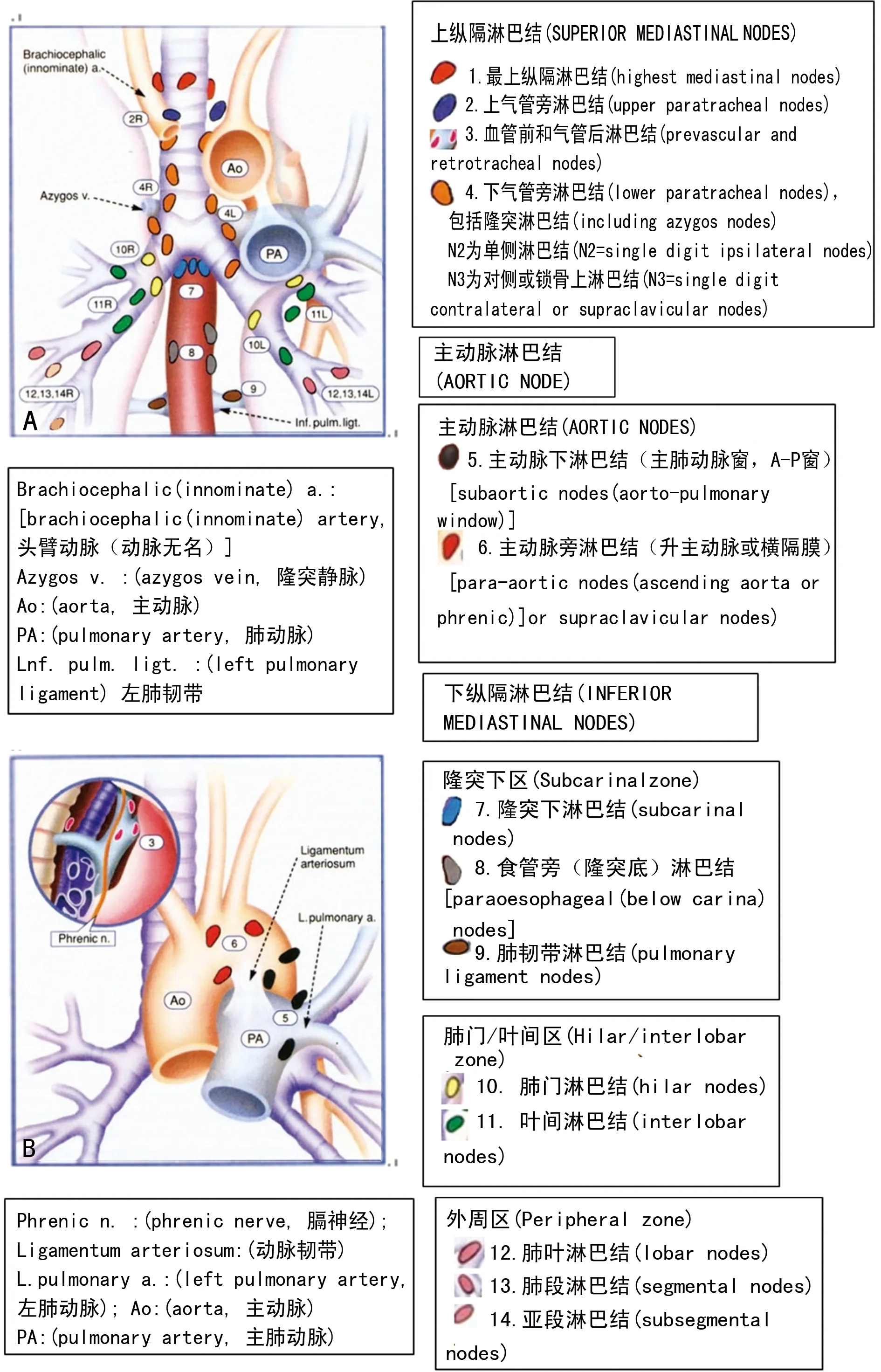
A:Naruke图谱(正位);B:Naruke图谱(右侧位);C:Naruke图谱(左侧位)。仿Tusguo Naruke[12],引自日本肺癌协会。
图1 Naruke图谱
淋巴结分站是淋巴结廓清术的解剖基础。早在1967年,日本医生Tsuguo Naruke(1934-2006年)就绘制了世界上首张肺癌区域淋巴结图谱,随后被日本肺癌协会(the Japan Lung Cancer Society)接受,命名为Naruke图谱(Naruke map)[12]并大力提倡,至今仍在使用,见图1。1996年,美国胸科协会(American Thoracic Society,ATS)描述的另一种淋巴结分布图:ATS图谱(ATS map),经Mountain和Dresler两位医生[13]与Naruke图谱进行整合,绘制成“所谓的ATS修正图谱(so-called Mountain-Dresler modification of the ATS map)”,简称MD-ATS图谱(图2A、B),被美国癌症联合会(AJCC)和国际抗癌协会(UICC)采纳。MD-ATS图谱与Naruke图谱最大的差别在于,前者第7组(隆突下淋巴结)对应后者的第7组和10组,导致部分按MD-ATS图谱分期为ⅢA期,N2,可能按Naruke图谱分期为Ⅱ期,N1,以至于1998年IASLC启动的肺癌新分期修订计划,在创建国际肺癌数据库过程中,二者矛盾集中显现。为消除分歧,受IASLC分期委员会委托,以Rusch和Asamura为首的专家组以预后分析为目的,将区域淋巴结(zones)包括各站点(stations)进行重新整合,制订了新的国际淋巴结图谱,最终于2009年完成,即IASLC图谱(IASLC map/nodal charts)[14](图3),新图谱为每一组淋巴结规定了精确的解剖学定义,被新版采纳,见表3。将14站淋巴结分为7大区域,各站淋巴结均有明确的上、下界,避免了各组淋巴结位置的重叠,对容易混淆的第4站和第10站淋巴结,不再以胸膜反折作为分界线,而是分别以奇静脉下缘(右侧)和肺动脉上缘(左侧)为界。锁骨上淋巴结和胸骨切迹淋巴结归入第1站淋巴结。对第7站隆突下淋巴结,新图谱摈弃了Naruke的定义,而延续MD-ATS的定义,为2009年第7版AJCC和UICC分期的修订提供了依据。准确定义各组淋巴结是肺癌N分期和治疗的基础,为方便分组,特别是未经外科切除的病例,相邻的淋巴结被划分为“淋巴结区(nodal zones)”,虽不适用于现在的标准命名,但可为评估增大或融合的跨组淋巴结转移提供便利。尽管Naruke图谱已成过去,但简单而实用,MD-ATS图谱也在北美部分地区继续使用,而在我国,两种图谱均有使用,所谓温故而知新,转载于此,以便集中对照与查询,但所引图片务必注明出处,以便保护其版权。图片略有修饰,若有不当之处,敬请原图作者及各位读者批评指正。

表3 国际肺癌研究会(IASLC)提议的正常淋巴结分区及每个区域淋巴结分组图谱中的解剖定义[14]

续表3 国际肺癌研究会(IASLC)提议的正常淋巴结分区及每个区域淋巴结分组图谱中的解剖定义[14]
a:淋巴结亚组分类(subcategories of station)可供选择。临床上一般称为淋巴结“分组,grouping”为了避免与下文的TNM分组混淆,此处仍然应用原文词汇“站,stations”。

表4 肺癌TNM分类

续表4 肺癌TNM分类
a:任何大小不常见的浅表肿瘤,只要局限于支气管壁,即使累积主支气管,也定义为T1a;b:单发腺癌,小于或等于3.0 cm,附壁性生长为主,且浸润性成分在任何点都小于或等于0.5 cm;c:T2期肿瘤,如果小于或等于4.0 cm或大小不能确定,归入T1a;如果大于4.0 cm,小于或等于5.0 cm,则为T2b。d:大部分肺癌患者的胸腔积液或心包积液是由肿瘤所引起的,但如果多次细胞学检查未能找到癌细胞,积液又是非血性和非渗出的,临床判断该积液与肿瘤无关,这种类型的胸腔积液不影响分期,患者应归类为M0;e:包括累及单个远处淋巴结(非区域淋巴结)。

表5 肺癌TNM分期组别(续表4)

续表5 肺癌TNM分期组别(续表4)
A:前面(腹前面);B:后面(背侧面)。引自Mountain和Dresler,由美国胸科协会(ATS)推荐[13]。
图2 MD-ATS图谱
3 TNM分期(TNM Staging)
TNM分期是恶性肿瘤患者首要的预后因素。目前肺癌TNM分期为第7版[15],涉及包括中国在内20个国家45个数据库中的81 015例肺癌患者,其资料由IASLC完成数据回顾、验证及统计学分析,向UICC和AJCC提出修改意见并被采纳,由WHO新版收录。TNM分期独立地基于疾病解剖学程度,而非其他诸如临床症状或肿瘤分子生物学特征,成为全球肺癌治疗的金标准。尽管如此,本着开放而发展的理念,UICC计划将于2017年1月推出第8版肺癌TNM分期[16-18],分期建议已于2016年JTO第1期刊出(表4、5)[19]。第8版收集了1999-2010年国际上16个国家,35个数据库中94 708例初选肺癌患者,77 156例最终纳入研究,其中约2/3为腺癌患者,体现了近年来肺癌流行病学变化趋势。亚洲地区(日本、韩国、中国)贡献最大,占全部数据的79%。第8版进一步精准化,将1 cm,而不是第7版的2 cm作为T分期分界值(cut-off value)[16],以此强调肿瘤大小与T分期的关系,肿瘤直径越大,T分期越高,患者预后越差(表6)。建议将T1分为T1a(≤2 cm)和T1b(>2~≤3 cm);将T2分为T2a(>3~≤5 cm)和T2b(>5~≤7 cm);将大于7 cm者定义为T3。建议将原发肿瘤所在肺叶内发现结节定义为T3,而同侧非原发肺叶内出现结节定义为T4,缘于研究发现原发肿瘤所在肺叶内出现卫星结节预后与其他T3相同,非原发肿瘤所在肺叶内出现转移灶预后与其他T4相同,好于M1。可以预见,第8版肺癌TNM分类中原位鳞状细胞癌(squamous cell carcinoma in situ,SQCCIS)将被纳入,与原位腺癌(adenocarcinoma in situ,AIS)一样,归于Tis并分别标示。MIA将被归为T1mi,此处mi与另一个被编码为后缀的(mi)不同,后者使用圆括号,指的是直径小于或等于0.2 mm的淋巴结微转移(micrometastasis)[20],微转移与最大径大于2.0 mm的淋巴结宏转移(macrometastasis,ma)或肉眼可见转移相对应,而(mi)特指孤立性肿瘤细胞(isolated tumour cells,ITCs),又称为细胞簇(cellular clusters),为形态学技术(HE和免疫组织化学)或非形态学技术(流式细胞仪和DNA分析)证实存在于淋巴结或骨髓中最大径小于或等于0.2 mm的微转移,在肿瘤发生远处转移以前,这些成功离开原发灶又躲过前哨淋巴结免疫识别的肿瘤细胞,出现于骨髓中被称作播散肿瘤细胞(disseminated tumor cells,DTCs),在血液中的则被称为循环肿瘤细胞(circulating tumour cells,CTCs)[21],二者可相互流通,为了防止被肿瘤相关巨噬细胞(tumour associated macrophages,TAMs)或脾窦/淋巴窦的滤泡树突状细胞(follicular dendritic cells,FDCs)清除,肿瘤细胞自始至终均非单打独斗,而是抱团形成球形或饼状,在湍急或缓慢的血液中集结流窜,呈现“集团性侵袭(collective invasions,CVs)”[22-23],形成“堰塞湖(barrier lake)”,产生溃坝(dam burst)效应,或留或走,若机体抗瘤能力不足或治疗不及时,最终形成宏转移。DTCs与CTCs是否为同一克隆目前尚不清楚,需进一步研究,但有的通过“达尔文选择(Darwinian selection)”融入新环境,形成小生境(niche),形态发生改变,癌细胞呈现多形性及异质性,不仅原发灶与转移灶存在显著组织学差异,而且可去分化(dedifferenciation)或转分化(trans-differenciation),更具侵袭性。所谓“狡兔三窟”,其动态变化,不仅成为肿瘤复发及转移的源泉,而且也是癌症作为全身性疾病的佐证。新版规定仅包含ITCs的淋巴结不计入总的阳性淋巴结数,不改变N分期,尽管没有资格成为N1、N2、N3或M1b,但ITCs具有固有的识别符号,表7分别列举了各自独特的编码及定义。DTCs与CTCs被定义为cM0(i+),仍然归类为M0,但影像学发现远处转移或组织学证实转移灶大于0.2 mm,则归入M1。请注意:新版仅将直径小于或等于0.2 mm的转移灶定义为微转移,并没有提及0.2~2.0 mm转移瘤的问题,也就是说没有明确界定或更改ITC和微转移的诊断分界值,提示任何有志之士,不妨做进一步相关研究。M分期中,第8版细分为M1a(胸腔内)、M1b(胸腔外单发转移)及M1c(单或多个器官多处转移),其中M1b与寡转移(oligometastasis)[24]的概念相呼应。寡转移性病(oligometastatic disease)对应于系统性病(systemic disease)[25]。寡转移指的是患者发生有限的部位和数量的转移[24-31],最常发生于肺、脑、肾上腺、肝及骨。一般认为转移灶小于或等于5个[24-27,29-31],一说小于或等于3个[28]。也有根据肿瘤位置、体积、进展速度、组织学特征和遗传学特点综合评估,还有研究者基于转移的时间和进展对患者进行分类,把诊断最初即存在的转移称为从头寡转移(de novo oligometastases)[26],而系统治疗后仍存在的残留转移灶,称为诱导寡转移/寡复发(induced oligometastases/oligo-recurrence)[26]。寡转移预后较广泛转移者好,行转移灶手术切除或立体定向放疗(stereotactic body radiation therapy,SBRT),约1/4患者在清除所有转移灶后获益,有的能长期生存[26-27,30-31]。
A:前面(腹前面);B:A-P区(主-肺动脉区);C:左侧面。引自Mountain和Dresler,由美国胸科协会(ATS)推荐[13]。

图3 IASLC图谱表6 第7版与第8版T分期对照[16,19]

表7 淋巴结孤立性细胞团编码代表意义(isolated tumour cells,ITCs)[32]
相同编码同样适用于远处转移,届时,PN将被替换成M,即M0(i+)。
4 肺癌组织学分级(histological grade)
新版采用形态结构、细胞核二选一,或将它们组合起来的方法将肺腺癌分级。附壁型腺癌为高分化,腺泡状腺癌与乳头状腺癌为中分化,而微乳头状腺癌及实体性腺癌则属于低分化。研究表明,腺泡型腺癌的筛状模式(cribriform pattern)被认为类似实体型腺癌,预后不佳[33]。
5 活检小标本及细胞学(small biopsy/cytology)的诊断分步(step by step)
新版首次为小活检及细胞学标本制订诊断标准,在第21页精心制作了诊断流程图(algorithm)并分步介绍。自2011年IASLC/ATS/ERS分类问世之初,国内周晓军等[34]、钟文昭等[35]早有解读或翻译,在此不赘述。事实上病理诊断是个连续过程,基于传统HE并借助于免疫组织化学及黏蛋白等特殊染色,流程可简可繁,根据具体情况进一步优化,为此,新版引用并总结了许多诸如“最佳临床实践的病理学考虑因素”之类的标准或经验之谈,如选用胞核和胞质分别阳性的“鸡尾酒(cocktails)”抗体,将TTF-1/CK5/6、p40/naspin-A或p63/CK7等搭配,可减少用于鉴别诊断的抗体。新版推荐能HE诊断的就不必使用免疫组织化学,若镜下腺样或鳞状分化清晰可见,则此肿瘤分别诊断为腺癌或鳞状细胞癌;若存在一定程度的不确定性,应描述为低分化非小细胞癌,倾向腺癌或鳞状细胞癌,并做注释,此诊断仅凭光镜做出;如果常规病理和免疫组织化学对腺癌和鳞状细胞癌的诊断都不支持,可以酌情使用“非小细胞肺癌,非特殊类型(non small cell lung carcinoma,not otherwise specified,NSCLC-NOS)”这一术语,但不可滥用,估计所占比例不足活检小标本的5%,更不得使用非鳞状细胞癌(nonSQC)的病理诊断。由于多达1/3的腺癌可以表达p63,如果腺癌TTF-1阳性,即使同时表达任一鳞状细胞癌标记(如p63),该肿瘤仍然要归类为“NSCLC,倾向于腺癌”,实际上那些表达p63和TTF-1形态学缺乏鳞状细胞癌特征的肿瘤可能都是腺癌,但如果p63和TTF-1表达于不同的肿瘤细胞且各自比例均大于10%,则支持腺鳞癌的诊断。

表8 新IASLC/ATS/ERS活检小标本/细胞学分类诊断术语与2015年WHO分类对照[38]
a:一种疑似LCNEC的非小细胞癌,但常规染色不能证实存在神经内分泌分化;b:出现腺癌、鳞状细胞癌两种成分,可代表腺鳞癌;c:可代表腺鳞癌。
表8列举了新版与2011年IASLC/ATS/ERS活检小标本/细胞学分类诊断术语的异同点。取材不易,务必珍惜,但活检小标本/细胞学毕竟局限,只是冰山一角,病理要有所为,有所不为,如AIS/MIA及大细胞癌的诊断必须基于完全切除的手术标本而非穿刺活检小标本,不可缺位,更不可错位或越位。细胞学检查,也称液体活检[36],有条件的可制成细胞蜡块并辅以免疫组织化学或DNA检查,提高癌细胞检出率[37]。
我国幅员辽阔,各地医疗水平不均,有的县级医院尚未开展免疫组织化学等辅助检测手段,应用新分类可能会遇到一些困难,所幸新版专门提及医疗资源不足环境中的分类,认为肺腺癌的诊断及亚型分类可仅凭光镜评估而做出,对于实体性腺癌,应仔细寻找线索,如在两个高倍视野的任意一个中至少有5个肿瘤细胞中出现细胞内黏液,也可以确诊。若NSCLC显示神经内分泌的形态学特征,可先行诊断为“大细胞癌,具有神经内分泌形态特点,可能为大细胞神经内分泌癌,需要做免疫组织化学进一步证实”。病理应有所担当,而非顾左右而言他或模棱两可,以便临床及时治疗。
6 肺癌分子假说(molecular hypothesis of lung cancer)
胚胎在原始肺芽形成后,形态上重复分叉,最终形成中央气道(支气管)和终末呼吸单位(terminal respiratory unit,TRU)。TRU由终末细支气管、肺泡管、肺泡组成,包含Clara细胞和Ⅱ型肺上皮细胞,二者及其发生的肿瘤均可表达TTF-1[39],而中央气道存在基底细胞和黏液细胞,二者发生的肿瘤不表达TTF-1。正是基于表达谱的分层聚类分析将肺腺癌分为TRU相关和非TRU型腺癌,这就是肺癌发病“两室模型(two-compartment model)”分子假说(图4)[40-41]。解剖学上,肺上皮细胞位于与其特定功能相关的两个隔室,中央气道系统主要用于空气传导,而外周终末呼吸单位进行气体交换。每一隔室均已确定存在不同的干细胞小生境。不同的隔室相应触发不同类型的肺癌。吸烟可引起中央气道及外周气道致癌,尽管对前者的影响更大。与此相反,非吸烟患者的肺癌似乎由特异性针对外周终末呼吸单位的不明原因所导致,EGFR激活非吸烟患者有关,而KRAS活化在吸烟者中更加频繁。同样存在其他引发突变的因素,该模型仅揭示了主要的途径,其他未知的小通路也可能存在。图5为常见肺癌组织学亚型的肿瘤细胞起源示意图,引自最近一期《新英格兰医学杂志》[42]。
7 分子分型(molecular classification)
近年来,肺腺癌的分子分型已经初露头角,如关键原癌“驱动基因”事件,包括KRAS和EGFR的互相排斥性激活突变。肺癌的分子靶向治疗要求更精确的组织学分类,如腺癌对多靶点抗叶酸药物培美曲赛(pemetrexed)和抗血管内皮生成药物贝伐珠单抗(bevacizumab)治疗有效,而鳞状细胞癌对培美曲赛治疗效果不如腺癌,用贝伐珠单抗治疗可引起威胁生命的大出血。虽然纳武单抗(nivolumab)作为PD-1抑制剂仅在晚期鳞状细胞癌中获批,但其疗效尚待进一步验证。尽管如此,第8版TNM分类并没有像一些药商期待的那样,进行所谓的驱动基因分类(driver gene classification),因为大部分癌症至少包含一种似是而非、对治疗具有指导意义的基因改变,缘于“实际意义的癌基因就像长有长尾,真身难见(a long tail of actionable cancer gene)[43]”,疗效令人难以捉摸,表明传统临床试验设计方法很可能没有可行性,分子分型尚需时日(there is still a long way to go)。但2016年第4版《WHO中枢神经系统肿瘤分类修订版》[44]的发行,预示着肿瘤分子分型已经提上议事日程,估计WHO不会再等大约10年,而很可能在不久的将来,新版同样新增分子分型内容,出版4+,即修订版。

图4 肺癌发病“两室模型(two-compartment model)”分子假说示意图

图5 常见肺癌组织学亚型的肿瘤细胞起源示意图
表9列举了肺癌的主要基因变化,从中可以看出:女性,无吸烟患者及伴黏液产生的实体型腺癌,常伴ALK融合基因突变[45]。对附壁型腺癌、乳头型腺癌及微乳头型腺癌,若TTF1阳性,可能存在EGFR基因突变[42];在TTF1阴性的浸润型黏液腺癌和胶样腺癌中,可能存在KRAS基因突变;ALK、EGFR及KRAS均无突变者,又称为三阴性病例(triple negative cases),可出现RET[46]、ROS1突变[47-48],后者主要发生在非吸烟人群,无人种差异,发病年龄较轻,患者以腺癌为主,晚期克唑替尼治疗有效且较安全。
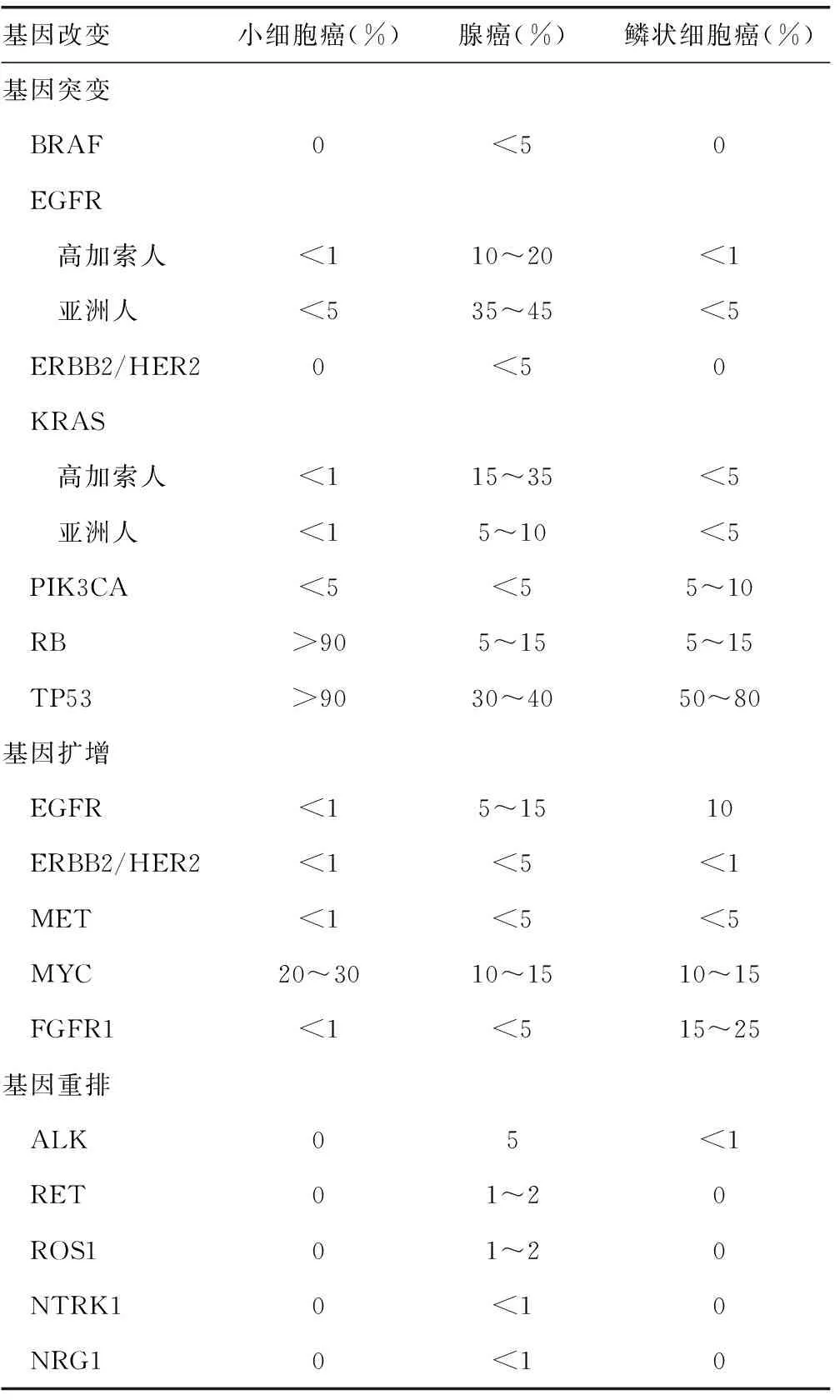
表9 肺癌的主要基因变化
新版着重介绍了肺腺癌EGFR突变的特点及肺癌ALK融合基因的特性。EGFR突变发生在酪氨酸激酶受体激酶结构域,导致组成性激活下游信号没有配体。女性和不吸烟者首当其冲,但与之相关的生物学基础尚不明了。尽管文献中报道了许多其他突变,如密码子G719及外显子20框内插入突变,但最常见的突变为密码子858(L858R)的点突变和外显子19框内缺失,约占所有病例的90%以上。其中EGFR突变与肺腺癌具有高度特异性。EGFR突变在附壁样和乳头状生长方式的腺癌中频繁检测到,并与TTF-1阳性有关。其他主要肺癌驱动基因如KRAS、ALK、ROS1、BRAF、RET和ERBB2遗传改变,与EGFR突变相互排斥,大概与它们共聚于同一细胞内信号通路,通路中单一损伤足以驱动肿瘤形成有关。罕见的家族胚系突变,尤其是EGFR的T790M突变,形成肺腺癌的风险较高,可为多灶性。EGFR突变的肺腺癌显示种族差异,患者中高加索人(白人)约占10%~15%,亚洲人约占30%~40%。EGFR突变除了预测表皮生长因子受体酪氨酸激酶抑制剂的治疗反应,还是重要的预后因子。EGFR外显子20框内插入突变和罕见的T790M突变,与表皮生长因子受体酪氨酸激酶抑制剂原发性抵抗有关,而T790M附加突变是继发性表皮生长因子受体酪氨酸激酶抑制剂最常见的原因。
肺癌ALK融合基因特性。ALK与ALK-1不同,虽然ALK-1融合多见于在间变性大细胞淋巴瘤和炎性肌纤维母细胞肿瘤,但特异性EML4-ALK融合几乎只发现于肺癌。肺癌的ALK重排强烈提示与腺癌组织学类型有关,特别是出现砂粒体的腺泡和(或)实性腺癌及富于印戒细胞的肠型腺癌。EML4-ALK融合占肺腺癌ALK重排的90%以上,其他较少见的ALK融合成员包括KIF5B、LKC1、TFG,与EGFR突变不同,ALK重排在非吸烟患者中频繁,与女性相关性不大。ALK阳性肺癌患者中位数年龄比ALK阴性患者年轻约10岁。ALK基因异常相关性肿瘤统称为ALKoma[49]。ALK阳性的肺腺癌构成非小细胞肺癌的4%~5%,种族差异尚未见报道。与EGFR突变不同的是,ALK重排可预测ALK抑制剂治疗反应,但并不是一个预后因素。ALK检测需要注意免疫组织化学判读对阳性细胞没有量的要求,任何百分比的肿瘤细胞呈强的颗粒状胞质染色,即可视为阳性,用一个加号(+)表示即可,而并非乳腺癌HER-2检测那样,需要判定1个加号(+),2个加号(++)或3个加号(+++),也无需使用程度副词强或弱,但需除外巨噬细胞及淋巴细胞、神经和神经节细胞、黏膜上皮或残存的正常肺泡上皮及坏死组织背景着色。若仅出现数量较少、胞质弱的表达,可判断为可疑阳性,用(+/-)表示,就像乳腺HER-2两个加号(++)一样,应采用FISH法,进一步甄别。
8 分享与分工(share and division of work)
临床医生力求活检出血少,创伤小,恨不得取一个细胞就确诊,但病理基于“经验法则(rule of thumb)”讲究证据,既要满足形态学诊断,又要进行分子分型,还可能为标本库留存样本,僧多粥少,为此形成矛盾,但学科间统筹管理、资源共享的前提是必须优先保证病理诊断,组织库留取不可影响pTNM分期,而且操作必须标准化,如正常组织(normal,N)需距肿瘤组织(tumour,T)5 cm以外、癌旁组织(around the tumour,A)被定义为距肿瘤组织1 cm以内。
如同骨肿瘤的诊断一样,肺癌也需要临床、影像与病理三者结合,对于MIA这样的特殊病例,任何一家均不能独善其身,需临床病理讨论(clinical pathological conference,CPC)或MDT[7],临床医生提供患者的第一手信息,借助于肺癌的症状与体征(表10),结合影像学所见,综合判断。病理就像树叶,而影像学如同森林,其最大的优势是可以观察肿瘤全貌(panorama),宏观上诠释全部图像,分辨出实性成分和磨玻璃样成分各自所占比例,目前认为实性成分与侵袭性生长方式相对应,而这一点恰恰弥补了病理取样不足的缺陷。影像学上将单个,球形,直径小于或等于3.0 cm,无肺不张及肺门异常的肺内占位性病变称为孤立性肺结节(solitary pulmonary nodule,SPN),其中小于或等于2.0 cm的称为小结节,小于或等于1.0 cm者称为微结节,而大于3.0 cm的称为肿块(mass)。同时注意胸膜反应(pleural reaction)或(和)胸膜凹陷征(pleural indentation)。通常浸润性腺癌和鳞状细胞癌(SQC)在X线片上表现为外周肺孤立性结节或肿块。空洞常见于SQC,但几乎不出现在小细胞癌。肺门体积大的癌性肿块可以是任何细胞类型,最常见的是SQC或小细胞癌,最不可能为浸润性腺癌。肺炎样的实变阴影可见于浸润性黏液腺癌和SQC伴阻塞性肺炎。肺外周较大的肿块最常见的浸润性腺癌,其次是SQC和大细胞癌。钙化在中央型支气管典型类癌中较常见。CT上AAH表现为小于或等于0.5 cm、密度很淡的纯磨玻璃影(pure ground glass opacity,pGGO),可单发或多发;非黏液型AIS多表现为pGGN,也可呈混合型毛玻璃影(mixed ground glassopacity,mGGO);黏液型AIS,多表现为实性结节(solid nodule);而侵袭性腺癌通常为实性结节,也可以是部分实性(part-solid nodule)。非黏液性MIA,通常表现为以毛玻璃样成分为主伴部分实性的结节,直径小于或等于0.5 cm。
低剂量螺旋CT(low-dose helical computed tomography,LDCT)能发现直径小于1.0 cm的早期肺癌。近年一种由病理医生参与CT引导下的穿刺活检术“快速现场评估(rapid on-site evaluation,ROSE)”用于临床[50-55],ROSE一般是由一名细胞学病理医生操作,经济而实用,穿刺组织一经获得,先在载玻片上轻轻滚动或沾一沾,制成细胞印片或涂片,风干后放入75%乙醇中固定,做快速HE或Diff-Quick染色,然后在床旁显微镜下观察,以确定穿刺部位是否准确,先做初步分流(bypass):是癌还是非癌?若是癌,初步判断是小细胞癌还是非小细胞癌,如果是后者,倾向鳞状细胞癌,还是腺癌?并评估活检组织是否足够用于病理诊断及精准治疗。ROSE技术像一朵盛开的玫瑰花(rose),全程不超过5 min,既可初步诊断,又可做适当的组织分流,为下一步石蜡切片制作、免疫组织化学检查及基因检测等做必要的准备。

表10 肺癌症状与体征[1]

续表10 肺癌症状与体征[1]
9 新版结构与内容变化
新版将不成熟性畸胎瘤ICD-O编码改为1,而非心脏及卵巢同名肿瘤那样,编码为3。同时肺内胸腺瘤已为恶性,ICD-O编码由8580/1改为8580/3。删除了遗传肿瘤综合征。一些显著改变,新版主编之一的Travis等[56]专门做了论述,此不一一讨论,具体变化详见新增病种。
10 新增病种中部分病种不仅改换名称,而且增加了新的内容,具体分述如下
10.2 微乳头状腺癌 此种变异型的肿瘤细胞成分以乳头簇(papillary tufts)生长为主,缺乏纤维血管轴心,形如花蕾(florets),与肺泡壁相连或分离,肿瘤细胞小而立方形,具有不同程度的核非典型,常由于乳头折断或游离,形成类似甲状腺乳头状癌或卵巢浆液性癌那样的沙粒体,较为特别。有时肺泡间隙可见环状(ring-like)腺样结构,“漂浮”在肺泡间隙内,血管及间质浸润常见。与乳头状腺癌不同之处在于后者腺样肿瘤细胞沿中央纤维血管束生长,无需间质浸润便可诊断。部分表现为腺泡型或贴壁型腺癌,而肺泡腔内有微乳头存在,应被诊断为微乳头型。微乳头状腺癌预后差,即使早期诊断仍然预后不良,可能与其独特“由内而外”的生长方式(“inside-out growth”pattern),使肿瘤细胞反向生长,破坏血管基膜和间质金属蛋白酶,导致肿瘤细胞簇向四周扩散,发生脉管转移有关。
10.3 浸润性黏液腺癌(invasive mucinous adenocarcinoma,IMA) 旧版称黏液性细支气管肺泡癌。大体呈胶样,边界不清,质软。镜下杯状或柱状肿瘤细胞以形成丰富的细胞外黏液为特征,核定向排列于细胞基底部,核的非典型通常不明显,甚至缺乏,肿瘤周围的肺泡间隙常充满黏液,有的表现为弥漫扩散的结节或肺炎样实性小叶。缺乏中央促结缔组织增生、碳末沉着或胸膜凹陷(pleural puckering)。IMA具有独特的细胞学特征:细胞外黏液背景中形成所谓的“朦胧的蜂窝(drunken honeycomb)”伴核间距不均。除了实体性腺癌外,附壁型(最多)、腺泡性、乳头状、微乳头状均可见。与MIA及AIS的鉴别诊断见表3。IMA的ICD-O编码除了8253/3外,尚有另一个ICD-O编码8254/3,代表浸润性黏液/非黏液混合性腺癌,诊断标准是两种成分都超过10%。肿瘤细胞表达CK7、CK20,常不表达TTF-1、Napsin A。如果肿瘤中混有附壁性、腺泡性、乳头状和微乳头状癌等非黏液腺癌成分,非黏液腺癌成分大于或等于10%时,则诊断为混合性浸润性黏液型和非黏液型腺癌,并需注明非黏液腺癌成分的组织类型。尽管非黏液浸润性腺癌可产生黏液,但缺少富有黏液的杯状细胞和柱状细胞。还要注意来自胰腺、卵巢、结肠等与转移性黏液腺癌鉴别。表11列举了几种易混淆疾病的鉴别诊断。需借助于临床及影像学查找原发灶,胰腺黏液腺癌更易表达CK20及MUC2。转移性结直肠癌常表达CDX2与CK20,而不表达CK7。IMA与KRAS突变密切相关,而非黏液性腺癌更可出现EGFR突变,偶见KRAS突变。浸润性黏液腺癌需要与伴有黏液产生的,形态学缺乏杯状或柱状细胞的腺癌相鉴别,当光镜下或黏液染色证实黏液产生但比例又达不到上述诊断标准时,仍然按照新分类中浸润性腺癌的标准进行分类,同时注明有黏液产生,可以描述为“伴黏液产生”或者“伴黏液样特征”,如实体型腺癌伴黏液产生。
10.4 胶样腺癌(colloid adenocarcinoma) 胶样腺癌是一种丰富的黏液池取代气道间隙的腺癌。曾称为交界恶性黏液性囊性肿瘤及黏液性囊腺癌。镜下大量的细胞外黏液形成黏液池,使肺泡腔扩大,肺泡壁破坏,呈明显浸润性生长突入肺泡间隙,沉积的黏液致肺实质扩大并分割,产生富含基质的黏液池,而灶性或高柱状伴杯状细胞特征的肿瘤成分呈附壁样生长,肿瘤腺体可漂浮在黏液性物质当中,典型者黏液性肿瘤细胞不完全沿肺泡,且分化极好,上皮呈假复层排列,核轻度非典型,核分裂较少,坏死罕见,小标本或术中冰冻时给诊断带来挑战。与浸润性黏液腺癌不同之处在于前者的黏液池替代其下的肺泡结构,散在黏液性肿瘤细胞簇填充气体间隙。肿瘤细胞除了表达MUC-2、CDX2及CK20,可局灶或弱表达TTF-1、CK7和Napsin A,结合临床病史有助于与转移性黏液腺癌区别。
10.5 肠型腺癌(enteric adenocarcinoma) 由具有结直肠腺癌某些形态学和免疫表型特点的成分所组成,且肠分化成分占肿瘤的50%以上,几乎全部位于外周肺。肿瘤组织均可显示腺泡和(或)筛状及乳头管状(腺样)结构,嗜酸性细胞呈高柱状或立方状,具有刷状缘,假复层核呈空泡状,中央可见地图样或点状坏死,偶见中央瘢痕及胸膜凹陷。至少可表达一种结直肠癌的标记物如CDX2、CK20或MUC2,半数病例可表达肺腺癌标记物CK7和TTF-1,结合临床病史,以资与转移性结直肠癌鉴别。转移癌边界清楚,无纤维化特征,脉管内瘤栓多见。对于形态学与结直肠腺癌相似,但免疫组织化学不表达肠型分化标记的原发性肺腺癌,新分类推荐使用“肺腺癌伴肠形态学特征”,而非“肺腺癌伴肠型分化”。新版删除了印戒细胞癌及透明细胞癌,认为二者为细胞学特征而非组织学亚型,即可发生于肺腺癌实体成分内,也可见于其他类型如腺泡、乳头及微乳头腺癌,不应当纳入“为主”亚型或按百分比综合归为组织学亚型,尽管很小,也应在诊断后按其细胞学特征提及,如腺泡型腺癌伴印戒细胞特征(with signet ring features)或伴透明细胞特征(with clear cell features)。从表8可以看出,约35%~45%的亚洲人呈现KRAS基因突变,多见于肠性腺癌及其变异型,最近《Nature》专门撰文阐述了由其驱动的肺癌基因突变及化学模式[58]。
10.6 微浸润性腺癌(MIA) 被定义为孤立性,以附壁样生长方式为主且浸润灶小于或等于0.5 cm的小腺癌(≤3.0 cm),通常为非黏液性,黏液性罕见。新版引用了主编Travis等[3]的MIA诊断标准:以附壁型生长方式为主直径小于或等于3.0 cm的孤立性腺癌,任何一个病灶浸润成分最大径小于或等于0.5 cm。浸润性成分的测量不光为附壁型,还要任何一种组织学亚型如腺泡、乳头、微乳头、实体性、胎儿型或浸润性黏液腺癌;肿瘤细胞浸润间质肌纤维母细胞,尚需除外肿瘤浸润淋巴管、血管、气体间隙或胸膜,无气道扩散及肿瘤坏死。MIA常见细胞学类型为非黏液性(起源于Ⅱ型肺泡上皮或Clara细胞,ICD-O编码为8250/2,为交界性),罕见黏液性(癌细胞高柱状,细胞核位于基底部,胞质富含黏液,有时可类似杯状细胞。其ICD-O编码为8257/3,属于恶性)。浸润性结构是指腺泡型、乳头型、实体型和微乳头型腺癌成分,如存在血管淋巴浸润性黏液腺癌与非黏液性原位腺癌(AIS)/MIA/LPA的鉴别诊断,所给数据为报告呈阳性的部分病例,引自Travis等[2]的文献。

表11 浸润性黏液腺癌与非黏液性原位腺癌(AIS)/MIA/LPA的鉴别诊断[3]
管、胸膜、肺泡内肿瘤细胞,坏死和气道播散等,则不能诊断MIA,而应诊断为附壁型腺癌。新分类建议出现多个浸润灶,以其中最大者直径为诊断标准。影像学上,MIA表现不一,非黏液性通常表现为以GGN成分为主的部分实性结节,实性成分位于病变中央,小于或等于0.5 cm。黏液性MIA罕见,表现为实性或部分实性结节[58]。当MIA出现淋巴管/血管或胸膜侵犯,肿瘤出现坏死,浸润成分最大径大于5.0 mm或出现STAS,应诊断为附壁型腺癌。
10.7 原位腺癌(AIS) AIS被定义为纯粹附壁型直径小于或等于3 cm的局限性腺癌,肿瘤细胞沿固有的肺泡结构生长,无间质、血管及胸膜侵犯,缺乏腺泡、乳头、实体型及微乳头生长方式及肺泡内肿瘤细胞(intra-alveolar tumour cells)。AIS大多数为黏液性,非黏液性罕见。旧版称为细支气管肺泡癌(bronchioloalveolar carcinoma,BAC),新版摒弃,原因是旧称BAC包括部分AIS、MIA、LAC和IMA,这些从侵袭前病变、低度到高度恶性肿瘤都归为BAC,显得混乱。事实上大多数腺癌同一肿瘤的不同区域可观察到AAH-AIS-MIA到浸润性腺癌的谱系性病变,其中相当一部分具有附壁性生长方式(lepidic patten),而恶性程度迥然不同。AIS需要与另一个侵袭前病变AAH相鉴别,AAH常小于或等于0.5 cm,局部中央腺泡性肺泡壁增厚,立方状肺泡上皮数量增加,相邻细胞间有裂隙,呈不连续排列,而AIS的瘤细胞在肺泡壁上呈连续排列,AIS通常体积更大(>0.5 cm),肿瘤细胞更丰富、拥挤且异型性更大,肿瘤性肺泡形态与周围正常肺泡转换更加突然,而在AAH二者可见渐进改变的过程。尽管AIS属于侵袭前病变,但早年认为BAC沿肺泡壁生长蔓延,尤其多灶性者面积之广,超出任何一个其他部位的高级别上皮内瘤变,对换气功能危害极大,预后不佳,但自从更名为AIS,许多文献都认为经手术切除被证实有100%无病生存(DFS)和无复发生存(RFS),这种差异显然有待循证医学或大宗病例进一步验证。AIS通常小于2.0 cm,但偶尔还是可达3.0 cm。2015版还提出对于大于3.0 cm的肿瘤,如形态完全符合原位腺癌的诊断标准,可做出“附壁生长为主的腺癌,倾向(或疑为)原位腺癌”的诊断。为了与MIA相区分,如果结果显示浸润灶大于5.0 mm,应该诊断为“贴壁为主型腺癌”。如果大于3.0 cm的肿瘤经完整组织学采样并无浸润成分或浸润成分小于或等于0.5 cm,应归为“贴壁型腺癌,可疑AIS或MIA”。AIS/MIA的诊断必须基于完全切除的手术标本,而小活检标本不可诊断。影像学上,AAH通常为小于或等于0.5 cm的GGN,而AIS在HRCT上比AAH的密度稍高,有时病变表现为部分实性结节,偶为实性结节。在诊断“AIS”时最好附上2004年WHO分类中“原来的BAC”做辅助说明或过渡。但当“AIS”的肺泡结构消失和(或)出现肌纤维母细胞性基质,就应诊断为腺泡型腺癌。AIS的ICD-O编码为8140/2,根据定义不会出现CTCs/DTCs。新版摘掉了其作为癌的帽子,在我国,意味着一些不能享受癌症患者的待遇,如纳入大病医疗报销等,故诊断务必慎重,而是否进一步放化疗,也是研究的课题。
10.8 肺神经内分泌肿瘤(neuroendocrine tumours,NET) 新版单设“肺神经内分泌肿瘤”一章,集中了形态有异而共同表达神经内分泌标志物的一组肿瘤。其实早在1981年WHO第2版分类就曾将类癌、小细胞肺癌(SCLC)和大细胞神经内分泌癌(LCNEC)单独分组。新版并非单纯复古,而是更有条理,从侵袭前病变到癌,从低级别到高级别,从单纯神经内分泌癌到复合性癌,不一而足。新版分类再次说明认识的反复性和无限性,追求真理的过程,就是一个从实践到认识,从认识到实践波浪式前进或螺旋式上升的过程。与胃肠道和胰腺神经内分泌肿瘤的统一分类不同的是,尽管这些肿瘤归为一类,但重复性差,其临床特点、流行病学、病理特征和基因学上均有差异[59],但可借用其分级,如,NET,G2。神经内分泌肿瘤的诊断标准如下[2]。典型类癌:具有类癌的形态特点,直径大于或等于0.5 cm,有丝分裂小于2/2 mm2,缺乏坏死。不典型类癌:具有类癌的形态特点,核分裂2~10/2 mm2,或出现坏死(常强调)或二者均出现。大细胞神经内分泌癌:(1)具有神经内分泌肿瘤的形态特征(器官样、巢状、栅栏样、呈现菊形团或呈小梁状排列);(2)核分裂比率高,常大于10/2 mm2(中位数达70/2 mm2);(3)坏死(常较大区域出现);(4)具有非小细胞癌的细胞学特点,如细胞增大,核质比降低,核空泡状,染色质粗细不等和(或)常伴核仁。有时染色质纤细并缺乏核仁,但由于体积硕大、胞质丰富而貌似非小细胞癌;(5)免疫组织化学染色1个或多个神经内分泌标记物[而非神经元特异性烯醇化酶(neuron-specificenolase,NSE)呈阳性]和(或)经电镜观察具有神经内分泌颗粒。小细胞癌:细胞较小(通常小于3个成熟淋巴细胞的直径)。(1) 胞质稀少;(2)胞核染色质呈细颗粒状,缺乏或隐约可见核仁;(3)核分裂比率高,常大于10/2 mm2(中位数达8/2 mm2);(4) 坏死频繁,常出现大片坏死。
表12列举了基于临床病理特征神经内分泌肿瘤的鉴别诊断要点。诊断NET应注意:(1)由于细胞分化差,形态幼稚,胞质稀少,裸核状,容易出现“人工挤压(crush artefact)”或染色质条纹现象(即azzopardi effect效应,血管壁变性呈强嗜碱性),导致标本模糊、蓝染,造成诊断困难,但恰好这种“蓝湖”和(或)“烂糊”形态,具有诊断提示作用,高级别如小细胞癌比低级别如类癌更容易出现。此时,应巧用Ki-67,尽管无法用来鉴别典型类癌与不典型类癌,但在活检小标本中可防止过度诊断,Ki-67<20%时,强烈支持非高级别,而大于50%时,几乎全部为高级别NET。有丝分裂应在活性最高的2 mm2区域,也就是热点(hot spot)进行计数,而非旧版要求的10个高倍镜视野。(2)病理报告中应记录典型和不典型类癌的有丝分裂率(n/2 mm2)和坏死状态,后者Ki-67约5%~20%,常为灶性坏死,若大面积坏死也不支持,很可能是小细胞癌。(3)精准医学讲究证据,借助于Syn、CgA、CD56等,选用2种或以上神经内分泌标记物,均呈阳性方可支持诊断。其中Syn较可靠,CgA常在核旁颗粒状表达,低倍镜下易被忽略,但特异性较好,而CD56敏感性较好。如果仅表达CD56或NSE,诊断NET要谨慎。(5)小细胞癌不仅细胞较小,裸核,而且染色质细腻,细颗粒或椒盐样;而大细胞神经内分泌癌的细胞不仅较大,还可出现不同程度的胞质或核仁。对于不大不小或中等大小的细胞,呈卵圆形、梭形或燕麦样,核仁不明显,不妨归入小细胞癌。(6)不像胃肠道那样呈惰性(indolent),肺类癌具有侵袭性,可发生转移。(7)弥漫性特发性肺神经内分泌细胞增生(DIPNECH)局限于基膜内,一般直径小于2 mm,单个或簇状(cluster)的肺神经内分泌细胞(pulmonary neuroendocrine cells,PNCs)增生,可局部浸润,形成直径2~5 mm“小瘤(tumourlet)”,也可发展为类癌,诊断类癌需直径大于或等于5 mm,若肿瘤小于5 mm,则归入微瘤型类癌(carcinoid tumourlet)。(8)应注意与转移性肿瘤(尤其是胃肠道来源)鉴别。(9)10%~20%的NSCC可伴神经内分泌分化,由于不影响患者的预后和治疗,因此新版并没有采纳,不推荐使用诸如“腺癌伴神经内分泌分化”这样的诊断术语。
我想,妈是不是也有过这样难受的时候?她是不是也眨过眼睛?是不是没人看见她,直到她再也不能睁开眼睛!妈啊,妈—
10.9 NUT癌(NUT carcinoma) 在旧版胸腺瘤分类中被称之为“伴t(15;19)易位的癌”,新版呈开放模式,现设“其他未分类的癌”,项下列举原归于大细胞癌的淋巴上皮瘤样癌及新增NUT癌。后者被定义为一种呈现UNT基因重排(睾丸核蛋白UNTM1)分化差的侵袭性癌,至今报道不足100例。肿块较大,向肺门结构或胸膜及胸壁扩展。切面灰白色、鱼肉状,可见地图样坏死。镜下由片层或实性排列,形态单一,小到中等大小的未分化细胞构成,核轮廓不规则,染色质粗颗粒状,常见并且特征性地表现为“突然灶性角化(abrupt foci of keratinization)”现象。诊断NUT癌需要免疫组织化学证实NUT蛋白表达或有NUT重排,70%的NUT癌以NUT基因染色体易位及融合到BRD4形成t(15;19)(q13;p13.1),约6%与BRD3融合形成t(15;19)(15q14;9q34.2)为特征。NUT癌为侵袭性极强的肿瘤,中位存活期仅7个月。
10.10 硬化性肺细胞瘤(sclerosing pneumocytoma,SP) 由旧版“肺硬化性血管瘤(sclerosing hemangioma of the lung,SHL)”演变而来,可谓实至名归。命名堪称中西合璧,归功于包括中国学者在内许多专家的不懈努力。SHL因组织结构类似皮肤的硬化性血管瘤于1956年由Liebow和Hubbell首次报道并命名。随后人们对其血管来源提出了质疑,称之为“所谓的肺硬化性血管瘤”(so-called sclerosing hemangioma of lung)。早年我国著名呼吸病理学家李维华教授就曾提出过“肺细胞瘤(pneumocytoma)”的概念。旧版将SHL排在“混杂性肿瘤”中,而新版把SP归入“肺腺瘤”,定义为“一种肺细胞起源肿瘤,由类似Ⅱ型肺泡上皮及圆形细胞2种表面细胞构成,轻微显示其形态差异,组织学所见包括实性、乳头状、硬化及出血不同复合区域”,简明扼要地概括了SP的形态特征:“2种细胞,4种结构(two cell types,four patterns)”。2种细胞中一种是被覆在乳头及腔隙表面增生的肺泡上皮,大部分为立方形或扁平,少部分呈卵圆形或柱状,可有异型性;另一种是位于上皮下间质中明显增生的单核样细胞,成分较单一,大小形态较一致,呈卵圆形或多角形,胞质淡染或透明,胞核呈卵圆形并可见小核仁,无核分裂及坏死,但可出现奇异性核。2种细胞均被认为是肿瘤性的,可能起源于呼吸道多潜能原始上皮细胞,具有Ⅱ型肺泡上皮的分化特征,在冰冻切片、小活检和细胞学上易被误诊为癌,但泡沫样组织细胞灶性聚集及肥大细胞散在分布对SP的诊断及鉴别诊断有重要提示意义。4种结构为实性、乳头状、硬化区和出血区4种原发生长模式,成分复杂,大多数肿瘤至少可见其中3种。临床上SP呈良性进程,女性患者约占80%。诊断须在切除标本而非小活检甚至细胞学检查做出。在没有免疫组织化学标记的情况下,部分病例易误诊为实性腺癌或类癌。除非合并其他癌,有些所谓的转移性病例,很可能将乳头状腺癌或瘢痕癌误诊为SP。

表12 基于临床病理特征神经内分泌肿瘤的鉴别诊断[1]
a:大多数类癌患者从不吸烟或仅轻度吸烟,与典型类癌患者相比,不典型类癌多与目前或以前吸烟有关。
10.11 肺错构瘤(pulmonary hamartoma) 由至少两种数目不等的间质成分如软骨、脂肪、结缔组织和平滑肌,加上夹带的呼吸道上皮细胞组成。位于支气管内者可以主要由脂肪成分组成。若单纯由软骨组织构成,则为软骨瘤,二者易混淆,故充分取材很关键。旧版仅称为错构瘤(hamartoma),作为肺部最常见的良性肿瘤,约8%的肺错构瘤在胸片上显示为“所谓的钱币样病变(so-called coin lesions)”伴爆米花样钙化,手术切除即可治愈。
10.12 PEComa样肿瘤(PEComatous tumour) PEC即血管周上皮样细胞(perivascular epithelioid cells)缩写。血管周上皮样细胞肿瘤在肺内包括:(1)弥漫性囊性增生,称为淋巴管肌瘤病(LAM);(2)较少的、良性局限性肿块,称为透明细胞瘤或PEComa;(3)弥漫性增生,同时兼有LAM和透明细胞瘤两种类型。新版将这些病变统一命名并分为LAM、良性PEComa(透明细胞瘤)及恶性PEComa,均可不同程度表达HMB-45、MelanA及小眼转录因子(MITF)。肺LAM由肥胖的伴典型嗜酸性胞质的梭形肌样细胞(spindle-shaped myoid cells)组成,常位于囊壁,形成斑片或结节状,可侵犯血管或淋巴管引起继发性肺出血。LAM与Ⅱ型肺细胞结节性增生相关,特别见于伴有结节性硬化症的患者。而透明细胞瘤旧称糖瘤,由圆形、椭圆形细胞组成,边界清晰,具有丰富的透明或嗜酸性胞质。核大小轻微异常,核仁明显,但一般无核分裂,坏死罕见,如果出现坏死则应考虑为恶性,恶性PEComa有丝分裂活跃,浸润明显,具有特征性的薄壁窦状血管。
10.13 上皮样血管内皮瘤(epithelioid haemangioendothelioma,EHE) 旧版属于归于交界性,ICD-O编码为3133/1,而新版重新归定义为恶性,并强调WWTR1和CAMTA1融合基因检测有助于诊断。EHE是一类中低恶性的血管源性肿瘤,由位于黏液玻璃样变性基质中的实性巢状和短梭形上皮样内皮细胞组成。患者年龄7~81岁(中位38岁),女性约占60%~80%。大体多结节状,边界清楚,切面灰白,呈软骨样。镜下与动静脉或淋巴管关系密切,形成圆形到卵圆形结节,肿瘤中央区为富含纤维的少细胞性或硬化区,嗜酸或硬化伴灶性坏死;外周富于细胞,由索状或实性圆形至轻度梭形内皮细胞构成,胞质内空腔形如印戒,内含有红细胞。一般肿瘤细胞形态温和,低级别者无或罕见核分裂,间质软骨样、玻璃样或黏液样变性,可呈现钙化或骨化。常见肺泡内生长方式。中度恶性者表现为坏死、核分裂增多(平均2/2 mm2)及更大的非典型核,需要与上皮样血管肉瘤鉴别,后者的细胞异型性更大,核分裂更多,管腔不规则,缺乏血管定向生长方式,无典型的细胞内空泡及黏液样间质。肿瘤细胞除了表达CD31、CD34、Fli-1及FⅧa外,25%~30%的病例局灶性表达CK,多达50%的病例表达CK7,故名上皮样。重复发生t(1;3)(p36.3;q25)染色体易位是EHE的特征,由WWTR1和CAMTA1基因融合所致。作为一种存在转移风险的低度到中度恶性肿瘤,已由中间型/交界性归入恶性[60],其5年生存率约60%。相对于低级别,中度恶性的预后较差,5年生存率可降至20%。广泛的肺内和胸膜转移、体质量减少和血性胸腔积液表明患者预后较差。
10.14 肺动脉内膜肉瘤(pulmonary artery intimal sarcoma) 新版取消了肺静脉肉瘤、肺动脉肉瘤的名称。新增的肺动脉内膜肉瘤据推测起源于弹力性肺动脉内膜,可完全为内膜起源的未分化多形性肉瘤,也可显示骨肉瘤、软骨肉瘤等异源性成分。患者平均年龄56岁。大体表现为息肉状生长方式,类似黏液状或胶样血凝块填充于血管腔内,临床易误诊为急慢性肺栓塞。组织异质性明显,最常呈现为多形性未分化肉瘤,其次为低级别梭形细胞肉瘤伴黏液背景或黏液样纤维肉瘤,约1/6显示骨肉瘤或软骨肉瘤分化,与之鉴别诊断很重要。
10.15 肺黏液样肉瘤伴EWSR1-CREB1易位(pulmonary myxoid sarcoma with EWSR1-CREB1 translocation) 肺黏液样肉瘤伴EWSR1-CREB1易位也译为“EWSR1-CREB1易位的肺黏液样肉瘤”,从名称可以看出,诊断需要3个要素:(1)发病于气道(airway);(2)由中等非典型的圆形或梭形肉瘤细胞构成,且富于黏液样基质;(3)具有独特的EWSR1-CREB1基因易位。非常罕见,证实并报道的病例不足15例,多位于年轻女性的支气管,呈结界状,直径常小于4 cm,边界清楚,切面苍白或呈果胶样。低倍镜下呈分叶状结构,可存在纤维性假包膜。典型者肿瘤由梭形、星形到多边形细胞组成,伴纤细花边样条索构成的网状黏液样基质,轻度嗜酸,少数可见实性区域。尽管罕见病例存在局灶性明显异型性和多核化,但肺黏液样肉瘤细胞一般呈轻到中度异型性。有丝分裂或多或少,约有50%的肿瘤可见坏死,且倾向于局灶性。大多数病例伴有以淋巴细胞和浆细胞为主的慢性炎症浸润。所有肿瘤都表达vimentin,60%EMA呈弱或局灶性阳性。由FISH检测可发现EWSR1重组,逆转录PCR(RT-PCR)可发现EWSR1-CREB1融合,已被直接测序所证实。尽管这种易位也发生于其他肿瘤如血管瘤样纤维细胞瘤和透明细胞肉瘤,但缺乏黏液样背景。按“多见的多诊断,少见的少诊断,未见的不诊断”原则,若无基因检测,病理诊断要慎重。肿瘤局限于肺,大多数预后较好。罕见病例发生转移则预后不佳,侵袭性行为并非与其组织学特征,而与坏死与多形性有关。
10.16 肌上皮肿瘤(Myoepithelial tumours) 分为肌上皮瘤(myoepithelioma)及肌上皮癌(myoepithelial carcinoma),新版归于“唾液腺肿瘤”项下,相关章节由Travis及Fletcher两位软组织病理大师亲自执笔撰写[1,60]。肺的肌上皮肿瘤罕见,文献仅报道15例,主要或明显呈肌上皮分化,成人多见。良性者多发生于女性,大小1.5~15.0 cm,恶性者更大,且可见局灶性浸润性生长、坏死和(或)出血。镜下,肿瘤呈小梁状或网状排列,黏液性基质丰富,细胞呈上皮样或纺锤形,胞质透明或嗜酸,核大小一致,有时呈砂粒体样外观,胞质内可见玻璃样砂粒体,恶性者核分裂多见,呈现出血、坏死及核的非典型。肿瘤细胞可表达CK、S-100及Calponin,大多数可表达GFAP、SMA、p63,而desmim及CD34阴性。越来越多的证据表明EWSR1基因重排是肌上皮肿瘤重要的标志物,而上皮肌上皮癌具有显著多形性,缺乏EWSR1基因重排。肌上皮瘤不同于混合瘤之处在于后者尚显示导管分化。与上皮肌上皮癌鉴别点在于后者由两种细胞构成管状结构,内侧的上皮细胞表达CK,有时表达TTF-1,但不表达S-100蛋白,而周边的肌上皮不仅弱表达CK、vimentin、CD117及GFAP,还表达S-100及SMA。
10.17 黏膜相关淋巴组织结外边缘区淋巴瘤(MALT淋巴瘤)[extranodal marginal zone lymphoma of mucosa-associated lymphoid tissue(MALT lymphoma)] 旧版称为MALT型边缘区B细胞淋巴瘤 [marginal zone B-cell lymphoma of the mucosa-associated lymphoid tissue(MALT type)],占所有肺部淋巴瘤的70%~90%,因其生物性行为惰性(indolent),曾称为假性淋巴瘤,现已明了为真性肿瘤。镜下由4种基本细胞构成:小B(small B)细胞及单核细胞样(monocytoid)B细胞为主,散在免疫母(immunoblast)和中心母样(centroblast-like)细胞,有时向浆细胞分化(plasma cell diffrentiation)。肿瘤性B细胞主要围绕反应性滤泡的边缘区(marginal zone)浸润,故名,可向滤泡中央区扩展,甚至滤泡完全被肿瘤细胞占据,导致滤泡克隆化(follicular colonization)。常浸润支气管黏膜上皮,形成淋巴上皮病变(lymphoepithelial lesion)。Ki-67常小于20%,属于低级别淋巴瘤,5年生存率约84%~94%,10年生存率达70%。
10.18 血管内大B细胞淋巴瘤(intravascular large B-cell lymphoma) 是一种非常罕见的侵袭性结外弥漫大B细胞淋巴瘤亚型,以淋巴细胞出现于小血管,特别是毛细血管内为特征。几乎只发生于成人的小动脉、小静脉或毛细血管腔内,有时可见纤维性血栓。细胞具有大的泡状核,核仁明显,核分裂多见,罕见情况下可出现间变。常表达CD20及CD79,CD5常见阳性,尽管有使用利妥昔单抗(rituximab)成功治愈的报道,但患者预后差。
10.19 Erdheim-Chester病(Erdheim-Chester disease,ECD) 是一种罕见的黄色肉芽肿性组织细胞增生性病变,以载脂组织细胞浸润骨骼和内脏为特征,肺内引起沿淋巴管周围分布的间质纤维化,又称脂质肉芽肿病,但54%的患者检测到BRAF(V600E)突变,可能为真性肿瘤[1,58]。男性略多。发病高峰期50~70岁,中位年龄为53岁。约20%的患者发生胸腔积液,一般有轻度的骨痛、发热、体质量减轻及肌无力。从结构上看,组织细胞的浸润和纤维化主要沿肺内淋巴(脏层胸膜,支气管血管束和肺叶间隔)分布。组织细胞通常为泡沫状,Touton巨细胞常见。病变含有不同密度的纤维、淋巴细胞、浆细胞和嗜酸性粒细胞。免疫组织化学证实存在单核/巨噬细胞系,载脂泡沫细胞和巨细胞表达FⅧa、溶菌酶、MAC387、CD68(KP1)、CD4、α-1抗糜蛋白酶、α-1抗胰蛋白酶,不同程度表达S-100,但不表达CD1α。尽管ECD的ICD-O编码为1,属于交界性病变,但20%~30%的ECD累及肺,显示预后不佳,大部分患者在3年内死亡,但B-raf抑制剂维罗非尼(vemurafenib)靶向治疗有效[61]。
10.20 脑膜瘤,非特殊类型(meningiomas,NOS) 证实肺脑膜瘤与颅内连于硬脑膜表面蛛网膜细胞(arachnoidal cell)发生的肿瘤相对应,原发于肺而无中枢神经系统(CNS)累及。女性略多,发病中位年龄57岁。可能起源于肺多潜能细胞(pluripotent cell)、异位胚胎残余(heterotopic embryonic rests)或脑膜上皮样结节(meningothelioid nodules),虽然孤立性脑膜上皮样结节缺乏突变损伤,但多发性者因基因转变,促进其发生肿瘤性增生。大多数边界清楚,质硬,切面灰白色到黄褐色,直径4~60 mm(中位数18 mm)。镜下各种组织学亚型均可发生,以过渡性及砂粒体型多见。肿瘤细胞表达vimentin、EMA、PR,偶尔灶性表达S-100。与CNS同名肿瘤一样,新版在147页引用并列举了各型脑膜瘤的WHO分级及ICD-O编码,呈“933模式”,即9种良性 [WHO分级Ⅰ级,分别为脑膜上皮型、纤维型(纤维母细胞型)、过渡型(混合型)、砂粒体型、血管瘤样型、微囊型、分泌型、富于淋巴浆细胞型、化生型],3种中间型/交界性 [WHO分级Ⅱ级,分别为脊索样、透明细胞型、非典型]及3种恶性 [乳头状、横纹肌样、间变型,为WHO分级 Ⅲ级]。
11 一些易混淆疾病的诊断问题
肺癌应施以手术为主的综合性治疗,而有的肿瘤科或放疗科要求仅将肺癌分为小细胞癌与非小细胞癌(NSCC),这种模糊的做法已经过时且不规范。
旧版将分化差、异质性明显的一组非小细胞癌包括多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤、肺母细胞瘤置于同一章节叙述,统称肉瘤样癌,而新版基于发病人群、发生部位、组织形态及分子遗传学差异,将前3者归于一个章节,后2个独立成章,建议使用具体的术语来描述而非统称避免与真正的肉瘤相混淆。癌肉瘤须列出切片中出现的所有上皮性和肉瘤成分;多形性癌诊断仍要求肿瘤性梭形细胞和(或)巨细胞至少占10%,若含有腺癌成分,应检测EGFR突变和(或)ALK重排;胎儿型腺癌常伴β-catenin基因突变,被视为腺癌的一种变异型,而非肺母细胞瘤的一种上皮性亚型。有时很难通过小活检标本明确诊断,如果形态学表现为腺癌伴有多形性特征,应该在诊断中加以注明,如“NSCLC,倾向于腺癌伴巨细胞和(或)梭性细胞特征”。肉瘤样癌不足肺癌的1%,易转移,预后不佳[62],但最近研究发现Met抑制剂治疗有效[63]。
腺鳞癌仅限于手术切除标本,不管以何种组织结构为主,鳞状细胞癌和腺癌成分须各占10%以上,两种成分可在不同区域单独存在,也可混合或交错排列。诊断时注意与陷入鳞状细胞癌中的良性腺体及腺癌中的鳞化上皮(腺棘皮癌,adenoacanthoma)鉴别。
大细胞癌在新版中被定义为一种未分化的非小细胞肺癌,在细胞学和组织结构及免疫表型等方面缺少小细胞癌、腺癌及鳞状细胞癌的特征,诊断只有在手术切除标本才能做出。免疫组织化学和黏液染色必要的。肿瘤细胞表达CK,但不表达mucin。新、旧版均作为一个排除性诊断或垃圾桶使用,细胞大小并不是作为其必然诊断指标。自2011年IASLC/ATS/ERS国际多学科分类以来,大细胞癌的成员及诊断数量显著减少,有逐渐淡出之势。
原发于肺的恶性肿瘤容易与胸腺、胸膜及心脏(心包)的相互蔓延、累及或转移。同一组织学类型的肿瘤,定位于不同器官,具有迥异的临床病理分期,需借助仔细而全面的病理检查包括大体所见、免疫表型甚至分子生物学等手段,确定原发灶。
12 存在的问题
MIA的小于或等于0.5 cm诊断标准基于有限的数据,需进一步的确认。新分类认为,大多数AIS为非黏液性,黏液性AIS少见,而非黏液与黏液混合性则更是难以见到。如李娜等[5]报道的2 000余例手术切除的肺癌标本中,未发现1例混合性AIS,更未见到混合性MIA,如此之少的腺癌种类是否值得被列为一种类型,值得商榷。
新版将鳞状细胞癌分为角化型、非角化型及基底细胞样3种,认为小细胞性、乳头状及透明细胞鳞状细胞癌只是形态模式(pattern),而非独立病种(entity),故而删除。对于非角化型鳞状细胞癌,除了标记p40和(或)p63及CK5/6外,尚需观察TTF-1、Napsin A或CK7等表达情况,如果一个分化差的肿瘤同时表达上述腺鳞标记物,宁可诊断为(实性)腺癌。基底细胞样鳞状细胞癌缺乏角化珠、细胞内角化和(或)细胞间桥等鳞状分化形态,但呈现鳞状细胞癌的表型,异型增生的梭形小细胞具有小叶状结构、栅栏状排列及粉刺样坏死,而不表达神经内分泌标记物,根据定义,基底细胞样区域需大于50%,而不论是否存在角化,故诊断不可贸然在穿刺活检标本上做出。但新、旧版均认为只要见到角化珠形成,肿瘤即被分类为角化型鳞状细胞癌,问题在于,为何不用5%或10%进行量化,任意比例是否得到循证医学的支持。周围型鳞状细胞癌的癌细胞在肺泡腔内生长,四周围着一圈肺泡上皮,癌组织在肺实质内浸润性生长而不损害气道,具有独特的生长方式[64],不妨作为一种亚型独立出来。
13 小 结
肺癌是当今全球病死率最高的恶性肿瘤,尽管取得一定进展,但生存率并未显著提高,故早期发现、精确诊治非常重要。新版继往开来,免疫组织化学技术(immunohistochemistry)、遗传学特征(genetic profile)、影像学所见(image finding),甚至一些分子检测(molecular detection)[65-66],终贯穿整个分类,体现了精准医学之精确(the right treatment)、准时(at the right time)、共享(give all of us access)及个体化(personalized information)特点[7,67],作为全球通用标准,既具专业化及标准化特点,又要求同存异(common but differentiated),正是基于此,通过WHO新旧版对照及解读,相当于同行评议(peer review),加强学习与交流,早日用于临床实践。
[1]Travis WD,Brambilla E,Burke AP,et al.WHO classification of tumours of the lung,pleura,thymus and heart[M].4th.Lyon:IARC Press,2015:153-181.
[2]Travis WD,Brambilla E,Muller-Hermelink HK,et al.WHO classification of pathology and genetics of tumours of the lung,pleura,thymus and heart[M].3rd.Lyon:IARC Press,2004:125-144.
[3]Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J].J Thorac Oncol,2011,6(2):244-285.
[4]Tsao MS,Travis WD,Brambilla E,et al.Forty years of the international association for study of lung cancer pathology committee[J].J Thorac Oncol,2014,9(12):1740-1749.
[5]李娜,赵珩,张杰,等.2 056例手术切除肺腺癌的临床病理分析[J].中华胸心血管外科杂志,2014,30(12):715-718.
[6]Saito M,Shiraishi K,Kunitoh H,et al.Gene aberrations for precision medicine against lung adenocarcinoma[J].Cancer Sci,2016,107(6):713-720.
[7]Kidane B,Toyooka S,Yasufuku K.MDT lung cancer care:input from the surgical oncologist[J].Respirology,2015,20(7):1023-1033.
[8]Kadota K,Nitadori J,Sima CS,et al.Tumor spread through air spaces is an important pattern of invasion and impacts the frequency and location of recurrences after limited resection for small stage Ⅰ lung adenocarcinomas[J].J Thorac Oncol,2015,10(5):806-814.
[9]Warth A,Muley T,Kossakowski CA,et al.Prognostic impact of intra-alveolar tumor spread in pulmonary adenocarcinoma[J].Am J Surg Pathol,2015,39(6):793-801.
[10]Carson J,Finley DJ.Lung cancer staging:an overview of the new staging system and implications for radiographic clinical staging[J].Semin Roentgenol,2011,46(3):187-193.
[11]Eom JS,Mok JH,Lee MK,et al.Efficacy of TB-PCR using EBUS-TBNA samples in patients with intrathoracic granulomatous lymphadenopathy[J].BMC Pulm Med,2015,15(1):166-167.
[12]Naruke T,Suemasu K,Ishikawa S.Lymph node mapping and curability at various levels of metastasis in resected lung cancer[J].J Thorac Cardiovasc Surg,1978,76(6):832-839.
[13]Mountain CF,Dresler CM.Regional lymph node classification for lung cancer staging[J].Chest,1997,111(6):1718-1723.
[14]Rusch VW,Asamura H,Watanabe H,et al.The IASLC lung cancer staging project:a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer[J].J Thorac Oncol,2009,4(5):568-577.
[15]Detterbeck FC,Boffa DJ,Tanoue LT.The new lung cancer stagging system[J].Chest,2009,136(1):260-271.
[16]Rami-Porta R,Bolejack V,Crowley J,et al.The IASLC lung cancer staging project:proposals for the revisions of the T descriptors in the forthcoming eighth edition of the TNM classification for lung cancer[J].J Thorac Oncol,2015,10(7):990-1003.
[17]Asamura H,Chansky K,Crowley J,et al.The International Association for the study of lung cancer lung cancer staging project:proposals for the revision of the N descriptors in the forthcoming 8th edition of the TNM classification for lung cancer[J].J Thorac Oncol,2015,10(12):1675-1684.
[18]Eberhardt WE,Mitchell A,Crowley J,et al.The IASLC lung cancer staging project:proposals for the revision of the m descriptors in the forthcoming eighth edition of the TNM classification of lung cancer[J].J Thorac Oncol,2015,10(11):1515-1522.
[19]Goldstraw P,Chansky K,Crowley J,et al.The IASLC lung cancer staging project:proposals for revision of the TNM stage groupings in the forthcoming(eighth) edition of the TNM classification for lung cancer[J].J Thorac Oncol,2016,11(1):39-51.
[20]Leong SP,Tseng WW.Micrometastatic cancer cells in lymph nodes,bone marrow,and blood:clinical significance and biologic implications[J].CA Cancer J Clin,2014,64(3):195-206.
[21]Plaks V,Koopman CD,Werb Z.Cancer.Circulating tumor cells[J].Science,2013,341(6151):1186-1188.
[22]Wang X,Enomoto A,Asai N,et al.Collective invasion of cancer:perspectives from pathology and development[J].Pathol Int,2016,66(4):183-192.
[23]Cheung KJ,Ewald AJ.A collective route to metastasis:seeding by tumor cell clusters[J].Science,2016,352(6282):167-169.
[24]Hellman S,Weichselbaum RR.Oligometastases[J].J Clin Oncol,1995,13(1):8-10.
[25]Reyes DK,Pienta KJ.The biology and treatment of oligometastatic cancer[J].Oncotarget,2015,6(11):8491-8524.
[26]Patel PR,Yoo DS,Niibe Y,et al.A call for the aggressive treatment of oligometastatic and oligo-recurrent non-small cell lung cancer[J].Pulm Med,2012:480961.
[27]Yarchoan M,Lim M,Brahmer JR,et al.Oligometastatic adenocarcinoma of the lung:a therapeutic opportunity for long-term survival[J].Cureus,2015,7(12):e409-410.
[28]Ashworth A,Rodrigues G,Boldt G,et al.Is there an oligometastatic state in non-small cell lung cancer? A systematic review of the literature[J].Lung Cancer,2013,82(2):197-203.
[29]Pfannschmidt J,Dienemann H.Surgical treatment of oligometastatic non-small cell lung cancer[J].Lung Cancer,2010,69(3):251-258.
[30]Guerrero E,Ahmed M.The role of stereotactic ablative radiotherapy(SBRT) in the management of oligometastatic non small cell lung cancer[J].Lung Cancer,2016(92):22-28.
[31]Siva S,Kron T,Bressel M,et al.A randomised phase Ⅱ trial of stereotactic ablative fractionated radiotherapy versus radiosurgery for oligometastatic neoplasia to the lung(TROG 13.01 SAFRON Ⅱ)[J].BMC Cancer,2016,16(1):183-184.
[32]Sobin LH,Gospdarowizc M,Wittekind C.TNM classificntion of malignant tumours[M].7th.Hoboken(NJ):Willy-blackwell,2002:136-147.
[33]Kadota K,Yeh YC,Sima CS,et al.The cribriform pattern identifies a subset of acinar predominant tumors with poor prognosis in patients with stage Ⅰ lung adenocarcinoma:a conceptual proposal to classify cribriform predominant tumors as a distinct histologic subtype[J].Mod Pathol,2014,27(5):690-700.
[34]周晓军,刘标.解读2011年IASLC/ATS/ERS肺腺癌国际多学科分类[J].临床与实验病理学杂志,2011,27(8):801-810.
[35]钟文昭,董嵩,李磊,等.国际肺癌研究协会/美国胸科学会/欧洲呼吸学会肺腺癌的国际多学科分类[J].循证医学,2011,11(4):193-225.
[36]Buder A,Tomuta C,Filipits M.The potential of liquid biopsies[J].Curr Opin Oncol,2016,28(2):130-134.
[37]Wang W,Tang Y,Li J,et al.Detection of ALK rearrangements in malignant pleural effusion cell blocks from patients with advanced non-small cell lung cancer:a comparison of ventana immunohistochemistry and fluorescence in situ hybridization[J].Cancer Cytopathol,2015,123(2):117-122.
[38]Travis WD,Brambilla E,Noguchi M,et al.Diagnosis of lung cancer in small biopsies and cytology:implications of the 2011 International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification[J].Arch Pathol Lab Med,2013,137(5):668-684.
[39]Kadota K,Nitadori J,Sarkaria IS,et al.Thyroid transcription factor-1 expression is an independent predictor of recurrence and correlates with the IASLC/ATS/ERS histologic classification in patients with stage Ⅰ lung adenocarcinoma cancer[J].Cancer,2013,119(5):931-938.
[40]Desai TJ,Brownfield DG,Krasnow MA.Alveolar progenitor and stem cells in lung development,renewal and cancer[J].Nature,2014,507(7491):190-194.
[41]Yatabe Y.EGFR mutations and the terminal respiratory unit[J].Cancer Metastasis Rev,2010,29(1):23-36.
[42]Swanton C,Govindan R.Clinical implications of genomic discoveries in lung cancer[J].N Engl J Med,2016,374(19):1864-1873.
[43]Louis DN,Ohgaki H,Wiestler OD,et al.WHO classification of tumors of the central nervous system[M].4th.Lyon:IARC Press,2016:1-408.
[44]Van Allen EM,Wagle N,Stojanov P,et al.Whole-exome sequencing and clinical interpretation of formalin-fixed,paraffin-embedded tumor samples to guide precision cancer medicine[J].Nat Med,2014,20(6):682-688.
[45]Solomon BJ,Mok T,Kim DW,et al.First-line crizotinib versus chemotherapy in ALK-positive lung cancer[J].N Engl J Med,2014,371(23):2167-2177.
[46]Mizukami T,Shiraishi K,Shimada Y,et al.Molecular mechanisms underlying oncogenic RET fusion in lung adenocarcinoma[J].J Thorac Oncol,2014,9(5):622-630.
[47]Shaw AT,Ou SH,Bang YJ,et al.Crizotinib in ROS1-rearranged non-small-cell lung cancer[J].N Engl J Med,2014,371(21):1963-1971.
[48]Mazières J,Zalcman G,Crinò L,et al.Crizotinib therapy for advanced lung adenocarcinoma and a ROS1 rearrangement:results from the EUROS1 cohort[J].J Clin Oncol,2015,33(9):992-999.
[49]Mano H.ALKoma:a cancer subtype with a shared target[J].Cancer Discov,2012,2(6):495-502.
[50]Mallya V,Kumar SP,Meganathan P,et al.The utility of ROSE(rapid on-site evaluation) in endobronchial ultrasound(EBUS)-guided transbronchial needle aspiration(TBNA):is the picture rosy[J].J Cytol,2015,32(4):230-233.
[51]Thiryayi SA,Rana DN,Narine N,et al.Establishment of an endobronchial ultrasound-guided transbronchial fine needle aspiration service with rapid on-site evaluation:2 years experience of a single UK centre[J].Cytopathology,2016,27(5):335-343.
[52]Mfokazi A,Wright CA,Louw M,et al.Direct comparison of liquid-based and smear-based cytology with and without rapid on-site evaluation for fine needle aspirates of thoracic tumors[J].Diagn Cytopathol,2016,44(5):363-368.
[53]Guo H,Liu S,Guo J,et al.Rapid on-site evaluation during endobronchial ultrasound-guided transbronchial needle aspiration for the diagnosis of hilar and mediastinal lymphadenopathy in patients with lung cancer[J].Cancer Lett,2016,371(2):182-186.
[54]Choi SM,Lee AR,Choe JY,et al.Adequacy criteria of rapid on-site evaluation for endobronchial ultrasound-guided transbronchial needle aspiration:a simple algorithm to assess the adequacy of ROSE[J].Ann Thorac Surg,2016,101(2):444-450.
[55]Travis WD,Brambilla E,Nicholson AG,et al.The 2015 World Health Organization classification of lung tumors:impact of genetic,clinical and radiologic advances since the 2004 classification[J].J Thorac Oncol,2015,10(9):1243-1260.
[56]Travis WD,Brambilla E,Burke AP,et al.Introduction to The 2015 World Health Organization classification of tumors of the lung,pleura,thymus and heart[J].J Thorac Oncol,2015,10(9):1240-1242.
[57]Lee KH,Goo JM,Park SJ,et al.Correlation between the size of the solid component on thin-section CT and the invasive component on pathology in small lung adenocarcinomas manifesting as ground-glass nodules[J].J Thorac Oncol,2014,9(1):74-82.
[58]Westcott PM,Halliwill KD,To MD,et al.The mutational of genetic and chemical models of Kras-driven lung cancer[J].Nature,2015,517(7535):489-492.
[59]Schnabel PA,Junker K.Pulmonary neuroendocrine tumors in the new WHO 2015 classification:start of breaking new grounds[J].Pathologe,2015,36(3):283-292.
[60]Fletcher CDM,Bridge JA,Hogendoorn PCW,et al.WHO classification of tumours of soft tissue and bone[M].Lyon:IARC Press,2013:239-394.
[61]Tzoulis C,Schwarzlmüller T,Gjerde IO,et al.Excellent response of intramedullary Erdheim-Chester disease to vemurafenib:a case report[J].BMC Res Notes,2015,8(1):171-172.
[62]Shum E,Stuart M,Borczuk A,et al.Recent advances in the management of pulmonary sarcomatoid carcinoma[J].Expert Rev Respir Med,2016,10(4):1-10.
[63]Awad MM,Oxnard GR,Jackman DM,et al.MET exon 14 mutations in non-small-cell lung cancer are associated with advanced age and stage-dependent MET genomic amplification and c-MET overexpression[J].J Clin Oncol,2016,34(7):721-730.
[64]Yousem SA.Peripheral squamous cell carcinoma of lung:patterns of growth with particular focus on airspace filling[J].Hum Pathol,2009,40(6):861-867.
[65]Masters GA,Temin S,Azzoli CG,et al.Systemic therapy for stage Ⅳ non-small-cell lung cancer:American Society of Clinical Oncology clinical practice guideline update[J].J Clin Oncol,2015,33(30):3488-3515.
[66]Pan Y,Zhang Y,Li Y,et al.ALK,ROS1 and RET fusions in 1139 lung adenocarcinomas:a comprehensive study of common and fusion pattern-specific clinicopathologic,histologic and cytologic features[J].Lung Cancer,2014,84(2):121-126.
[67]Borczuk AC,Allen TC.PD-L1 and lung cancer:the era of precision-ish medicine[J].Arch Pathol Lab Med,2016,140(4):351-354.
方三高(1969-),副主任医师、副教授,硕士,科技部专家库专家成员,华夏病理网“骨组织病理”栏目版主,中国病理学论坛“研究生栏目”及“英语栏目”版主,主要从事肿瘤病理的研究,擅长骨与关节疾病、消化系统肿瘤及女性生殖系统肿瘤病理。
�南解读·
10.3969/j.issn.1671-8348.2017.01.002
R734.2
A
1671-8348(2017)01-0004-020
2016-08-22
2016-11-17)

