宫颈癌组织中FOXP3、PD-1及PD-L1蛋白的表达
韩丽萍,刘丽雅,孙晓慧,李 元,余海洋,张庆庆
1)郑州大学第一附属医院妇产科 郑州 450052 2)河南省高等学校临床重点学科开放实验室 郑州 450052 3)安阳市肿瘤医院妇产科 河南安阳 455000 4)郑州市中心医院妇产科 郑州 450007
宫颈癌组织中FOXP3、PD-1及PD-L1蛋白的表达
韩丽萍1)△,刘丽雅1,2),孙晓慧3),李 元1,2),余海洋4),张庆庆1,2)
1)郑州大学第一附属医院妇产科 郑州 450052 2)河南省高等学校临床重点学科开放实验室 郑州 450052 3)安阳市肿瘤医院妇产科 河南安阳 455000 4)郑州市中心医院妇产科 郑州 450007
△女,1969年8月生,博士,教授,研究方向:妇科肿瘤与妇科内分泌,E-mail:hanliping0825@163.com
宫颈癌; PD-1;PD-L1;FOXP3
目的:研究宫颈癌组织中FOXP3、PD-1及PD-L1蛋白的表达情况及其与临床病理特征的关系。方法:采用免疫组织化学SP法检测64例宫颈癌组织、40例宫颈上皮内瘤样病变(CIN)组织、18例正常宫颈组织中PD-1、PD-L1、FOXP3蛋白的表达。结果:PD-1 、FOXP3蛋白主要表达于肿瘤浸润淋巴细胞(TIL),PD-L1 蛋白主要表达于宫颈癌细胞及TIL。正常宫颈组织不表达PD-1、PD-L1、FOXP3蛋白,宫颈癌组织中PD-1的表达显著高于CIN和正常宫颈组织 (P<0.05) ;宫颈癌组织中PD-1、PD-L1、FOXP3蛋白的表达与组织分化程度、FIGO分期有关(P<0.05),与患者年龄、肿瘤直径、HPV感染或分型无关(P>0.05)。宫颈癌组织中PD-L1与PD-1蛋白的表达呈正关联(rS=0.562,P<0.001)。宫颈癌组织中FOXP3与PD-1 、PD-L1蛋白的表达无关联(rS=0.218和0.257,P>0.05)。结论:人子宫颈癌组织高表达PD-1、PD-L1、FOXP3蛋白,且与肿瘤的发生发展、浸润密切相关。
宫颈癌是妇科最常见的恶性肿瘤之一,近年来呈现年轻化的趋势[1]。子宫颈局部微环境免疫监视功能下降是宫颈癌发生发展的重要原因,而肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)尤其 CD8+T 细胞数量减少和免疫无能起关键性作用[2]。TIL是存在于肿瘤间质内以T淋巴细胞为主的一种异质性淋巴细胞群体。程序性死亡受体配体-1(programmed death ligand 1,PD-L1),又称B7-H1,是免疫反应中极其重要的协同刺激分子。程序性死亡受体-1(programmed death 1,PD-1)属于 CD28/CTLA-4 受体亚家族,表达在活化的 T 细胞和 B 细胞上。近来文献[3]报道,多种恶性肿瘤异常表达 PD-L1,高表达的PD-L1与TIL上的PD-1相结合,抑制了周围淋巴细胞的活性,从而使肿瘤细胞逃避了免疫系统的监视与攻击。调节性T细胞(regulatory T cell,Treg)在免疫稳态的维持中扮演者重要的角色[4]。叉头翼状螺旋转录因子(forkhead or winged helix transcription factor,FOXP3)目前被认为是Treg细胞独立的标记物[5]。该研究应用免疫组织化学的方法检测PD-1、PD-L1、FOXP3 在正常宫颈、宫颈上皮内瘤样病变(CIN)、宫颈癌组织中的表达情况,探讨它们与宫颈癌发生发展的关系,为宫颈癌诊断及治疗开拓新的方向。
1 资料与方法
1.1 临床资料 选取郑州大学第一附属医院病理科2012年4月至2014年11月手术切除或活检的蜡块标本,经3名有经验的病理医师确诊。宫颈癌标本64例,按国际妇产科联盟(FIGO)临床分期:Ⅰ、Ⅱ期35例,Ⅲ、Ⅳ期29例;患者年龄33~66岁,中位年龄48岁;组织学分级:低分化28例,中分化22例,高分化14例。CIN标本40例,其中CIN Ⅰ级10例、CIN Ⅱ级15例、CINⅢ级15例,患者年龄32~54岁,中位年龄42岁。正常宫颈组织18例,患者年龄34~51岁,中位年龄49岁。所有纳入对象均未接受过放、化疗等。
1.2 主要试剂与来源 小鼠抗人PD-1、FOXP3单克隆浓缩抗体和兔抗人CD3单克隆浓缩抗体均为英国Abcam公司产品,小鼠抗人PD-L1多克隆抗体购自R&D公司,兔/鼠通用型Streptavidin-HRP试剂盒(带DAB显色液)和柠檬酸缓冲液均购自北京康为世纪生物科技有限公司。
1.3 PD-1、PD-L1、FOXP3蛋白表达的免疫组织化学SP法检测 宫颈癌、CIN、正常宫颈组织均4 μm厚连续切片,按常规方法脱蜡至水并用微波修复抗原。采用免疫组织化学SP法检测,按试剂说明书进行操作。一抗PD-1(稀释50倍)、PD-L1(稀释33倍)、FOXP3(稀释100倍)、CD3(稀释150倍)单克隆抗体4 ℃孵育切片过夜,生物素标记的羊抗兔/鼠二抗工作液室温孵育30 min。DAB显色,苏木精轻度复染。以PBS代替一抗作为空白对照,采用已知蛋白表达阳性的结肠癌组织石蜡切片作为阳性对照。PD-L1、PD-1 阳性物为棕黄色颗粒,均定位于细胞膜和细胞质;FOXP3阳性物为黑色颗粒,定位于细胞核。每张切片中选取癌细胞数较多的5个高倍视野(×400),每个视野计数100个细胞。染色强度:无着色记为0分,淡黄色记为1分,棕黄色记为 2分,棕褐色或黑色记为3分;阳性细胞百分比:无阳性细胞记为0分,阳性细胞小于25%记为1分,阳性细胞数在25%~50%记为2分,阳性细胞数大于50%记为3分。两项得分相乘,结果 0~1 分为(-),≥2分为(+)。
1.4 统计学处理 采用SPSS 17.0进行分析,多个样本率的比较采用χ2检验,两分类变量间的关联分析采用列联系数分析。检验水准α=0.05。
2 结果
2.1 不同宫颈组织中PD-1、PD-L1和FOXP3蛋白的表达 见图1和表1。正常宫颈组织无PD-1、PD-L1和FOXP3蛋白的表达。PD-1和FOXP3主要表达于TIL,宫颈癌细胞无表达; PD-L1 主要表达于宫颈癌细胞及TIL。CD3为T淋巴细胞表面标志物,CD3阳性颗粒定位于TIL,TIL为小圆形,核大质少,点样分布。
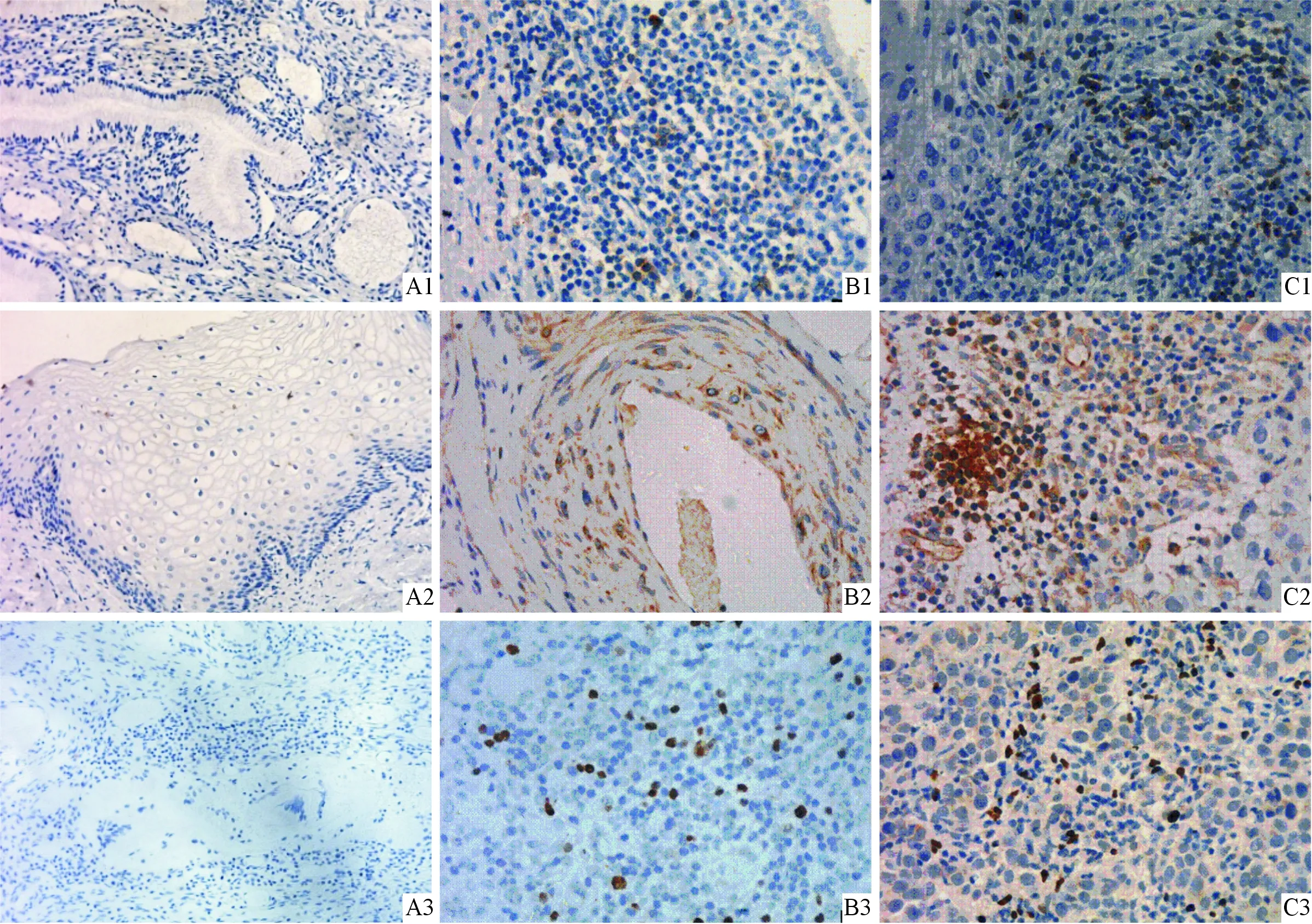
A:正常宫颈组织;B:CIN组织;C:宫颈癌组织。图1 不同宫颈组织中PD-1(1)、PD-L1(2)、FOXP3(3)蛋白的表达(SP,×400)
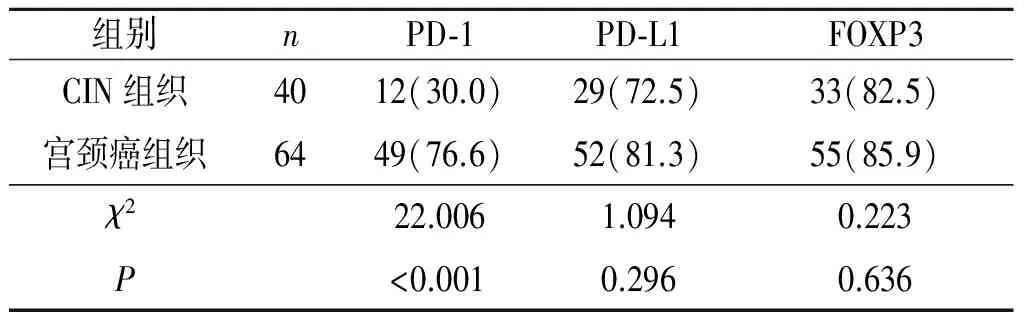
2.2 PD-1、PD-L1及FOXP3表达与宫颈癌临床病理特征的关系 见表2。PD-1、PD-L1及FOXP3的表达与宫颈癌患者的年龄、肿瘤直径及HPV感染或分型无关(P>0.05),但与宫颈癌FIGO分期、组织学分级有关(P<0.05)。
2.3 宫颈癌组织中PD-1、PD-L1、FOXP3表达的关联性分析 结果见表3~5。
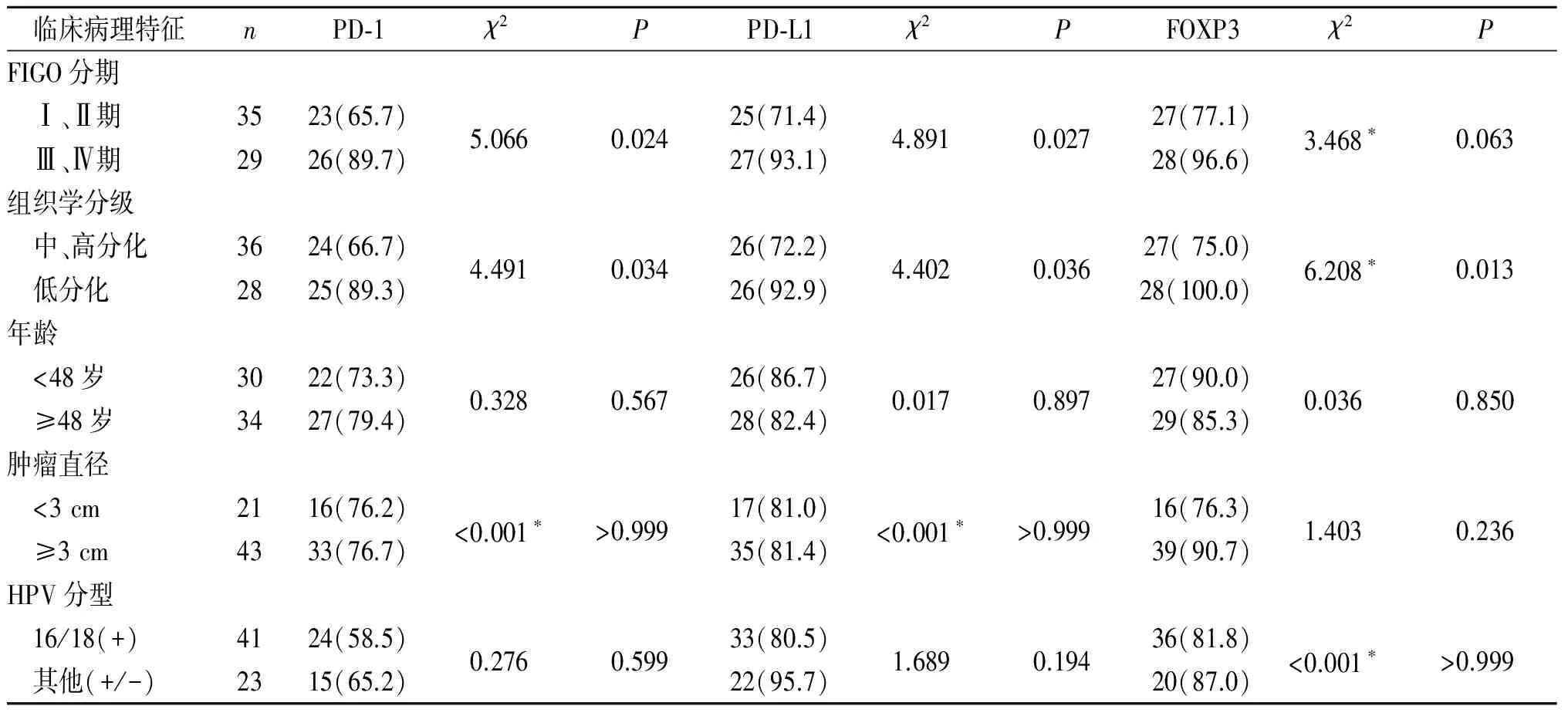
表2 宫颈癌组织中PD-1、PD-L1及FOXP3表达与临床病理特征的关系 例(%)
*:校正χ2检验。

表3 宫颈癌组织中PD-1与PD-L1的关系 例
χ2=25.562,rS=0.562,P<0.001。

表4 宫颈癌组织中FOXP3与PD-1之间的关系 例
χ2=1.866,rS=0.218,P=0.172。

表5 宫颈癌组织中FOXP3与PD-L1之间的关系 例
χ2=2.788,rS=0.257,P=0.095。
3 讨论
宫颈局部微环境免疫监视功能下降及免疫逃逸现象的产生在宫颈癌发生发展中起到重要的作用。肿瘤抗原特异性T细胞的诱导凋亡和无反应性是肿瘤细胞免疫逃逸的主要机制,协同刺激分子及其相应的调节系统参与了这一过程。同时Treg细胞在机体免疫系统中主要发挥负向调节作用,其在宫颈癌的发生和发展中所起的作用逐渐受到了重视。
PD-1属于免疫球蛋白超家族中的一员。许多肿瘤组织的淋巴细胞,尤其是T淋巴细胞中均可检测到 PD-1 蛋白的表达[3]。PD-1表达于人多种类型细胞中,包括T细胞、B细胞、自然杀伤细胞、活化的单核细胞、树突状细胞[6]。正常人淋巴组织生发中心中的T淋巴细胞表面可以检测到PD-1的表达[7]。PD-1的结合配体是PD-L1。PD-L1通常表达于肿瘤细胞表面[8]。PD-L1也表达在其他类型的细胞中,如T细胞和B细胞、树突状细胞、巨噬细胞、间充质干细胞和骨髓来源的肥大细胞[9]。正常情况下,组织细胞表面的 PD-L1 与淋巴细胞表面的 PD-1 结合后,可抑制淋巴细胞功能,诱导活化的淋巴细胞凋亡,从而在自身免疫耐受及防止自身免疫性疾病中发挥重要作用[10]。PD-L1 与 PD-1 的结合可产生多种生物学作用,如能够抑制淋巴细胞的增殖和活化、抑制CD4+T 细胞向 Th1 和 Th17 细胞分化、抑制炎性细胞因子的释放,这些都起到了免疫负调控的作用[11]。
该研究结果表明PD-L1在宫颈癌组织的阳性表达率为81.3%,与Karim 等[12]报道的宫颈癌 PD-L1阳性表达率19%存在差异,原因可能与作者采用不同方法观察以及宫颈癌患者来源于不同人种有关。该研究结果亦表明PD-1和PD-L1在正常宫颈、宫颈CIN及宫颈癌组织中的表达逐渐升高,可能是PD-L1 与 PD-1结合后抑制了间质中淋巴细胞的功能及活性,从而促进了肿瘤发生发展。同时,作者还发现PD-L1和PD-1在Ⅲ、Ⅳ期宫颈癌组织中的表达较Ⅰ、Ⅱ期宫颈癌组织高,提示PD-1/PD-L1通路在肿瘤的发生发展、浸润及转移中的重要作用。Shi等[3]研究发现,PD-1/PD-L1在肿瘤免疫逃逸中起着举足轻重的作用,而阻断PD-1/PD-L1通路则会增强CD8+T细胞清除肿瘤的能力。
该研究发现宫颈癌组织中PD-1与PD-L1的表达有正关联。马薇等[13]认为肺癌中癌间质PD-L1表达与 PD-1 阳性淋巴细胞浸润程度呈正相关。吴圣等[14]认为PD-1和PD-L1在胃癌中的表达无显著相关性。刘书漫等[15]则认为胃癌中 PD-L1 表达与 PD-1 阳性的TIL数目呈负相关性。肿瘤组织中关于PD-1和PD-L1之间的相关性还没有统一的结论,提示 PD-L1 的受体可能不仅仅只有 PD-1,可能还存在其他受体参与淋巴细胞功能的调控,有待于进一步的研究。
Treg是一类多免疫调节T细胞。Treg细胞可以抑制其他T细胞的活化,阻碍机体的免疫系统对肿瘤的监视[16],并防止肿瘤相关抗原-抗体的有效的免疫反应,从而为肿瘤细胞的免疫逃逸提供有利环境,促进肿瘤的发展。FOXP3是Treg细胞最特异的标志,参与Treg细胞的激活及功能的调节[17],是动态免疫平衡调节必不可少的因子。FOXP3缺失是导致自身免疫性疾病的重要因素[18]。以往的研究发现[19-20],肺、乳腺、卵巢、结肠肿瘤患者外周血CD4+CD25+Treg细胞水平显著高于健康受试者,且与临床分期和荷瘤状态密切相关。该研究发现FOXP3在宫颈癌和CIN组织中表达均高于正常宫颈组织,说明FOXP3+Treg细胞参与了宫颈癌的发生发展过程。Scott等[21]研究也发现FOXP3在宫颈癌及CIN组织中的表达明显升高,且FOXP3的表达随着CIN级别的升高而升高。该研究也发现FOXP3与PD-1及PD-L1的表达无关联,另外该研究发现PD-1、PD-L1和FOXP3与患者HPV感染状态无关,可能是与研究样本数较少有关。
综上所述,PD-1、PD-L1和FOXP3在宫颈癌的发生发展中起到了一定的作用。PD-L1和PD-1分子有望成为有效的抗宫颈癌免疫治疗靶点,但PD-L1 与 PD-1 在肿瘤免疫逃逸中的调控机制尚未完全阐明,需要进一步的研究证实。而FOXP3与肿瘤的发生、发展及转移密切相关,已成为肿瘤研究中的重要因子,有望成为宫颈癌筛查及诊疗的重要标志物。
[1]JEMAL A,BRAY F,CENTER MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69
[2]JAYSHREE RS,SREENIVAS A,TESSY M,et al.Cell intrinsic extrinsic factors in cervical carcinogenesis[J].Indian J Med Res,2009,130(3):286
[3]SHI F,SHI M,ZENG Z,et al.PD-1 and PD-L1 upregulation promotes CD8(+) T-cell apoptosis and postoperative recurrence in hepatocellular carcinoma patients[J].Int J Cancer,2011,128(4):887
[4]GERSHON RK.A disquisition on suppressor T cells[J].Transplant Rev,1975,26:170
[5]VAN DER BURG SH,PIERSMA SJ,DE JONG A,et al.Association of cervical cancer with the presence of CD4+regulatory T cells specific for human papillomavirus antigens[J].Proc Natl Acad Sci U S A,2007,104(29):12087
[6]KEIR ME,BUTTE MJ,FREEMAN GJ,et al.PD-1 and its ligands in tolerance and immunity[J].Annu Rev Immunol,2008,26:677
[7]DORFMAN DM,BROWN JA,SHAHSAFAEI A,et al.Programmed death-1 (PD-1) is a marker of germinal center-associated T cells and angioimmunoblastic T-cell lymphoma[J].Am J Surg Pathol,2006,30(7):802
[8]OHAEGBULAM KC,ASSAL A,LAZAR-MOLNAR E,et al.Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J].Trends Mol Med,2015,21(1):24
[9]YAMAZAKI T,AKIBA H,IWAI H,et al.Expression of programmed death 1 ligands by murine T cells and APC[J].J Immunol,2002,169(10):5538
[10]LI B,VAN ROEY M,WANG CY,et al.Anti-programmed death-1 synergizes with granulocyte macrophage colony-stimulating factor-secreting tumor cell immunotherapy providing therapeutic benefit to mice with established tumors[J].Clin Cancer Res,2009,15(5):1623
[11]DULOS J,CARVEN GJ,VAN BOXTEL SJ,et al.PD-1 blockade augments Th1 and Th17 and suppresses Th2 responses in peripheral blood from patients with prostate and advanced melanoma cancer[J].J Immunother,2012,35(2):169
[12]KARIM Rezaul,JORDANOVA S,PIERSMA J,et al.Tumor-expressed B7-H1 and B7-DC in relation to PD-1+ T-cell infiltration and survival of patients with cervical carcinoma[J].Clin Cancer Res,2009,15(20):6341
[13]马薇,罗殿中,陈源,等.PD-L1和PD-1在非小细胞肺癌中的表达及其临床意义[J].实用医学杂志,2011,27(9):1551
[14]吴圣,邵婧怡,王芳,等.PD-L1和 PD-1在胃癌组织中的表达及其临床意义[J].安徽医科大学学报,2015(6):821
[15]刘书漫,孟青,张钦宪,等.B7-H1及其受体PD-1在胃癌组织中的表达与意义[J].中华肿瘤杂志,2008,30(3):192
[16]WHITESIDE TL.Regulatory T cell subsets in human cancer: are they regulating for or against tumor progression?[J].Cancer Immunol Immunother,2014,63(1):67
[17]HORI S,NOMURA T,SAKAGUCHI S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003,299(569):1057
[18]JIN Yonglong,GUAN Songlei,LIU Linlin,et al.Anti-p16 autoantibodies may be a useful biomarker for early diagnosis of esophageal cancer[J].Asia Pac J Clin Oncol,2015,11(4):e37
[19]YE L,GUAN S,ZHANG C,et al.Circulating autoantibody to FOXP3 may be a potential biomarker for esophageal squamous cell carcinoma[J].Tumour Biol,2013,34(3):1873
[20]CUNHA Leite,MORARI Cristina,NONOGAKI Suely,et al.Foxp3 expression is associated with aggressiveness in differentiated thyroid carcinomas[J].Clinics (Sao Paulo),2012,67(5):483
[21]SCOTT ME,MA Y,KUZMICH L,et al.Diminished IFN-gamma and IL-10 and elevated Foxp3 mRNA expression in the cervix are associated with CIN 2 or 3[J].Int J Cancer,2009,124(6):1379
(2016-08-01收稿 责任编辑李沛寰)
Expression and correlation analysis of FOXP3, PD-1 and PD-L1 in the cervical cancer
HANLiping1),LIULiya1,2),SUNXiaohui3),LIYuan1,2),YUHaiyang4),ZHANGQingqing1,2),
1)DepartmentofGynaecology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)Key-DisciplinesLaboratoryofClinical-MedicineofHenan,Zhengzhou450052 3)DepartmentofGynaecology,TumorHospitalofAnyang,Anyang,Henan455000 4)DepartmentofGynaecology,ZhengzhouCentralHospitalAffiliated,ZhengzhouUniversity,Zhengzhou450007
cervical cancer;PD-1;PD-L1;FOXP3
Aim: To explore the expression of PD-1, PD-L1 and FOXP3 proteins in human normal cervical tissues, cervical intraepithelial neoplasia,cervical cancer, and their relationship with clinical features. Methods: Immuno-histochemical SP method was used to detect the expressions of PD-1, PD-L1, FOXP3 in tissue obtained from 64 cases of cervical cancer, 40 cases of cervical intraepithelial neoplasia (CIN),18 cases of normal cervical tissue. Results: FOXP3, PD-1 was mainly expressed on TIL, PD-L1was mainly expressed in cervical cancer cells and TIL. There were no expression of PD-1, PD-L1,FOXP3 in normal cervical tissues. The positive expression rate of PD-1, PD-L1, FOXP3 in cervical cancer tissues was significantly higher than that in cervical CIN tissues, and the difference was statistically significant (P<0.05); The expression of PD-1, PD-L1 and FOXP3 in cervical carcinoma was related to the degree of differentiation ,FIGO stage, the difference being statistically significant (P<0.05), and without any correlation with age, tumor size, HPV infection (P>0.05). The expression of PD-L1 and PD-1 in cervical carcinoma cells was positively correlated (rS=0.562,P<0.001). The expression of FOXP3 and PD-1 ,PD-L1 in cervical cancer tissue had no significant correlation(rS=0.218,0.257,P>0.05). Conclusion: The expression of PD-L1 and PD-1 in human cervical cancer tissues is increased, which is closely related to the occurrence, development, infiltration and metastasis of the tumor.
10.13705/j.issn.1671-6825.2017.01.022
R711.74

