婴儿双歧杆菌对ConA诱导小鼠肝纤维化的影响*
刘 超,郭 琦,郑鹏远,刘 霞,于 泳,唐芙爱,赵治国
1)郑州大学第二附属医院消化内科 郑州 450014 2)郑州大学第二附属医院超声科 郑州 450014 3)郑州大学第五附属医院消化内科 郑州 450052
婴儿双歧杆菌对ConA诱导小鼠肝纤维化的影响*
刘 超1),郭 琦2),郑鹏远3)#,刘 霞1),于 泳3),唐芙爱1),赵治国1)
1)郑州大学第二附属医院消化内科 郑州 450014 2)郑州大学第二附属医院超声科 郑州 450014 3)郑州大学第五附属医院消化内科 郑州 450052
#通信作者,男,1965年2月生,博士,教授,主任医师,研究方向:胃肠道感染与免疫,E-mail:medp7123@126.com
婴儿双歧杆菌;小鼠;肝纤维化;刀豆蛋白
目的:研究婴儿双歧杆菌对刀豆蛋白A(ConA)诱导的小鼠肝纤维化的作用及其机制。方法:36只小鼠随机分为正常组、模型组和婴儿双歧杆菌组,每组12只。正常组静脉注射生理盐水,模型组和婴儿双歧杆菌组静脉注射12.5 mg/kg ConA溶液,每周1次。每日通过灌胃给予正常组和模型组蒸馏水,婴儿双歧杆菌组通过灌胃给予0.5 g/kg婴儿双歧杆菌溶液,持续7周。检测小鼠肝脏质量指数,小鼠血清肝功能生化指标(ALT、AST、ALB),透明质酸(HA),Ⅲ型前胶原肽(PC Ⅲ)的水平,以及小鼠肝组织Ⅰ型胶原(ColⅠ)、Ⅲ型胶原(Col Ⅲ)、基质金属蛋白酶抑制因子(TIMP)-1、基质蛋白金属酶(MMP)-1、MMP-2、MMP-9、肿瘤坏死因子α(TNF-α)、IL-6、IL-10的含量。结果:婴儿双歧杆菌能显著降低ConA诱导小鼠的肝脏质量指数(P<0.05),改善血清肝功能生化指标(P<0.05),降低血清HA、PC Ⅲ水平(P<0.05),降低肝组织中ColⅠ、Col Ⅲ、MMP-2、MMP-9、TIMP-1、TNF-α、IL-6含量(P<0.05),升高小鼠肝组织中MMP-1、IL-10含量(P<0.05)。结论:婴儿双歧杆菌具有明确的抗小鼠肝纤维化作用。
肝纤维化是各种病因导致的肝脏内结缔组织的异常增生,肝纤维化的持续发展最终将导致肝硬化的发生。肝纤维化是一个可逆的过程,防止肝纤维化的发生发展是防治肝硬化的重要措施[1-2]。研究[3-6]表明,益生菌可通过免疫调节机制改善小鼠肠道状况,也可治疗实验动物的肝炎、肝硬化等,提示益生菌可能通过免疫调节机制抑制免疫反应诱发的肝纤维化。婴儿双歧杆菌是一种重要的益生菌,具有调节肠道菌群、调节免疫反应、抗肿瘤、抗感染等生物学活性,可能通过调节机体特异性或非特异性免疫反应发挥抗肝纤维化作用[7]。该研究建立刀豆蛋白A(concanavalin A,ConA)诱导的免疫性小鼠肝纤维化模型,研究婴儿双歧杆菌抗小鼠肝纤维化的作用,初步明确其作用机制,为应用婴儿双歧杆菌治疗肝纤维化提供可靠的实验依据[8-9]。
1 材料与方法
1.1 实验动物和主要试剂 4周龄雄性BALB/c小鼠36只,购于河南省实验动物中心,合格证号 SCXK(豫)2010-0002。婴儿双歧杆菌粉(山东科兴生物制品有限公司),ConA(美国Sigma公司),小鼠透明质酸(HA)、Ⅲ型前胶原肽(PC Ⅲ)、Ⅰ型胶原(ColⅠ)、Ⅲ型胶原(Col Ⅲ)、肿瘤坏死因子α(TNF-α)、IL-6、IL-10、基质金属蛋白酶抑制因子(TIMP)-1、基质蛋白金属酶(MMP)-1、MMP-2、MMP-9 ELISA检测试剂盒(上海西唐生物科技有限公司)。
1.2 实验分组与造模 小鼠适应性饲养1周后,按随机数字表法分为:正常组、模型组、婴儿双歧杆菌组,每组12只。于造模首日,正常组静脉注射生理盐水,模型组和婴儿双歧杆菌组静脉注射12.5 mg/kg ConA的溶液,此后每周注射1次,连续7周。于造模首日起,每日给予正常组和模型组蒸馏水灌胃,婴儿双歧杆菌组给予婴儿双歧杆菌溶液灌胃,剂量0.5 g/kg,每日1次,持续7周。末次给药后,各组小鼠禁食不禁水12 h,称重后摘眼球取血,将收集的全血放置于1.5 mL离心管静置60 min,4 ℃3 500 r/m离心15 min,取血清保存于-20 ℃冰箱,用于血清指标检测。取血完毕后脱颈椎处死小鼠,摘取小鼠肝脏组织,生理盐水冲洗干净后称重。每只小鼠取3片肝组织,将其中一片置于体积分数10%甲醛溶液固定,经常规病理组织学检查;另外两片肝组织经液氮冷冻后于-80 ℃低温冰箱中保存,用于指标检测。
1.3 小鼠肝脏质量指数 电子天平称量小鼠空腹体重及肝脏质量,计算肝脏质量与空腹体重比(mg/g),即肝脏质量指数。
1.4 小鼠血清ALT、AST和ALB水平检测 取小鼠血清,全自动生化分析仪检测血清ALT、AST、ALB水平。
1.5 小鼠肝纤维化因子及炎症因子检测 取小鼠血清,ELISA法检测HA和PC Ⅲ的含量。取肝组织匀浆,ELISA法检测ColⅠ、Col Ⅲ、TNF-α、IL-6、IL-10的含量。
1.6 小鼠肝组织细胞外基质相关因子检测 取肝组织匀浆,ELISA法检测TIMP-1、MMP-1、MMP-2、MMP-9的含量。
1.7 统计学处理 采用SPSS 18.0分析。3组小鼠各指标的比较采用单因素方差分析,组间两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 3组小鼠肝脏病理组织学表现 正常组小鼠肝组织内肝细胞排列整齐,肝小叶结构正常,未见炎性细胞浸润及细胞变性坏死。模型组及婴儿双歧杆菌组小鼠肝组织内肝细胞排列紊乱,肝小叶结构破坏,汇管区结缔组织增生,可见炎性细胞浸润及细胞变性坏死。婴儿双歧杆菌组小鼠肝组织内纤维化程度较模型组减轻。见图1。
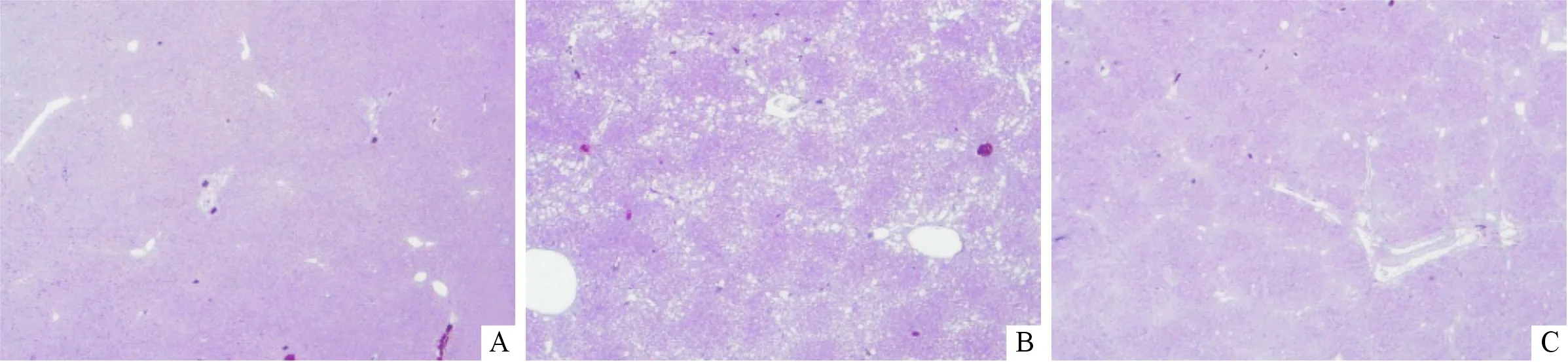
A:正常组;B: 模型组;C:婴儿双歧杆菌组。图1 3组小鼠肝组织HE染色结果(×200)
2.2 3组小鼠肝脏质量指数和血清ALT、AST、ALB水平的比较 结果见表1。与正常组相比,模型组小鼠肝脏质量指数显著升高,血清ALT、AST水平显著升高,ALB水平显著降低。与模型组相比,婴儿双歧杆菌组小鼠上述指标明显改善。
2.3 3组小鼠肝纤维化因子及炎症因子水平的比较 结果见表2、3。与正常组相比,模型组小鼠血清HA、PC Ⅲ及肝组织ColⅠ、Col Ⅲ、TNF-α、IL-6含量升高,IL-10含量降低。与模型组相比,婴儿双歧杆菌组小鼠血清HA、PCⅢ浓度降低,肝组织中ColⅠ、Col Ⅲ和TNF-α、IL-6含量降低,IL-10含量升高。
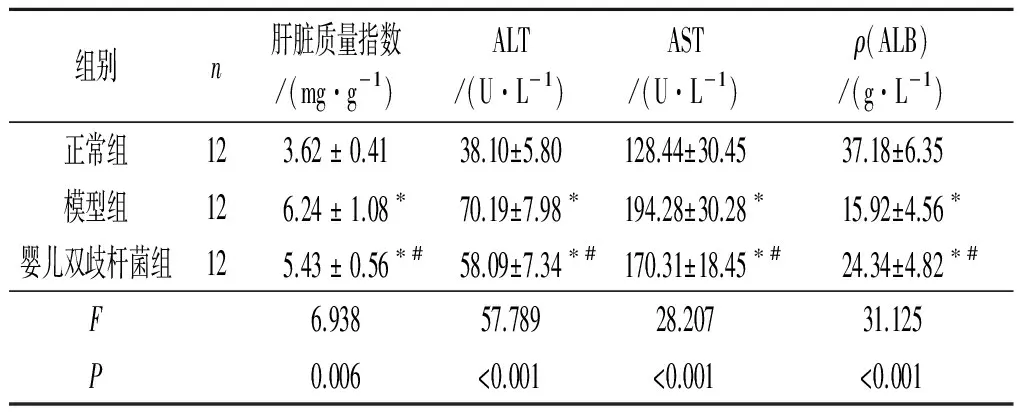
表1 3组小鼠肝脏质量指数和血清ALT、AST和ALB水平的比较
*:与正常组相比,P<0.05;#:与模型组相比,P<0.05。

表2 3组小鼠肝纤维化因子HA、PC Ⅲ、ColⅠ和Col Ⅲ的比较
*:与正常组相比,P<0.05;#:与模型组相比,P<0.05。

表3 3组小鼠炎症因子TNF-α、IL-6、IL-10的比较 mg/kg
*:与正常组相比,P<0.05;#:与模型组相比,P<0.05。
2.4 3组小鼠肝组织TIMP-1、MMP-2、MMP-9含量的比较 结果见表4。与正常组相比,模型组小鼠肝组织TIMP-1、MMP-2、MMP-9含量升高,MMP-1含量降低。与模型组相比,婴儿双歧杆菌组小鼠肝脏TIMP-1、MMP-2、MMP-9含量降低,MMP-1含量升高。

表4 3组小鼠肝脏组织TIMP-1、MMP-1、MMP-2、MMP-9含量的比较 mg/kg
*:与正常组相比,P<0.05;#:与模型组相比,P<0.05。
3 讨论
在肝纤维化发展过程中,多种信号转导通路的平衡被打破,各种促肝纤维化因子的合成增加、活性发生变化,而抗肝纤维化因子的效应减弱或受到抑制,细胞外基质代谢失衡而发生过度沉积,最终导致肝硬化的发生。MMPs是一组可降解细胞外基质的重要酶类,而TIMPs则能够结合MMPs以降低其表达,肝损伤发生后肝组织内MMPs减少,TIMPs增加[10]。PCⅢ、ColⅣ、层黏连蛋白、HA与肝纤维化的活动程度密切相关,均可反映肝纤维化因子合成状况和炎症活动程度。自身免疫反应引起的TNF-α和白介素家族的异常表达是免疫性肝纤维化形成的主要原因之一[11-12]。在免疫功能紊乱的情况下,TNF-α可引起细胞外基质合成和沉积,最终导致肝纤维化形成[13-14]。IL-6可促进肝成纤维细胞增生和胶原合成,并可影响肝脏组织内MMPs和TIMPs的合成和降解,从而发挥促肝纤维化作用[15]。IL-10可下调MMPs的表达和抑制TIMPs的合成,通过免疫调节机制发挥抗纤维化的作用[16]。李延玲等[4]研究发现,含双歧杆菌、嗜酸乳杆菌、肠球菌三联活菌的益生菌胶囊能抑制肝硬化大鼠肝细胞凋亡,具有肝脏保护作用。Zuo等[6]研究发现,婴儿双歧杆菌可调节T细胞亚型的生物学功能,通过干预细胞免疫而缓解结肠炎症状。
该研究选择ConA作为诱导剂,建立小鼠自身免疫性肝纤维化动物模型,经病理证实模型组和婴儿双歧杆菌组小鼠肝纤维化存在。该研究结果显示与正常组相比,模型组小鼠肝功能指标(肝脏质量指数、ALT、AST、ALB)和肝纤维化指标(HA、PC Ⅲ、ColⅠ、Col Ⅲ)含量明显升高,炎症因子及细胞外基质相关因子(TNF-α、IL-6、IL-10、TIMP-1、MMP-2、MMP-9、MMP-1)均明显异常,而与模型组相比,婴儿双歧杆菌组小鼠以上指标均有显著改善,说明婴儿双歧杆菌可能通过干预肝纤维化因子、炎症因子及细胞外基质相关因子等指标而发挥抗肝纤维化的作用。
总之,该研究结果显示给予肝纤维化小鼠婴儿双歧杆菌可能抑制肝纤维化,其作用机制可能与调节肝脏TNF-α,IL-6和 IL-10表达,进而调节小鼠肝纤维化过程中的免疫反应有关。
[1]MORMONE E,GEORGE J,NIETO N.Molecular pathogenesis of hepatic fibrosis and current therapeutic approaches[J].Chem Biol Interact,2011,193(3):225
[2]曾璐,周本杰.肝纤维化发病机制和治疗方法的研究进展[J].广东医学,2014,35(24):3918
[3]王玉玉,张军,郑鹏远,等.双歧杆菌、酪酸梭菌及谷氨酰胺对慢性应激模型小鼠肠黏膜屏障的影响[J].郑州大学学报(医学版),2014,37(2):153
[4]李延玲,张怀宏,翟玉峰.益生菌对肝硬化大鼠肝细胞凋亡的干预作用[J].中国老年学杂志,2014,34(3):708
[5]谢基明,王玉珍,张威,等.益生菌L.Casei Zhang对大鼠急性肝损伤的保护作用及其对TLR-4-ERK-PPARγ通路的影响[J].中国免疫学杂志,2013,29(9):910
[6]ZUO L,YUAN T,YU L,et al.Bifidobacterium infantis attenuates colitis by regulating T cell subset responses[J].World J Gastroenterol,2014,20(48):18316
[7]刘思濛,郑鹏远,李付广,等.婴儿双歧杆菌对肠易激综合征小鼠肠道黏膜 CRF 受体表达及肥大细胞活化的影响[J].中华微生物学和免疫学杂志,2014,34(8):571
[8]吴丽,魏伟.肝纤维化的动物模型及治疗药物研究[J].中国药理学通报,2004,20(5):481
[9]李鸿立,田聆,魏于全,等.刀豆素蛋白A诱导小鼠肝纤维化模型的建立[J].免疫学杂志,2004,20(5):390
[10]邵祥强,肖华胜.肝纤维化发病机制与临床诊断的研究进展[J].世界华人消化杂志,2011,19(3):268
[11]宗蕾,陆伦根.免疫因素在肝纤维过程中的作用的研究进展[J].世界华人消化杂志,2007,15(3):205
[12]吴丽,郑仕中,潘苏华,等.免疫细胞对肝纤维化发展的影响[J].中国药理学通报,2010,26(12):1557
[13]MIGITA K,MAEDA Y,ABIRU S,et al.Immunosuppressant FK506 inhibits matrix metalloproteinase-9 induction in TNF-alpha-stimulated human hepatic stellate cells[J].Life Sci,2006,78(21):2510
[14]KLIRONOMOS S,NOTAS G,SFAKIANAKI O,et al.Octreotide modulates the effects on fibrosis of TNF-α, TGF-β and PDGF in activated rat hepatic stellate cells[J].Regul Pept,2014,188(1):5
[15]BANSAL B,KOVALOVICH K,GUPTA R,et al.Interleukin-6 protects hepatocytes from CCl4-mediated necrosis and apoptosis in mice by reducing MMP-2 expression[J].J Hepatol,2005,42(4):548
[16]ZHENG WD,ZHANG LJ,SHI MN,et al.Expression of matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-1 in hepatic stellate cells during rat hepatic fibrosis and its intervention by IL-10[J].World J Gastroenterol,2005,11(12):1753
(2016-09-11收稿 责任编辑李沛寰)
Effect of infant bifidobacteria on liver fibrosis of mice induced by ConA
LIUChao1),GUOQi2),ZHENGPengyuan3),LIUXia1),YUYong3),TANGFu′ai1),ZHAOZhiguo1)
1)DepartmentofGastroenterology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014DepartmentofUltrasound,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014DepartmentofGastroenterology,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
infant bifidobacteria;mouse;liver fibrosis;concanavalin
Aim: To research the preventive effects and mechanism of infant bifidobacteria on liver fibrosis of mice induced by concanavalin A(ConA). Methods: The mice were randomly allocated into three groups: normal group, model group and infant bifidobacteria-treated group,12 in each group. The ConA solution(12.5 mg/kg) was given by intravenous injection to the model group and infant bifidobacteria-treated group once a week, normal group and model group were given normal saline by gavage,and infant bifidobacteria-treated group was given infant bifidobacteria(0.5 g/kg) by gavage once a day. After 7 weeks, liver weight index, liver function, concentrations of HA and PCⅢ in serum, as well as collagen Ⅰ, collagen Ⅲ, MMP-1, MMP-2, MMR-9, TIMP-1,TNF-α, IL-6, IL-10 in liver tissue were determined. Results: Infant bifidobacteria could decrease liver weight index(P<0.05), improve the liver function(P<0.05), decrease the serum concentrations of HA and PC Ⅲ(P<0.05), decrease the contents of collagen Ⅰ, collagen Ⅲ, MMP-2, MMR-9, TIMP-1,TNF-α, IL-6(P<0.05) in mice liver tissue, and increase the contents of MMP-1 and IL-10 in mice liver tissue(P<0.05).Conclusion: Infant bifidobacteria could prevent liver fibrosis of mice induced by ConA.
10.13705/j.issn.1671-6825.2017.01.004
*国家自然科学基金资助项目 81370494;郑州市科技领军人才项目 131PLIRC656
R575

