冬凌草活性成分KY3对食管癌EC109 细胞增殖的抑制作用*
方 莉,王赛琪,陈雪梅,薛博涵,王冠涛,李玉萍,刘宏民#
1)郑州大学医院检验科 郑州 450001 2)郑州大学药学院 郑州 450001 3)郑州大学基础医学院人体解剖学系 郑州 450001
冬凌草活性成分KY3对食管癌EC109 细胞增殖的抑制作用*
方 莉1),王赛琪2),陈雪梅3),薛博涵3),王冠涛3),李玉萍3),刘宏民2)#
1)郑州大学医院检验科 郑州 450001 2)郑州大学药学院 郑州 450001 3)郑州大学基础医学院人体解剖学系 郑州 450001
#通信作者,男,1960年3月生,博士,教授,研究方向:药物化学,E-mail:liuhm@zzu.edu.cn
EC109细胞;凋亡;周期阻滞;KY3
目的:探讨冬凌草活性成分KY3对食管癌细胞EC109增殖的抑制作用及其机制。方法:MTT法测定0、10、20、30、40、60、80、100 μmol/L KY3对EC109细胞增殖的影响;流式细胞术检测0、10、20、30 μmol/L KY3对EC109细胞凋亡和细胞周期分布的影响,免疫荧光法观察KY3对EC109细胞中微管结构的影响,Hoechst 33258染色观察KY3作用后EC109细胞核的形态。结果:KY3能够抑制EC109细胞的体外增殖;KY3处理后EC109细胞周期阻滞在G2/M期并发生凋亡(P<0.05);KY3作用于EC109细胞后,微管遭到破坏,随着KY3剂量的增加,α-微管蛋白逐渐发生降解并出现细胞核固缩、浓染等典型的凋亡形态。结论:冬凌草活性成分KY3在体外对EC109细胞具有增殖抑制作用,其机制可能与破坏细胞微管结构、G2/M期细胞周期阻滞及诱导细胞凋亡有关。
食管癌是发生于食管上皮组织的常见消化系统肿瘤,分为腺癌和鳞状细胞癌,在世界范围内发病率位居恶性肿瘤第8位,主要流行于发展中国家。我国食管癌发病率和病死率均居世界首位,其中河南、山西、河北等太行山以南的一些省份是食管鳞状细胞癌的高发地区[1]。冬凌草,又名冰凌草,系唇形科香茶菜属多年生草本植物,具有抗肿瘤、抗突变、抗菌抗炎、抗氧化等多种药理作用,其主要成分是贝壳杉烷型二萜类化合物[2]。冬凌草的主要成分冬凌草甲素被证实对多种肿瘤细胞具有体内外增殖抑制作用[3-6],包括食管癌、结肠癌、胃癌、肝癌、卵巢癌、宫颈癌等。最近,作者所在的课题组从冬凌草中分离得到一种结构全新的贝壳杉烷型二萜类化合物KY3,该研究旨在探索KY3对食管癌EC109细胞体外增殖的影响及其分子学机制。
1 材料与方法
1.1 药品与试剂 KY3由郑州大学新药研究开发中心提供,RPMI 1640培养基和胎牛血清均为Thermo Scientific HyClone公司产品。兔抗α-微管蛋白多克隆IgG抗体购自北京中杉金桥生物技术有限公司,Alexa Fluor 488标记山羊抗兔IgG购自Jackson 公司,Annexin V-FITC/PI双染凋亡检测试剂盒购自凯基生物有限公司,MTT、PI等购自Sigma公司,RNase A购自索莱宝科技有限公司,Hoechst 33258购自西安沃尔森生物技术有限公司。
1.2 细胞培养 EC109细胞购自中国科学院上海细胞库,用含体积分数10%胎牛血清、100 kU/L青霉素、100 mg/L 链霉素的RPMI 1640培养液在体积分数5% CO2、37 ℃、饱和湿度条件下培养,取对数期生长的细胞进行实验。
1.3 MTT法测定细胞生存率[7-8]2.5 g/L胰蛋白酶消化后收集细胞,吹打成单细胞悬液,将细胞密度调整为2.0×105mL-1并接种于96孔板,每孔200 μL,待细胞贴壁后弃上清,加入含不同浓度(0、10、20、30、40、60、80、100 μmol/L)KY3的完全培养基培养24、48或72 h。药物作用结束后每孔加入5 g/L MTT 溶液20 μL,继续培养4 h后弃上清,每孔加入DMSO 150 μL,振荡10 min,酶标仪检测570 nm 波长处各孔吸光度(A)值,计算细胞生存率。细胞生存率=A给药组/A对照组×100%。每组设6个平行孔,实验重复3次。将细胞生存率数据输入SPSS 17.0,采用回归分析计算半数抑制浓度(IC50)。
1.4 流式细胞术检测细胞凋亡[9]消化、收集对数期生长的EC109细胞,制成单细胞悬液,计数后按1.0×105/孔接种于6孔板,培养24 h后弃去培养基,加入含不同浓度(0、10、20、30 μmol/L)KY3的新鲜培养基继续培养。24 h后,消化、收集细胞,4 ℃预冷PBS洗涤2次,按试剂盒说明书进行操作:加入500 μL Binding Buffer 重悬细胞,加入5 μL Annexin V-FITC,混匀后室温、避光染色15 min,再加入5 μL PI,室温、避光染色5 min后上流式细胞仪检测细胞早期和晚期凋亡率[10]。每组设2个复孔,实验重复3次。
1.5 流式细胞术检测细胞周期 消化、收集对数生长期的EC109细胞,制成单细胞悬液,计数后按1.0×105/孔接种于6孔板,培养24 h后弃去培养基,PBS洗涤1次后加入含不同浓度(0、10、20、30 μmol/L)KY3的新鲜培养基继续培养。10 h后消化、收集细胞,4 ℃预冷PBS洗涤2次,体积分数70%乙醇4 ℃固定过夜。预冷PBS洗涤2次,加入PI染液,室温避光染色30 min 后上机检测。每组设2个复孔,实验重复3次。
1.6 免疫荧光法检测α-微管蛋白 消化、收集细胞,制成单细胞悬液,接种于含有盖玻片的24孔板中,培养24 h后弃去培养基,加入含有不同浓度(0、10、20、30 μmol/L)KY3的新鲜培养基,继续培养20 h后取出细胞爬片,PBS洗涤3次,40 g/L多聚甲醛固定20 min,PBS洗涤3次,体积分数0.1% Triton X-100通透10 min,PBS洗涤3次,体积分数5%胎牛血清室温封闭1 h。兔抗α-微管蛋白多克隆抗体4 ℃孵育过夜,PBS洗涤3次,Alexa Fluor 488标记的山羊抗兔IgG二抗室温孵育2 h,PBS洗涤3次,Hoechest 33258染液(10 mg/L)染色15 min,滴加抗淬灭剂封片后共聚焦显微镜下观察。
1.7 统计学处理 采用SPSS 17.0进行数据分析,不同组间凋亡率、细胞周期分布情况及不同时间KY3的IC50的比较均采用单因素方差分析和SNK-q检验,检验水准α=0.05。
2 结果
2.1 KY3对EC109细胞增殖的抑制作用 结果见图1。由图1可知,随着KY3浓度的增加和干预时间的延长,EC109细胞生存率不断下降,即KY3在体外对EC109细胞具有增殖抑制作用。24、48、72 h的IC50分别为(31.01±1.49)、(14.70±1.17)、(4.10±0.61) μmol/L(F=284.200,P<0.001)。

图1 KY3对EC109细胞增殖的抑制作用
2.2 KY3诱导EC109细胞凋亡 各组细胞凋亡率的比较见表1。由表1可知,20、30 μmol/L KY3组细胞早期凋亡率和晚期凋亡率均高于0 μmol/L KY3组。
2.3 KY3对EC109细胞周期的影响 结果见表2。由表2可知,30 μmol/L KY3处理EC109细胞后,G0/G1期细胞增多,S期细胞减少,G2/M期细胞增多,与0 μmol/L KY3组相比,差异有统计学意义。
2.4 KY3对EC109细胞微管的影响 KY3处理EC109细胞后用免疫荧光法检测α-微管蛋白表达情况,Hoechst 33258染色检测细胞核形态,结果见图2。由图2可知,正常细胞微管呈均匀、规律的丝状,以辐射状排列在整个细胞中,支撑细胞形状;10 μmol/L KY3处理细胞后,微管骨架遭到破坏、丝状微管消失,细胞萎缩呈圆形;当KY3的浓度增加到20 μmol/L时,α-微管蛋白的绿色荧光信号开始减弱;当KY3的浓度增加到30 μmol/L时,α-微管蛋白信号明显减弱,大量α-微管蛋白降解,同时细胞核开始固缩、浓染,细胞发生凋亡。在凋亡的细胞中,残存的α-微管蛋白仅分布在细胞核周围,而在未发生凋亡的细胞中,残存的α-微管蛋白主要聚集在细胞膜。
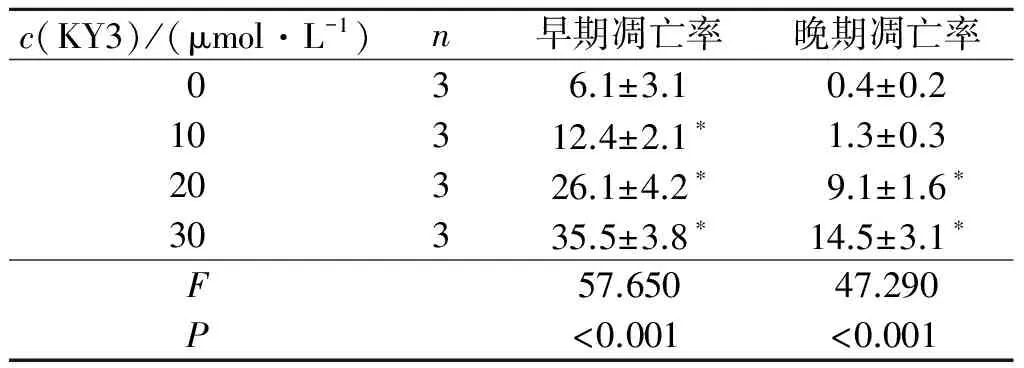
表1 KY3对EC109细胞凋亡率的影响 %
*:与0 μmol/L KY3组相比,P<0.05。
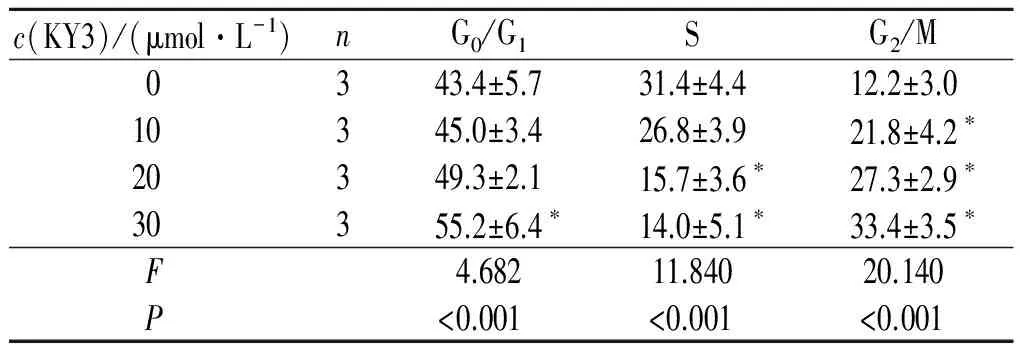
表2 KY3对EC109细胞周期的影响 %
*:与0 μmol/L KY3组相比,P<0.05。
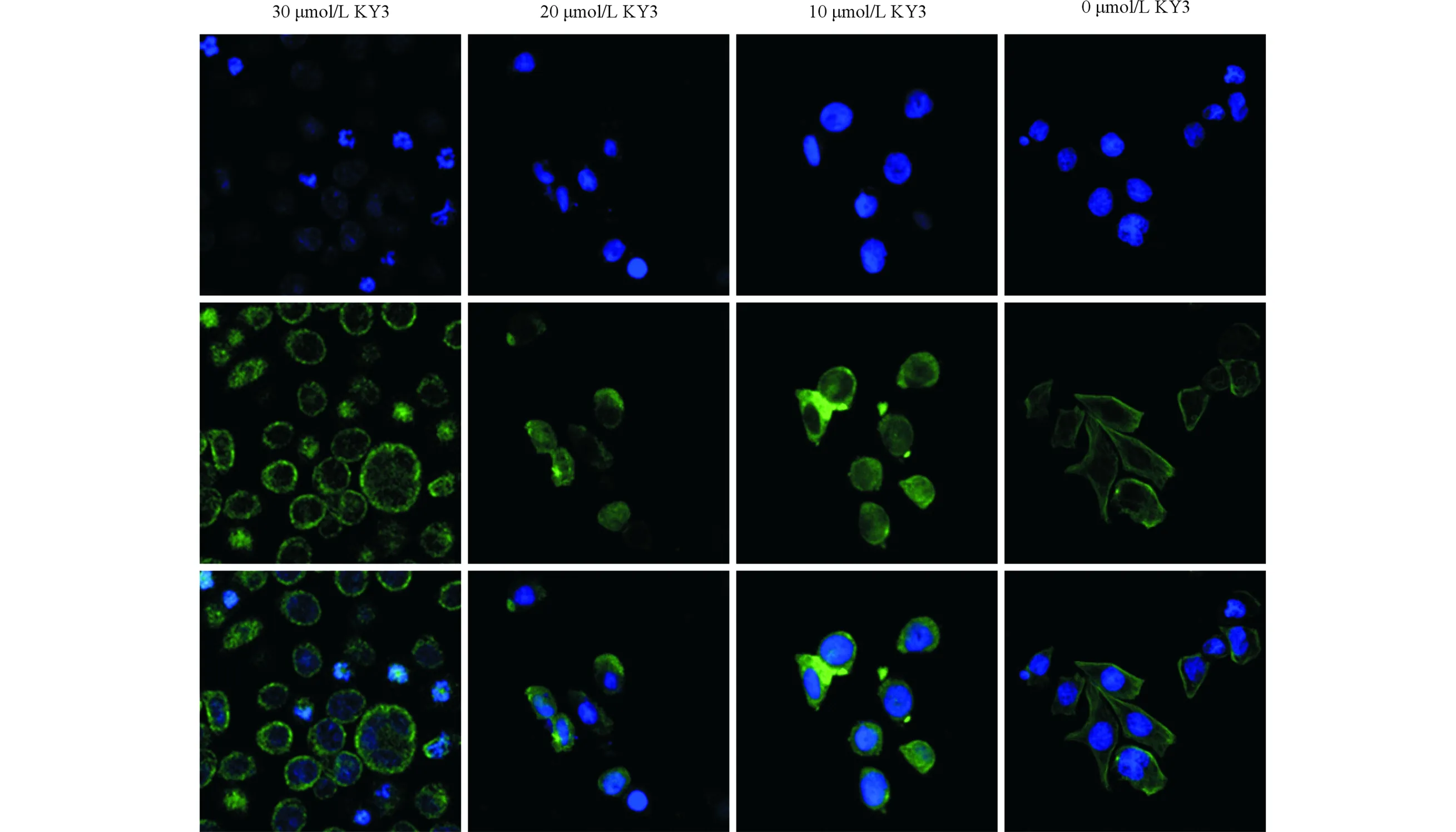
上排:Hoechst 33258;中排:α-微管蛋白;下排:合并。图2 免疫荧光法检测KY3处理后α-微管蛋白的形态(×400)
3 讨论
微管由α-微管蛋白和β-微管蛋白异二聚体组成,是细胞骨架的主要成分。正常的微管在维持细胞形态、细胞有丝分裂、信号转导及物质运输等过程中起着重要作用[11]。在有丝分裂期间,胞质中的微管解聚成微管蛋白,微管蛋白聚合形成纺锤体,纺锤体通过微管的聚合与解聚不断延长和缩短,牵引染色体向细胞两极移动进入2个子细胞中,完成有丝分裂[12]。干扰微管蛋白聚合-解聚过程的药物往往干扰细胞的有丝分裂,引起细胞周期阻滞,最终导致细胞凋亡,因而是一类极具前景的抗肿瘤药物[13]。
冬凌草是我国一味传统的中草药,味甘苦、性微寒,具有清热解表、消炎止痛、健胃活血、增强免疫及抗肿瘤等功效。河南食管癌高发区林州、济源等地的居民依据经验将冬凌草用于治疗贲门癌、食管癌已有30 a的历史,且治愈率很高。由于冬凌草具有独特的抗食管癌、贲门癌及原发肝癌的功效,因而被誉为“紫杉醇第二”[14]。
在以往的工作中,作者从冬凌草中分离得到了一种结构全新的二萜类化合物KY3,初步评价了KY3对人食管癌细胞EC109增殖的抑制作用。结果显示,在3个时间段内,EC109细胞的生存率均随着KY3浓度的增加而降低;同时,在相同的KY3浓度下,EC109细胞的生存率随着KY3处理时间的延长而逐渐降低。该结果提示,KY3呈剂量和时间依赖性降低EC109细胞的生存率。为探寻KY3抑制EC109细胞增殖的分子机制,作者随后检测了KY3处理之后EC109细胞的凋亡情况。结果显示,不同剂量的KY3作用后,EC109细胞均发生了凋亡,且凋亡率随着KY3浓度增加而逐渐增加。在肿瘤的治疗中,除了诱导细胞凋亡,诱导细胞周期阻滞也是一个行之有效的手段。因此,接下来作者观察了KY3对EC109细胞周期分布的影响。结果显示,随着KY3浓度的增加,G2/M期细胞逐渐增多,提示KY3将EC109细胞周期阻滞在G2/M期。此外,作者还发现,KY3作用之后,EC109细胞的微管形态遭到了破坏,提示KY3抑制EC109细胞增殖可能与微管损伤有关。
总之,KY3通过诱导凋亡、将细胞周期阻滞在G2/M期、破坏微管结构形态抑制EC109细胞体外的增殖。
[1]OKA M,YAMAMOTO K,TAKAHASHI M,et al.Relationship between serum levels of interleukin 6, various disease parameters and malnutrition in patients with esophageal squamous cell carcinoma[J].Cancer Res,1996,56(12):2776
[2]刘净,梁敬钰,谢韬.冬凌草研究进展[J].海峡药学,2004,16(2):1
[3]LIU Z,OUYANG L,PENG H,et al.Oridonin: targeting programmed cell death pathways as an anti-tumour agent[J].Cell Prolif,2012,45(6):499
[4]LI CY,WANG EQ,CHENG Y,et al.Oridonin:an active diterpenoid targeting cell cycle arrest, apoptotic and autophagic pathways for cancer therapeutics[J]. Int J Biochem Cell Biol,2011,43(5):701
[5]CHEN SS,MICHAEL A,BUTLER-MANUEL SA.Advances in the treatment of ovarian cancer: a potential role of antiinflammatory phytochemicals[J].Discov Med,2012,13(68):7
[6]崔侨,田代真一,小野寺敏,等.冬凌草甲素通过诱导人宫颈癌HeLa细胞自噬下调凋亡的机制[J].药学学报,2007,42(1):35
[7]潘剑,李绍平,李建雄,等.羟基红花黄色素A对MPP+诱导的SH-SY5Y细胞凋亡的保护作用[J].西安交通大学学报(医学版),2014,35(5):690
[8]王光兰,崔俊生,王心蕊,等.20(S)-人参皂苷Rg3诱导肺癌细胞NCI-H460凋亡的机制[J].吉林大学学报(医学版),2008,34(6):980
[9]刘亮,左连富,王静.青蒿琥酯对食管癌Ec9706细胞线粒体膜电位及凋亡的影响[J].解放军医学杂志,2014,39(1):25
[10]李银英,陈成群,张振中.2-甲氧基雌二醇联合冬凌草甲素对胃癌 SGC-7901细胞增殖和凋亡的影响[J].郑州大学学报(医学版),2016,51(5):602
[11]DUMONTET C, JORDAN MA. Microtubule-binding agents: a dynamic field of cancer therapeutics[J]. Nat Rev Drug Discov,2010,9(10):790
[12]尚海,潘莉,杨澍,等.微管蛋白抑制剂的研究进展[J].药学学报,2010,45(9):1078
[13]PASQUIER E,KAVALLARIS M.Microtubules: a dynamic target in cancer therapy[J].IUBMB Life,2008,60(3):165
[14]徐铮奎.冬凌草有望成为“紫杉醇第二”[J].中国现代中药,2007,9(8):43
(2016-05-09收稿 责任编辑姜春霞)
Inhibitory effect of active ingredient of Rabdosia rubescens KY3 on proliferation of esophageal carcinoma EC109 cells
FANGLi1),WANGSaiqi2),CHENXuemei3),XUEBohan3),WANGGuantao3),LIYuping3),LIUHongmin2)
1)ClinicalLaboratory,HospitalofZhengzhouUniversity,Zhengzhou450001 2)SchoolofPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou450001 3)DepartmentofHumanAnatomy,CollegeofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou450001
EC109 cell;apoptosis;cycle arrest;KY3
Aim: To investigate the proliferation inhibition and the mechanism of active ingredients of Rabdosia rubescens KY3 on esophageal carcinoma EC109 cells.Methods: MTT assay was performed to measure the effect of 0,10,20,30,40,60,80,100 μmol/L KY3 on EC109 cell proliferation. Flow cytometry assay was conducted to measure the effect of 0,10,20,30 μmol/L KY3 on apoptosis and cell cycle distribution of EC109 cells, immunofluorescence was used to determine the effect of KY3 on microtubule structure of EC109 cells, and Hoechst 33258 staining was used to detect the morphological changes of the nucleus of EC109 cells after the treatment of KY3. Results: KY3 could inhibit the proliferation of EC109 cellsinvitro,and induce cell cycle arrest in G2/M phase as well as apoptosis of EC109 cells(P<0.05). After being treated by KY3, the microtubule of EC109 cells was destroyed. After the dose of KY3 increasing, α-microtubulin degradated gradually and had a typical morphological characteristic of apoptosis such as nucleus pycnosis and bright nuclei. Conclusion: The active ingredient of Rabdosia rubescens KY3 could inhibit the proliferation of EC109 cellsinvitro, and the underlying mechanisms may be related to the destruction of microtubule, the cell cycle arrest at G2/M phase as well as the induction of the apoptosis of EC109 cells.
10.13705/j.issn.1671-6825.2017.01.001
*国家自然科学基金面上项目 81430085,21372206,81172937;河南省科技厅基础与前沿项目 142300410038;河南省教育厅基金资助项目 17A310006;第59批国家博士后基金面上资助项目 2016M592314
R979.1

