原发性癫痫患儿脑电图与血清炎性因子水平的相关性分析
韩 洁,平莉莉, 胡丽敏,侯晓英
(1.河北省邯郸市中心医院功能科,河北 邯郸 056001;2.河北省邯郸市中心医院新生儿科,河北 邯郸 056001;3.河北省邯郸市中心医院儿科, 河北 邯郸 056001)
原发性癫痫患儿脑电图与血清炎性因子水平的相关性分析
韩 洁1,平莉莉2, 胡丽敏3,侯晓英1
(1.河北省邯郸市中心医院功能科,河北 邯郸 056001;2.河北省邯郸市中心医院新生儿科,河北 邯郸 056001;3.河北省邯郸市中心医院儿科, 河北 邯郸 056001)
目的分析原发性癫痫患儿脑电图与血清炎性因子水平的相关性。方法将75例原发性癫痫患儿根据癫痫发作情况分为癫痫频发组、癫痫持续状态组、非癫痫频发非持续状态组各25例。另选取同期30例健康体检儿童作为对照组。观察对照组和癫痫患儿血清高迁移率族蛋白B1(high-mobility group protein box-1,HMGB1)、白细胞介素2(interleukin-2,IL-2)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)水平及脑电图检查结果。结果癫痫患儿HMGB1、IL-2、IL-6、TNF-α及脑电图异常率均明显高于健康对照组(P<0.05),癫痫持续状态组、癫痫频发组血清HMGB1、IL-2、IL-6、TNF-α水平均高于非癫痫频发非持续状态组(P<0.05);脑电图癫痫样放电组及慢波异常组血清中HMGB1、IL-2、IL-6、TNF-α水平明显高于脑电图正常及界线性组(P<0.05),脑电图癫痫样放电组血清中HMGB1、IL-2、IL-6、TNF-α水平明显高于脑电图慢波异常组(P<0.05)。结论血清HMGB1、IL-2、IL-6、TNF-α是影响原发性癫痫患儿病情的重要炎性因子,脑电图异常改变与炎症因子表达水平呈正相关。
癫痫;炎性因子;脑电描记术;儿童
癫痫是小儿神经系统常见的慢性疾病,表现为脑神经元异常同步放电引起的暂时性脑功能障碍综合征[1-2],具有反复发作的特点,严重影响患儿的生活质量。其发病机制尚未完全清楚,可能与炎性因子、神经免疫调节失衡有关。高迁移率蛋白1(high-mobility group protein box-1,HMGB1)是一类非组蛋白染色体结合蛋白,参与呼吸系统疾病、脓毒症及缺血性脑损伤等多种疾病病理过程,在难治性癫痫患者海马组织中也呈高表达[3-4]。白细胞介素6(interleukin-6,IL-6)是临床常用的炎性因子指标。本研究探讨原发性癫痫患儿脑电图检查结果与血清HMGB1及炎症因子水平的相关性,旨在为原发性癫痫患儿选择更好的治疗方法。
1 资料与方法
1.1 一般资料 选择2014年1月—2015年10月来我院就诊的原发性癫痫患儿75例,男性41例,女性34例,年龄6个月~12岁,平均(6.27±1.48)岁;另选取同期体检健康儿童30例作为对照组,男女性各15例,年龄3~10岁,平均(7.13±0.36)岁。2组性别、年龄差异无统计学意义(P>0.05),具有可比性。原发性癫痫患儿根据癫痫发作情况分为3个亚组,3亚组间性别、年龄、病程、发病原因差异均无统计学意义(P>0.05),见表1。
本研究经医院伦理委员会批准,所有患儿监护人均知情同意。
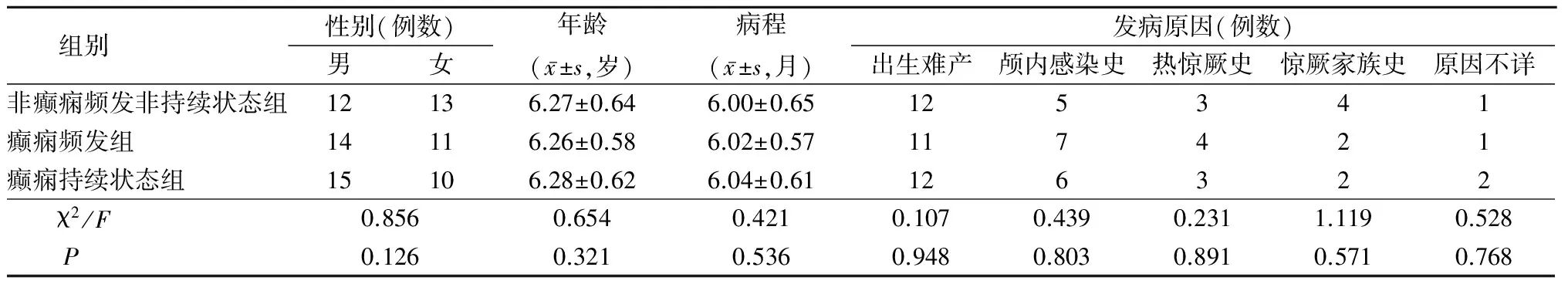
表1 3组原发性癫痫患儿一般资料比较Table 1 Comparison of general data between 3 groups of primary epilepsy children (n=25)
1.2 纳入及排除标准 纳入标准:①原发性癫痫患儿诊断符合2010年国际抗癫痫联盟及国际癫痫局制定的癫痫发作和癫痫综合征诊断指南[5],结合临床表现、既往史及个人史、家族史、脑电图检查予以确诊;②根据癫痫发作的频率及每次持续时间进行分组,癫痫频发定义为癫痫发作>3次/d,癫痫持续状态定义为发作持续30 min以上或短期内连续间断发作超过30 min、间歇期未恢复到发作前状态;③健康对照组无癫痫病史及家族史。排除标准:①中枢神经系统感染、颅脑创伤、脑出血、脑部占位或遗传代谢性疾病引起的继发性癫痫;②近期有感染史;③近1个月内应用免疫抑制剂及激素治疗者。
1.3 脑电图检查 应用日本光电EEG1200视频脑电图仪进行监测,常规予以单极和双极导联描记,其间作睁、闭眼试验,闪光刺激和过度呼吸诱发试验,详细记录脑电波变化,脑电图检查时间3.5~4 h。根据脑电图检测结果分为脑电图正常、脑电图界线性、脑电图慢波异常、脑电图癫痫样放电4个等级[6]。
1.4 炎性因子检测 健康对照组儿童在体检时、癫痫患儿在癫痫发作后12 h内,采集空腹外周静脉血2 mL,于室温下静置30 min,3 000 r/min离心10 min(离心半径3 cm),留取血清置于-80 ℃冰箱保存后行批量操作检测。采用酶联免疫吸附测定法检测血清HMGB1、白细胞介素2(interleukin-2,IL-2)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平;HMGB1试剂盒批号为A729AD0275,IL-2试剂盒批号为A729AD0277,IL-6试剂盒批号为A729AD0278,TNF-α试剂盒批号为A729AD0230,均购自上海生工生物工程股份有限公司,严格按说明书进行操作。
1.5 统计学方法 应用SPSS 20.0软件进行统计分析。计量资料比较分别采用单因素方差分析和SNK-q检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 癫痫患儿与健康对照组血清炎症因子水平及脑电图异常率比较 非癫痫频发非持续状态组、癫痫频发组和癫痫持续状态组HMGB1均高于健康对照组(P<0.05),癫痫频发组和癫痫持续状态组又高于非癫痫频发非持续状态组(P<0.05);非癫痫频发非持续状态组、癫痫频发组和癫痫持续状态组IL-2高于健康对照组(P<0.05),癫痫频发组、癫痫持续状态组又高于非癫痫频发非持续状态组(P<0.05);癫痫频发组和癫痫持续状态组IL-6高于健康对照组和非癫痫频发非持续状态组(P<0.05);非癫痫频发非持续状态组、癫痫频发组TNF-α高于健康对照组,癫痫持续状态组高于健康对照组、非癫痫频发非持续状态组和癫痫频发组(P<0.05);非癫痫频发非持续状态组、癫痫频发组和癫痫持续状态组脑电图异常率均高于健康对照组(P<0.05)。见表2。
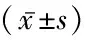
组别 例数HMGB1(μg/L)IL⁃2(ng/L)IL⁃6(ng/L)TNF⁃α(ng/L)脑电图异常(例数,%)健康对照组 304.22±0.903.81±0.458.11±1.080.05±0.020(0.00)非癫痫频发非持续状态组257.86±0.41∗5.32±0.86∗11.98±1.270.10±0.02∗17(68.00)∗癫痫频发组 258.72±0.64∗#6.54±0.75∗#14.60±1.51∗#0.11±0.01∗23(92.00)∗癫痫持续状态组 259.00±0.74∗#8.17±0.92∗#△14.75±1.60∗#0.14±0.03∗#△24(96.00)∗F/χ2 276.742177.005144.41594.52470.379P 0.0000.0000.0000.0000.000
*P<0.05与健康对照组比较 #P<0.05与非癫痫频发非持续状态组比较 △P<0.05与癫痫频发组比较(SNK-q或χ2检验)
2.2 癫痫患儿脑电图检查与血清炎症因子表达水平比较 根据原发性癫痫患儿脑电图检查结果分析,脑电图正常组、界线性组、慢波异常组、癫痫样放电组血清炎症因子呈逐渐升高。脑电图癫痫样放电组及慢波异常组血清HMGB1、IL-2、IL-6和TNF-α水平均显著高于脑电图正常组和界线性组(P<0.05),而脑电图癫痫样放电组又明显高于脑电图慢波异常组(P<0.05)。见表3。
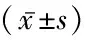
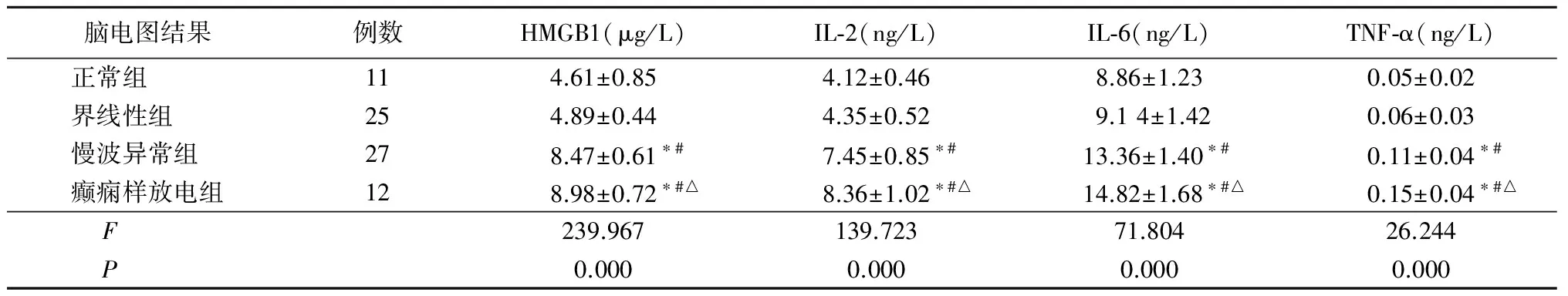
脑电图结果例数HMGB1(μg/L)IL⁃2(ng/L)IL⁃6(ng/L)TNF⁃α(ng/L)正常组 114.61±0.854.12±0.468.86±1.230.05±0.02界线性组 254.89±0.444.35±0.529.14±1.420.06±0.03慢波异常组 278.47±0.61∗#7.45±0.85∗#13.36±1.40∗#0.11±0.04∗#癫痫样放电组128.98±0.72∗#△8.36±1.02∗#△14.82±1.68∗#△0.15±0.04∗#△F 239.967139.72371.80426.244P 0.0000.0000.0000.000
*P<0.05与正常组比较 #P<0.05与界线性组比较 △P<0.05与慢波异常组比较(SNK-q检验)
3 讨 论
HMGB1首先发现于脑内,是存在于真核生物细胞内的一类非组蛋白染色体结合蛋白,通过调节神经细胞的迁移和出芽等生理功能来参与脑的发育。有研究发现,癫痫大鼠海马神经元细胞、星形细胞内外和难治性颞叶癫痫患者海马组织中神经元细胞、胶质细胞中HMGB1均呈高表达[7-8]。HMGB1广泛存在于脑、淋巴组织等组织细胞的细胞核中,在巨噬细胞、单核细胞、TNF-α等诱导后,HMGB1可分泌到细胞外,参与许多感染性、非感染性疾病的发病与发展,HMGB1的异常增高还与危重患者的病情严重程度及临床病死率有关。动物实验发现,在海人藻酸注射前15 min,在C57BIJ6大鼠海马内注入HMGB1,大鼠癫痫发作频率提高2.5倍,每次癫痫持续时间也相对延长[9-10]。范真等[11]研究表明,在侧脑室注射HMGB1中和抗体可以抑制海马炎性因子合成及胶质细胞活化,减轻神经元损伤,发挥神经保护作用。
IL-2、IL-6、TNF-α均是反映机体炎症状状态的常用炎性因子。IL-2是由活化T细胞产生的具有广泛生物学活性的细胞因子,不仅参与机体免疫应答反应,同时作为神经调质样物质,可通过升高神经元细胞内游离钙离子浓度,促进N-甲-D-天门冬氨酸受体1型亚单位合成,参与中枢神经系统病理与生理过程,发挥兴奋性神经调质作用[12]。IL-6是一种具有多种生物活性的早期炎性因子,参与机体的免疫反应,在巨噬细胞等受刺激后数小时即可释放至胞外发挥致炎效应;IL-6水平升高程度与癫痫本身有关,癫痫发作后IL-6由脑血管释放后进入血液循环,造成外周血IL-6水平升高,反复全身强直阵挛发作患者IL-6水平呈强表达;有研究认为IL-6可保护急性癫痫发作造成的脑损伤,但IL-6长期过度表达可加重癫痫,引起神经胶质增多症、神经细胞减少,造成神经组织的结构改变[13-15]。TNF-α是具有多种生物学效应细胞调节因子,主要由单核巨噬细胞与淋巴细胞分泌产生,通过花生四烯酸作用诱导自由基产生,从而改变神经元膜与突触功能,调节膜离子分布与密度,导致钙离子进入细胞内而发生进行性去极与兴奋性升高,增强海马CA3锥体细胞兴奋性,降低抑制性突触后电位活动,导致癫痫样放电[16]。相关研究表明,癫痫患儿脑组织IL-6、TNF-α表达水平均异常升高,惊厥发作患儿血清及脑脊液IL-2、IL-6、TNF-α表达水平与惊厥呈正相关[17]。本研究结果显示,癫痫患儿血清HMGB1、IL-2、IL-6、TNF-α水平均显著高于健康对照组,癫痫持续状态组、癫痫频发组血清HMGB1、IL-2、IL-6、TNF-α水平均高于非癫痫频发非持续状态组。表明HMGB1、IL-2、IL-6、TNF-α的异常表达与癫痫的发生发展密切相关。
癫痫是因为脑组织神经元突然、间歇性痫样放电所诱发的一种中枢神经系统综合征,临床呈反复、短暂性发作等特点。脑电图检测是临床诊断癫痫发作的重要手段[18-19]。李欣等[20]研究证实,老年癫痫患者脑电图检查与血清细胞因子表达水平呈正相关。本研究脑电图慢波异常、癫痫样放电组血清中HMGB1、IL-2、IL-6、TNF-α水平明显高于脑电图正常及界线性组。姚丹等[21]也有类似报道。
本研究结果表明,HMGB1、IL-2、IL-6、TNF-α是影响原发性癫痫患儿病情的重要炎性因子,且患儿血清HMGB1、IL-2、IL-6、TNF-α表达水平越高,脑电图的异常率越高,临床给予HMGB1及IL-2、IL-6、TNF-α抑制剂可能有利于癫痫的控制。需要指出的是,本研究仅仅是一个小样本的分析,所有患儿均来自同一家医院,可能会存在样本数量、样本来源上的偏畸,更准确的结论还有待于今后扩大样本展开研究。
[1] Chiavegato A,Zurolo E,Losi G,et al. The inflammatory molecules IL-1β and HMGB1 can rapidly enhance focal seizure generation in a brain slice model of temporal lobe epilepsy[J]. Front Cell Neurosci,2014,8:155.
[2] 王怀立,郭庆敏,禚志红,等.癫痫患儿血清高迁移率族蛋白1及白细胞介素-6水平变化的意义[J].中华实用儿科临床杂志,2015,30(22):1738-1740.
[3] 李桂花,张震中,梁文宝,等.原发性癫痫患者睡眠呼吸事件分析[J].实用医学杂志,2012,28(10):1658-1659.
[4] Cervigni RI,Bonavita R,Barretta ML,et al. JNK2 controls fragmentation of the Golgi complex and the G2/M transition through phosphorylation of GRASP65[J]. J Cell Sci,2015,128(12):2249-2260.
[5] Hauptman JS,Salamon N,Mathern GW. Neuroimaging in the definition and organization of the epilepsies:we're not there yet[J]. Epilepsia,2012,53(Suppl 2):S22-27.
[6] 李克伟,娄丹.110例癫痫患儿动态脑电图及常规脑电图监测分析[J].河南科技大学学报:医学版,2014,32(3):214-215.
[7] 杜春艳,卢强,李玉品,等.大叶性肺炎患儿血清肿瘤坏死因子-a、白细胞介素-6、白细胞介素-8、白细胞介素-10和高迁移率族蛋白B1表达意义[J].中华实用儿科临床杂志,2014,29(16):1224-1226.
[8] Marais C,Wattelet-Boyer V,Bouyssou G,et al. The Qb-SNARE Memb 11 interacts specifically with Arf1 in the Golgi apparatus of Arabidopsis thaliana[J]. J Exp Bot,2015,66(21):6665-6678.
[9] 张奇.癫痫持续状态患儿的临床特点与影响近期疗效的相关因素分析[J].国际医药卫生导报,2016,22(2):184-186.
[10] 杨盈.动态脑电图与剥夺睡眠脑电图在小儿癫痫的诊断比较[J].海南医学院学报,2016,22(1):99-101,104.
[11] 范真,黄斌,孙红斌.高迁移率族蛋白1抑制剂甘草酸对大鼠癫痫持续状态后血脑屏障的影响[J].国际神经病学神经外科学杂志,2015,42(4):311-315.
[12] 陈凌,胡万华,陈克龙,等.抗痫汤对戊四氮致癫大鼠血清白细胞介素2、6水平的影响[J].中国基层医药,2015,22(4):566-568.
[13] Rudolph S,Hull C,Regehr WG. Active Dendrites and Differential Distribution of Calcium Channels Enable Functional Compartmentalization of Golgi Cells[J]. J Neurosci,2015,35(47):15492-15504.
[14] 杜省古,宋洪波,高晓玲,等.高密市原发性惊厥型癫痫遗传流行病学调查[J].精神医学杂志,2015,28(3):214-216.
[15] 陈倩,程大志,郑彤,等. 新诊断良性癫痫伴中央颞区棘波儿童的认知特征[J].中华儿科杂志,2015,53(10):754-759.
[16] 李兰.癫痫患者脑脊液和血清中miRNAs含量检测及其对相关细胞因子的调控作用[J].海南医学院学报,2016,22(6):611-613,616.
[17] 张尚波,石学慧,王净净,等.愈痫灵方对PTZ致痫大鼠脑组织海马CA3区TLR4、NF-kB P65、TNF-α表达的影响[J].湖南中医药大学学报,2016,36(1):33-36,40.
[18] De los Reyes M,Palomino J,Jofré S,et al. Golgi Apparatus and Endoplasmic Reticulum Dynamic during Meiotic Development in Canine Oocytes[J]. Reprod Domest Anim,2012,47(Suppl 6):93-97.
[19] 李凤强. 原发性癫痫患者焦虑抑郁情绪现状和影响因素分析[J].中国临床研究,2013,26(2):123-127.
[20] 李欣,曹祥,汪麟,等.老年癫痫患者脑电图检查与血清细胞因子水平的相关性[J].中国老年学杂志,2015,35(11):3055-3056.
[21] 姚丹,邓星强.探究24 h动态脑电图在小儿癫痫诊断中的临床应用[J].中国妇幼健康研究,2015,26(5):966-967,978.
(本文编辑:许卓文)
Correlation analysis of EEG and serum levels of inflammatory factors in children with idiopathic epilepsy
HAN Jie1, PING Li-li2, HU Li-min3, HOU Xiao-ying1
(1.Department of Function, Handan Central Hospital, Hebei Province, Handan 056001, China; 2.Department of Neonatology, Handan Central Hospital, Hebei Province, Handan 056001, China; 3.Department of Pediatrics, Handan Central Hospital, Hebei Province, Handan 056001, China)
Objective To analyze the relevance of EEG in children with idiopathic epilepsy to serum levels of inflammatory factors. Methods Seventy-five cases diagnosed with idiopathic epilepsy included in the study were divided into 3 groups according to the frequency of epileptic seizures: epilepticus status group, non-epileptic frequent or persistent state group, and persistent state group, which included 25 cases in each group. Thirty healthy children were enrolled as control cases. Serum level of inflammatory factors (HMGB1, IL-6, IL-2, TNF-α) and EEG findings were analyzed in both epilepsy and control groups. Results Serum level of HMGB1, IL-2, IL-6, TNF-α in in cases with epilepsy were significantly higher than that in control group (P<0.05), serum level of HMGB1, IL-2, IL-6, TNF-α in cases with epilepticus status and frequent epilepsy were both higher than that in non-frequent seizures or persistent state group (P<0.05); Serum level of HMGB1, IL-2, IL-6, TNF-α in cases with EEG epileptic discharge and slow waves were significantly higher than those with normal EEG and boundary resistance (P<0.05). Serum level of HMGB1, IL-2, IL-6, TNF-α levels in cases with EEG epileptic discharge were significantly higher than those with EEG slow waves (P<0.05). Conclusion HMGB1, IL-2, IL-6, TNF-α are important inflammatory factors relevance to idiopathic epilepsy. Abnormalities findings in EEG were positively correlated with serum levels of HMGB1, IL-2, IL-6, TNF-α.
epilepsy; inflammatory cytokines; electroencephalography; child
2016-06-06;
2016-09-19
韩洁(1975-),女,河北平山人,河北省邯郸市中心医院副主任医师,医学学士,从事脑电图监测及小儿发作性疾病研究。
R742.1
A
1007-3205(2017)01-0051-05
10.3969/j.issn.1007-3205.2017.01.012

