β-淀粉样肽对大鼠原代海马神经细胞中SIRTs表达的影响*
董阳婷, 谭龙春, 官志忠,**
(1.贵州医科大学附院 病理科, 贵州 贵阳 550004; 2.贵州医科大学 地方病与少数民族性疾病教育部重点实验室, 贵州 贵阳 550004)
β-淀粉样肽对大鼠原代海马神经细胞中SIRTs表达的影响*
董阳婷1, 谭龙春2, 官志忠1,2**
(1.贵州医科大学附院 病理科, 贵州 贵阳 550004; 2.贵州医科大学 地方病与少数民族性疾病教育部重点实验室, 贵州 贵阳 550004)
目的: 探讨β-淀粉样蛋白(Aβ)对原代培养海马神经细胞中沉默信息调节因子( SIRTs)表达的影响。方法: 分离出生24 h内SD乳鼠大脑海马区域,培养原代神经细胞,CCK-8试验观察0、0.1、0.2、0.5、1.0、1.5及2.0 μmol/L Aβ寡聚体(AβOs)对细胞增殖的影响,选取恰当浓度的AβOs进行后续实验;将实验分为对照组(Control)和Aβ组,Aβ组给AβOs 处理24 h后,运用Western blotting方法及Realtime PCR方法检测SIRT1、SIRT3、SIRT4及SIRT5的蛋白及mRNA表达水平。结果: CCK-8结果显示,0.5 μmol/L AβOs作用于大鼠原代海马神经细胞24 h时细胞存活率明显低于对照组(P<0.05),且不影响细胞的存活率;0.5 μmol/L AβOs处理大鼠原代海马神经细胞24 h后,与Control相比,SIRT1、SIRT3、SIRT4及SIRT5蛋白及mRNA表达水平均不同程度降低(P<0.05或0.01)。结论: AβOs可使海马神经细胞中SIRTs 蛋白及mRNA表达水平降低,这可能与AD病人发病后学习记忆能力减退有关。
阿尔茨海默病; β-淀粉样肽1-42; 海马神经元; 沉默信息调节因子
阿尔茨海默病(alzheimer’s disease, AD),又称原发性老年痴呆症,是一种主要在老年期发生的神经元退行性变性疾病,以进行性痴呆为主要特征,包括记忆力衰退、认知功能障碍、失语、性格和行为改变等,该病首先由德国的精神病医生Alois Alzheimer[1-2]于1907年发现,并以他的名字命名。AD的主要病理改变是相关脑区出现以β-淀粉样肽(β-amyloid peptide,Aβ)沉积形成的老年斑(senile plaques,SPs)、高度磷酸化Tau蛋白聚集形成的神经元纤维缠结(neurofibrillary tangles,NITs)及神经元丢失[3],研究还发现AD的发病机制与β-淀粉样肽沉积、脂质代谢、线粒体老化、氧化应激、凋亡及突触功能有着密切关系[4-6]。沉默信息调节因子(silent information regulators, SIRTs)是具有去乙酰化作用的蛋白,其激活依赖于烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+),研究表明哺乳动物SIRTs可与p53、FOXO、PGC-1α、NF-κB、Ku70等蛋白相互作用调控细胞应激反应、代谢衰老和凋亡等过程,尤其是在神经退行性疾病中扮演了重要角色。本研究用AβOs处理原代海马神经元细胞,建立类AD细胞模型,观察AβOs对神经元中SIRTs的作用,探讨AD发病中学习记忆能力减退的相关机制。
1 材料与方法
1.1 实验动物及主要试剂
实验动物为24 h内新生SD (Sprague Dawley)乳鼠14只,体重5~10 g(由贵州医科大学动物实验中心提供),本研究获得贵州医科大学伦理委员会批准(编号1311018)。主要试剂有多聚赖氨酸、Aβ1-42、六氟异丙醇购自Sigma公司(美国),Neurobasal-A 培养基、Hibernate-A培养基、B-27添加剂、GlutaMAX添加剂购自Gibco公司(美国),青霉素及链霉素购自Hyclone公司(美国),BCA蛋白定量试剂盒购自Thermo公司(美国), CCK-8试剂盒购自Dojindo公司(日本),鼠抗SIRT1抗体购自Abcam公司(英国),兔抗SIRT3抗体购自Santa Cruz公司(美国),兔抗SIRT4抗体购自Gene Tex公司(美国),鼠抗SIRT5抗体购自Santa Cruz公司(美国);兔抗β-actin(Abmart,上海),辣根过氧化物酶(HRP)标记的抗兔、抗鼠二抗均购自Cell Signaling公司(美国),Trizol 试剂(美国Invitrogen公司);逆转录试剂盒(美国 Fermentas Life Sciences公司),SYBR Green染料试剂盒(美国 Roche Diagnostics公司)。
1.2 方法
1.2.1 体外制备AβOs 参照文献[7-10]在体外制备AβOs的方法,将Aβ1-42粉末中加入充分预冷的HFIP,使其终浓度为1 mmol/L。瓶口保持封闭,室温孵育60 min后,冰上静置10 min,分装成5管,开盖通风过夜,使HFIP完全挥发后,-80 ℃冰箱保存。使用时于冰上加入DMSO充分溶解,终浓度为5 mmol/L,再用不含酚红的F12培养基稀释,4℃孵育24 h后,14 000 g,4 ℃离心10 min,备用。
1.2.2 大鼠原代海马神经细胞的培养 大鼠原代海马神经细胞培养参考文献[7]并适当改进。取新生SD乳鼠,75%酒精浸泡5 min,无菌条件下取出大脑,放入预冷的D-Hank’s平衡盐液中,迅速去除脑膜及血管。海马以0.25% 胰蛋白酶37 ℃消化15 min,中间振摇3次,用含10%胎牛血清的DMEM-F12种植培养基终止消化,吸出种植培养基,加入含2% B27的Neurobasal培养基,轻轻吹打20次,静置2 min,轻轻吸取上层细胞悬液,用含2% B27的Neurobasal培养基稀释成单细胞悬液,以1×109个/L密度接种在经左旋赖氨酸(PLL)铺被过的6孔板内,于37 ℃,相对体积分数为0.05的CO2培养箱中进行培养,每隔3 d以Neurobasal-A/B27培养基半量换液。
1.2.3 细胞毒性实验 采用CCK-8法,原代海马神经细胞以1×108个/L浓度接种于96孔板中,分别以0、0.1、0.2、0.5、1.0、1.5及2.0 μmol/L的AβOs处理细胞,每个浓度设5个复孔,每孔加100 μL细胞悬液,培养至24 h后,将每孔原始培养基取出,置换为不含B27及药物的纯培养基100 μL,空白对照组加入100 μL无细胞纯培养基,于每孔中加入10μL CCK-8试剂,37 ℃孵育2 h,450 nm波长测定吸光度。
1.2.4 AβOs处理细胞 大鼠原代海马神经细胞培养至第7~10 天,形态完整时,用不含B27的纯培养基培养2 h,加入0.5 μmol/L AβOs处理24 h后收集细胞,强效裂解液提取细胞总蛋白,BCA法进行蛋白定量。
1.2.5 SIRT1、SIRT3~5蛋白表达水平 用5×蛋白上样缓冲液及去离子水按照样品浓度稀释样品,95 ℃加热变性5 min,然后进行电泳。转膜、封闭后,分别用SIRT1及SIRT 3~5抗体(浓度分别为1∶1 000、1∶500、1∶1 000及1∶300)与转蛋白膜4 ℃孵育过夜,再与辣根过氧化物酶联结的抗兔或抗鼠IgG(浓度为1∶5 000)室温孵育1 h。将膜与ECL-plus试剂反应,显影胶片曝光,冲洗胶片后用图像分析仪处理。
1.2.6 SIRT、SIRT 3~5 mRNA表达水平 采用标准Trizol-酚-氯仿一步法提取总RNA,设计SIRT1及SIRT 3~5和β-actin引物,引物序列见表1。将mRNA逆转录反应生成cDNA,以逆转录产物为模板进行Real-time PCR。SDS 1.4软件分析其ΔCt、2-ΔCt值及RQ(relative quantity)值,RQ=2-ΔΔCt。分析实验结果以β-actin为内对照,计算各种基因的相对表达水平。

表1 SIRTs及β-actin基因引物序列Tab.1 Primer sequences of SIRTs gene and β-actin
1.3 统计学处理
2 结果
2.1 AβOs细胞毒性试验
CCK-8试验结果显示,0.5 μmol/L AβOs作用于大鼠原代海马神经细胞24 h时细胞存活率明显低于对照组,差异有统计学意义(P<0.05),且不影响细胞的存活率,故选择0.5 μmol/L Aβ1-42处理细胞进行以下研究。见图1。
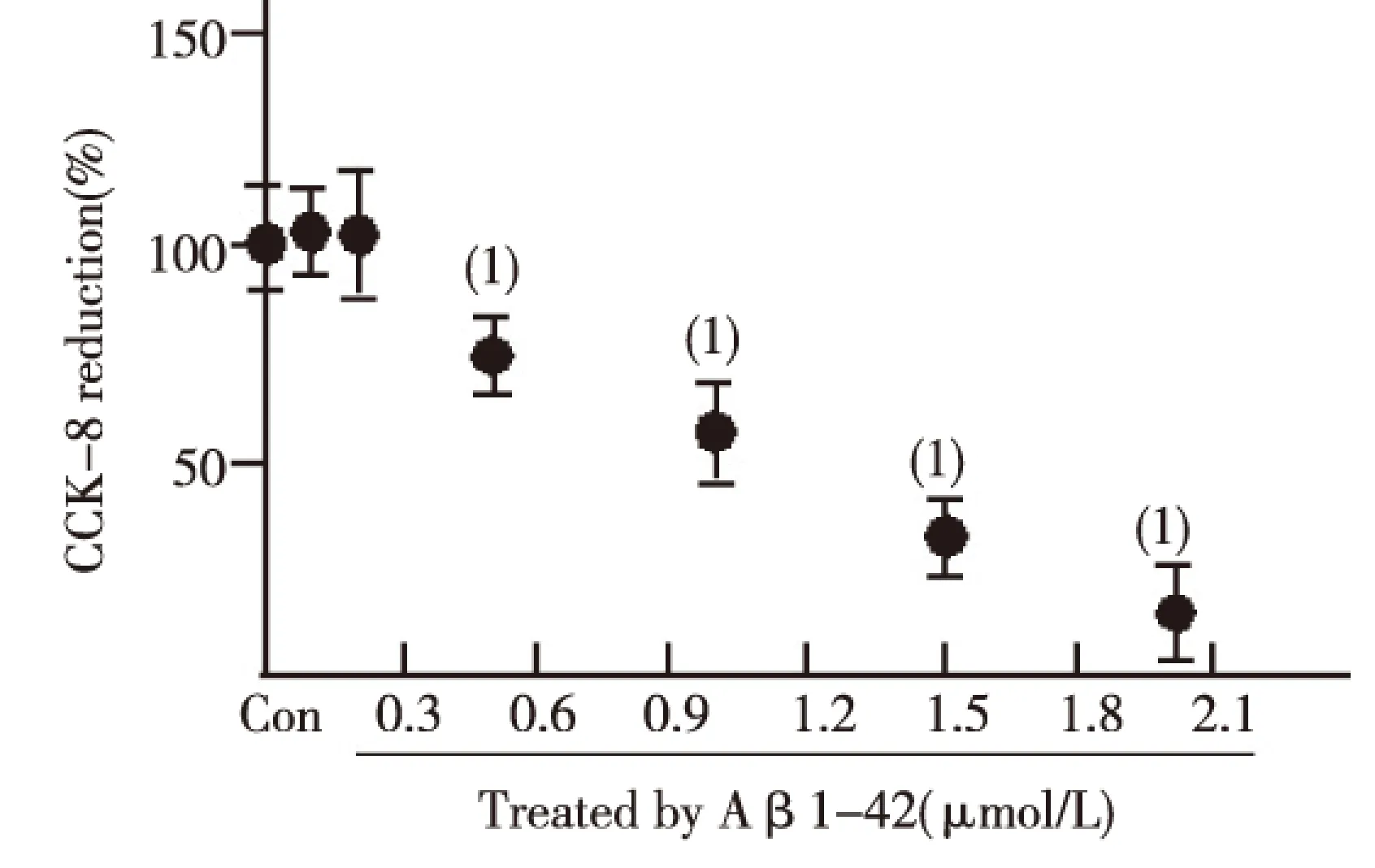
(1)与Control组比较,P<0.01图1 不同浓度AβOs对大鼠原代海马神经 细胞存活率的影响Fig.1 The effect of different concentrations of AβOs on survival rate of primary rat hippocampal neurons
2.2 SIRT1及SIRT 3~5蛋白表达水平
与Control组相比,0.5 μmol/L AβOs处理大鼠原代海马神经细胞24 h后,SIRT1及SIRT3-5蛋白相对表达水平明显升高,差异有统计学意义(P<0.01),见图2。
2.3 SIRT1及SIRT 3~5 mRNA表达水平
与Control组相比,0.5 μmol/L AβOs处理大鼠原代海马神经细胞24 h后,SIRT1及SIRT3~5mRNA相对表达水平明显升高(P<0.05或P<0.01),见图3。
3 讨论
SIRTs是一组激活依赖于NAD+的具有去乙酰化作用的蛋白;研究表明,哺乳动物SIRTs可与p53、FOXO、PGC-1α、NF-κB、Ku70等蛋白相互作用调控着细胞应激反应、代谢衰老和凋亡等过程,尤其是在神经退行性疾病,如AD中扮演了重要角色。目前人类SIRTs家族中公认的成员有7个,分别是SIRT1~SIRT7。目前研究最多的是SIRT1,其参与众多神经损伤及神经退行性疾病的神经保护作用[12-13],尤其是在AD中具有复杂、多方面的神经保护作用[14-16],其与记忆的形成和维持与突触可塑性、DNA甲基化、组蛋白尾的翻译后修饰、非编码RNA等机制有关,以小鼠作为模型,特异性敲除脑内SIRT1的小鼠出现认知及记忆障碍,表明SIRT1在维持神经可塑性方面发挥重要作用;突触核蛋白(synuclein)是一种突触前膜蛋白,其α亚型已被证实与帕金森病等多种神经退行性疾病有关,而且使用白藜芦醇处理后可以对抗α-Synuclein的毒性[17-18]。研究发现,Tg2576小鼠大脑的初级神
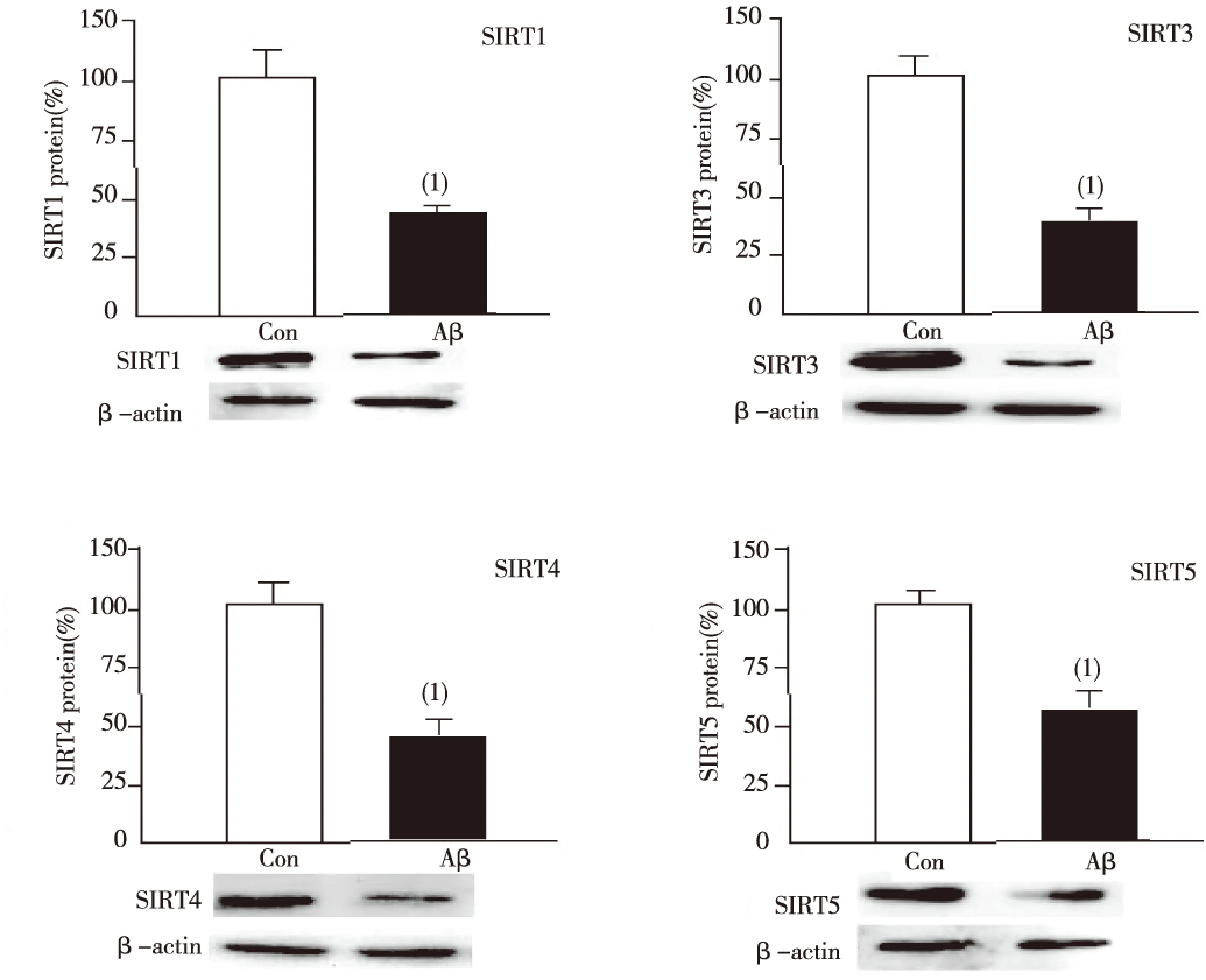
注:(1)与Control组比较, P<0.01图2 大鼠原代海马神经细胞中SIRT1、SIRT3、SIRT4及SIRT5蛋白表达水平Fig.2 The protein expression of SIRT1, SIRT3, SIRT4 and SIRT5 in primary rat hippocampal neurons after treated with AβOs
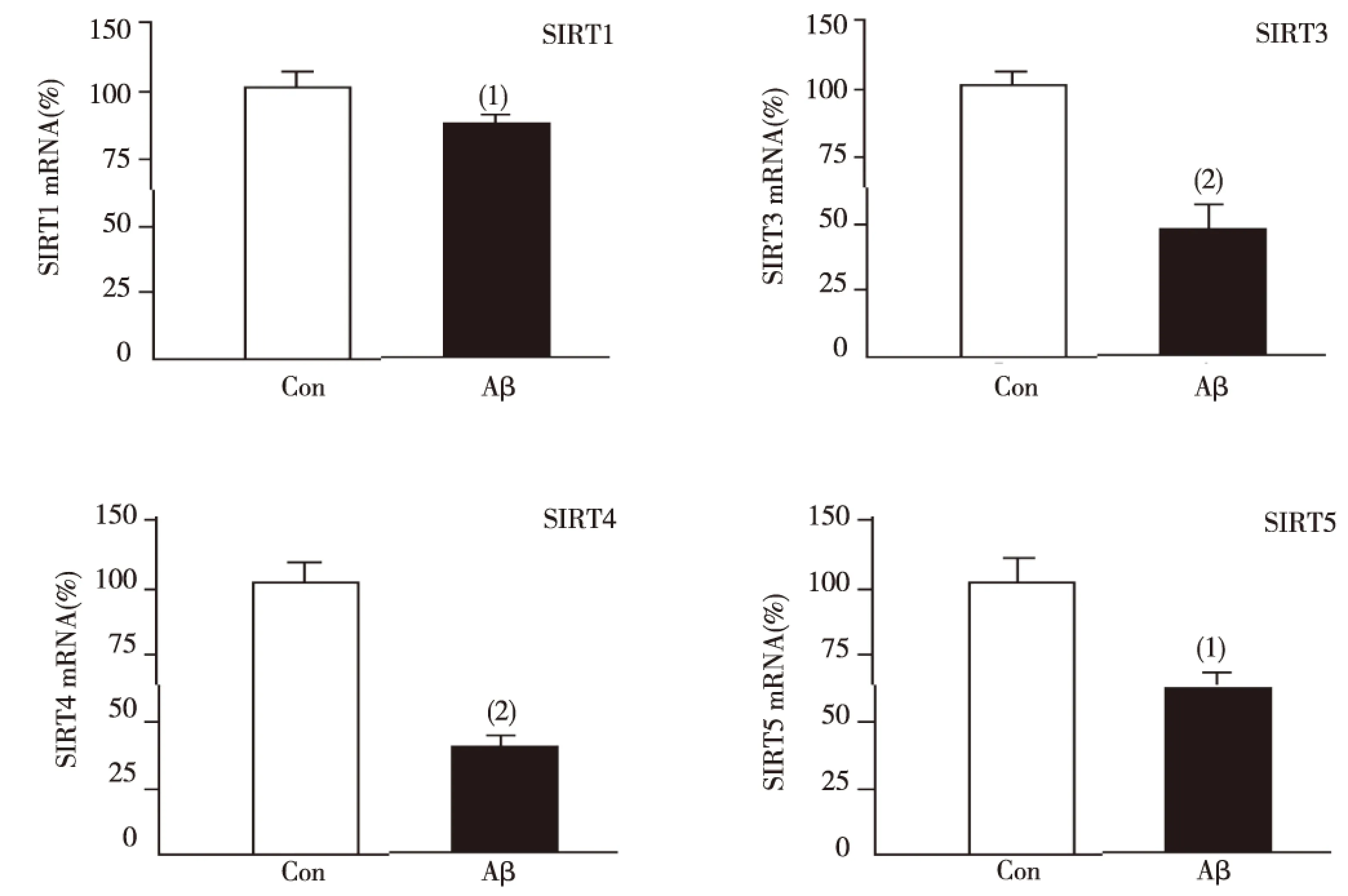
注:与Control组比较,(1)P<0.05,(2)P<0.01图3 大鼠原代海马神经细胞中SIRT1、SIRT3、SIRT4及SIRT5 mRNA表达水平Fig.3 The mRNA expression of SIRT1, SIRT3, SIRT4 and SIRT5 in primary rat hippocampal neurons after treated with AβOs
经元中过表达SIRT1基因,可减少Aβ的分泌,引起sAPPα水平升高,减少Rho激酶1(rho-activated kinase 1,ROCK1)的表达[16],而通过抑制他汀类药物刺激sAPPα生成激活ROCK1,可以减少SIRT1介导的一些反应[19]。
另外,AD认知功能下降与年龄相关的神经元结构及功能改变有关,如突触功能障碍[20],而突触活动又强烈依赖于线粒体提供足够ATP的功能[21]。SIRT 3~5存在于线粒体基质中,可调节其多种代谢酶的乙酰化作用,在赖氨酸乙酰化的蛋白质组学研究中发现,超过20%的线粒体蛋白被乙酰化,这项研究证明SIRTs(主要是SIRT1及SIRT3) 去乙酰化作用在维持线粒体功能中起到重要的调节作用[22]。最近一项研究得出结论,AD患者大脑SIRT3表达降低,SIRT3在很大程度上通过抗氧化系统的靶向调节减少ROS的产生[23-24];下调SIRT3可能破坏线粒体的能量代谢及合成,最终促进AD的病理变化[25]。另外两个存在于线粒体内的成员,包括SIRT4及SIRT5,其在AD发病机制中的作用并不十分清楚。
本研究发现,SIRT1及SIRT 3~5蛋白及mRNA的表达在加入AβOs的原代海马神经元中均出现不同程度的降低。已有研究表明,SIRT3表达的程度与SIRT1的表达是平行的,SIRT1表达的降低可以直接影响SIRT3的表达[26];当SIRT1表达减少同时引起SIRT3表达减少,进一步抑制电子传递链(electron transfer chain, ETC)蛋白的线粒体复合物I活化,从而减少NAD+的生成,ROS产生增加,并抑制ATP生成,导致神经元死亡;另外,SIRT4表达减少可引起谷氨酸产生增多,导致神经元损伤[27-28];而没有足够的SIRT5发挥去乙酰化作用,引起细胞色素C在线粒体中的蓄积,进而导致线粒体膜间隙调节氧化代谢功能紊乱及细胞凋亡的发生[29],最终促进AD的病理变化。
综上所述,SIRTs家族对神经系统具有一定保护作用,其可以通过不同途径影响神经退行性疾病的进展,现阶段除了SIRT1及SIRT2研究较多以外,SIRT3-SIRT7在该类疾病中的作用尚不十分明确,弄清楚SIRTs家族在AD发病机制中所扮演的角色,对AD的防治起着关键性作用。
[1] Pudielli L, Tarzi RE, Kovacs DM. A1zheimer’s disease: the cholesterol connection. Nat Neurosci, 2003(4):345-351.
[2] 官志忠. 阿尔茨海默病的病因和发病机制研究进展[J]. 贵阳医学院学报, 1998(3):303-306.
[3] 官志忠,齐晓岚.阿尔茨海默病的分子发病机制及其治疗研究进展[J].中华病理学杂志, 2008(1):11-15.
[4] Kurz A, Perneczky R. Novel insights for the treatment of Alzheimer’s disease[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2011(2):373-379.
[5] Kumar A, Dogra S. Neuropathology and therapeutic management of Alzheimer’s disease-an update[J]. Drugs of the Future, 2008(5):433-446.
[6] 曹颖,廖媛,肖雁,等. Β-淀粉样肽对人SH-SY5Y细胞突触素、发动蛋白I及衔接蛋白180表达的影响[J]. 中华神经医学杂志, 2011(8):774-778.
[7] Klein WL. Aβ toxicity in Alzheimer’s disease: globular oligomers (ADDLs) as new vaccine an drog targets[J]. Neurochemistry International, 2002(41): 345-352.
[8] 官志忠,齐晓岚,欧阳凯,等.阿尔茨海默病发病中β-淀粉样蛋白与胆碱能尼古丁受体的相互作用[C].第十三届全国诊断病理暨头颈部及内分泌系统疾病学术研讨会论文集, 2012:92-97.
[9] 杨帆,李东风,徐书雯.Aβ1-42寡聚体与纤维体的制备及鉴定[J].中华老年学杂志, 2013(33):2076-2078.
[10]谭现伟.Aβ1-42寡聚体制备方法的研究[D].北京:北京交通大学, 2009:1-37.
[11]Nunez J. Primary Culture of Hippocampal Neurons from P0 Newborn Rats.[J]. Journal of Visualized Experiments, 2008(19):e895.
[12]Donmez G,Outeiro TF. SIRT1 and SIRT2: emerging targets in neurodegeneration[J]. EMBO Mol Med, 2013(3): 344-352.
[13]Herskovits AZ,Guarente L. SIRT1 in neurodevelopment and brain senescence[J]. Neuron, 2014(3): 471-483.
[14]Ballard C, Gauthier S, Corbett A, et al. Alzheimer’ s disease[J]. Lancet, 2012 (9): 1019-1031.
[15]Bonda DJ, Lee HG, Camins A, et al. The sirtuin pathway in ageing and Alzheimer disease: mechanistic and therapeutic considerations[J]. Lancet Neurol, 2011(3): 275-279.
[16]Ng F, Wijaya L,Tang BL. SIRT1 in the brain-connections with aging-associated disorders and lifespan[J]. Front Cell Neurosci, 2015(9): 64.
[17]Gao J, Wang WY, Mao YW, et al. A novel pathway regulates memory and plasticity via SIRT1 and miR-134[J]. Nature, 2010 (7310): 1105-1109.
[18]Albani D, Polito L, Batelli S, et al. The SIRT1 activator resveratrol protects SK-N-BE cells from oxidative stress and against toxicity caused by α-synuclein or amyloid-β (1-42) peptide[J]. J Neurochem, 2009 (5): 1445-1456.
[19]Qin W, Yang T, Ho L, et al.Neuronal SIRT1 activation as a novel mechanism underlying the prevention of Alzheimer disease amyloid neuropathology by calorie restriction[J]. J Biol Chem, 2006 (31): 21745-21754.
[20]Geinisman Y, de Toledo-Morrell L,Morrell F. Loss of perforated synapses in the dentate gyrus: morphological substrate of memory deficit in aged rats[J]. Proc Natl Acad Sci USA, 1986 (9): 3027-3031.
[21]Weir HJM, Murray TK, Kehoe PG, et al. CNS SIRT3 expression is altered by reactive oxygen species and in Alzheimer’ s disease[J]. Plos One, 2012 (11): e48225.
[22]梁晓瑜,邹伟. S irtuins与神经退行性疾病的研究进展[J]. 蛇志, 2013(4):425-427.
[23]Lutz MI, Milenkovic I, Regelsberger G, et al. Distinct patterns of sirtuin expression during progression of Alzheimer's disease[J]. Neuromolecular Med, 2014(2): 405-414.
[24]Brenmoehl J,Hoeflich A. Dual control of mitochondrial biogenesis by sirtuin 1 and sirtuin 3[J]. Mitochondrion, 2013(6): 755-761.
[25]Ahn BH, Kim HS, Song S, et al. A role for the mitochondrial deacetylase Sirt3 in regulating energy homeostasis[J]. Proc Natl Acad Sci USA, 2008 (38): 14447-14452.
[26]Lutz MI, Milenkovic I, Regelsberger G, et al. Distinct patterns of sirtuin expression during progression of Alzheimer's disease[J]. Neuromolecular Med, 2014(2): 405-414.
[27]Choi DW. Bench to bedside: the glutamate connection[J]. Science, 1992(5080):241-243.
[28]Csibi A, Fendt SM, Li C, et al. The mTORC1 pathway stimulates glutamine metabolism and cell proliferation by repressing SIRT4[J]. Cell, 2013 (4): 840-854.
[29]Schlicker C, Gertz M, Papatheodorou P,et al. Substrates and regulation mechanisms for the human mitochondrial sirtuins sirt3 and sirt5[J]. J Mol Biol, 2008 (3): 790-801.
(2016-10-15收稿,2016-12-03修回)
中文编辑: 刘 平; 英文编辑: 周 凌
Effect of β-amyloid Peptide on SIRTs Expression in Rat Primary Hippocampal Neurons
DONG Yangting1, TAN Longchun2, GUAN Zhizhong1,2
(1.DepartmentofPathology,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China;2.TheKeyLaboratoryofEndemicandEthnicDiseasesinMinistryofEducationofP.R.China,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
Objective: To investigate the effect of β-amyloid peptide (Aβ) on expressions of silent information regulators (SIRTs) in rat primary hippocampal neurons. Methods: Rat primary neurons were prepared and cultured from the brain hippocampus of newborn (within 24 h) SD rats. Cell Counting Kit-8 (CCK-8) was employed to detect the effect of 0, 0.1, 0.2, 0.5, 1.0, 1.5 and 2.0 μmol/L Aβ oligomers (AβOs) on proliferation of neurons.The appropriate concentration of AβOs was selected for subsequent experiments. Rat primary hippocampal neurons were divided into control group and Aβ group which was treated with Aβ for 24 h. The protein and mRNA expressions of SIRT1, SIRT3, SIRT4 and SIRT5 were detected by Western blotting and real-time PCR. Results: According to CCK-8 results, 0.5 μmol/L AβOs was selected for subsequent experiments. The protein and mRNA expression of SIRT1, SIRT3, SIRT4 and SIRT5 were significantly attenuated when the cells treated with 0.5 μmol/L AβOs for 24 h. Conclusions: AβOs can reduce the levels of protein and mRNA of SIRTs in rat primary hippocampal neurons, which might be a mechanism of cognitive deficit of AD.
Alzheimer's disease; β-amyloid peptide1-42; hippocampal neurons; silent information regulators
国家自然科学基金(81260173); 教育部“长江学者和创新团队发展计划资助”(IRT13058); 贵州省科技计划[黔科合重大专项字(2014)6008号]; 贵州省创新计划项目[黔教合协同创新中心(2014)06]
时间:2016-12-15
http://www.cnki.net/kcms/detail/52.1164.R.20161215.1534.027.html
R749.1; R34-33
A
1000-2707(2016)12-1376-06
10.19367/j.cnki.1000-2707.2016.12.003
**通信作者 E-mail:1457658298@qq.com

