补肾强身胶囊微生物限度方法的研究及相关市场质量考查
阎雅宁
(天津市药品检验所,天津 300070)
补肾强身胶囊微生物限度方法的研究及相关市场质量考查
阎雅宁
(天津市药品检验所,天津 300070)
目的:建立补肾强身胶囊微生物限度检查方法,进行方法适用性试验,并对抽取的143批样品进行微生物限度检查。方法:细菌计数采用培养基稀释法,霉菌和酵母菌采用平皿法;大肠埃希菌和大肠菌群采用常规法。结果:稀释法可有效去除补肾强身胶囊的抑菌作用,使各试验菌的加菌回收率均符合《中国药典》要求。结论:补肾强身胶囊可按照此方法进行微生物限度检查。抽验143批次结果均符合规定。
国家评价性抽验,补肾强身胶囊,方法学验证试验
2015年国家对143批补肾强身胶囊进行了评价性抽验。补肾强身胶囊为中药成方制剂,处方中含有金樱子、菟丝子、淫羊藿、狗脊(制)、女贞子(制)等中药成分,为口服胶囊制剂,每粒装0.3 g,内容物为棕色或棕褐色的粉末,味微酸[1]。该品种临床上主要用于治疗头晕耳鸣、腰膝酸软、眼花心悸、阳痿遗精等症状。按照《中国药典》2010年版一部附录ⅩⅢC微生物限度检查法的要求,建立补肾强身胶囊的微生物限度检查方法并对其加以验证[2],用选定方法对抽取的143批样品进行微生物限度检查,方法可行,并对此次评价抽验情况及结果进行汇总和质量分析。
1 试验材料
1.1 培养基 玫瑰红钠琼脂培养基(批号1404082)、营养琼脂培养基(批号140313)、胆盐乳糖培养基(BL)(批号1404112)购自北京三药科技开发公司;营养肉汤培养基(批号140819)、4-甲基伞形酮葡萄糖苷酸培养基(MUG)、胆盐乳糖发酵培养基(批号20131114)、改良马丁培养基(批号051021)购自北京陆桥技术有限责任公司;pH 7.0无菌氯化钠-蛋白胨缓冲液、0.9%无菌氯化钠溶液自配。
1.2 菌种 金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B) 26003]、枯草芽孢杆(Bacillus subtilis)[CMCC(B) 63501]、大肠埃希菌(Escherichia coli)[CMCC(B) 44102]、白色念珠菌(Clostridium sporogenes)[CMCC(F) 98001]、黑曲霉菌(Aspergillus niger)[CMCC(F) 98003]均购自中国食品药品检定研究院,由本所传代保存。
1.3 样品 此次国家评价性抽验共抽取24个生产厂家的143批补肾强身胶囊,对广东罗浮山国药股份有限公司(批号L15E022)、太极集团四川绵阳制药有限公司(批号1501001)和陕西盘龙药业集团股份有限公司(批号20150102)三个厂家的样品进行了微生物限度检查方法学的验证,并对143批药品进行了微生物限度的检查。
2 方法与结果
2.1 试验菌液的制备
2.1.1 金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌 取金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌三种细菌的新鲜培养物少许,接种至营养肉汤培养基中,35 ℃培养18 h。取经35 ℃培养18 h的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌肉汤培养物1 ml,加9 ml的0.9%无菌氯化钠溶液,以10倍稀释至约10-5~10-7,混匀备用。
2.1.2 白色念珠菌 取白色念珠菌新鲜培养物接种至改良马丁培养基中,25 ℃培养48 h。取该培养物1 ml,加9 ml的0.9%无菌氯化钠溶液,以10倍稀释至约10-5~10-7,混匀备用。
2.1.3 黑曲霉 将黑曲霉新鲜培养物接种至改良马丁琼脂斜面培养基上,25 ℃培养7 d,使大量孢子成熟。取该培养物加0.9%无菌氯化钠溶液4 ml洗下孢子,吸出转移至空无菌试管作为原菌液,以10倍稀释至约10-4~10-5,混匀备用。各试验菌菌液浓度每1 ml含10~100 cfu。
2.2 供试品溶液的制备 选取广东罗浮山国药股份有限公司的样品,称取样品10 g,加pH 7.0无菌氯化钠-蛋白胨缓冲液稀释至100 ml,作为1∶10供试液。
2.3 菌落计数方法验证的预试验
2.3.1 常规平皿法 取1∶10的供试液1 ml和规定量的金黄色葡萄球菌、枯草芽孢杆菌和大肠埃希菌(约10~100 cfu)至平皿,立即倾注营养琼脂培养基。同法分别取1∶10供试液1 ml和规定量的白色念珠菌及黑曲霉至平皿,立即倾注玫瑰红钠培养基。含每种菌的供试液各制备两个平行平皿。
2.3.2 培养基稀释法 取1∶10供试液1 ml等量分注2皿,每皿0.5 ml,分别加入规定量试验菌(约50~100 cfu),立即倾注相应的培养基。取1∶10供试液1 ml等量分注5皿,每皿0.2 ml,分别加入规定量试验菌(约50~100 cfu),立即倾注相应的培养基。取1∶10供试液1 ml等量分注10皿,每皿0.1 ml,分别加入规定量试验菌(约50~100 cfu),立即倾注相应的培养基。
2.4 预试验结果 平皿法和稀释法回收率结果见表1。根据试验结果,采用常规法和培养基稀释法(0.5 ml/皿和0.2 ml/皿),枯草芽孢杆菌的回收率都小于70%, 说明该品种对细菌有一定的抑菌作用,采用培养基稀释法(0.1 ml/皿)能充分去除本品中的抑菌成分, 而对真菌没有抑制,可以用于补肾强身胶囊的细菌检查,平皿法可用于霉菌及酵母菌数的检查。
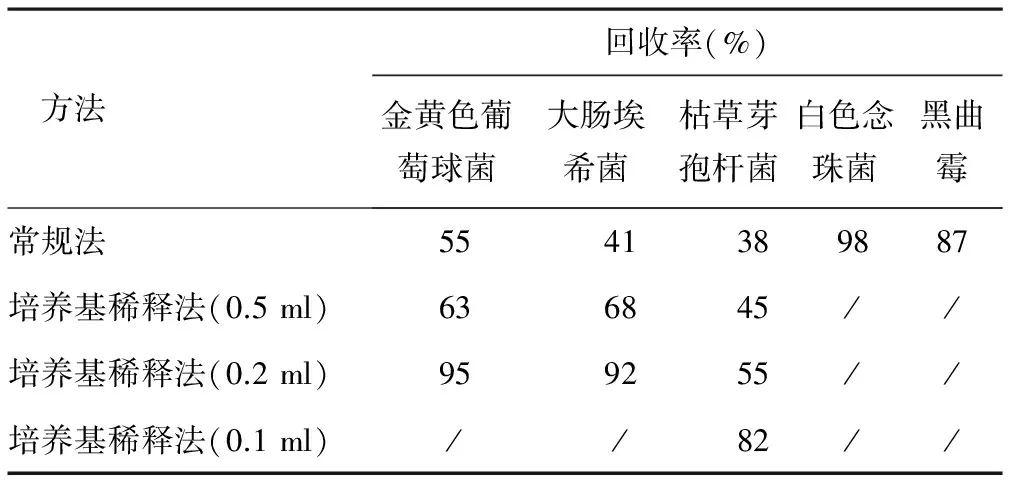
表1 平皿法和稀释法回收率结果
2.5 细菌数、霉菌和酵母菌数测定方法的验证 选取三个厂家:广东罗浮山国药股份有限公司、太极集团四川绵阳制药有限公司和陕西盘龙药业集团股份有限公司的样品,细菌按培养基稀释法(0.1 ml/皿)、霉菌及酵母菌按平皿法进行验证试验, 结果见表2。通过对三个厂家的验证试验结果表明,补肾强身胶囊的方法学验证试验结果为细菌计数采用培养基稀释法(0.1 ml/皿),霉菌和酵母菌计数采用平皿法,方法可行。

表2 试验组各菌株回收率测定结果
2.6 控制菌检查方法的验证
2.6.1 大肠埃希菌检查方法的验证
2.6.1.1 试验组 取1∶10的供试液10 ml和规定量大肠埃希菌(约10~100 cfu)加入到100 ml胆盐乳糖培养基中,35 ℃培养24 h。
2.6.1.2 阳性对照组 取规定量的大肠埃希菌(约10~100 cfu),加入到100 ml胆盐乳糖培养基中,35 ℃培养24 h。
2.6.1.3 大肠埃希菌试验 试验组和阳性对照组的培养基均浑浊,取上述培养物各0.2 ml,分别接种至含5 ml MUG培养基的试管内,培养,于5 h和24 h在366 nm紫外光下观察,然后再进行靛基质试验。结果见表3。
表3 大肠埃希菌试验结果
2.6.2 大肠菌群检查方法验证
2.6.2.1 试验组 取1∶10的供试液1 ml和规定量大肠埃希菌(约10~100 cfu)加入到10 ml的胆盐乳糖发酵培养基中,35 ℃培养24 h。
2.6.2.2 阳性对照菌 取规定量大肠埃希菌(约10~100 cfu),加入到10 ml的胆盐乳糖发酵培养基中,35 ℃培养24 h。
2.6.2.3 大肠菌群试验结果 结果见表4。

表4 大肠菌群试验结果
2.7 143批抽验样品微生物限度检查结果 结果见表5。

表5 抽验结果
3 讨论
3.1 补肾强身胶囊为中药成方制剂,其中所含有的一些成分会对细菌有一定的抑制作用,常规法和培养基稀释法(0.5 ml/皿和0.2 ml/皿)的细菌回收率都不能达到70%,均不能起到消除抑菌作用的目的。最后通过对3个厂家的3批样品的验证试验确定培养基稀释法(0.1 ml/皿)为细菌计数的方法,该方法能够有效去除对细菌的抑制作用;采用平皿法对霉菌和酵母菌数进行测定,回收率大于70%;控制菌检查(大肠埃希菌和大肠菌群)按常规法进行,符合《中国药典》的规定,在一定的程度上保证了微生物限度检查方法的科学有效,为补肾强身胶囊的质量标准制定提供了切实有效的保证。
3.2 本次抽样来源于17个省、自治区以及直辖市,从北方到南方,从西部到东部,涉及到24个生产企业,127个流通领域,基本涵盖了全国补肾强身胶囊的主要生产地和生产企业。因此,对其进行检验和数据统计分析,应该能较好地反映目前国产补肾强身胶囊的质量现状和市场情况。在执行标准方面,其中131批次执行标准为《卫生部药品标准中药成方制剂第四册》,4批次执行《国家食品药品监督管理局标准》YBZ09362004,4批次执行《国家食品药品监督管理总局国家药品标准》WS3-B-0751-91-5,2批次执行《国家食品药品监督管理总局国家药品标准》WS3-B-0751-91-4,1批次执行《国家食品药品监督管理局标准(试行)》YBZ10592004,1批次执行《国家食品药品监督管理局标准(试行)》YBZ22522005。各标准的微生物限度检查方法均参照《中国药典》2010年版一部附录ⅩⅢC微生物限度检查法的要求,根据各自的执行标准进行微生物限度检查,结果为:细菌数均小于10 cfu/g,霉菌和酵母菌数均小于10 cfu/g,大肠埃希菌均未检出,大肠菌群均小于10个/g,结果均符合规定,合格率为100%。此次抽验结果说明该中药品种在流通运输等环节稳定可靠,抽验的生产企业对该药品的原料采集、制备、工艺和生产等环节及药品的质量安全方面相对稳定。
1 王敏.药品评价性抽验的作用与意义[J].海峡药学,2007,19(6):133-134
2 中国药典[S].一部.2010:附录79-88
2016-07-13
R927.1
A
1006-5687(2016)06-0021-03

