赤雹根总皂苷缓释片含量测定的方法学研究
田沂凡,刘春楠,佟继铭,刘永平
(河北省中药开发与研究重点实验室,承德医学院中药研究所,承德 067000)
赤雹根总皂苷缓释片含量测定的方法学研究
田沂凡,刘春楠,佟继铭,刘永平*
(河北省中药开发与研究重点实验室,承德医学院中药研究所,承德 067000)
目的:建立赤雹根总皂苷(TSTR)缓释骨架片的含量测定方法。方法:采用单因素考查的方法考查溶出条件对药物体外释药可能产生的影响,对TSTR缓释骨架片的含量测定方法进行方法学考查。结果:赤雹皂苷F在4.84~309.76 μg/ml范围内呈良好的线性关系(r=0.999 7)。药物的体外释放条件为:以500 ml脱气后的pH 6.8的磷酸盐缓冲液(PBS)作为溶出介质,温度为(37±0.5) ℃,转速为100 r/min。结论:建立了稳定可靠的TSTR骨架缓释片的含量测定方法。
赤雹根,总皂苷,含量测定,骨架缓释片
赤雹为葫芦科多年蔓生草本植物,是我国满族民间长期沿用药材,多用来治疗风湿腰腿痛、软组织损伤[1]。前期研究表明,TSTR具有显著的镇痛抗炎作用[2,3],对佐剂诱导的类风湿性关节炎大鼠治疗效果明显[4,5]。本试验针对临床治疗类风湿性关节炎普通片剂给药频繁等缺点,并结合前期研究,制备TSTR缓释片,并对TSTR缓释片含量测定的方法学进行考查,预期建立稳定可靠的TSTR骨架缓释片的含量测定方法。
1 仪器与试药
1.1 仪器 Agilent HPLC-1260型高效液相色谱仪(美国安捷伦公司);依利特色谱柱(Hypersil ODS2,250 mm×4.6 mm,5 μm,批号11109);ZDY-8型重型单冲压片机(上海远东制药机械总厂);RC806溶出试验仪(TDTF/天大天发);YP1200型电子天平(上海精科天美科学仪器有限公司);AG-245型电子分析天平(瑞士梅特勒-托利多公司);YPD-300型片剂硬度仪(上海黄海药检仪器有限公司);热风循环干燥箱(吴江华飞电热设备有限公司)。
1.2 试药 赤雹根总皂苷(TSTR,实验室自制,纯度大于50%);赤雹皂苷F(实验室自制,纯度大于96%);甲醇、乙腈均为色谱纯;羟丙甲纤维素(HPMC K4M、HPMC K15M、HPMC K100M,安徽山河药用辅料股份有限公司,批号依次为140607、141017、140209);微晶纤维素(B型,湖州展望药业股份有限公司,批号20150631);硬脂酸镁(湖州展望药业股份有限公司,批号20150604);羧甲淀粉钠(CMS-Na,湖州展望药业股份有限公司,批号20150233);聚维酮 K30(PVP K30,湖州展望药业股份有限公司,批号20150410);纯净水(高碑店娃哈哈启力饮料有限公司);氢氧化钠(分析纯,天津市佳兴化工玻璃仪器工贸有限公司);磷酸二氢钾(分析纯,西陇化工股份有限公司)。
2 方法与结果
2.1 TSTR缓释片的制备 综合考虑TSTR的提取率,拟定片重450 mg,每片中TSTR干膏150 mg。根据赤雹根药材的常用剂量考虑,拟定服用方法为:1次/d,2片/次。由前期预试验得知,当TSTR作为主药时,由于TSTR干膏本身具有一定的黏度,湿法制粒后片剂硬度过大,不利于缓释的进行,故根据辅料性质及其余辅料的组成,将TSTR与各辅料充分混合,采用粉末压片法直接压片即得。
2.2 体外释放条件的考查
2.2.1 溶出介质对药物体外释放的影响 释放介质的选择与药物的理化性质、生物学特性及服用后所遇到的生理环境等因素有关。模拟人体胃肠道的生理环境,考查不同的pH值下溶出介质对药物释放的影响,对于研究药物服用后在不同生理环境下的敏感性及不同处方在不同释放介质中的释药差异具有重大意义[6]。本研究根据人体胃肠道中的生理环境不同,选择三种不同pH值下的释放介质,即1 mol/L的稀盐酸、脱气后的新鲜蒸馏水、pH 6.8的PBS缓冲液[7]。取上述同一批次制备的TSTR骨架缓释片各1片,分别在以上3种不同的释放介质中溶出,在相同位置定时取样,每次取样1 ml迅速过滤。以赤雹皂苷F的累积释放度为评价指标,采用HPLC法测定每一份样品的峰面积,计算其累积释放度。结果见图1。由图1可知,溶出介质对药物的体外释药过程影响较大,药物在人工胃液环境中的累积释放度较低,在水和pH 6.8的PBS缓冲液中缓慢释放,符合Higuchi释放曲线。结果表明药物具有良好的体外缓释作用,无明显突释。

图1 不同溶出介质对皂苷F体外释放的影响
2.2.2 溶出介质温度的选择 溶出介质温度对药物体外释放的影响大小主要由药物与辅料的溶解性所决定。人体正常体温为(37±0.5) ℃,《中国药典》一部2015版规定溶出介质温度为(37±0.5) ℃,更能够准确反应药物在体内的释药过程。
2.2.3 转速对药物体外释放的影响 采用篮法对同一批次的TSTR缓释片进行体外释放测定试验,考查转速对体外释药行为的影响,转速分别设定为50 r/min和100 r/min,保持其他条件不变,按照“2.2.1”项下方法测定其累积释放度。结果见图2。由图2可知,转速大小对药物的体外释放速率影响较大,其大小与药物体外释放速率呈正相关关系。溶出度测定方法中转速的大小范围一般在50~100 r/min,篮法和桨法分别以100 r/min、50 r/min为主[8]。测定药物体外释放度时转速应选择100 r/min。
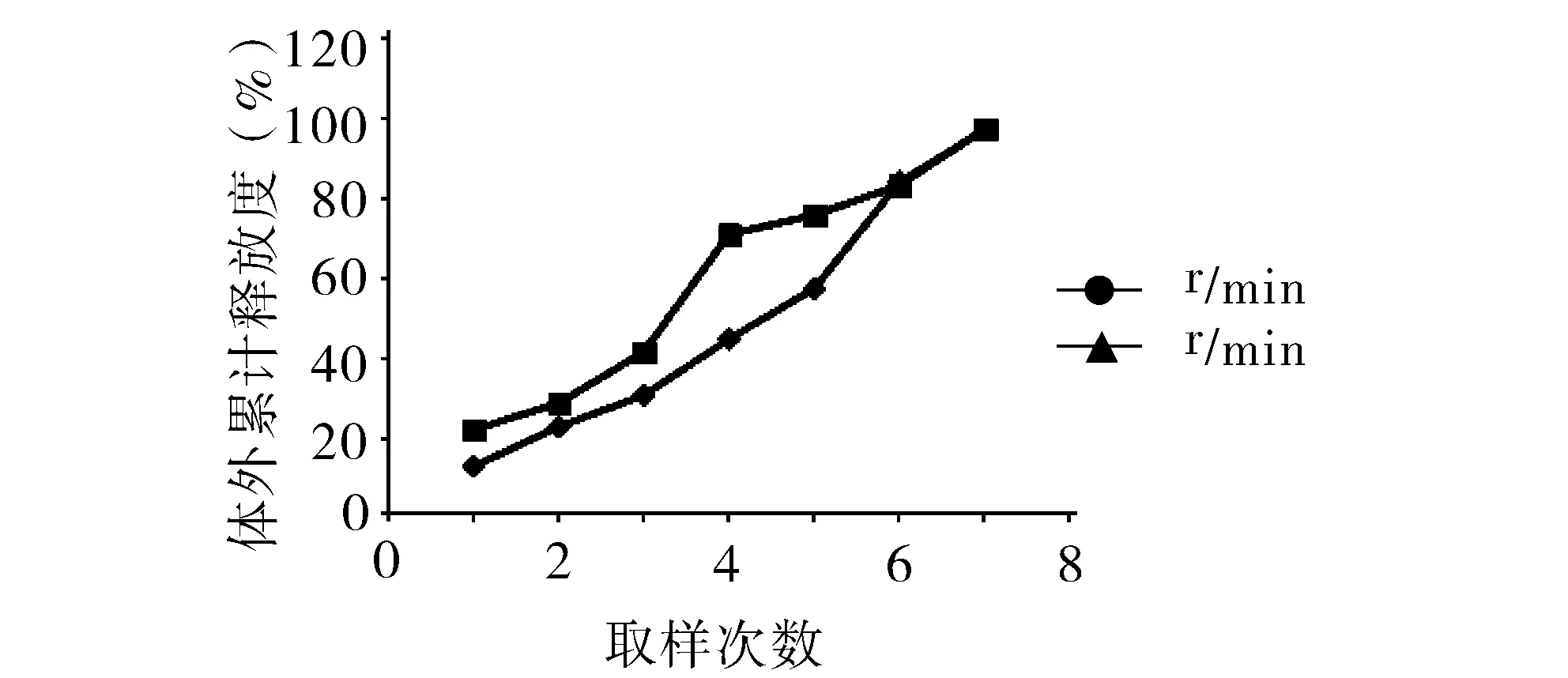
图2 转速不同时对皂苷F体外释放的影响
2.3 含量测定
2.3.1 色谱条件 Discovery-C18色谱柱(Hypersil ODS2,250 mm×4.6 mm,5 μm,批号11109);流动相:乙腈-水(24∶76);检测波长:200 nm;柱温:35 ℃;流速:1.0 ml/min;进样量:20 μl[9]。
2.3.2 溶液的制备
2.3.2.1 对照品溶液的制备 精密称定赤雹皂苷F 10 mg,用25%乙腈水溶解并定容至10 ml,分别精密量取上述标准液3.2、1.6、0.8、0.4、0.2、0.1和0.05 ml于10 ml量瓶中,用25%乙腈水定容,摇匀,即得对照品溶液。
2.3.2.2 供试品溶液的制备 精密称取预制备的TSTR缓释片研碎后的粉末10 mg,用25%乙腈水超声溶解并定容至10 ml,摇匀,即得。
2.3.2.3 阴性对照溶液 取TSTR缓释骨架片的阴性制剂,粉碎,混匀后精密称取20 mg,置于10 ml量瓶内,加25%乙腈水超声30 min后定容,摇匀。过0.45 μm滤膜,精密吸取对照品溶液、供试品溶液和阴性对照溶液各20 μl,按照“2.3.1”项下色谱条件进样测定,对比样品和对照品的HPLC图谱,空白制剂的HPLC图谱在58 min左右赤雹皂苷F出峰处没有干扰峰。结果见图3。
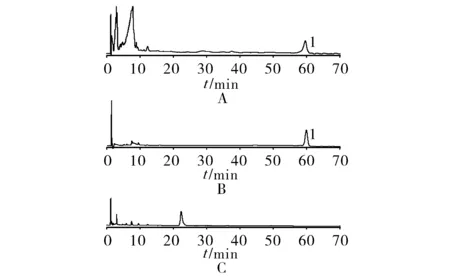
1.赤雹皂苷F图3 供试品(A) 对照品(B)阴性对照(C)HPLC色谱图
2.3.3 标准曲线的制备 分别取上述对照品溶液各1 ml于上样瓶中,按照上述色谱条件进样,测定其每份对照品溶液的峰面积。以对照品峰面积值(Y)为纵坐标,赤雹皂苷F的浓度X(μg/ml)为横坐标,绘制标准曲线,回归方程:Y=11 148X-40 230(r=0.999 7)。表明赤雹皂苷F在4.84~309.76 μg/ml范围内呈良好的线性关系。
2.3.4 精密度试验 移取40 μg/ml的对照品溶液各1 ml于上样瓶中。按照“2.3.1”项下色谱条件重复进样6次,并记录峰面积。结果6份供试品的峰面积均值为369 600,RSD为0.77%,表明该仪器精密度良好。
2.3.5 稳定性试验 移取供试品溶液1 ml于上样瓶中。按照“2.3.1”项下色谱条件分别在1、2、4、8、12和24 h进样1次,测定样品的峰面积。结果所测得峰面积的平均值为455 825,RSD为0.31%,表明供试品溶液在24 h内稳定性良好。
2.3.6 重现性试验 取5份TSTR缓释片粉末各10 mg于10 ml量瓶内,加25%乙腈水超声溶解并定容至10 ml,各取1 ml于上样瓶中,按照“2.3.1”项下色谱条件进样,测定其峰面积并记录。结果所测得TSTR缓释骨架片中赤雹皂苷F含量的平均值为4.45%,RSD值为0.50%,表明该方法重现性良好。
2.3.7 加样回收率试验 精密称定9份已知赤雹皂苷F纯度的TSTR缓释片粉末各10 mg于10 ml量瓶中,依次编号1~9号,1~3号、2~6号和7~9号量瓶内依次加入0.36、0.45和0.53 mg的对照品,分别加入25%乙腈水超声溶解30 min,定容至10 ml。按“2.3.1”项下色谱条件依次测定其峰面积,并计算加样回收率。平均回收率为101.1%,RSD为1.27%。结果见表1。

表1 加样回收率试验结果(n=9)
2.3.8 缓释片中赤雹皂苷F的含量测定 取预制备的TSTR缓释片(片重依次为458、452和457 mg)3片,粉碎后分别置于3支500 ml量瓶内,加纯水超声溶解并定容。在“2.3.1”项色谱条件下分别测定以上3份样品中赤雹皂苷F的含量。结果见表2。
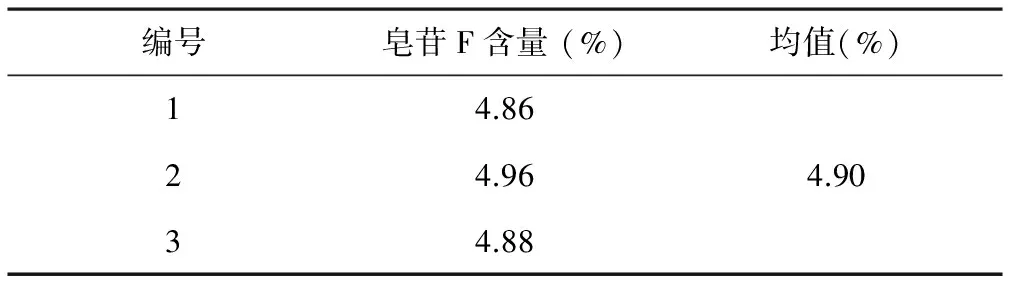
表2 缓释片中赤雹皂苷F的含量测定结果
3 讨论
根据《中国药典》规定,缓释制剂在体外释放过程中,溶出介质的体积一般为500~900 ml。预试验结果发现,当溶出介质为900 ml时,皂苷F在溶出介质中的浓度过低,小于含量测定的线性范围,通过对比不同体积对结果的影响,最终确定溶出介质的体积为500 ml。
通过对阴性制剂、TSTR缓释骨架片样品和赤雹皂苷F对照品的HPLC谱图进行比较,阴性制剂谱图在赤雹皂苷F的保留时间附近未出现干扰峰,说明骨架材料和辅料对赤雹皂苷F的HPLC检测没有影响。
1 宋立人,红恂,丁绪亮,等.现代中药大辞典(上册)[M].北京:人民卫生出版社,2001:1022
2 刘永平,陈建双,张玉玲,等.赤雹根总皂苷镇痛作用研究[J].辽宁中医杂志,2001,38(5):993-995
3 陈建双,张玉玲,赵波,等.赤雹根总皂苷抗炎作用研究[J].中国实验方剂学杂志,2012,18(8):163-166
4 张玉玲,赵波,陈建双,等.赤雹根镇痛作用及有效部位研究[J].时珍国医国药,2010,21(10):2483-2484
5 刘永平,陈建双,赵波,等.赤雹根总皂苷对实验性佐剂型关节炎镇痛作用的研究[J].辽宁中医杂志,2011,38(8):1659-1661
6 周松,陈腾.盐酸伪麻黄碱缓释制剂的研制及其体外释放度测定[J].中国药师,2006,9(8):60-62
7 彭芝萍.三七总皂苷缓释片的制备工艺及其体内外释药的研究[D].武汉:湖北中医药大学,2012:28-29
8 魏农农,王霞,苏敏.药物溶出度试验方法研究进展[J].中国新药杂志,2013,22(17):1119-1124
9 毛晓霞,苗光新,赵春颖,等.赤雹根中Dubioside F的分离纯化及含量测定[J].中国实验方剂学杂志,2014,20(24):62-65
安全用药
2016-09-13
河北省科技厅支撑项目(No.14272502D),河北省教育厅重大项目(No.ZD 2016013)
R927.2
A
1006-5687(2016)06-0024-03
*通讯作者:刘永平,E-mail:lyp@cdmc.edu.cn。

