CYP3A5/3A4多态性对肾移植患者术后早期他克莫司剂量的影响
郭媛媛,张 弋
(天津市第一中心医院,天津 300192)
CYP3A5/3A4多态性对肾移植患者术后早期他克莫司剂量的影响
郭媛媛,张 弋*
(天津市第一中心医院,天津 300192)
目的:探索肾移植患者术后早期遗传因素与他克莫司(FK506)个体化给药的规律,并探讨各单倍型患者在术后不同时间所需剂量的个体差异。方法:观察113例肾移植术后常规应用他克莫司+霉酚酸酯+泼尼松三联免疫抑制治疗的患者,记录术后早期(3、5、7和 14 d)FK506全血谷浓度(C0)和剂量(D,每日每kg体重剂量),测定每个患者CYP3A5及CYP3A4基因多态性。采用酶联免疫吸附法(ELISA)监测患者术后FK506的C0,DNA直接测序法测定患者CYP3A5*3、CYP3A4*18B基因多态性。在此基础上,根据患者基因型进行分组,比较不同基因型患者FK506的C0、D及C0/D。结果:113例肾移植患者CYP3A5*3和CYP3A4*18B突变等位基因发生的频率分别为73.0%和30.5%,各基因频率达到遗传平衡。 CYP3A5不表达组(CYP3A5*3/*3)的C0/D是CYP3A5表达组(CYP3A5*1)的2.1~2.5倍(P<0.05);CYP3A4不表达组(CYP3A4*1/*1)的C0/D是CYP3A4表达组(CYP3A4*18B)的1.3~1.7倍(P<0.05);对于CYP3A5-CYP3A4单倍型,GG-GG组的C0/D是AA-AA组的2.0~2.8倍(P<0.05)。各基因型患者达目标靶浓度的人数比例随术后时间延长逐步增加,而 AA-AA组达靶浓度人数比例始终最少(P<0.05)。结论:CYP3A5*3和CYP3A4*18B基因多态性对肾移植术后FK506的药动学有显著影响,肾移植术前可通过对患者单独进行CYP3A5基因型的测定来确定术后早期FK506初始剂量,从而实现个体化用药。
肾移植,他克莫司,CYP3A5,CYP3A4,基因多态性,药动学
他克莫司(tacrolimus, FK506)作为钙调磷酸酶抑制剂(CNI)家族的一员,由于其抗排斥作用显著,已成为各器官移植的一线免疫抑制剂[1]。但药物基因组学认为,CYP3A4/5的基因突变是造成FK506临床疗效个体差异显著的原因之一[2,3],因此如何达到个体化用药,是目前其合理有效应用的一个难点,严密的药物浓度监测对于获得满意的免疫抑制效果,减少毒副作用意义很大[4]。尽管已有许多关于他克莫司药代动力学的研究报道,但国内外大部分对基因影响FK506药动学的研究都集中在术后1个月或0.5年以上,其实移植术后将他克莫司血药浓度稳定于目标范围内尤其在术后早期仍然十分困难[5]。针对这一现状,本研究将研究重点放在确定FK506初始剂量的术后早期,旨在借助测定肾移植患者体内CYP3A5*3、CYP3A4*18B基因多态性,并结合患者术后不同时期服用FK506的D、C0情况,以探讨遗传因素对肾移植患者术后FK506个体化用药影响的变化规律,以期为基因导向的个体化给药提供依据,从而可以预先针对性给药,达到减少药物毒性和不良反应,减少早期急性排斥反应,进一步提高肾移植临床效果的目的。
1 资料与方法
1.1 入选标准和排除标准
1.1.1 入选标准 本院首次行肾移植手术的中国籍患者,没有合并其他移植。术前诊断均为慢性肾功能衰竭、尿毒症,年龄18~70岁,性别不限,术后应用他克莫司(FK506)+霉酚酸酯(MMF)+泼尼松(Pred)三联免疫移植抗排斥治疗方案。FK506初始给药剂量为0.1 mg/kg·d-1,MMF为0.54~2.0 g/d,Pred分阶段给药:术后1~3 d 500 mg/d;术后5 d 250 mg/d;术后1周 50 mg/d;术后2周 30 mg/d。
1.1.2 排除标准 随访期间因感染等因素使用过抗感染药物,如氟康唑(大扶康)、西咪替丁(泰胃美)等的患者以及有严重心、肝、造血系统、神经系统疾病及精神病患者。
1.2 研究对象 依据严格的入选及排除标准,从2009年8月—2012年4月期间行肾移植手术的患者中筛选出113例。比较CYP3A5、CYP3A4不同基因型的患者在术后早期(3、5、7和14 d)FK506的全血谷浓度(C0)和剂量(D,为每日每kg体重的给药剂量),以及浓度/剂量(C0/D)之间的关系。其中肾移植患者男71例,女42例,其他基本资料见表1。

表1 肾移植患者的基本资料(n=113)
1.3 标本采集 所有患者均为早上服药前30 min空腹采血2~3 ml,密闭保存于EDTA抗凝管中,供血药浓度测定。测序部分留取EDTA抗凝全血1~2 ml,于-80℃深低温冰箱内保存备用。
1.4 FK506全血谷浓度的测定 采用酶联免疫吸附法(ELISA)进行测定,初始给药剂量为 0.1 mg/kg·d-1,之后根据C0调整用药剂量。术后前3个月的有效浓度目标范围为5~8 μg/L。
1.5 基因测序 CYP3A5及CYP3A4基因多态性检测用设计的引物(表2),严格按照全血DNA提取试剂盒操作流程提取DNA后,PCR法扩增[反应体系CYP3A5*3:95 ℃预变性15 min,变性、退火、延伸分别为94 ℃ 45 s、58 ℃ 30 s、72 ℃ 45 s,共35个循环,最后72 ℃延伸7 min,4 ℃保温。CYP3A4*18B:96 ℃ 2 min、96 ℃ 20 s、60 ℃ 30 s(-1 ℃ per cycle)、68 ℃ 50 s 10个循环,96 ℃ 20 s、56 ℃ 30 s、68 ℃ 50 s、68 ℃ 5 min 30个循环,15 ℃保存。]PCR扩增后用3730XL DNA测序仪进行测序。

表2 CYP3A5*3和 CYP3A4*18B基因测序引物序列及片段长度

2 结果
2.1 CYP3A5*3和CYP3A4*18B基因型分布 113例肾移植患者CYP3A5*3和CYP3A4*18B突变等位基因发生的频率分别为73.0%和30.5%,各基因型及等位基因突变频率见表3。经Hardy-Weinberg检验分析,结果显示P>0.05,各基因频率达到遗传平衡,研究资料具有群体代表性。
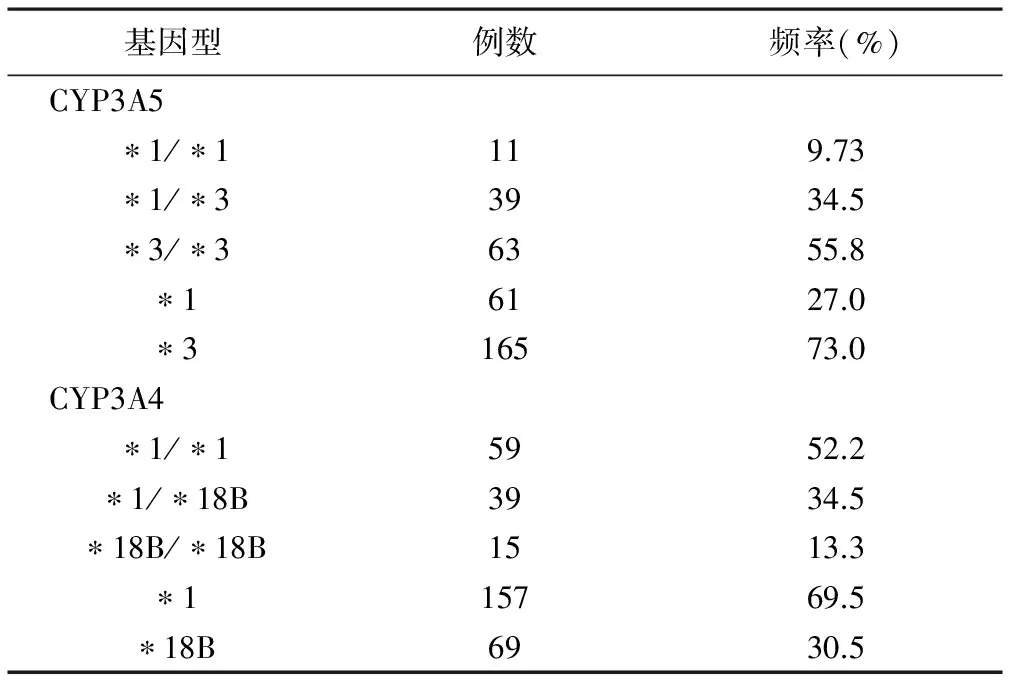
表3 CYP3A5*3和 CYP3A4*18B基因型及等位基因突变频率
2.2 CYP3A5*3对肾移植患者FK506药动学的影响 CYP3A5不同基因型FK506 C0与C0/D都呈现如下特征:*1/*1<*1/*1+*1/*3<*1/*3<*3/*3,且与慢代谢型CYP3A5*3/*3相比较,都具有显著性差异;但D在术后7 d后才表现出显著性差异,且规律与C0及C0/D相反。术后各时间段慢代谢组与快代谢组之间C0/D分别为:(92.30±56.71) vs (43.80±34.51)(3 d,2.1倍);(94.73±53.89) vs (41.43±38.40)(5 d,2.3倍);(94.32±45.90) vs (40.53±22.91)(7 d,2.3倍);(116.01±66.02) vs (46.90±24.26)(14 d,2.5倍)。同时,慢代谢患者在相应的时间临床实际给药剂量分别为0.07 mg/kg·d-1。见表4。
2.3 CYP3A4*18B对肾移植患者FK506药动学的影响 CYP3A4不同基因型FK506 C0与C0/D都呈现如下特征:术后3 d和5 d时,*1/*18B<*18B/*18B+*1/*18B<*18B/*18B<*1/*1,术后7 d和 14 d时,*18B/*18B<*18B/*18B+*1/*18B<*1/*18B<*1/*1,且与慢代谢型CYP3A4*1/*1相比较,具有显著性差异。D在术后14 d,表现出显著性差异。同时,慢代谢患者在相应的时间临床实际给药剂量分别为0.07 mg/kg·d-1。见表5。

表4 CYP3 A5*3对肾移植患者术后FK506 C0、D和C0/D的影响
与*3/*3比较,△P<0.01
2.4 CYP3A5*3和CYP3A4*18B联合效应对肾移植患者FK506药动学的影响 联合考虑CYP3A5*3和CYP3A4*18B,在CYP3A5*1组中, CYP3A4不同基因型FK506C0与C0/D有如下特征:术后3 d和5 d时,*1/*18B<*18B/*18B<*1/*1,术后7 d和 14 d时,*18B/*18B<*1/*18B<*1/*1,这与单独考虑CYP3A4时的规律一致,且与GG-GG组相比较均表现显著性差异;而在CYP3A5*3/*3组中,各组之间与GG-GG组相比较均没有显著性差异。见表6。

表5 CYP3A4*18B对肾移植患者术后FK506 C0、D和C0/D的影响
与*1/*1比较,△P<0.05, △△P<0.01
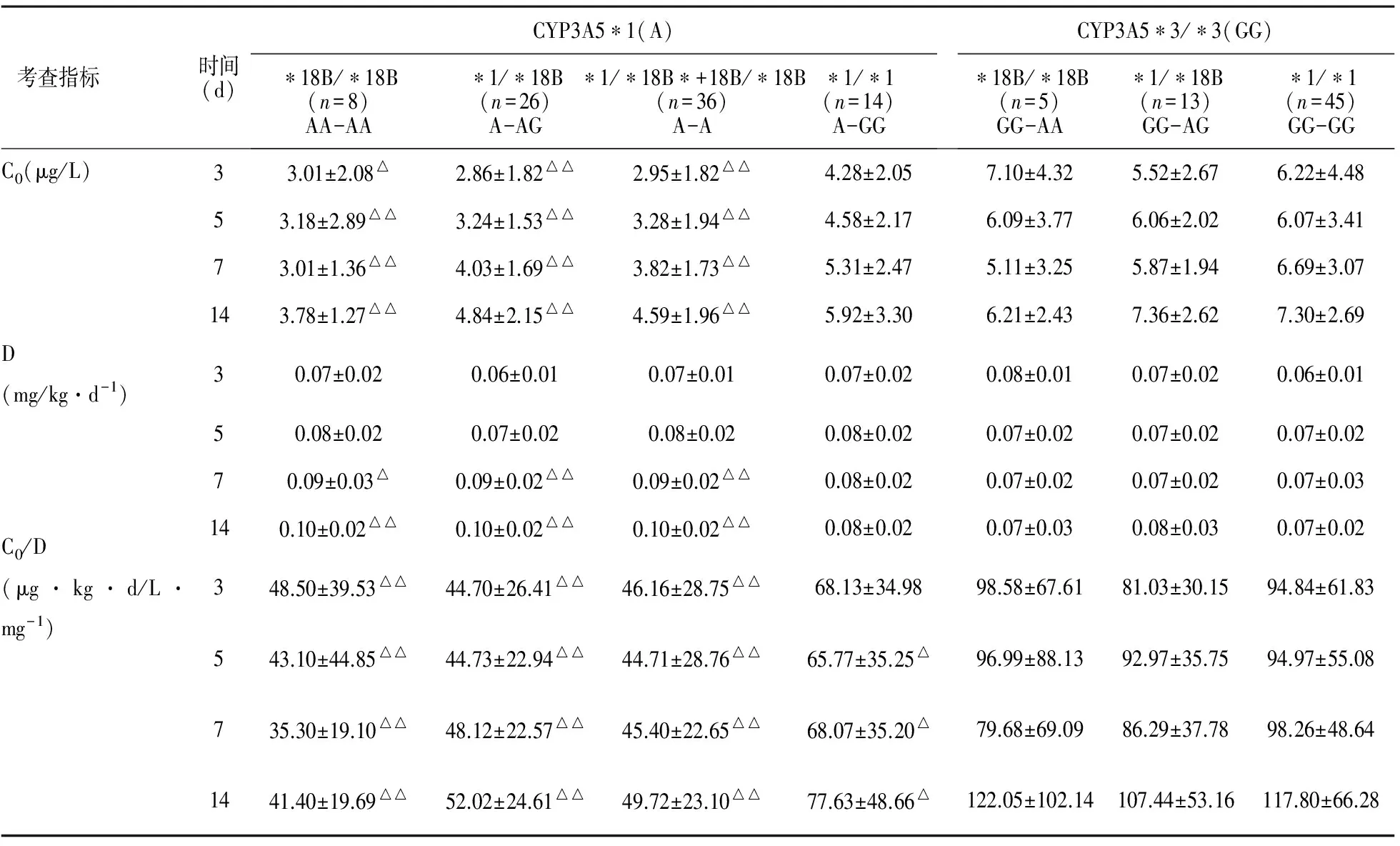
表6 CYP3A5*3和CYP3A4*18B对肾移植患者术FK506 C0、D和C0/D的影响
与GG-GG组比较,△P<0.05, △△P<0.01
2.5 肾移植术后不同时间达靶浓度人数百分比 将患者C0达到5 μg/L以上视为达到目标靶浓度,计算术后不同时间不同代谢类型组中达靶浓度的患者占该组患者百分比的差异。由于术后各时间快代谢人数都非常少,因此未进行统计分析,利用四格表卡方检验对慢代谢和中间代谢达靶浓度人数进行统计分析,可以看出术后不同时间达靶浓度的比例关系为:慢>中>快,且从术后第7 d开始慢代谢与中间代谢达靶浓度比例均有显著性差异,总达靶浓度比例随时间延长逐步上升,见表7。

表7 CYP3A5-CYP3A4 单倍型术后不同时间达靶浓度比例
慢代谢与中间代谢比较,△P<0.05
3 结论
FK506主要由CYP3A亚家族代谢,其中最主要的是CYP3A5和CYP3A4。编码这些酶基因的基因多态性(SNPs)会影响其活性及表达量,从而影响FK506的药动学及药效学。CYP3A5基因型与FK506的血药浓度相关,使血药浓度/剂量值表现出显著的个体差异性[6],CYP3A4也会影响FK506的代谢,但中国人群中CYP3A4的多态性出现的很少,几乎为零[7]。本研究分别考查了CYP3A5、CYP3A4以及联合效应对FK506药动学的影响,与大多数文献不同的是,还考查了术后早期(14 d内)不同基因型患者的差异,这为早期确定FK506的初始剂量提供了临床依据,从而实现采用基因测定的方法进行个体化用药的可能。
单独考查CYP3A5对FK506药动学影响时发现:在术后14 d内,各组之间的C0和C0/D一直存在显著性差异,且基本趋势是*1/*1<*1/*3<*3/*3,而D只在术后7 d和14 d有显著性差异,且基本趋势与C0和C0/D相反,这与CHEN通过对67例肾移植患者7 d服药情况的分析结论一致,即不同基因型患者达治疗窗所需FK506的剂量关系为:CYP3A5*1/*1>CYP3A5*1/*3>CYP3A5*3/*3[8]。可以看出CYP3A5表达组(CYP3A5*1)在术后3和5 d服用相同剂量FK506以及在术后7和14 d服用更高剂量FK506,却出现较不表达组(CYP3A5*3/*3)低的C0和C0/D。当CYP3A5表达组的D是不表达组的1.0~1.4倍时,不表达组C0是表达组的1.6~2.3倍,C0/D是2.1~2.5倍。由各代谢类型患者术后不同时期C0/D之间的关系可以得出:在术后不同时期欲达到相同的靶浓度,快代谢患者所需的剂量应是慢代谢患者的2.1、2.3、2.3和2.5倍。虽然同一单倍型患者每日给药剂量差异很大,但是若等价成每日每公斤体重给药剂量就较为稳定,在本研究所考查的四个时间点中,临床上对于慢代谢患者的实际给药剂量变化不大,均为0.07 mg/kg·d-1,同时因为慢代谢患者是术后最容易达到目标靶浓度的人群,因此,以慢代谢患者的给药剂量为标准,得出快代谢在术后3、5、7和14 d的所需剂量分别为0.15、0.16、0.16和0.18 mg/kg·d-1。单独考查CYP3A4对FK506的影响时,与单独考查CYP3A5表现出类似的规律:各组之间的C0和C0/D一直存在显著性差异,但术后3和5 d,*1/*18B<*18B/*18B<*1/*1,术后7和14 d,*18B/*18B<*1/*18B<*1/*1,总体也呈现CYP3A4表达组(CYP3A4*18B)服用相同或更高剂量FK506,却出现较不表达组(CYP3A4*1/*1)低的C0和C0/D的趋势。当CYP3A4表达组的D是不表达组的1.0~1.2倍时,不表达组C0是表达组的1.3~1.6倍,C0/D是1.3~1.7倍。
联合考查CYP3A5与CYP3A4对FK506药动学影响时,在CYP3A5*3/*3组中,无论CYP3A4是快代谢还是慢代谢,C0、D和C0/D在各个时期均无显著性差异,从这可以看出CYP3A5是主要影响FK506代谢的酶,这与文献报道一致[9-12]。在CYP3A5*1组中,各单倍型的C0、D和C0/D与GG-GG比较,大多数都具有显著性差异,尤其是AA-AA型,即CYP3A5与CYP3A4均为快代谢型,当GG-GG组的D是AA-AA组的1.1~1.4倍时,AA-AA组C0是GG-GG组的1.9~2.0倍,C0/D是2.0~2.8倍。由此可以看出,联合考查CYP3A5-CYP3A4单倍型比单独考查CYP3A5或CYP3A4影响更为显著,而且与单独考查CYP3A5的数据结论相似。从达靶浓度比例比较中可以看出,AA-AA型患者在不同时期达目标靶浓度的比例都是最低的,这应该引起临床的足够重视,欲达到相同的目标靶浓度,AA-AA型患者所需的初始D几乎是GG-GG患者的2倍多,经数据分析,得出本院所有慢代谢患者的给药剂量的均值为0.07 mg/kg·d-1,因此,最快代谢AA-AA型患者初始D至少应为0.14 mg/kg·d-1。除此以外,从数据中可以看出,对于GG型(GG-A或GG-GG)患者,有的患者FK506的C0>10 μg/L,甚至有一个患者高达22.64 μg/L,这提示对于CYP3A5*3/*3的患者可以适当降低FK506的初始剂量,以防因浓度过高而产生急排反应。Queineh[13]通过对136例肾移植患者不同基因型与排斥反应的关系研究发现CYP3A5*1/*1与CYP3A5*1/*3或CYP3A5*3/*3相比,会增加急性排斥反应的发生(38% vs 10% vs 12%,P=0.03),但对肾毒性的研究中,Kurpers等[14]认为肾移植术后3个月,携带CYP3A5*1等位基因者较携带CYP3A5*3等位基因者更易出现肾毒性,但Chen等[8]结论与其相反,即CYP3A5*3*3型患者肾毒性发生率较*1*1型患者明显升高,而Queineh等[13]研究则认为不同CYP3A5基因型与他克莫司相关肾毒性并无明显关系。因此,关于肾毒性与CYP3A5的关系比较有争议,并没有一个统一的结论,而且也很少有文献报道术后急排及肾毒性的发生与CYP3A4有关。因此,对于快代谢患者,虽然给药剂量较慢代谢患者大,但只要密切监测血药浓度,保证在治疗窗范围之内,便可有效预防因浓度过低产生排斥反应或因浓度过高产生毒副作用。Jun等[15]指出CYP3A5与CYP3A4之间有连锁,而Birdwell等[16]利用基因芯片对399例肾移植患者共2 025个与他克莫司代谢相关的基因多态性位点进行了筛查。经过人口统计学和临床因素的校正后发现,CYP3A5*3是影响他克莫司给药剂量的最相关因素,与本研究发现CYP3A5的基因多态性是影响FK506药动学的关键的结论一致,因此,如果在经济条件有限的前提下,可以考虑只测定CYP3A5的基因型,以为患者节省部分开支及时间。
在临床应用免疫抑制剂的治疗方案时,国内的多数移植中心都采用统一的FK506起始剂量(本院的起始剂量为0.1 mg/kg·d-1),并没有根据基因型的差异实行不同的个体化给药方案,这样可能会导致部分基因型患者不能在术后早期尽快达到足够的免疫抑制效果,而有的则会发生毒副作用,影响移植疗效。本研究证实了CYP3A5*3和CYP3A4*18B对肾移植术后早期FK506药动学有显著性影响,对CYP3A5*3和CYP3A4*18B基因型的监测有助于预测术后早期FK506的用药剂量,在确定FK506初始剂量的早期为实施器官移植的个体化给药提供参考。但本研究只考查了CYP3A5、CYP3A4这两个主要影响FK506代谢的遗传因素,并没有将其他基因及非遗传因素纳入考查,对FK506的血药浓度影响研究的并不全面,因此,随着人们对人类基因组了解的深入以及快速测定基因多态性方法的建立,采用基因测定的方法实现用药个体化应用于临床还需要进行大规模、多角度和多方位的考查与研究。
1 李丹滢, 葛卫红. 药物基因组学对器官移植后他克莫司药动学影响的研究进展[J].医药导报, 2015,34(8):1059-1063
2 Rosso F C, D E Sandes T V, Sampaio E L,etal. Clinical impact of polymorphisms of transport proteins and ellzymes involved in the metabolism of inlmunosuppressivedrugs[J]. Transplant Proc, 2009, 41(6): 1441-1455
3 张海燕, 张小明, 吴小丽, 等.CYP3A5基因多态性对中国肾移植受者他克莫司血药浓度和疗效的影响[J]. 器官移植, 2011, 2(6): 328-331
4 Masatomo M, Shigeru S, Hideaki K,etal. Impact of the CYP3A4*1G polymorphism and its combination with CYP3A5 genotypes on tacrolimus pharmacokinetics in renal transplant patients[J]. Pharmacogenomics, 2011, 12(7): 977-984
5 Jacobson P A, Oetting W S, Brearlty A M,etal. Novel polymorphisms associated with tacrolimus trough concentrations: Results from a multicenter kidney transplantconsortium[J]. Transplantation, 2011, 91(3): 300-308
6 Dawei C, Feng G, Jinxiu S,etal. Association of hemoglobin levels, CYP3A5, and NR1I3 gene polymorphisms with tacrolimus pharmacokinetics in liver transplant patients[J].Drug Metab and Pharmacokinet, 2014, 29(3): 249-253
7 Lee J S, Cheng H S, Kim L H,etal. Screening of genetic polymorphisms of CYP3A4 and CYP3A5 genes[J]. Korean J Physiol Pharmacol, 2013, 17(6): 479-484
8 Chen J S, Li L S, Cheng D R,etal. Effect of CYP3A5 genotype on renal allograft recipients treated with tacrolimus[J]. Transplant Proc, 2009, 41(5): 1557-1561
9 Gervasini G, Garcia M, Maeias R M,etal. Impact of genetic polymorphisms on Taerolimus pharmacokinetics and the clinical outcome of renal transplantation[J]. Transpl Int, 2012, 25(4): 47l-480
10 Staatz C E, Goodrnfln L K, Tett S E. Effect of CYP3A and ABCB1 single nucleotide polymorphisms on the pharmaeokinetics and pharmacodynamics of calcineurin inhibitors: Part II[J]. Clin Pharmaeokinet, 2010, 49(4): 207-221
11 Zhang J, Zhang X, Liu L,etal. Value of CYP3A5 genotyping on determining initial dosages of Tacrolimus for Chinese renal transplant recipients[J]. Transplant Proc, 2010, 42(9): 3459-3464
12 Monchaud C, Winter D, Knoop C,etal. Population pharmacokinetic modelling and design of a Bayesian estimator for therapeutic drug monitoring of Tacrolimus in lung transplantation[J]. Clin Pharmacokinet, 2012, 51(3): 175-186
13 Quteineh L, Verstuyft C, Furlan V,etal. Influence of CYP3A5 genetic polymorphsim on tacrolimus daily requirements and acute rejection in renal graft recipients[J]. Basic Clin Pharmacol Toxicol, 2008, 103(6): 546-552
14 Kuypers D R, Jonge H, Naesens M,etal. CYP3A5 and CYP3A4 but not MDR1 single-nucleotide polymorphisms deter mine long term tacrolimus disposition and drug-related nephrotoxicity in renal recipients[J]. Clin Pharmacol Ther, 2007, 82(6): 711-725
15 Jun K R, Lee W, Jang M S,etal. Tacrolimus concentrations inrelation to CYP3A4 and ABCB1 polymorphisms among solid organ transplant recipients in Koreal[J]. Transplantation, 2009,87(8): 1225-1231
16 Birdwell K A, Grady B, Chol L,etal. The use of a DNA biobank linked to electronic medical records to characterize pharmacogenomic predictors of tacrolimus dose requirement in kidney transplant recipients[J]. Pharmacogenet Genomics, 2012, 22(1): 32-42
Influence of CYP3A5/3A4 polymorphism on rational medication of FK506 in patients with renal recepients during early period of postoperation
Guo Yuanyuan, Zhang Yi
(Tianjin First Central Hospital, Tianjin 300192)
Objective: To explore the regular influence of genetic factors on individualized dosing of tacrolimus (FK506) and to investigate individual variations among the patients with haploid type in different time of postoperation. Methods 113 renal recepients were involved in this study, and the blood samples of each patient were collected. The dose(D), blood trough concentration of FK506(C0) and genotypes were detected and recorded on 3, 5, 7, 14 days. C0 was detected by enzyme-linked immunosorbent assay (ELISA), and polymorphism of CYP3A5*3 and CYP3A4*18B were detected by DNA direct sequencing. And then the recipients were grouped according to different gene phenotypes, C0、D、C0/D of FK506 in different groups were compared. Results The frequency of CYP3A5*3 and CYP3A4*1 8B was 73.0% and 30.5%, respectively. C0/D in Group CYP3A5*3/*3 was 2.1-2.5 times greater than that in Group CYP3A5*1 (P<0.05), while C0/D in Group CYP3A4*1/*1 was 1.3-1.7 times greater than that in Group CYP3A4*18B (P<0.05). For the CYP3A5-CYP3A4 phenotype,C0/D in the recipients with GG-GG was 2.0-2.8 times greater than those with AA-AA (P<0.05). With the extension of the postoperative time, more and more patients with different genotypes got the target concentration of FK506, but the number of the patients in Group AA - AA was the least. Conclusion: Pharmacokinetics of FK506 is greatly influenced by CYP3A5*3 and CYP3A4*18B. Detection of CYP3A5 genotypes prior to transplantation is meaningful to determine an appropriate initial dose of FK506 and to practice individualized medication.
kidney transplantation, tacrolimus, CYP3A5, CYP3A4, gene polymorphisms, pharmacokinetic
2016-09-11
R969.1
A
1006-5687(2016)06-0003-07
*通讯作者:张弋,E-mail:wing_zh1821@sina.com。

