罗伊氏乳杆菌发酵液中具有降胆固醇能力蛋白的分离、纯化和鉴定
陈 臣,于瑞莉
(1.上海应用技术大学,香料香精技术与工程学院,上海 201418; 2.江南大学,食品科学与技术国家重点实验室,江苏无锡 214122)
罗伊氏乳杆菌发酵液中具有降胆固醇能力蛋白的分离、纯化和鉴定
陈 臣1,*,于瑞莉2
(1.上海应用技术大学,香料香精技术与工程学院,上海 201418; 2.江南大学,食品科学与技术国家重点实验室,江苏无锡 214122)
罗伊氏乳杆菌DSM122460无细胞上清发酵液(cell-free supernatant,CFS)具有较高的胆固醇移除能力,经初步鉴定有效成分为蛋白质。通过超滤浓缩、硫酸铵分级沉淀、DEAE Sepharose F.F阴离子交换层析进一步对该活性成分进行分离纯化。纯化后,其比活力达到61.6 U/mg,纯化倍数为32.4。经SDS-PAGE检测,样品达到电泳级纯,分子量约为60 ku。通过质谱鉴定初步认定该活性蛋白为一假设蛋白,其功能尚待进一步研究。
罗伊氏乳杆菌,无细胞上清发酵液,移除胆固醇,纯化,假设蛋白
胆固醇又称胆甾醇,是动物组织细胞所不可缺少的重要物质,它不仅参与形成细胞膜,而且是合成胆汁酸、维生素D和甾体激素的原料,是人体内重要的营养成分[1]。胆固醇分为高密度胆固醇和低密度胆固醇两种,前者对心血管有保护作用,后者偏高,能对动脉造成损害。随着人们生活水平的逐渐提高,低密度胆固醇摄入量普遍偏高。血清中低密度胆固醇含量偏高,容易导致动脉粥样硬化、冠心病、脑中风、高血压等心脑血管疾病,严重威胁人类健康。研究表明,血清中低密度胆固醇减少1%就可以使冠心病的危险降低2%~3%[2],因此,降低血清和食物中低密度胆固醇含量是当前科学研究热点之一。
早在1974年,Mann等研究者就发现大量饮用酸乳等发酵乳制品的非洲Masai人血清胆固醇保持在非常低的水平[3],之后的很多研究都表明乳酸菌具有降低血清总胆固醇及低密度胆固醇的功能[4]。然而益生菌降解血清胆固醇的确切机理目前仍不明确。Gilliland等[5]认为在厌氧的条件下,乳酸菌在含有胆盐的高胆固醇培养基中生长时,菌体细胞可以吸收介质中的胆固醇,降低介质中的胆固醇含量。Klaver[6]和Corzo[7]研究表明乳酸菌从培养基中去除胆固醇是因其分泌胆盐水解酶促进甘氨酸钠和牛磺酸钠水解,细菌在动物或人体内通过水解结合型胆盐转变为游离胆酸,进而与胆固醇发生共沉淀作用。随着研究的开展,目前人们越来越倾向于认为,细菌降低胆固醇的作用是由于菌体吸收和胆固醇共沉淀协同作用的观点,而且不同条件下细菌会表现出以某种方式(吸收或共沉淀)为主的能力[8]。此外,研究还发现乳酸菌发酵生成的不可消化短链脂肪酸、胞外多糖、蛋白质等均参与对胆固醇的分解和去除作用[9-10]。上述研究结果充分说明乳酸菌的降胆固醇机制是复杂的,或许还有其它的作用方式存在。
罗伊氏乳杆菌普遍存在于人类和大部分动物的肠道中,是目前已报道的具有降胆固醇能力的乳酸菌之一。研究发现罗伊氏乳杆菌DSM122460在无细胞参与的情况下仍表现出胆固醇移除能力,其无细胞上清发酵液(Cell free supernatant,CFS)的胆固醇移除率可达到69%。通过比较对照组和处理组的胆盐水解酶活性和移除胆固醇能力得出CFS中含有除胆盐水解酶以外的可移除胆固醇的有效成分,经硫酸铵沉淀等方法初步鉴定为蛋白类物质[11]。本文对此有效成分进行了分离纯化,并通过质谱进行初步鉴定。
1 材料与方法
1.1 材料与仪器
罗伊氏乳杆菌DSM122460 台湾大学赠送;邻苯二甲醛 Sigma公司;MRS培养基 德国Merck公司;DEAE Sepharose F.F Ameisham Biosciences 公司;胆固醇、硫酸铵、牛血清白蛋白、考马斯亮蓝G250等其他试剂 国药集团化学试剂有限公司。
Avanti J30I高速冷冻离心机 美国Beckman Coulter公司;CE7250型紫外分光光度计 英国BIO-AQUARIUS公司;真空冷冻干燥机 美国LABCONCO公司;AKTK purifier层析仪 美国GE Healthcare公司;Mini-PROTEAN Tetra垂直电泳仪、Geldoc 2000凝胶成像系统 美国Bio-Rad公司;4800 MALDI-TOF/TOF串联质谱仪 美国Applied Biosystems公司。
1.2 实验方法
1.2.1 菌种活化 罗伊氏乳杆菌DSM122460使用前按1%的接种量接种到MRS肉汤,在37 ℃培养12 h,传代两次进行活化,实验菌株在实验过程中4 ℃冰箱保存。
1.2.2 粗蛋白液的制备 罗伊氏乳杆菌DSM122460菌液按1%接种于2 L MRS培养基中,37 ℃培养24 h,4 ℃,12000×g离心10 min收集上清液,经0.22 μm微滤膜过滤后用截留分子量为30000 ku的膜超滤浓缩至200 mL。
1.2.3 硫酸铵分级沉淀 取200 mL蛋白浓缩液在冰浴条件下缓慢加入研磨好的硫酸铵粉末,依次至30%、40%、50%、60%、70%、80%的饱和度,缓慢搅拌防止泡沫产生。每加完一次硫酸铵后,将上清液于4 ℃冰箱静置3 h,然后离心(10000×g,4 ℃,25 min),收集上清和沉淀,吸取少量上清液测定蛋白质含量。剩余上清液继续加入硫酸铵至下一设定饱和度,静置,离心收集上清和沉淀,如此循环操作。考马斯亮蓝法测定上清液的蛋白含量,沉淀用约两倍体积的磷酸盐缓冲液(50 mmol/L,pH7.0)溶解后,透析,测定胆固醇清除能力。
确定最佳饱和度后,在后续操作中,首先在冰水浴条件下向上清液中加入硫酸铵至饱和度范围的下限,4 ℃冰箱静置过夜,离心(10000×g,4 ℃,25 min),弃去沉淀,量取上清液体积;冰浴条件下向上清液中加入硫酸铵至饱和度上限,4 ℃冰箱静置3 h,离心(10000×g,4 ℃,25 min),收集沉淀,弃去上清液,将沉淀复溶至约2倍体积的磷酸盐缓冲液(50 mmol/L,pH7.0)中,透析除盐。透析后的蛋白样品装入冻干瓶中,经真空冷冻干燥后得到蛋白粉,磷酸盐缓冲液溶解后进行下一步纯化操作。
1.2.4 阴离子交换层析 将DEAE-Sepharose F.F离子交换琼脂糖凝胶沿玻璃棒缓慢加入到型号XK16/20层析柱中,凝胶沉降过夜,确保胶面平整。连接AKTA purifier层析仪,使用Unicorn软件调整流速为0.5 mL/min,最大柱压为0.15 MPa,UV 280 nm进行检测。先用经抽滤脱气的超纯水平衡两个柱体积至仪器基线平直,再用经抽滤脱气的缓冲液(pH7.0,25 mmol/L磷酸盐缓冲液)平衡至仪器基线平直。上样前,样品需经过0.45 μm膜过滤,用注射器将样品注入每次上样量为3mL待样品全部进入层析柱后,用缓冲液洗脱,流速0.5 mL/min,UV 280 nm检测紫外吸收峰,待穿透峰洗脱结束后,以含0.5 mol/L NaCl的平衡缓冲液洗脱蛋白[12]。手动收集样品,当UV 280 nm吸收开始明显升高时开始进行收集,每管5 mL,待UV 280 nm吸收值降低至基线时停止收集。收集产物4 ℃透析除盐后浓缩测定其胆固醇清除能力。
梯度洗脱时,起始缓冲液A为pH7.0,25 mmol/L的磷酸盐缓冲液,洗脱缓冲液B为含1 mol/L NaCl的pH7.0、25 mmol/L的磷酸盐缓冲液,60 min内洗脱8个柱体积后,两种缓冲液按合适比例混合,可得到NaCl浓度在0~0.5 mol/L范围的离子强度梯度。
1.2.5 SDS-PAGE电泳分析 采用不连续垂直板SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行蛋白的纯度和分子量的分析,5%浓缩胶,12%分离胶,以低分子量标准蛋白为标准。模式为恒压模式,电压为110 V;电泳完后,用考马斯亮蓝染色液于室温染色2 h,用脱色液脱色至蛋白条带清晰。通过凝胶成像仪灰度扫描电泳胶板,分析蛋白分布与浓度。
1.2.6 目的蛋白的二级质谱鉴定 将含有目的蛋白的SDS-PAGE胶块切成1 mm3左右的小块,装入离心管中,水洗一次。用脱色缓冲液浸泡15 min。反复三次,直至将颜色脱尽,蒸馏水洗涤1次,将胶块浸入30 μL 100%乙腈中5 min,脱水使胶块变白,然后室温抽干加8 μL胰蛋白酶液(0.005 mg/mL),37 ℃放置16 h左右。将0.3 μL已酶解的样品点到样品板上,室温晾干,上MALDI-TOF/TOF串联质谱仪选用正离子反射模式进行一级质谱解析,选择强度最大的10个峰进行二级质谱,将一级和二级质谱数据整合并使用GPS 3.6(Applied Biosystems)和Mascot 2.1(Matrix Science)对质谱数据进行分析和蛋白鉴定。
1.2.7 胆固醇清除能力的测定 为了防止CFS有效成分纯化过程中胆盐水解酶的干扰,在每一步纯化后进行移除胆固醇能力测定时不再添加牛磺胆酸钠。
取一定量的溶液或冻干粉溶于1 mL pH4.4的醋酸-醋酸钠的缓冲液中,以相同体积的缓冲液作对照,分别加入制备好的卵磷脂-胆固醇胶束,混合均匀,37 ℃反应30 min,利用改良的邻苯二甲醛法[14]测定对照组和样品组胆固醇含量。以1 h内转化1 μg胆固醇所需的物质含量定义为一个活力单位[13]。
式中:K,蛋白液稀释倍数;W,转化胆固醇的量(μg);V,蛋白液液的体积(mL);T,反应时间(h)。
1.2.8 蛋白质浓度的测定 采用考马斯亮蓝G250的方法,并计算比活力。
2 结果与讨论
2.1 粗蛋白液的浓缩
在分别研究罗伊氏乳杆菌DSM122460的CFS和细胞裂解物移除胆固醇能力后,结果显示罗伊氏乳杆菌DSM122460的CFS具有相当高的胆固醇移除能力,细胞裂解物基本无移除能力,表明参与移除胆固醇的物质主要位于CFS[11]。经蛋白浓度测定实验,CFS中蛋白含量偏低,蛋白浓度只有40 μg/mL左右,不利于进一步蛋白的分离和纯化。因此,CFS经超滤浓缩至十分之一体积的浓缩液作为粗蛋白液的来源。
2.2 硫酸铵浓度的确定
如图1所示,随着硫酸铵浓度的增加,发酵上清液中的蛋白浓度随着硫酸铵加入量的增加而逐渐减少,硫酸铵饱和度为30%时上清液中蛋白浓度为31.2 μg/mL时,硫酸铵达到80%时上清液中蛋白浓度减低到10.8 μg/mL。不同饱和度沉淀得到的蛋白经过盐析脱盐后,测得其去除胆固醇的能力。研究表明硫酸铵饱和度为30%、40%、50%和80%时沉淀出的蛋白没有移除胆固醇的能力;饱和度为60%时,活力为8.4 U/mL,饱和度为70%时,活力为14.8 U/mL,胆固醇清除除能力最高。因此选用50%~70%硫酸铵饱和度纯化该蛋白。

图1 硫酸铵饱和度与降胆固醇能力的关系曲线Fig.1 The relationship between saturated ammonium sulfate solution and the cholesterol reduction ability
2.3 阴离子交换层析
罗伊氏乳杆菌DSM122460在pH为4.0的情况下胆固醇移除率最高,随着pH的升高,移除率下降,推断此蛋白的等电点在pH7.0以下[11]。因此选用阴离子交换剂(DEAE-Sepharose F.F)进行实验[15]。
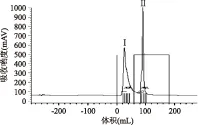
图2 pH7.0,NaCl浓度为0.5 mol/L时目的蛋白在DEAE-Sepharose F.F层析图谱Fig.2 Chromatography of the active substance on a DEAE-Sepharose F.F column at pH7.0 and 0.5 mol/L NaCl
从图2可以看出,进样后得到一个蛋白峰Ⅰ,经过0.5 mol/L NaCl-25 mmol/L磷酸盐缓冲液洗脱后得到洗脱峰Ⅱ,经活力测定,峰Ⅱ具有降胆固醇能力。蛋白电泳结果表明(图4),峰Ⅱ中含有多种蛋白。可能由于离子浓度太强,几种蛋白同时洗脱下来。采用起始缓冲液A(pH7.0,25 mmol/LPBS)与洗脱缓冲液B(pH7.0、25 mmol/LPBS,1 mol/L NaCl)进行线性梯度洗脱,经过60 min缓冲液B从0达到100%,峰II被洗脱开,得到3个洗脱峰,分离效果较好,结果如图3所示。经活力测定,NaCl浓度约为0.25 mol/L时洗脱出的峰Ⅱ-3具有降胆固醇能力,收集该组分,冻干备用。

图3 pH7.0、采用线性梯度洗脱(NaCl浓度0~0.5 mol/L)时目的蛋白在DEAE-Sepharose F.F层析图谱Fig.3 Chromatography of the active substance on a DEAE-Sepharose F.F column at pH7.0 with linear gradient elution of NaCl(0~0.5 mol/L)
由表1中可得,粗蛋白液成分较复杂,比活力较低;经超滤浓缩和硫酸铵沉淀后,对目的蛋白进行了富集,其比活力达到29.4 U/mg;再通过阴离子交换层析进行分离,采用线性梯度洗脱方式,比活力达到了61.6 U/mg,纯化倍数为32.4。

表1 降胆固醇相关蛋白的分离纯化结果
2.4 SDS-PAGE蛋白电泳分析
将纯化过程中硫酸铵分级沉淀、两次阴离子交换层析收集的样品用分离胶浓度12%的SDS-PAGE分析,选择低分子量的标准蛋白作为分子量标准(图4)。电泳结果表明,经过上述纯化步骤后得到目的蛋白的单一条带,达到电泳纯,结合Marker分析,此蛋白的分子质量约为60 ku。

图4 分离纯化各组分的SDS-PAGE分析Fig.4 SDS-PAGE of samplesfrom different steps of purification注:M.Marker,1.硫酸铵分级沉淀,2.阴离子层析(0.5 mol/L NaCl洗脱),3. 峰Ⅱ-3,阴离子层析(0.1~0.5 mol/L NaCl梯度洗脱)。
2.5 目的蛋白的质谱鉴定
对图4泳道3中的蛋白条带挖点后进行酶切,然后将其进行串联质谱(MALDITOF/TOF)分析,并利用Mascot搜索引擎将数据在蛋白质数据库(NCBInr)中检索。利用数据库检索对目的蛋白进行检索后得到Mascot Score图(图5)。结果表明,目的蛋白与检索结果的匹配分数达到108分,远远高于其阈值分数65分,说明两者匹配上的概率是显著的(p<0.05)。检索结果显示其分子量为60802,和样品SDS-PAGE电泳显示结果接近。肽段比对到的蛋白质为:hypothetical protein[Lactobacillus reuteri],NCBI数据库中登录号No.gi|:489764699。氨基酸覆盖率为12%(图6),已用粗体标明。目前对于该蛋白的研究还较少,通过保守结构域分析,该蛋白含有由63个氨基酸组成的含有三段重复区域糖苷结合位点,其中短的重组区域可能与胆碱的结合有关。

图5 目的水解后肽段的序列检索Mascot score图Fig.5 Mascot score histogram of peptides from the digestion of the target protein searching in the database

图6 质谱分析中与比对蛋白匹配的肽段序列Fig.6 Matched peptides identified by mass spectrometry with the target protein
与降胆固醇有关的蛋白主要包括胆盐水解酶和胆固醇氧化酶。自从发现乳酸菌在肠道中可使结合胆盐分解为游离胆盐以来,胆盐水解酶被认为在乳酸菌移除胆固醇方面起着关键作用。胆盐水解酶将结合胆盐水解为游离胆盐后,游离胆盐需要在酸性条件下(pH<6.0)才能和胆固醇发生共沉淀作用,从而起到移除胆固醇的能力[16]。通过前面的研究已经表明,CFS中除了胆盐水解酶以外还含有可移除胆固醇的有效成分[11]。另一和胆固醇降解代谢相关的酶是胆固醇氧化酶,它在氧气的参与下,可将胆固醇转化成胆甾-4-烯-3-酮。然而,目前还未有乳酸菌产胆固醇氧化酶的报道[17]。除此以外,于平[18]等人也发现植物乳杆菌在生长过程中产生了特殊的酶系,从而将胆固醇降解成其他物质,导致其含量降低,然而具体酶的种类并未说明。韩国Kim等在嗜酸乳杆菌ATCC43121的CFS中也发现了与降低胆固醇有关的蛋白,其分子量为12 ku[13]。本研究中发现的与降胆固醇有关的蛋白为一假设蛋白,其功能尚需进一步研究。
3 结论
罗伊氏乳杆菌DSM122460的CFS通过超滤装置得到浓缩液,硫酸铵分级沉淀的饱和度范围为50%~70%,胆固醇移除能力最高;样品采用DEAE Sepharose F.F阴离子交换层析进一步分离纯化,当pH为7.0,采用含0.1~0.5 mol/L NaCl的磷酸盐缓冲液进行梯度洗脱时,分离效果较好,得到了电泳纯的目的蛋白,纯化倍数为32.4;经SDS-PAGE分析,其分子量约为60 ku,通过质谱鉴定初步认定该活性蛋白为一假设蛋白,其功能尚待进一步研究。
[1]于守洋. 中国保健食品的进展[M]. 北京:人民卫生出版社,2001:1-213
[2]Manson J E,Tosteson H,Ridker P M,et al. The primary prevention of myocardial infarction[J]. N Engl J Med,1992,326(21):1406-1416.
[3]Mann G V. Studies of a surfactant and cholesteremia in Maasai[J]. Am J Clin Nutr,1974,27(5):464-469.
[4]Martinez R C,Bedani R,Saad S M. Scientific evidence for health effects attributed to the consumption of probiotics and prebiotics:an update for current perspectives and future challenges[J]. Br J Nutr,2015,114(12):1993-2015.
[5]Gilliland S E,Nelson C R,Maxwell C. Assimilation of cholesterol by Lactobacillus acidophilus[J]. Appl Environ Microbiol,1985,49(2):377-381.
[6]Klaver F A,Van Der Meer R. The assumed assimilation of cholesterol by Lactobacilli and Bifidobacterium bifidum is due to their bile salt-deconjugating activity[J]. Appl Environ Microbiol,1993,59(4):1120-1124.
[7]Corzo G,Gilliland S E. Measurement of bile salt hydrolase activity from Lactobacillus acidophilus based on disappearance of conjugated bile salts[J]. J Dairy Sci,1999,82(3):466-471.
[8]Tsai C C,Lin P P,Shieh Y M,et al. Cholesterol-lowering potentials of lactic acid bacteria based on bile-salt hydrolase activity and effect of potent strains on cholesterol metabolisminvitroandinvivo[J]. Scientific World J,2014,2014:690-752.
[9]Pereira D I,Gibson G R. Effects of consumption of probiotics and prebiotics on serum lipid levels in humans[J]. Crit Rev Biochem Mol Biol,2002,37(4):259-281.
[10]Lindstrom C,Holst O,Nilsson L,et al. Effects of Pediococcus parvulus 2.6 and its exopolysaccharide on plasma cholesterol levels and inflammatory markers in mice[J]. AMB Express,2012,2(1):66.
[11]于瑞莉,郭本恒,张灏,等. 罗氏乳杆菌无细胞上清培养液移除胆固醇能力的研究[J]. 天然产物研究与开发,2012(1):89-93.
[12]Panthi S,Choi Y S,Choi Y H,et al. Biochemical and Thermodynamic Characterization of a Novel,Low Molecular Weight Xylanase from Bacillus Methylotrophicus CSB40 Isolated from Traditional Korean Food[J]. Appl Biochem Biotechnol,2016,179(1):126-142.
[13]Kim Y,Jin Y W,Whang K Y. Characterization of the Cholesterol-Reducing Activity in a Cell-Free Supernatant of Lactobacillus acidophilus ATCC 43121[J]. Biosci Biotech Biochem,2008,72(6):1483-1490.
[14]Rudel L L,Morris M D. Determination of cholesterol using o-phthalaldehyde[J]. J Lipid Res,1973,14(3):364-366.
[15]田亚平. 生化分离技术[M]. 化学工业出版社,2006:235-292.
[16]Jones M L,Tomaro-Duchesneau C,Martoni C J,et al. Cholesterol lowering with bile salt hydrolase-active probiotic bacteria,mechanism of action,clinical evidence,and future direction for heart health applications[J]. Expert Opin Biol Ther,2013,13(5):631-642.
[17]张玲,杨海麟,孙燕,等. 微生物胆固醇氧化酶的研究进展[J]. 食品科学,2009,30(9):225-229.
[18]于平,孙海森,励建荣,等. 植物乳杆菌LpT1和LpT2体外降胆固醇机制[J]. 微生物学报,2011,51(4):561-565.
Isolation,purification and identification of protein with cholesterol- reducing activity from the supernatant ofLactobacillusreuteri
CHEN Chen1,*,YU Rui-li2
(1.School of Perfume and Aroma Technology,Shanghai Institute of Technology,Shanghai 201418,China; 2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The cell-free supernatant(CFS)ofLactobacillusreuteriDSM122460 exhibited the cholesterol removal ability and the effective components were predicted as proteins. The active component was purified by ultrafiltration,ammonium sulfate precipitation,and DEAE-Sepharose F.F anion exchange chromatography. The specific activity of purified component was 61.6 U/mg with a purification factor of 32.4. The purified protein was electrophoresis pure determined by SDS-PAGE,and the estimated molecular weight was about 60 ku. The active protein was identified as a hypothetical protein by mass spectrometry and its function remains to be further studied.
Lactobacillusreuteri;cell-free supernatant(CFS);cholesterol reduction;purification;hypothetical protein
2016-05-24
陈臣(1982-),男,博士,讲师,研究方向:食品生物技术,E-mail:chenchen@sit.edu.cn。
国家自然科学基金(31501451)。
TS201.3
A
1002-0306(2016)22-0200-05
10.13386/j.issn1002-0306.2016.22.031

