茶叶中键合态香气前驱物的利用
龙丹,刘晓辉*,吴函殷,刘盼盼,罗龙新
1(深圳市深宝实业股份有限公司,广东 深圳,518040) 2(深圳市深宝华城科技有限公司,广东 深圳,518115)
茶叶中键合态香气前驱物的利用
龙丹1,刘晓辉1*,吴函殷2,刘盼盼2,罗龙新1
1(深圳市深宝实业股份有限公司,广东 深圳,518040) 2(深圳市深宝华城科技有限公司,广东 深圳,518115)
基础研究表明,茶叶中的香气物质绝大部分是以键合态的糖苷类香气前体存在,难以被开发利用。为了有效将对香气贡献极微的前体物质有效转化为可挥发性香气物质,该文采用正交试验优化酸解时间、酸解温度、酸解pH值、提香酶添加量和酶解时间等因素。研究结果表明,对挥发性香气物质总量影响因素从强到弱依次为:酸解时间、酶解时间、酶用量、酸解温度、酸解pH值。获得最多量的茶叶挥发性香气总量的最优参数为:在温度为60 ℃、pH=3.0条件下酸解0.5 h,随后添加质量分数0.5%的提香酶在45 ℃中处理0.5 h。对比空白组,处理组的挥发性香气总量提升89%,其中萜烯醇类糖苷物质提升11.1倍。
茶叶;键合态香气前驱物;酸解;酶解;正交设计
香气是决定茶叶品质的重要因子之一,在茶树生长过程中,所形成的香气物质一部分呈游离态的芳香性挥发物,但绝大部分是以键合态的香气前体形式存在[1]。键合态香气前体多以糖苷类为主,其糖基部分主要是β-D-葡萄糖、β-樱草糖、β-巢菜糖,配基部分(即苷元)主要是萜烯醇类、芳香醇类和脂肪醇类。其中,芳樟醇、苯乙醇、苯甲醇等萜烯醇类化合物是具有典型花香和果香的物质[2](如图1)。糖苷类键合态物质本身无味,但在采摘、水分亏缺、叶片损伤等胁迫环境下,或者是萎凋、揉捻、做青等加工过程中,易水解释放出苷元(即香气物质),从而构成了茶叶香气品质的物质基础[3]。多篇文献陆续确定了茶叶中多种挥发性香气组分中的呈香成分及其与糖苷类香气前体的密切关系[4]。
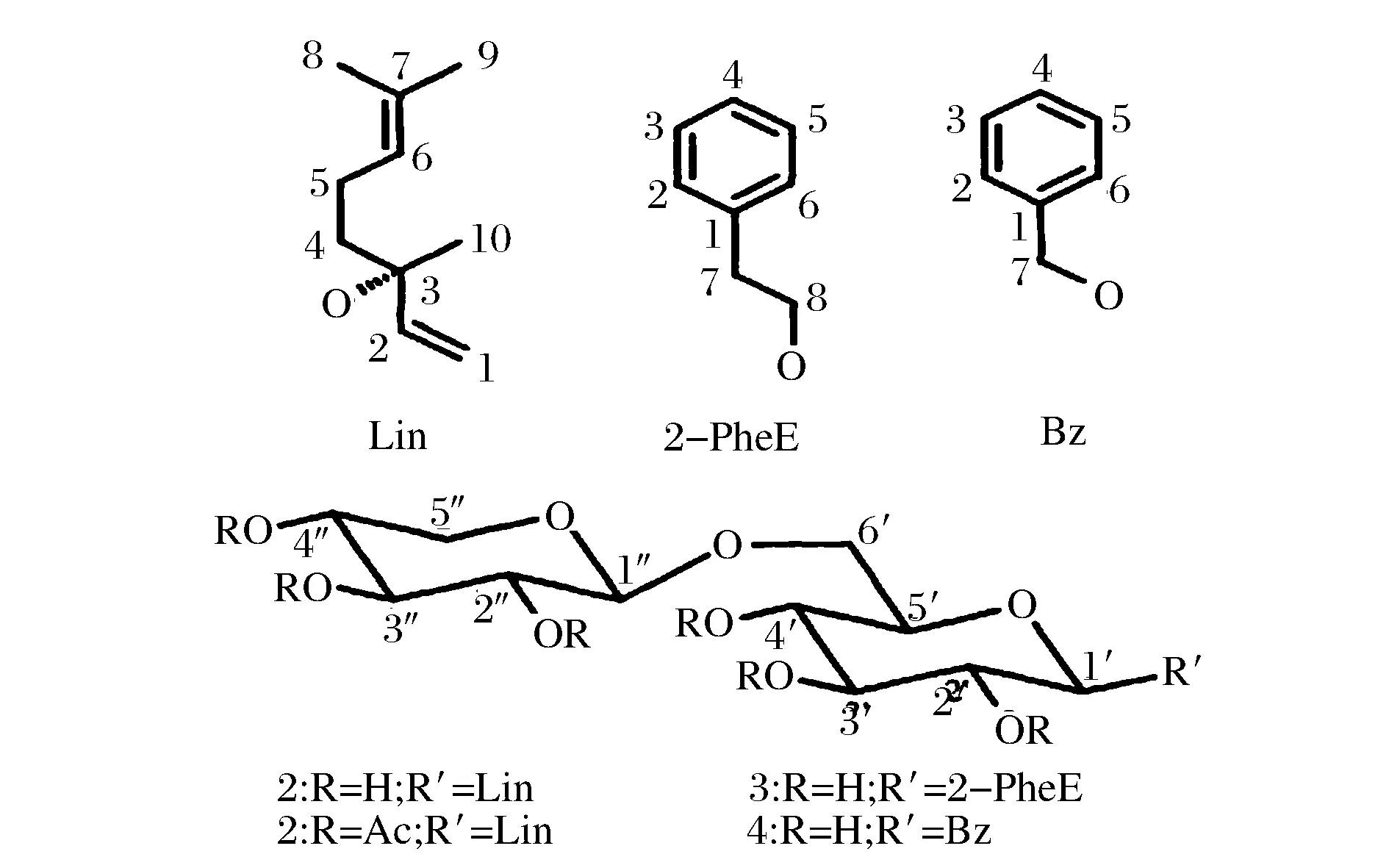
图1 乌龙茶中分离得到的芳樟醇、苯甲醇、苯乙醇结构Fig.1 Structures of (S)-Linalyl, 2-Phenylethyl, and Benzyl DisaccharideGlycosides Isolated fromOolong Tea Leaves
在茶叶深加工领域,香气寡淡是速溶茶产品普遍存在的瓶颈问题。如何将茶叶中键合态香气前体物质转化为游离态挥发性香气物质加以利用一直备受关注。目前,主要技术手段有超高压法、酶解法、酸解法。超高压法依赖于高压设备,一次性投入较大,一直以来仅停留于实验室阶段。相比之下,酶解法和酸解法的原辅料成本较低,对加工设备无特殊要求,增香效果明显且操作简便,是茶叶深加工中优先考虑的方法。现有文献多集中在使用酶解法增加茶叶香气,添加酶制剂种类较多且酶解耗时较长,而利用“先酸解”快速释放香气,结合“后酶解”塑造香型,实现高效短时的增香方法基本未曾涉及。本文运用单因素实验和正交实验,试从酸解结合酶解共同释香的角度,重点阐述其对茶叶香气的改善。
1 材料与方法
1.1 材料与试剂
炒青绿茶由浙江泰龙制茶有限公司提供;提香酶由天野阿玛诺公司提供。试剂:柠檬酸、癸酸乙酯。
1.2 仪器与设备
SHZ-B水浴恒温振荡器,上海博讯实验有限公司医疗设备厂;R201D旋转蒸发仪,巩义市予华仪器有限责任公司;Abbemat 300折光仪,Anton Paar;GC-MS(GC:7890A,MS:5977A),安捷伦科技有限公司。手动SPME进样器、50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydime thylsiloxane, DVB/ CAR / PDMS)萃取头,美国Supelco公司。
1.3 方法
1.3.1 酸解处理
在酸解单因素试验中,首先以80~90 ℃热水按1∶15茶水比冲泡茶叶,随后分别按照不同pH值(pH=2.5、3.0、3.5、4.0、4.5;80 ℃下酸解1 h)、不同温度(50、60、70、80 ℃;pH=4.0酸解1 h)、不同时间(1、3 h;80 ℃下pH=4.0),在水浴恒温环境中进行酸解处理。处理结束后,进行汤渣分离,收集茶汤待香气检测。
1.3. 2 酶解处理
在酶解试验中,首先以80~90 ℃热水按1∶15茶水比冲泡茶叶,随后冷却至40~50 ℃,用柠檬酸调节茶汤pH=4.5(酶解最适pH值),按占茶叶重量0.3%添加提香酶制剂,在45 ℃水浴恒温环境中酶解处理1 h。处理结束后,进行汤渣分离,收集茶汤待香气检测。
1.3.3 酸解酶解正交设计
在单因素试验的基础上,采用L16(45)正交试验设计,因素水平随机编号如表1所示。
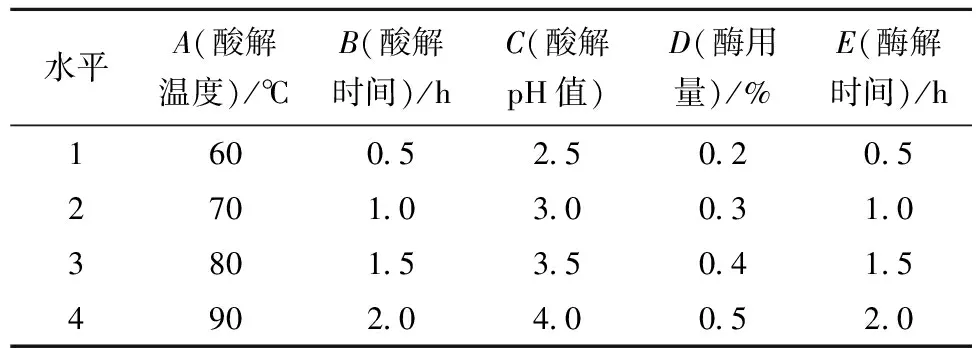
表1 正交试验因素水平表
1.3.4 香气成分检测方法
采用顶空固相微萃取-气相色谱质谱联用法(HS-SPME/GC-MS),添加癸酸乙酯为内标辅助定量分析。将茶汤稀释至统一浓度(brix=0.5%),取30 mL茶汤于60 mL顶空瓶中,加入6 g NaCl及已知量的癸酸乙酯后,立即放入50 ℃水浴锅中平衡10 min,随后推出SPME萃取头吸附40 min,随即插入GC仪进样口解吸附3 min,同时收集数据。
GC条件:HB-5MS弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);进样口温度240 ℃;载气为高纯氦气;流速1.0 mL/min。升温程序:50 ℃保持5 min,以3 ℃/min升至180 ℃保持2 min,然后以10 ℃/min升至250 ℃保持3 min。
MS条件:电子电离源:电子能量70 eV;质量扫描范围50~450 u;离子源温度230 ℃;四级杆温度150 ℃;质谱传输线温度280 ℃。
2 结果与讨论
2.1 酸解
据文献报道[5-7],稀酸处理能有效催化水解植物细胞内糖苷类物质的糖苷键(缩醛结构),使之生成相应的糖和配基(呈香物质)。前期预试验发现:酸解反应释放茶香的效果是与酸解时间、酸解pH值、酸解温度3个因素密切相关。
2.1.1 酸解不同时间后茶叶释放香气情况
如图2、表2所示,在pH=4,水浴80 ℃的环境下,酸处理茶叶1 h后的香气物质总量由对照组的21.8 μg/L增至91.1 μg/L,酸处理3 h后增至93.1 μg/L,提高近3倍。从香气组分上分析,醇类物质经由酸处理后增长近8倍,是拉动香气总量上升的主要物质,其中,以芳樟醇、香叶醇为代表性萜烯醇类苷元,在酸解1 h后含量分别增加11倍和3.8倍;以苯甲醇为代表的芳香族醇类苷元在酸处理1 h后被释放。从香气的感官审评上看,对照组以清香为主,酸处理20 min后熟栗香明显,40 min后熟栗香伴随水果香,60 min后水果香浓郁。随着酸处理时间的延长,香气的馥郁程度随之升高,香型由“清香型”向“花果香型”转变,是酸水解糖苷释放呈香苷元的又一证明。
从酸解时间对挥发性香气的影响看,由1 h延长至3 h在香气总量和组分上没有显著差别,说明酸解法能在1 h内极大程度地水解释放出大部分的香气物质。
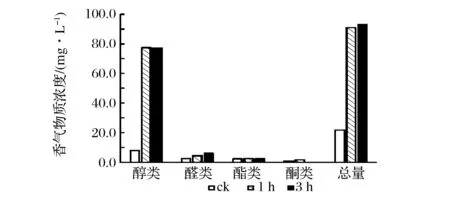
图2 酸解不同时间对香气组分的影响Fig.2 The effect of acidhydrolysisduration on aroma constituents

表2 酸解不同时间对香气组分的影响
2.1.2 不同温度下酸解茶叶释放香气情况
如图3所示,在50~70 ℃范围内,挥发性香气物质总量随酸处理温度上升而上升,80 ℃条件下香气总量较70 ℃略有下降,可能与高温加速香气物质挥发逸散和热劣变有关。从香气组分上看,无论在何种温度下酸处理,所得茶汤挥发性成分含量由高到低依次为:醇类、醛类、酮类、酯类。随着酸处理温度的上升,醇类物质进一步升高,主要包括(含量由高到低):芳樟醇、萜品醇、香叶醇、α-雪松醇。当酸解温度升高至时70 ℃,出现反-氧化芳樟醇、脱氢芳樟醇、萜烯醇等新增香气物质,其中前两者是芳樟醇的氧化或还原产物,也呈类似花果香型,增量较为迅速。
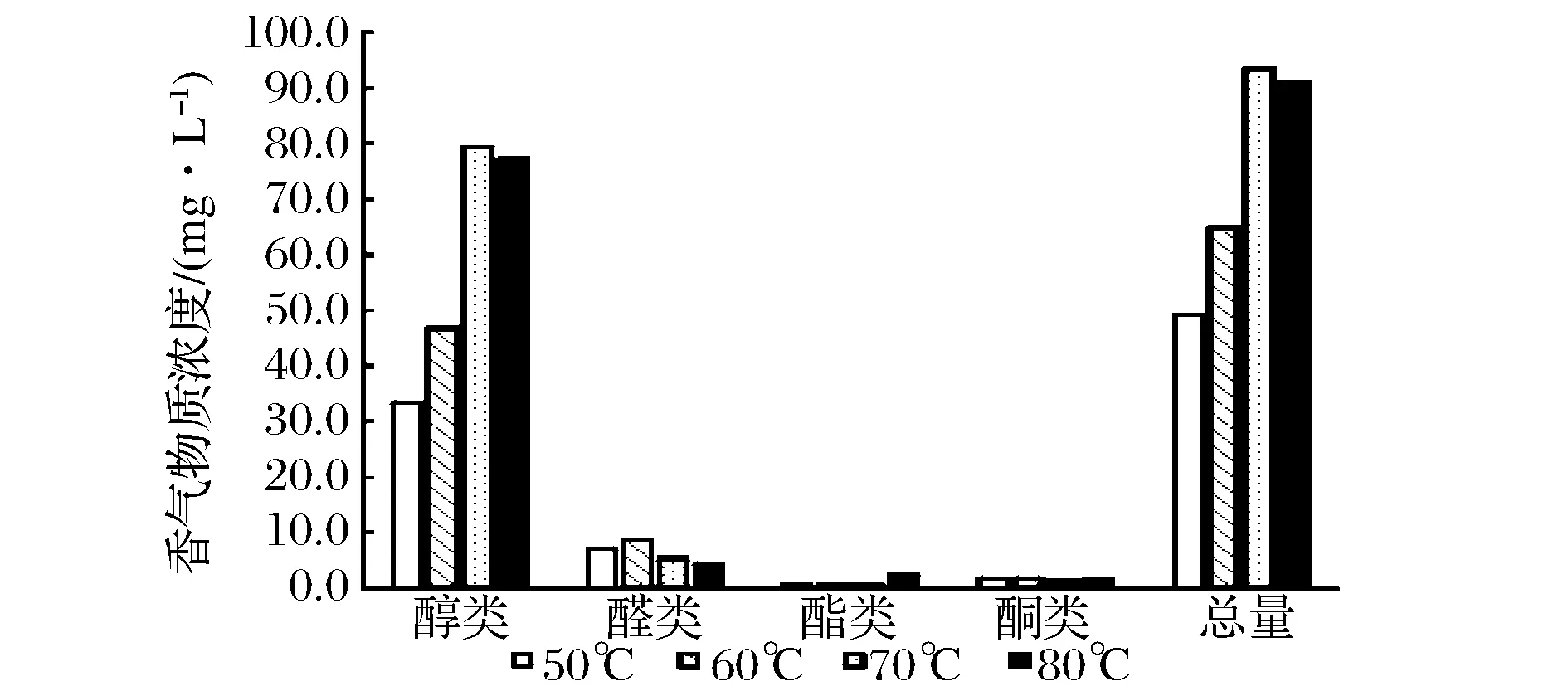
图3 不同温度下对香气组分的影响Fig.3 The effect of different temperatures on aroma constituents
2.1.3 不同pH下酸解茶叶释放香气情况
图4表明,茶叶在pH=3.0的酸解条件下,挥发性香气物质总量最高,其中醇类物质提高较为显著,当pH上升至3.5时基本没有起到酸解释香的作用。与此类似的是,水果中的键合态香气物质在不同pH值调节条件下酸解释香程度也存在显著差异[8-9]。在温和的酸性环境中,葡萄、树莓、烟草等植物材料中的部分键合态香气物质会自发地进行缓慢水解进而逐步释放香气物质,随着人为降低酸解环境的pH值,键合态香气物质的种类急剧增多,在pH值极低的剧烈酸性环境中甚至能够发生化学变化而生成新物质,如萜烯类物质的分子重排等[10]。
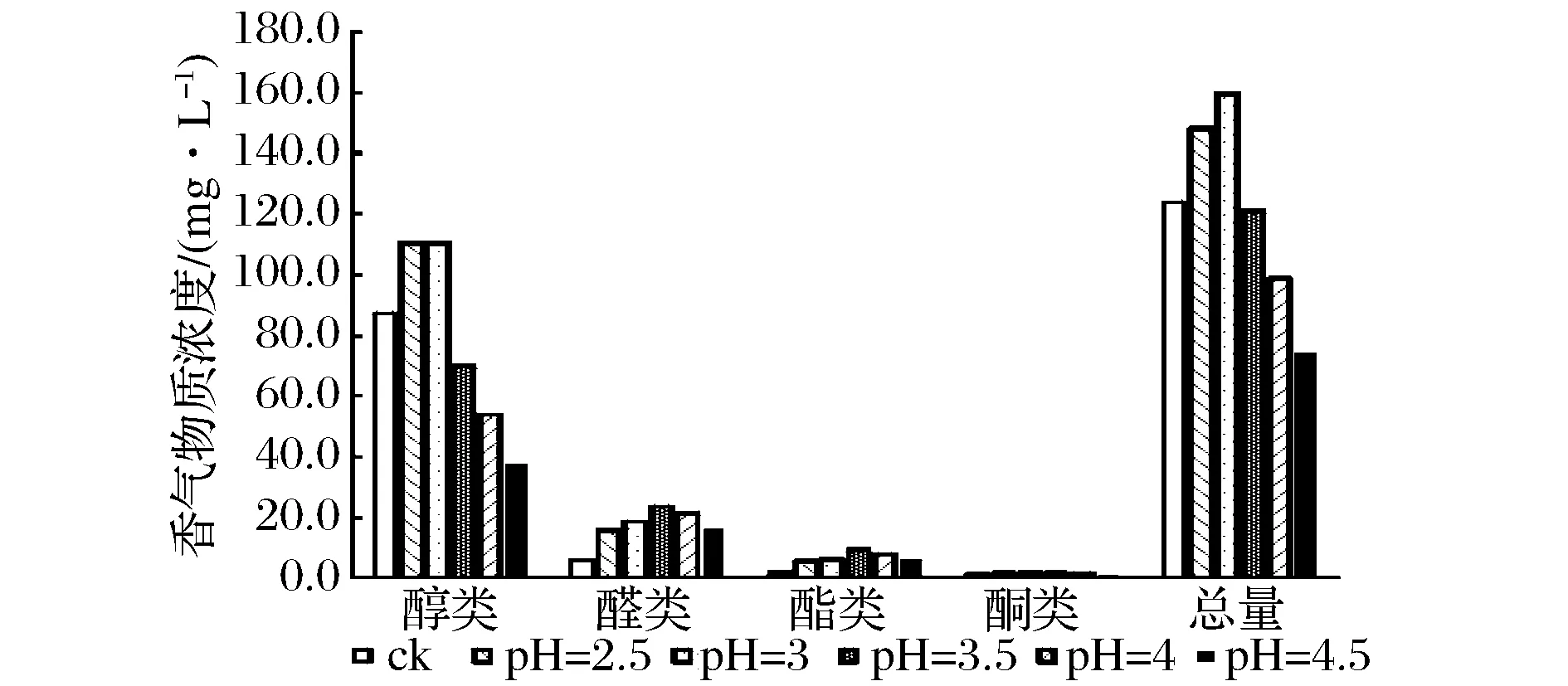
图4 不同pH环境对香气组分的影响Fig.4 The effect of different pH on aroma constituents
2.2 酶解
如图5所示,提香酶处理后挥发性香气总量在原有基础上提升60.29%,特别有助于醇类、醛类和酯类香气物质的释放。
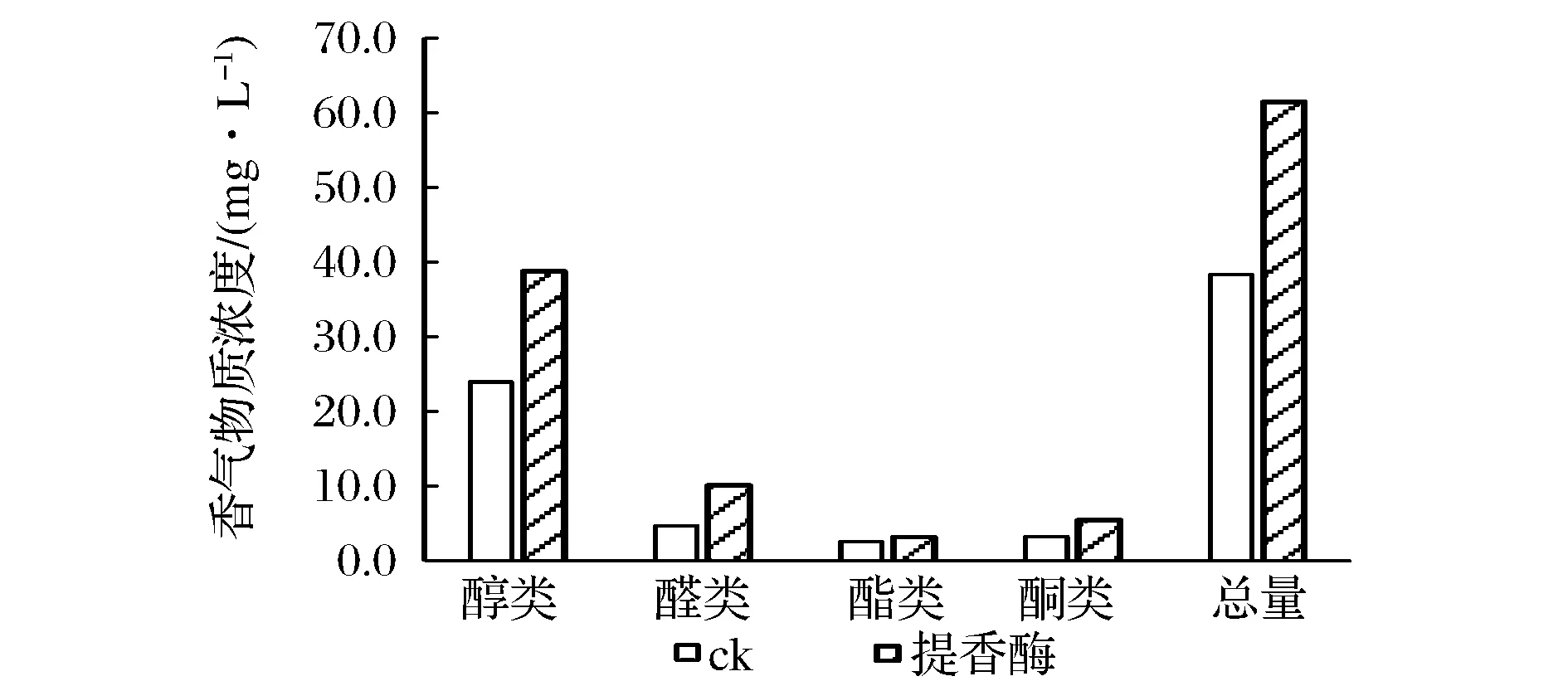
图5 提香酶对香气组分的影响Fig.5 The effect of flavoring enzyme on aroma constituents
2.3 酸解结合酶解正交试验
由表3得知,对茶叶挥发性香气物质总量影响因素强弱依次为:B(酸解时间)>E(酶解时间)>D(酶用量)>A(酸解温度)>C(酸解pH值)。在所选因素水平范围内,理论上最佳提香工艺为A1B1C2D4E1,即在温度为60 ℃、pH=3.0下酸解0.5 h,随后在45 ℃下添加0.5%提香酶1酶解0.5 h,得到茶叶挥发性香气物质总量最大。

表3 正交试验处理结果
经由最佳提香工艺(A1B1C2D4E1)处理后,茶汤呈显浓郁的水果香。如表4所示,处理组香气总量较对照提升89%,其中醇类芳香物质,特别是萜烯醇类香气物质在酸解酶解复合工艺下得以有效释放,提升11.1倍。在这一过程中,不仅具有花果香气的芳樟醇(增长32倍)、α-萜品醇(增长21倍)、香叶醇(增长6.9倍)增量显著,而且新增了具有典型绿茶清香的“反-3-己烯醇”以及具有花果香的橙花叔醇、橙花醇、苯甲醇等芳香物质。
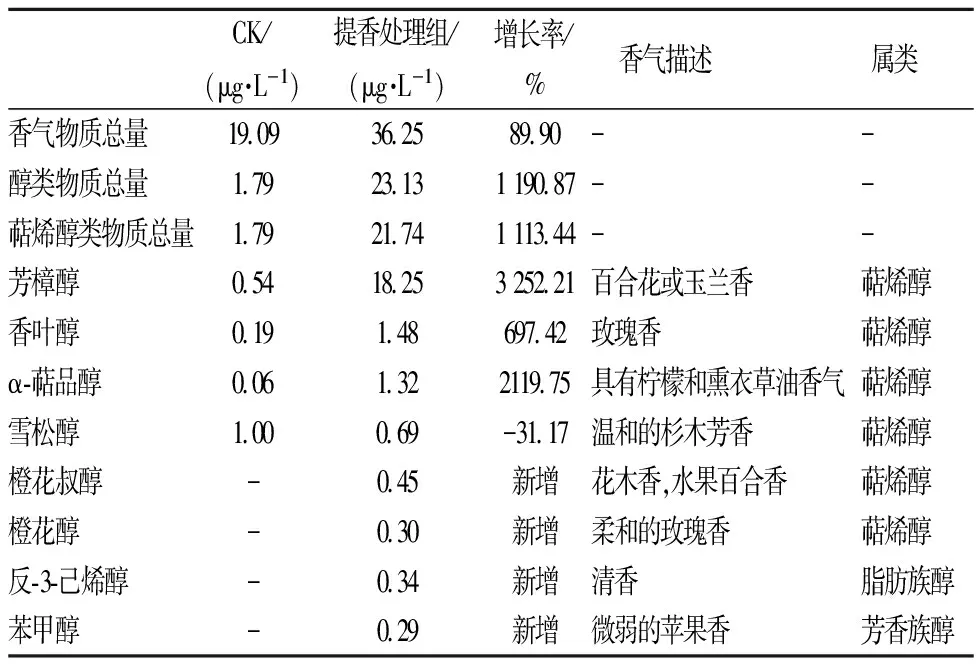
表4 醇类香气物质释放
3 讨论
自1969 年FRANCIS[11]从玫瑰花瓣中分离得到糖苷形式的单萜醇以来,糖苷类键合态香气物质的相关研究开始进入人们的视野。目前,已从茶叶中鉴定出二十多种糖苷类香气前体[12-13],主要是以芳樟醇及其氧化物、香叶醇、橙花醇、苯甲醛、苯甲醇、苯乙醇和水杨酸甲酯等为配基的糖苷, 上述糖苷水解释放后, 配基成为游离态茶叶香气成分, 是高档茶叶呈现花、果香的重要物质基础, 能显著提速溶茶制品的香气品质[14-15]。
在传统茶类的加工过程中,不同的工艺流程会不同程度地释放糖苷类物质[16],但绝大部分糖苷类物质依然保留在叶底中,难以得到有效释放和利用。现阶段,促使茶叶糖苷类键合态香气物质释放游离态香气物质的常用方法主要有酸解法[6]或酶解法[17]。从原理上看,糖苷键属于缩醛键,能被酸催化水解,生成相应的糖和配基物质(香气物质),向茶叶中添加外源酸会加速这一转化过程,是一种简单可行的水解方式。而酶解法水解糖苷时,糖基部分变为活性较高的半椅式构象,糖苷键上的氧原子从酶分子上获得质子(H),并以ROH的形式脱落,游离成为香气物质[18]。从反应的特点看,酸解法反应条件较为剧烈,且对底物不具有选择性,能短时间内彻底打开糖苷键,释放大量香气物质,增加速溶茶制品的香气的浓度。酶解法反应条件较为温和,产物种类较为丰富,香型较为愉悦。2种方法结合的优势在于,一方面,酸解法能在短时间内大大增加香气的浓度和馥郁程度,在此基础之上,继续酶解茶叶,能丰富茶叶香气物质的种类,有利于香型的塑造;另一方面,酸解处理后茶叶组织软化破碎,有利于下一步酶解的进行。
本文以炒青绿茶作为原料,以挥发性香气物质总量为指标,在单因素实验中,酸解的最适 pH=3,温度为70 ℃、时间为1 h。在酸解结合酶解的正交实验中,得到最佳提香工艺参数为:茶叶在60 ℃水浴、pH=3.0下酸解0.5 h,随后在45 ℃下添加0.5%提香酶酶解0.5 h,得到挥发性香气物质总量在空白的基础上提升89%,萜烯醇类糖苷物质在酸解酶解复合工艺下得以有效释放,提升11.1倍。上述因素对指标影响强弱依次为:B(酸解时间)>E(酶解时间)>D(酶用量)>A(酸解温度)>C(酸解pH值)。实验证明,利用”酸解酶解”串联反应,能有效水解糖苷态前体物质,从而提高速溶茶制品香气物质总量,显著丰富香气组分及改善绿茶香型,且所用辅料(柠檬酸、单一酶制剂)成本较低,处理温度较低(60 ℃以下),处理时间较短(约1 h),整个工艺流程操作较简单,具有一定的应用价值。
[1] 王华夫,游小清. 祁门红茶单萜烯醇形态转变的研究[J]. 中国茶叶, 1996(6): 22-23.
[2] GUO W, HOSOI R, SAKATA K, et al. (S)-linalyl, 2-phenylethyl, and benzyl disaccharide glycosides isolated as aroma precursors from oolong tea leaves[J]. Bioscience Biotechnology & Biochemistry, 1994, 58(8):1 532-1 534.
[3] 袁海波, 尹军峰, 叶国柱, 等. 茶叶香型及特征物质研究进展[J]. 中国茶叶, 2009, 31(8): 14-15.
[4] 郑得林, 谭俊峰, 林智. 茶叶中糖苷类香气前体的研究进展[J]. 热带作物学报, 2012, 33(9):1 708-1 713.
[5] 张正竹, 宛晓春, 夏涛. 天然高香液体茶的加工技术[J]. 食品与发酵工业, 2004, 30(11):106-109.
[6] 任婧楠, 荣茂, 彭勋,等. 树莓汁中键合态香气物质的酸解[J]. 食品科学, 2013, 34(13):101-104.
[7] 周志, 范刚, 王可兴,等. 微波辅助酸解释放刺梨汁键合态香气物质的效果[J]. 食品科学, 2012,33(8):99-103.
[8] BOULANGER R,CHASSAGNE D, CROUZET J. Free and bound flavour components of amazonian fruits. 1: Bacuri[J]. Flavour& Fragrance Journal, 1999, 14(5):303-311.
[9] 范刚. 柑橘及其加工制品中游离态和键合态挥发性物质的研究[D]. 武汉:华中农业大学, 2010: 39-48.
[10] CAI J, LIU B, LING P, et al. Analysis of free and bound volatiles by gas chromatography and gas chromatography-mass spectrometry in uncased and cased tobaccos[J]. Journal of Chromatography A, 2002, 947(2): 267-275.
[11] FRANCIS M J O,ALLCOCK C. Geraniol β-d-glucoside; occurrence and synthesis in rose flowers[J]. Phytochemistry, 1969, 8(8): 1 339-1 347.
[12] 朱圣洁. 茶叶主要糖苷类香气前体物质的色谱—质谱联用分析研究及初步分离[D]. 合肥:安徽农业大学, 2013, 8-15.
[13] 张正竹, 宛晓春, 陶冠军. 茶鲜叶中糖苷类香气前体的液质联用分析[J]. 茶叶科学, 2005, 25(4): 275-281.
[14] 张正竹, 宛晓春, 施兆鹏,等. 鲜茶叶摊放过程中呼吸速率、β-葡萄糖苷酶活性、游离态香气和糖苷类香气前体含量的变化[J]. 植物生理学报, 2003, 39(2):134-136.
[15] 张正竹, 宛晓春, 施兆鹏,等. 茶鲜叶在不同季节及绿茶加工贮藏过程中糖苷类香气前体含量变化研究[J]. 食品与发酵工业, 2003,29(3):1-4.
[16] 魏志文, 李大祥, 张华艳,等. 红绿茶加工工艺对茶鲜叶香气和糖苷类香气前体的影响[J]. 中国农学通报, 2007, 23(11): 109-112.
[17] 孙其富, 梁月荣, 陆建良. β-葡萄糖苷酶对绿茶汤香气的影响[J]. 茶叶, 2008, 33(4): 211-213.
[18] 孙爱东, 葛毅强, 阎红,等. 甜橙键合态芳香组分的酶(酸)解解离方法研究[J]. 食品与发酵工业, 2001,27(3): 33-36.
The utilization of bound aroma precursors in tea
LONG Dan1, LIU Xiao-hui1*, WU Han-yin2, LIU Pan-pan2, LUO Long-xin1
1(Shenzhen Shenbao Industrial Co. Ltd., Shenzhen 518040, China) 2(Shenzhen Shenbao Huacheng Tech. Co. Ltd., Shenzhen 518115,China)
Most of the tea aroma substances are bound glycosidic precursors that are difficult to be utilized. To transform unscented aroma precursors into volatile aroma substances, we optimized parameters such as the time, pH, temperature of acid hydrolysis and the time, addition of enzyme hydrolysis by orthogonal array design. Our study found that the factors influencing on total volatile aroma substances were as follows in order of strong to weak: acid hydrolysis time, enzyme hydrolysis time, enzyme addition amount, acid hydrolysis temperature and acid hydrolysis pH. For obtaining most of total tea aroma substances, the optimal treatments were 30 min infusion at 60 ℃ and pH=3.0, and then 30 min enzymolysis with 0.5% (w/w) flavor-enhancing enzyme at 45 ℃. Compared to that of the control sample, the volatile aroma content increased 89% after treatment, terpene glycosides increasing 11.1 fold.
tea; bound aroma precursors; acid hydrolysis; enzyme hydrolysis; orthogonal array design
10.13995/j.cnki.11-1802/ts.201612022
硕士,研发工程师(刘晓辉为通讯作者,E-mail:liuxiaohui@sbsy.com.cn)。
深圳市战略新兴产业发展专项(CXZZ20120612142335998)
2016-01-12,改回日期:2016-04-27

