基于发酵优化和动力学建立Levan果聚糖生产的数字化模型
于晓萌,张京良,孙永超,姜言晖,沈照鹏,王鹏,江晓路*
1(中国海洋大学 食品科学与工程学院,山东 青岛,266003) 2(中国海洋大学 医药学院,山东 青岛,266003) 3(青岛海洋生物医药研究院,山东 青岛,266071) 4(同济大学 数学科学学院,上海,200092)
基于发酵优化和动力学建立Levan果聚糖生产的数字化模型
于晓萌1,张京良2,3,孙永超4,姜言晖1,沈照鹏2,3,王鹏1,江晓路1*
1(中国海洋大学 食品科学与工程学院,山东 青岛,266003) 2(中国海洋大学 医药学院,山东 青岛,266003) 3(青岛海洋生物医药研究院,山东 青岛,266071) 4(同济大学 数学科学学院,上海,200092)
利用自动发酵罐对巨大芽孢杆菌(Bacillusmegaterium) GJT321生产Levan果聚糖的发酵培养条件进行优化,并对发酵动力学进行研究,采用Logistic方程、Luedeking-Piret方程和底物消耗的物料平衡方程分别建立菌体生长、产物合成和底物消耗动力学的数字化模型,应用MATLAB软件进行模型拟合,获得模型的参数、方程和曲线。模型的拟合值与发酵测定的实验值拟合良好,该模型能较好地反映BacillusmegateriumGJT321生产Levan果聚糖发酵过程中菌体生长、Levan果聚糖合成和蔗糖消耗的变化规律,为发酵过程的在线控制和预测提供理论基础。
动力学模型;发酵优化;Levan果聚糖;巨大芽孢杆菌
微生物多糖是一种高分子聚合物,在利用微生物发酵生产多糖的过程中,发酵液粘度高、产物分子量高却易降解、底物浓度难以控制等因素,给发酵生产带来一定困难,完善发酵工艺需要达到培养基成分合理、参数准确,以实现快速生产的要求。Levan果聚糖是D-呋喃果糖由β-(2,6)糖苷键连接而成的一种同多糖,它主要由微生物产生,其生物合成通常由果聚糖蔗糖酶完成[1],果聚糖蔗糖酶具有水解和转果糖基双重活性,蔗糖作为唯一底物同时作果糖基供体和果糖基受体。与存在植物体内的果聚糖相比,Levan果聚糖不能被酵母菌产生的淀粉酶或转化酶降解[2],具有抗氧化[3]、抗肿瘤[4]、免疫刺激[5]等药理活性,在心血管疾病和动脉粥样硬化方面[3]也能起到一定作用。近年来的研究表明,Levan果聚糖还有作为益生元和可溶性纤维的潜力,因此研究者们对其生产和应用的关注度逐渐提高[6]。
发酵罐发酵是实验室摇瓶发酵的放大,为工业化放大提供依据,有利于实现成果从实验室水平向工业化水平的转变。摇瓶发酵与发酵罐发酵生产间的差异,通常不仅是简单的放大,会伴随产物合成量的变化[7],且在发酵罐培养中,相对于摇瓶培养,通气量的控制是其特有的,用于调控发酵罐中空气成分,以期提高产量[8]。通过监测溶氧水平,还可了解更多发酵过程的变化情况。因此,利用发酵罐对发酵转速与通气量进行优化,不仅能在发酵罐水平得到优化的发酵条件,还能结合溶氧分析发酵过程。发酵动力学研究主要集中于对发酵过程中的菌体浓度、产物浓度及底物浓度随时间的变化规律进行研究,结合数学模型的应用,对发酵过程进行模型的拟合预测,目前对生产Levan果聚糖的研究主要集中在发酵条件的优化,未见细菌生产Levan果聚糖发酵动力学的相关报道。本文在优化发酵罐培养条件的基础上,通过建立由BacillusmegateriumGJT321生产Levan果聚糖的发酵动力学模型,探寻发酵过程中参数的变化规律,为实现规模化生产Levan果聚糖提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
巨大芽孢杆菌BacillusmegateriumGJT321菌株,由中国海洋大学食品科学与工程学院应用微生物学实验室筛选得到,已送至中国典型培养物保藏中心保藏,保藏号CCTCC M 2016073。该菌株经前期实验已证实,从发酵液中分离出的胞外多糖为Levan果聚糖。
斜面培养基:牛肉膏3 g,NaCl 5 g,蛋白胨10 g,琼脂18 g,蒸馏水1 L,pH为7.2;
种子培养基:蔗糖300 g,蛋白胨18 g,(NH4)2SO43 g,NaCl 1.5 g,MgSO40.1 g,CaCl20.05 g,K2HPO41 g,蒸馏水1 L,pH为 7.0;
发酵培养基:蔗糖300 g,蛋白胨18 g,(NH4)2SO43 g,NaCl 1.5 g,MgSO40.1 g,CaCl20.05 g,K2HPO41 g,蒸馏水1 L,pH为 7.0。
1.2 仪器与设备
LDZX-75KB立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-1D型单人净化工作台,苏州净化设备有限公司;ZWY-2102C恒温培养振荡器,上海智城分析仪器制造有限公司;BLBIO-5GJ-4-H自动发酵罐,上海百伦生物科技有限公司;GL-20G-II高速冷冻离心机,上海安亭科学仪器厂;721型可见分光光度计,上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 培养方法
将BacillusmegateriumGJT321菌株从斜面培养基接种至种子培养基中,在摇床转速32 ℃、160 r/min条件下培养24 h,将种子液以体积分数为7.5%的接种量接种至装有4 L发酵培养基的5 L发酵罐中,控制适宜的转速和通气量,于32 ℃条件下发酵培养。
1.3.2 发酵培养条件优化
在其他条件相同的条件下,分别考察发酵罐转速(200、400、600 r/min)和通气量(2、4、8 L/min)对发酵体系的溶氧量(dissolved oxygen,DO)、Levan果聚糖产量和生物量的影响,筛选最适转速和通气量。
1.3.3 发酵动力学数字化模型的建立
1.3.3.1 发酵过程曲线的制作
选择优化后的转速和通气量,根据1.3.1的方法进行发酵培养。从接种后发酵开始,每小时取样,对pH、生物量、Levan果聚糖浓度、葡萄糖浓度和蔗糖浓度进行测定,并制作BacillusmegateriumGJT321生产Levan果聚糖的发酵过程曲线。
1.3.3.2 菌体生长动力学模型的建立
采用Logistic方程建立BacillusmegateriumGJT321的菌体生长动力学模型,描述其菌体生长速率的Logistic微分方程为:
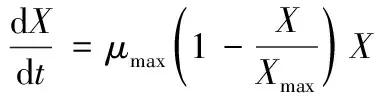
(1)
从方程(1)中可以看出,发酵初期X接近于0,且X/Xmax的值很小,dX/dt接近于0;之后X开始增大,X小于Xmax,dX/dt即菌体生长速率先升高后降低,菌体生长进入对数期;由于细菌在发酵体系中的生长环境是有限的,X越大,菌体间的竞争越激烈,当X达到最大值时,X=Xmax,会使dX/dt降至0。
初始条件t=0时,得X=X0,积分式为:
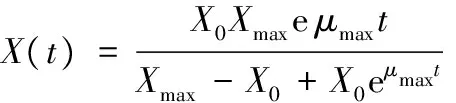
(2)
1.3.3.3 产物合成动力学模型的建立
采用Luedeking-Piret方程建立BacillusmegateriumGJT321的产物合成动力学模型,描述Levan果聚糖合成速率的Luedeking-Piret微分方程为:
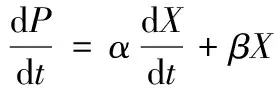
(3)
由方程(3)可以看出,产物合成速率可能与菌体生长速率和菌体浓度有关。α≠0、β=0时,产物合成与菌体生长相偶联,即产物合成速率与菌体生长速率有关,菌体生长伴随产物合成,与菌体浓度无关;α≠0、β≠0时,产物合成为菌体生长部分偶联,即产物合成速率与菌体生长速率和菌体浓度都有关;α=0、β≠0时,产物合成与菌体生长非偶联,即产物合成速率与菌体生长速率无关,只与菌体浓度有关。
初始条件t=0时,得P=P0,积分式为:
(4)
1.3.3.4 底物消耗动力学模型的建立
在发酵过程中,底物消耗主要用于菌体的生长、细胞维持基本生命活动和产物合成[9],根据基质平衡原理,建立BacillusmegateriumGJT321的底物消耗动力学模型,描述底物消耗的物料平衡微分方程为:
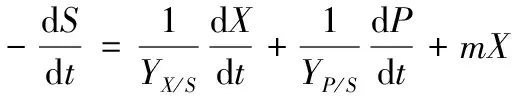
(5)
初始条件t=0时,得S=S0,积分式为:
(6)
1.3.3.5 参数说明
X、X0、Xmax分别为菌体浓度、起始菌体浓度和最大菌体浓度,g/L;P、P0分别为Levan果聚糖浓度和起始Levan果聚糖浓度,g/L;S、S0分别为蔗糖浓度和起始蔗糖浓度,g/L;t为时间,h;μmax为最大比生长速率,h-1;α为与菌体生长速率相关联的Levan果聚糖合成系数;β为与菌体浓度相关联的非生长耦联系数;YX/S为菌体对蔗糖的得率,g/g;YP/S为Levan果聚糖对蔗糖的得率,g/g;m为菌体的维持系数,h-1。
1.3.3.6 模型拟合
采用MATLAB软件进行数据与模型的拟合,将实验值与模型拟合值进行比较分析。
1.3.4 测定方法
1.3.4.1 生物量测定
发酵条件优化实验中,以600 nm的吸光值(OD600nm)表示生物量。
建立动力学模型实验中,取20 mL发酵液,10 000 r/min离心10 min,弃上清液,加入10 mL蒸馏水将沉淀均匀分散,再次离心后收集沉淀,于100 ℃烘干至恒重,以菌体干重表示生物量。
1.3.4.2 Levan果聚糖浓度测定
将发酵液于10 000 r /min离心10 min,在上清液加入1.5倍体积的乙醇,同样条件下离心弃上清液,向沉淀中加入蒸馏水复溶,采用苯酚-硫酸法[10]测定糖浓度,以葡萄糖为标准品绘制标准曲线。
1.3.4.3 葡萄糖浓度测定
生物传感器测定葡萄糖浓度[11]。
1.3.4.4 蔗糖浓度测定

2 结果与分析
2.1 培养条件优化结果
2.1.1 转速对Levan果聚糖发酵过程的影响
由图1可以看出,发酵初期生物量即增长迅速,消耗大量氧气,溶氧在发酵初期均呈迅速下降趋势,转速越高,溶氧下降越慢,溶氧最低值越高,低溶氧期越短。当生物量(OD600nm)开始下降,即菌体代谢减弱,进入衰亡期后,耗氧能力下降,溶氧上升恢复至发酵初期水平。在转速为200 r/min的发酵罐中,溶氧始终保持极低的水平,溶氧不足导致菌体生长缓慢,Levan果聚糖合成延滞,导致Levan果聚糖在发酵前16 h中上升趋势较平缓,16 h时才达到最高点。而在转速为400 r/min和600 r/min的2个发酵罐中,生物量和Levan果聚糖浓度的变化情况几乎相同,其发酵合成产物的速度和最大值也几乎相同,都能够在6 h时达到Levan果聚糖浓度最大值。虽然在转速为400 r/min的发酵罐中,溶氧在产物合成期保持较低水平,但是没有影响菌体的生长和Levan果聚糖的合成。由于转速为400 r/min的条件转速较低,节省能源,选择400 r/min作为BacillusmegathriumGJT321菌株发酵合成Levan果聚糖的最适转速。
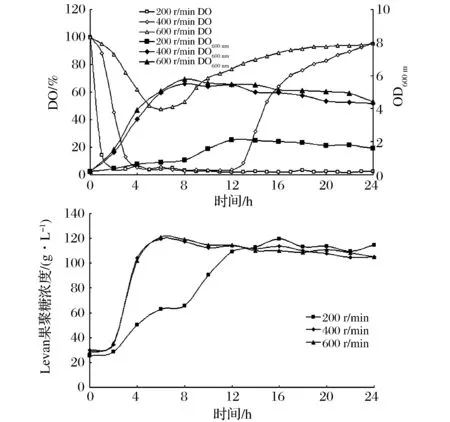
图1 转速对Bacillus megaterium GJT321生产Levan果聚糖发酵过程的影响Fig.1 Effect of mixing speed on fermentation process of Bacillus megaterium GJT321 producing levan
2.1.2 通气量对Levan果聚糖发酵过程的影响
实验结果如图2,通气量越大,溶氧低水平期越短,但对生物量和Levan果聚糖浓度影响不大。通气量为2 L/min的条件下,生物量总体偏低,Levan果聚糖达到最大值的时间也略延迟;通气量为8 L/min条件下,生物量最早达到最大值,说明氧气供应充足的条件下,菌体生长快;通气量为4 L/min时,生物量总体偏高,说明菌体长势好,虽然在4~12 h间溶氧偏低,但是没有影响菌体的长势,且Levan果聚糖产量相对较高,在第6 h达到最大值。从产量和节省能源两方面考虑,选择4 L /min作为BacillusmegathriumGJT321发酵生产Levan果聚糖的最适通气量。
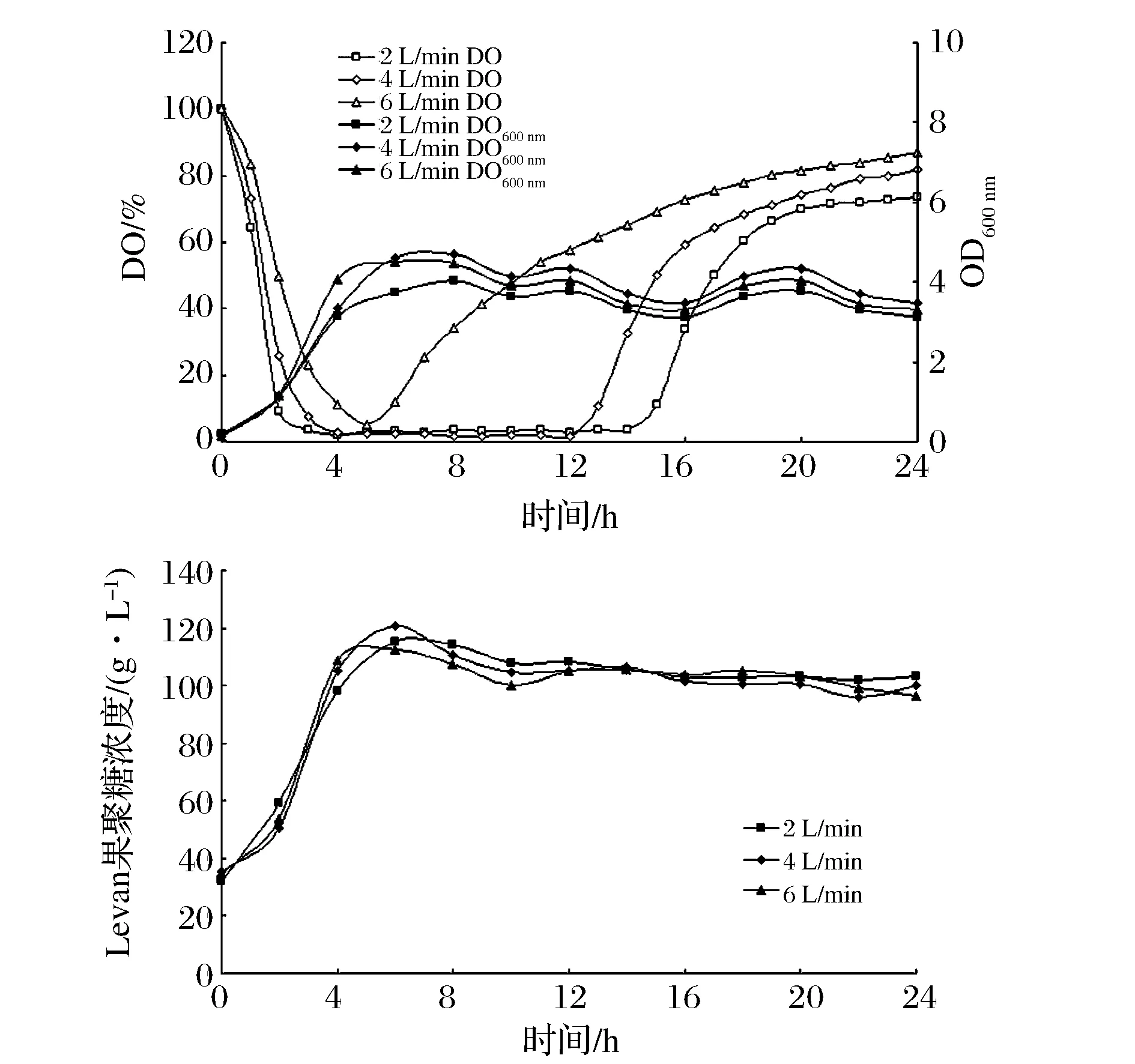
图2 通气量转速对Bacillus megaterium GJT321生产Levan果聚糖发酵过程的影响Fig.2 Effect of mixing speed on fermentation process of Bacillus megaterium GJT321 producing levan
2.2BacillusmegateriumGJT321生产Levan果聚糖发酵过程曲线及分析
BacillusmegateriumGJT321生产Levan果聚糖发酵生产Levan果聚糖过程曲线如图3所示。蔗糖浓度曲线表现为先快速下降后平稳,在4 h后降低的速率减缓,6 h后稳定在20 g/L以下。Levan果聚糖浓度曲线和葡萄糖浓度曲线在发酵过程中变化趋势一致,在发酵初期的1 h内,Levan果聚糖和葡萄糖浓度略有上升,在1~6 h内迅速升高,6 h时分别达到最大值为123.1、130.0 g/L,其后保持平稳。上述数据表明发酵前期蔗糖被迅速分解为葡萄糖和果糖,葡萄糖游离在培养基中,果糖则被迅速连接合成Levan果聚糖,蔗糖浓度降低过程与Levan果聚糖浓度升高过程相吻合,说明底物消耗与产物合成几乎同步进行。pH在Levan果聚糖合成期呈明显下降趋势,说明菌株在合成Levan果聚糖的同时产酸;当Levan果聚糖浓度达到最高点时,pH下降至最低点,此后pH和Levan果聚糖浓度均达到稳定。菌体生长曲线在发酵初期的1 h内上升缓慢,其后迅速上升,上升趋势与Levan果聚糖浓度基本一致,10 h时达到生物量最高点,最大生物量为1.62 g/L。
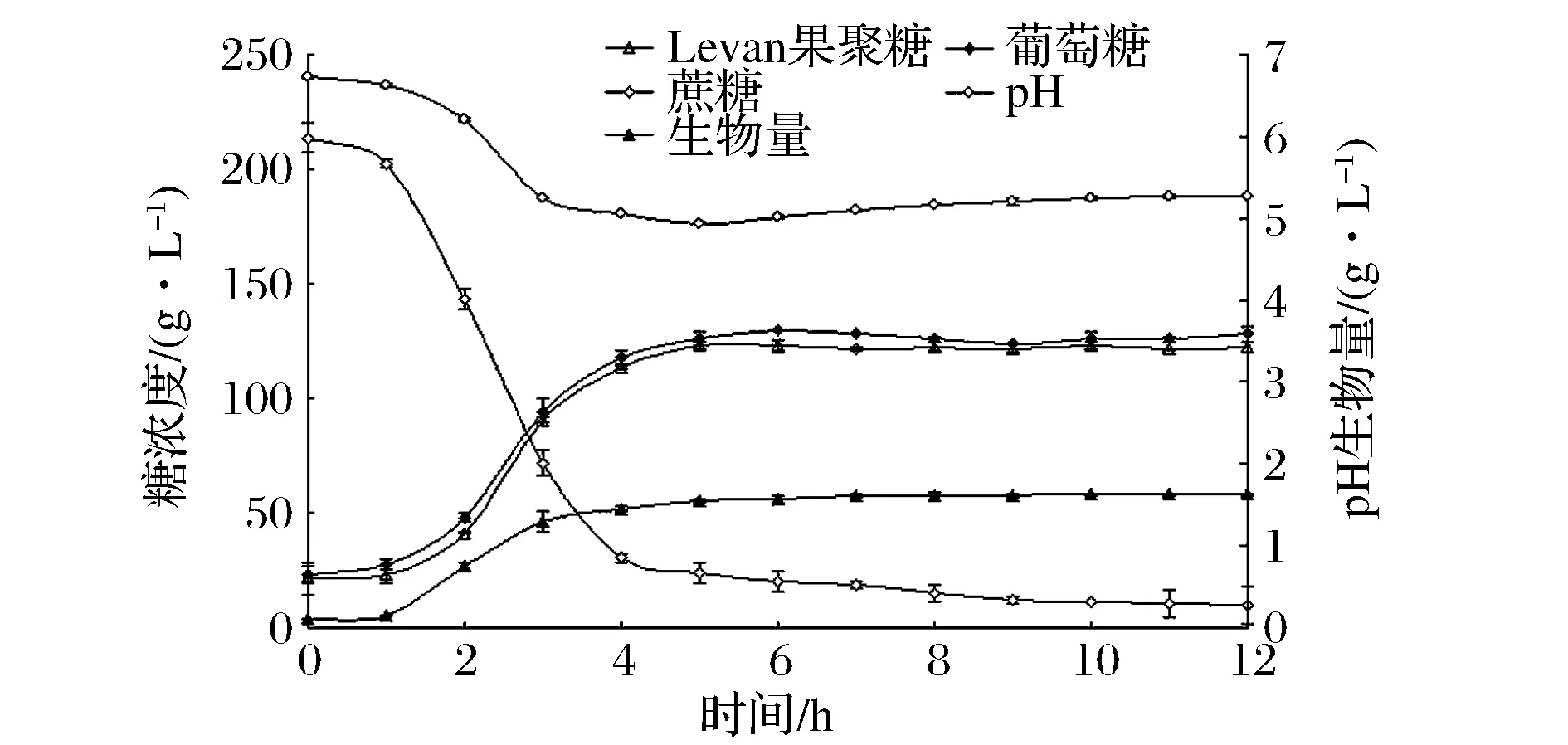
图3 Bacillus megaterium GJT321生产Levan果聚糖的发酵曲线Fig.3 Fermentation curve of Bacillus megaterium GJT321 producing levan
2.3BacillusmegateriumGJT321生产Levan果聚糖发酵动力学数字化模型参数值及方程
采用MATLAB软件建立BacillusmegateriumGJT321生产Levan果聚糖发酵动力学方程,其参数见表1。
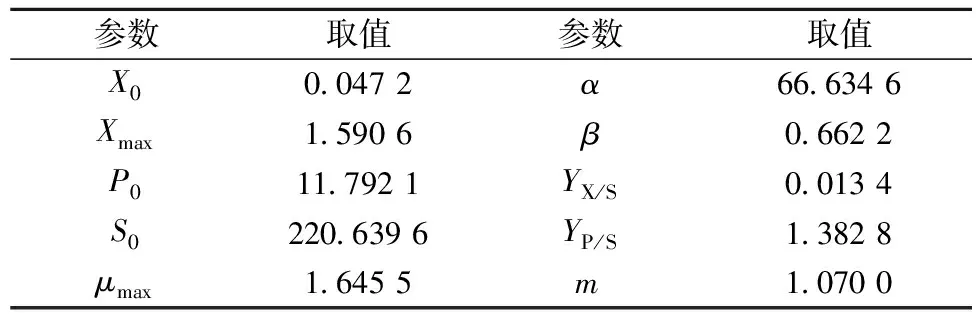
表1 发酵动力学模型参数值
将模型参数值代入(2)、(4)、(6)式,得到菌体生长、产物合成和底物消耗动力学方程分别为:
(7)
P(t)= 8.643 9+66.634 6X(t)+0.640 1ln
(8)
S(t)= 226.440 9-122.792 1X(t)-1.497 2ln
(9)
2.4BacillusmegateriumGJT321生产Levan果聚糖的发酵动力学数字化模型曲线
BacillusmegateriumGJT321生产Levan果聚糖的发酵动力学模型曲线如图4~图6。
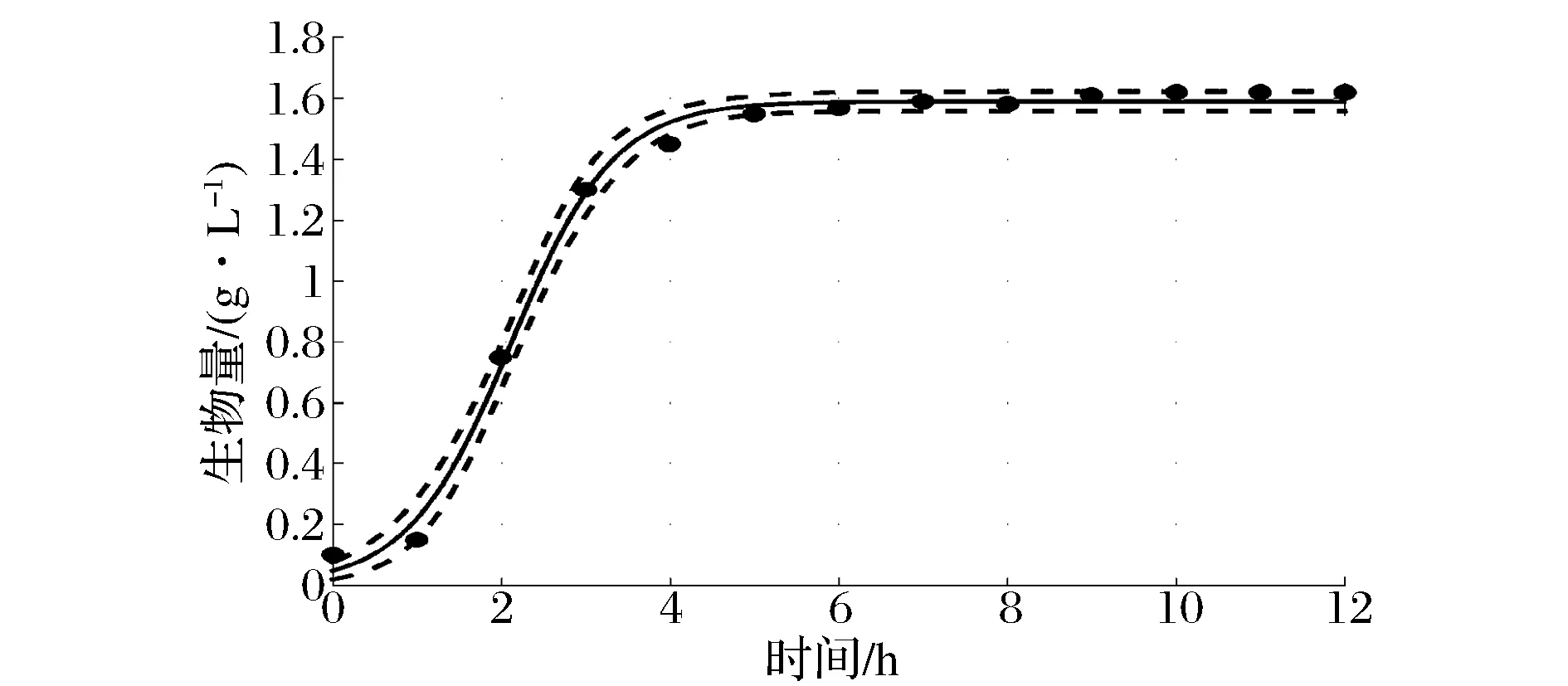
图4 菌体生长动力学模型拟合值与实验值比较Fig.4 Fitted values and experimental values of cell growth kinetic model comparison
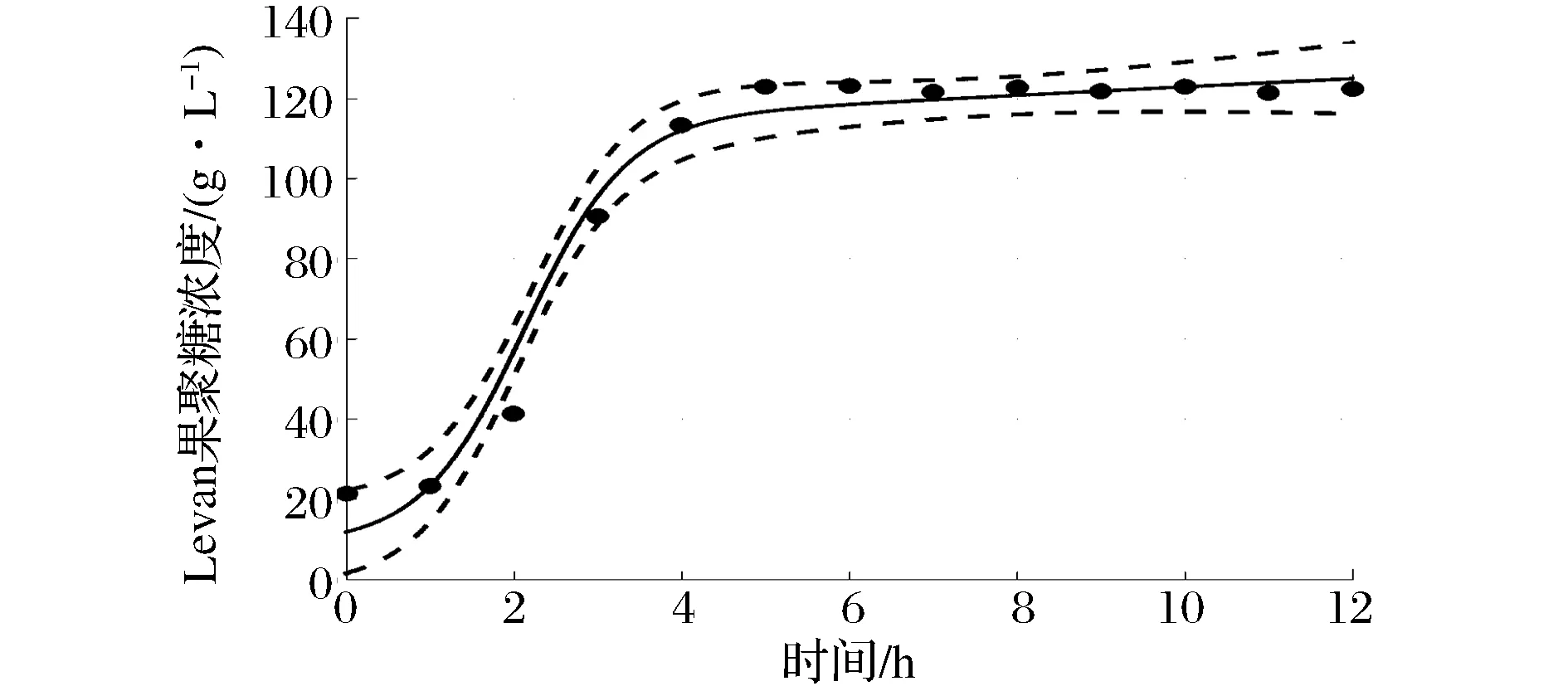
图5 产物合成动力学模型拟合值与实验值比较Fig.5 Fitted values and experimental values of product synthesis kinetic model comparison
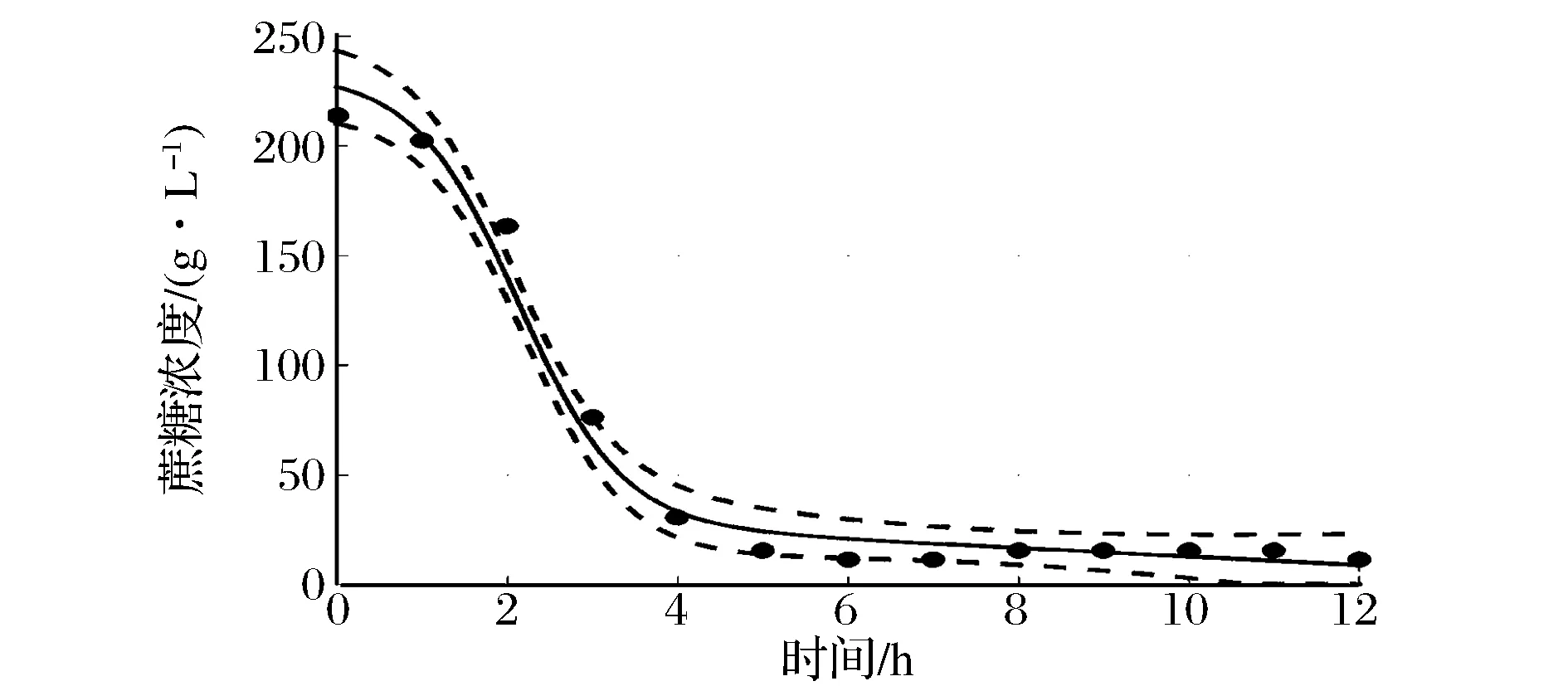
图6 底物消耗动力学模型拟合值与实验值比较Fig.6 Fitted values and experimental values of substrate consumption kinetic model comparison
拟合曲线两侧虚线间的范围为95%置信区间,从图中可以看出,拟合值与实验值较为接近,实验值大部分在95%置信区间内,且曲线拟合度R2分别为0.995 3、0.977 8和0.997 5,平均误差分别为9.19%、8.11%和9.39%,说明拟合的模型能够较好地反映BacillusmegateriumGJT321菌株实际的液体深层发酵过程。延滞期菌体浓度和产物浓度的拟合值与实验值之间的相对误差大于对数增长期和稳定期,可能是由于种子液的状态对发酵前期菌体浓度和Levan果聚糖浓度的影响较大。
3 讨论
发酵工程的相关理论已广泛应用于工业化微生物产品的生产和控制,使得现代微生物发酵产业发展迅速,产品品质也得到提升[12]。能够生产Levan果聚糖的微生物种类不同,其产量也相差较大。地衣芽孢杆菌8-37-0-1[13]发酵24 h生产Levan果聚糖,优化后产量为41.7 g/L。枯草芽孢杆菌54A-42通过紫外线-LiCl复合诱变获得的突变株Z-49[14],发酵52 h生产Levan果聚糖产量为16.1 g/L。多粘类芽孢杆菌BD3526[15]生产的分子质量为2.6×106Da的果聚糖,产量为36.25 g/L。本文利用BacillusmegateriumGJT321在自动发酵罐中发酵生产Levan果聚糖,优化培养条件后,确定最适转速400 r/min和通气量4 L/min,在优化条件下发酵6 h产量达123.1 g/L,远高于目前已报道的细菌生产Levan果聚糖的产量,该菌株易于培养,发酵周期短、产量高,具有大规模工业化生产的潜力。经过发酵动力学模型的拟合,建立了基于发酵动力学的BacillusmegateriumGJT321生产Levan果聚糖的数字化模型,探寻了其发酵过程中菌体生长、产物合成和底物消耗的规律,且模型的拟合值与发酵测定的实验值十分接近,模型拟合良好,实现了对BacillusmegateriumGJT321生产Levan果聚糖发酵过程参数变化的预测。从模型中可以看出,发酵6 h时达到Levan果聚糖产量最高点,即6 h时结束发酵能够获得产物浓度最大化,且节约了生产时间和成本;还可根据所需产量输入模型,得到对应的发酵时间,便于提前终止发酵,针对性地获得既定产量,对Levan果聚糖发酵生产过程的动态在线控制和预测具有指导性意义。还可根据此发酵动力学数字化模型开发相应的在线控制设备,实现发酵过程自动化,并对早期污染作出指示,及时终止发酵过程,减少损失。
由于BacillusmegateriumGJT321在发酵生产Levan果聚糖的过程中,Levan果聚糖浓度在6 h处便达到了最高点,底物能够被快速转化利用,产物合成十分迅速,而发酵体系中的葡萄糖浓度在达到最高值后稳定,消耗极少。因此在今后的研究中,可以考虑进行补料分批发酵实验,作为一种进行高密度发酵的重要技术手段,补料发酵既可以补充充足的营养,短时间内促进更多Levan果聚糖合成,又能够将发酵液中的葡萄糖放出体系,处理后可作其他用途,同时减少培养过程中高浓度抑制性副产物的积累[16]。
[1] SRIKANTH R, REDDY C H S S S, SIDDARTHA G, et al. Review on production, characterization and applications of microbial levan[J]. Carbohydrate Polymers, 2015, 120: 102-114.
[2] SRIKANTH R, SIDDARTHA G, REDDY C H S S S, et al. Antioxidant and anti-inflammatory levan produced fromAcetobacterxylinumNCIM2526 and its statistical optimization[J]. Carbohydrate Polymers, 2015, 123: 8-16.
[3] DAHECH I, HARRABI B, HAMDEN K, et al. Antioxidant effect of nondigestible levan and its impact on cardiovascular disease and atherosclerosis[J]. International Journal of Biological Macromolecules, 2013, 58: 281-286.
[4] SARILMISER H K, ONER E T. Investigation of anticancer activity of linear and aldehyde-activated levan fromHalomonassmyrnensisAAD6T[J]. Biochemical Engineering Journal, 2014, 92: 28-34.
[5] DONG Cai-xia, ZHANG Li-jiao, XU RONG, et al. Structural characterization and immunostimulating activity of a levan-type fructan fromCurcumakwangsiensis[J]. International Journal of Biological Macromolecules, 2015, 77: 99-104.
[6] BELGHITH K S, DAHECH I, BELGHITH H, et al. Microbial production of levansucrase for synthesis of fructooligosaccharides and levan[J]. International Journal of Biological Macromolecules, 2012, 50(2): 451-458.
[7] 孙菲. 脂肪酶抑制剂Lipstatin的发酵罐发酵工艺优化[J]. 食品与发酵工业,2014,40(9):63-67.
[8] 杨杰,程红艳,孙绪春等. 蛹虫草发酵罐培养的工艺优化[J]. 食用菌,2011(2):11-12.
[9] 崔玉海,童群义,吴胜军. 短梗霉多糖分批发酵动力学模型[J]. 食品与生物技术学报,2009,28(3):361-365.
[10] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[11] 赵晓华,孟庆军,毕春元,等. 葡萄糖生物传感器研究进展[J]. 山东科学,2009(2):34-38.
[12] 夏永,王斌,王公孝等. C群流行性脑膜炎球菌多糖分批发酵动力学模型的建立[J]. 中国生物制品学杂志,2014,11:1 473-1 476.
[13] 陆娟,肖敏,卢丽丽. 地衣芽孢杆菌产Levan果聚糖发酵条件的优化[J]. 食品科学,2011,07:183-187.
[14] 杨辉,李杰民,余磊等. 产左聚糖枯草芽孢杆菌的突变选育及多糖产物的生物物理分析[J]. 基因组学与应用生物学,2012(6):567-573.
[15] XU Xiao-fen, GAO Cai-xia, LIU Zhen-min, et al. Characterization of the levan produced byPaenibacillusbovissp. nov BD3526 and its immunological activity[J]. Carbohydrate Polymers, 2016, 144: 178-186.
[16] 易子霆,罗志威,徐滔明等. 1株耐盐枯草芽孢杆菌TGBio-1433发酵工艺优化[J]. 江西农业学报,2016(6):105-108.
Establishment of digital model for levan production based on fermentation optimization and kinetics
YU Xiao-meng1, ZHANG Jing-liang2,3, SUN Yong-chao4, JIANG Yan-hui1, SHEN Zhao-peng2,3, WANG Peng1, JIANG Xiaolu1*
1(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China) 2(School of Medicine and Pharmacy, Ocean University, Qingdao 266003, China) 3(Marine Biomedical Research Institute of Qingdao, Qingdao 266071, China) 4(School of Mathematical Sciences, Tongji University, Shanghai 200092, China)
The culture optimization and kinetics ofBacillusmegateriumGJT321 fermentation producing levan in automatic fermentor was studied in this paper. Logistic equation, Luedeking-Piret equation and material balance equation of substrate consumption were employed to establish cell growth, product synthesis and substrate consumption kinetics digital models. The parameters, equations and curves were determined by using MATLAB software. The model indicated a good correlation between fitted values and experimental values, and reflected the change rules of cell growth, levan synthesis and sucrose consumption during the production of levan byBacillusmegateriumGJT321. The establishment of fermentation kinetics digital models could provide fundamental basis for following production process control and prediction.
kinetics model; fermentation optimization; levan;Bacillusmegaterium
10.13995/j.cnki.11-1802/ts.201612004
硕士研究生(江晓路教授为通讯作者,E-mail:jiangxl@ouc.edu.cn)。
国家自然科学基金(U1406402-5)
2016-07-25,改回日期:2016-08-15

