建立实时荧光定量逆转录PCR方法检测非小细胞肺癌棘皮动物微管相关蛋白4-间变淋巴瘤激酶融合基因
赵 静,赵金银,陈志霞,钟 巍,李龙芸,刘利成,胡小许,陈唯军,王孟昭
1中国医学科学院 北京协和医学院 北京协和医院呼吸内科,北京 1007302中国科学院 北京基因组研究所基因组科学与信息重点实验室,北京 100029
·论 著·
建立实时荧光定量逆转录PCR方法检测非小细胞肺癌棘皮动物微管相关蛋白4-间变淋巴瘤激酶融合基因
赵 静1,赵金银2,陈志霞1,钟 巍1,李龙芸1,刘利成2,胡小许2,陈唯军2,王孟昭1
1中国医学科学院 北京协和医学院 北京协和医院呼吸内科,北京 1007302中国科学院 北京基因组研究所基因组科学与信息重点实验室,北京 100029
目的 建立一种实时荧光定量逆转录PCR方法,对非小细胞肺癌间变淋巴瘤激酶(ALK)融合基因进行快速、敏感和特异检测。方法 首先,应用Primer Premier 5.0软件,针对棘皮动物微管相关蛋白4(EML4)-ALK常见融合变异V1、V2、V3a和V3b设计引物和Taqman水解探针。然后,以包含EML4-ALK融合变异V1、V2、V3a和V3b的假病毒颗粒为研究对象,进一步分析所建立方法的灵敏度、敏感性和特异性。最后,用所建立的方法检测50例非小细胞肺癌临床标本,其中包含3例ALK-荧光原位杂交(FISH)(+)样本。结果 在无背景RNA干扰情况下,建立的实时荧光定量逆转录PCR方法检测灵敏度高达10拷贝/l。在500 拷贝/l的野生型背景RNA下,其敏感性达1%,在5000 拷贝/l的野生型背景RNA下,其敏感性达0.5%。对于检测特异性,以正常人白细胞及血浆RNA为研究对象,均未见非特异性扩增。对50例非小细胞肺癌临床标本进行检测,47例阴性标本检测均为阴性,3例ALK-FISH(+)标本2例检测阳性,1例未检出,未检出原因与标本RNA提取失败有关。结论 本研究建立的实时荧光定量逆转录PCR方法是一种快速、简便以及具有高灵敏度和特异性的EML4-ALK融合基因检测方法,值得在临床进一步验证和推广。
非小细胞肺癌;棘皮动物微管相关蛋白4-间变淋巴瘤激酶融合基因;实时荧光定量逆转录多聚酶链反应
ActaAcadMedSin,2016,38(6):643-649
具有棘皮动物微管相关蛋白4(echinoderm microtubule associated protein like 4, EML4)-间变淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因的非小细胞肺癌(non-small cell lung cancer, NSCLC)是新近发现的一种独特亚型,具有该亚型的NSCLC对ALK抑制剂,如克唑替尼[1- 2],疗效显著优于化疗。因此,在精准医学时代,对ALK融合基因进行有效、准确的检测显得尤为重要。目前关于ALK融合基因的检测方法很多,它们分别从DNA、RNA以及蛋白水平进行检测,各有优缺点。其中,基于PCR基础上的方法,灵敏度高、检测快速、结果容易判断、可对石蜡包埋组织进行测定、检测多个已知亚型、还可结合测序技术发现新类型,应用前景良好。为此,本研究自主构建了实时荧光定量逆转录PCR方法(real-time quantitative reverse transcriptase-PCR, qRT-PCR),用于检测NSCLC的ALK融合基因。
材料和方法
EML4-ALK融合位点引物及Taqman探针设计 在美国国立生物技术信息中心数据库下载EML4和ALK全基因序列(仅外显子),根据Sanger网站(http://cancer.sanger.ac.uk/cosmic)及文献报道确定EML4-ALK的15种融合突变,其中最常见的融合突变为EML4-ALK,E13;A20(V1),E6;A20(V3a/b)和E20;A20(V2)占EML4-ALK融合类型的70%以上[3- 4]。应用Primer Premier 5.0软件对EML4-ALK的15种融合突变分别设计引物和探针,并以管家基因β-actin的mRNA作为内参。引物长度为22 bp左右,GC含量为40%~60%,Tm值为55~58℃,扩增片段大小为80~150 bp,形成尽可能少的引物二聚体,探针长度为26~30 bp,GC含量为40%~60%,Tm值为65~70℃(序列见表1)。因涉及试剂盒商业开发,此处未列出全部融合变异的引物和Taqman探针。
EML4-ALK融合基因检测设2个反应管进行,其中V1/V6、V2/COSMIC ID731、V3a/V3b、V4/V7、V4’和V5’设在一个反应管进行,V5a/V5b/COSMIC ID733、V8a/V8b及内参β-actin设在另一反应管中进行。以携带EML4-ALK融合变异V1、V2、V3a和V3b的假病毒颗粒标准品(中国科学院北京基因组研究所赠送)为研究对象,筛选和确立最佳引物和探针。

表 1 检测EML4-ALK融合基因V1、V2和V3a/b融合位点及内参设计的引物和Taqman探针序列
EML4-ALK:棘皮动物微管相关蛋白4-间变淋巴瘤激酶
EML4-ALK:echinoderm microtubule associated protein like 4-anaplastic lymphoma kinase
灵敏度实验 从-80℃冰箱中取出携带EML4-ALK V1、V2、V3a和V3b融合位点的假病毒颗粒,提取假病毒RNA,分别进行梯度稀释,选取104、103、102、101、100拷贝/l稀释梯度,按上述PCR反应体系进行灵敏度实验,每个梯度设置3个重复孔。
敏感性实验 分别将梯度稀释的突变体V1假病毒RNA加入到500 拷贝/l和5000拷贝/l的野生型背景RNA中,分别制成依次为10%、5%、1%、0.5%、0.1%、0%突变率的样本,按上述PCR反应体系进行检测,以确定可检测的敏感性。V2、V3a/V3b突变体按相同方法建立突变率样本,按上述PCR反应体系进行检测,以确定可检测的敏感性。
特异性实验及ΔCt临界值的确定 选取10份正常人血液样本(来自中国科学院北京基因组研究所基因组科学与信息重点实验室工作人员),提取白细胞RNA,浓度1~50 ng/l,进行6次重复性实验,统计每次出现的非特异性扩增Ct值及样本内参Ct值,计算出ΔCt值(ΔCt=Ct非特异-Ct内参)。依据公式ΔCt临界值=平均ΔCt-3×标准差,计算出ΔCt临界值。收集40份血液样本(来自北京协和医院呼吸科血浆标本库),提取血浆中的RNA,按上述PCR反应体系进行检测,以验证特异性。
临床样本收集 NSCLC标本来自2012年1至12月北京协和医院呼吸科,共50例,其中男性12例、女性38例,均为腺癌样本,且均采用荧光原位杂交(fluorescence in situ hybridization, FISH)方法对EML4-ALK融合基因进行检测。其中ALK-FISH(+)标本仅3例,均为女性,腺癌,且不吸烟。
石蜡组织样本RNA提取 每例标本切取5 μm厚石蜡切片5张。采用离心柱法提取石蜡切片中的RNA(使用商品化Tiangen DNA/RNA共提取试剂盒,货号:DP422),用紫外分光光度计测定所得RNA溶液的浓度,最后置于-80℃保存,备用。
实时荧光定量逆转录PCR检测临床样本 按照建立的qRT-PCR方法对临床样本进行检测,并设1个阴性对照样本(采用纯水代替)和1个阳性对照样本(携带EML4-ALK V1融合位点的假病毒颗粒RNA)。计算出每个样本的△Ct(△Ct=Ct检测反应-Ct内参),依据所确定的△Ct临界值判断结果。若△Ct值小于△Ct临界值,则为阳性样本;若△Ct值大于△Ct临界值,则为阴性样本或超出检测范围。
结 果
qRT-PCR反应体系检测灵敏度结果 对EML4-ALK融合变异V1、V2、V3a和V3b分别进行灵敏度实验,各种融合变异的浓度梯度依次为104、103、102、101、100拷贝/l,最低检测限均为101拷贝l。图1所示为EML4-ALK融合变异V1、V2检测灵敏度均为101拷贝/l。
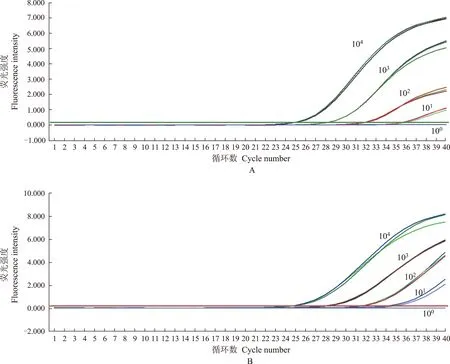
A.V1;B.V2
图 1 EML4-ALK融合突变扩增曲线,突变型RNA浓度梯度依次为:104、103、102、101、100拷贝/l
Fig 1 Amplification curves of variants of EML4-ALK fusion gene, and the concentrations of variant was 104, 103, 102, 101, 100copies/l, respectively
△Ct临界值设定及特异性验证 以10份白细胞RNA为对象,浓度1~50 ng/μl,进行△Ct临界值统计,所有反应均未出现非特异性扩增,以Ct值为40计算,最小ΔCt为7.9,最大ΔCt为19.13,依据公式:ΔCt 临界值=平均ΔCt-3×标准差,计算得出△Ct临界值为10。采用40份正常血浆样本进行特异性验证。从40份血浆中提取RNA,定量后,稀释至0~15 g/μl,结果显示均无非特异扩增信号出现。
NSCLC临床样本检测结果 50例NSCLC临床标本采用qRT-PCR检测EML4-ALK融合基因。其中47例ALK-FISH(-)标本内参扩增正常,样本检测均为阴性,3例ALK-FISH(+)样本在第1反应管中有2例(R2,R3)出现扩增曲线,即存在EML4-ALK融合基因,另1例(R1)未出现扩增曲线。在第2反应管中,标本R2和R3仍出现扩增曲线,其本质为内参β-actin的扩增曲线,而R1标本内参β-actin未出现扩增曲线,即R1检测失败与RNA提取失败有关(图3)。
讨 论
EML4-ALK融合基因是NSCLC一种新的亚型,约占所有NSCLC的5%,在腺癌、年轻患者(<60岁)以及不吸烟人群中发生率高,不同人种之间发生率差异无统计学意义,并均可从ALK抑制剂治疗中获益[1- 2,5- 6]。因此,建立简单、快速、准确和经济的检测EML4-ALK融合基因方法极为重要。
目前针对ALK融合基因检测常用的方法主要有3种: FISH、针对融合蛋白表达的免疫组织化学法(immunohistochemistry,IHC)和逆转录PCR。这3种方法各有其优缺点。FISH法虽然是临床试验验证的标准方法,但价格昂贵,操作规范要求高,结果判读只能由经验丰富的病理科医师完成,ALK-FISH阳性判断标准尚存争议[7],且只能判断ALK基因是否发生断裂,无法区分与其发生融合的基因类型。IHC法简便易行,费用低,但IHC阳性判断标准存在一定主观性。为提高IHC诊断特异性,2013年罗氏/Ventana公司在BenchMark平台上进一步优化了ALK-D5F3抗体试剂盒及检测流程。通过在该试剂盒中引入两级放大Optiview系统,使得原本表达非常弱的ALK融合蛋白得以呈现较为明显的染色效果。多项采用Ventana IHC检测ALK融合蛋白的研究显示,与FISH检测结果相比,两者的一致率高达94%~100%[8- 11]。因此,欧盟、中国以及美国等陆续批准Ventana IHC用于检测ALK融合基因,并可指导ALK抑制剂治疗,但该方法需要使用Ventana全自动染色仪,在我国大部分实验室尚不具备此条件。而逆转录PCR具有操作简便、结果判读容易、省时等优点,而且可以开发为专用试剂盒,适合于在我国广大分子病理实验室开展。
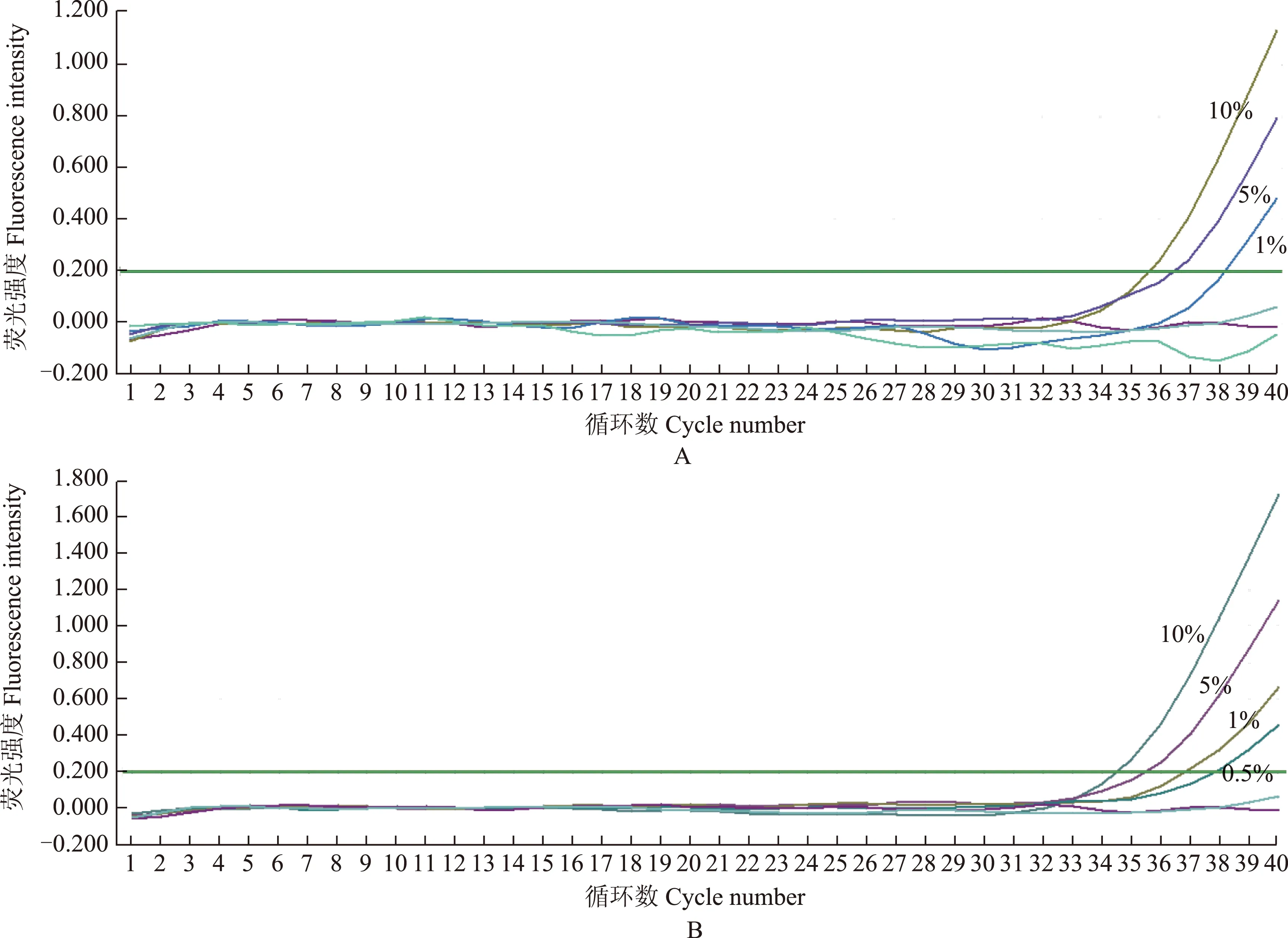
图 2 不同浓度的EML4-ALK融合突变V1扩增曲线[在500 拷贝/l(A)和5000 拷贝/l(B)的野生型RNA背景下]显示可分别检出1%和0.5%的突变率
Fig 2 The EML4-ALK V1 amplification curves for different concentrations of mutant pseudovirus [under the background of 500 copies/l(A) and 5000 copies/l(B) wild-type pseudovirus] showed the detection resolution was 1% and 0.5%
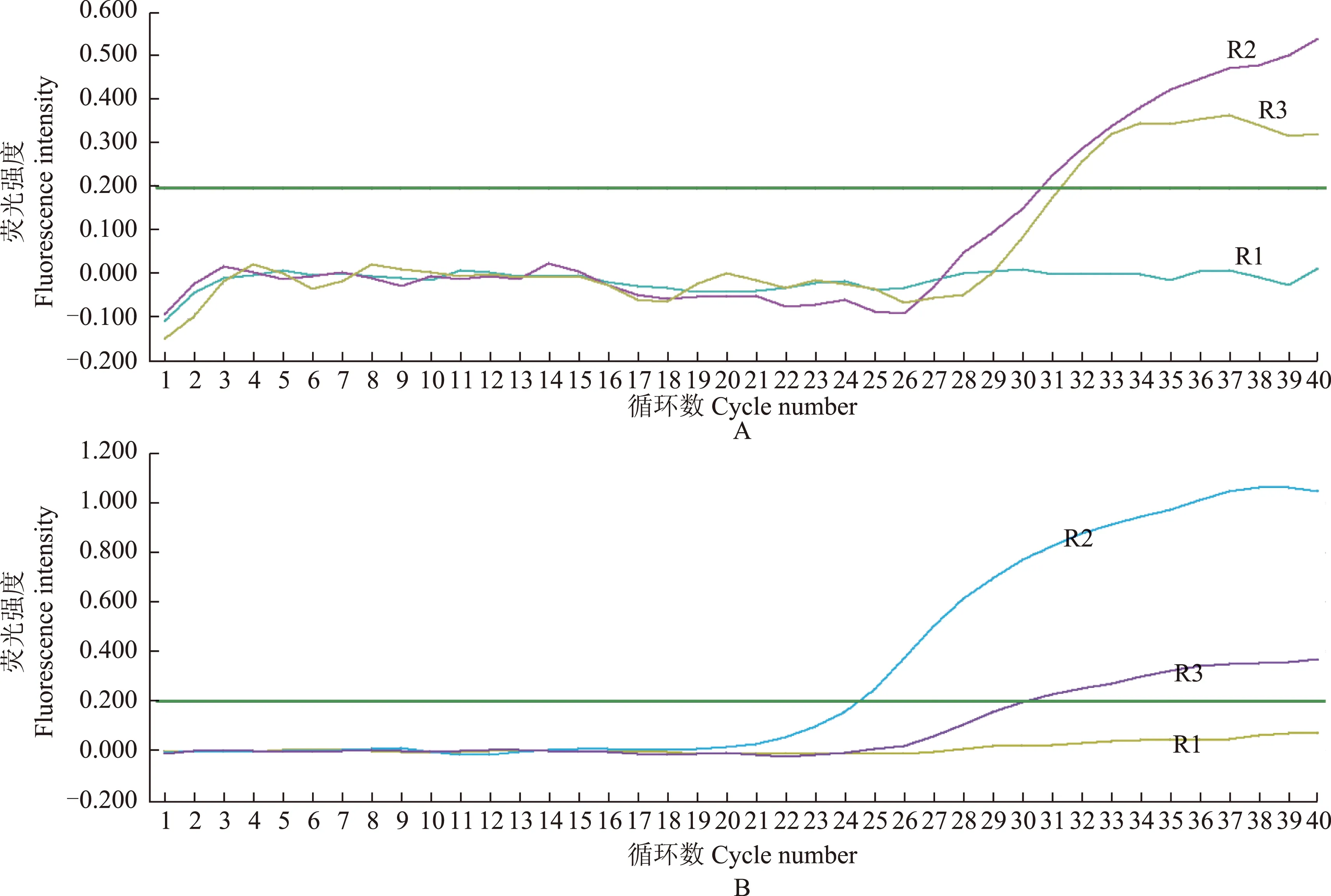
图 3 在第1个(A)和第2个(B)反应管中3份非小细胞肺癌标本(R1、R2、R3)扩增曲线
Fig 3 Amplification curves of 3 non-small cell lung cancer samples(R1,R2,R3)in the first (A) and second reaction tubes (B)
本研究建立了实时荧光定量逆转录PCR方法,从mRNA水平检测是否存在EML4-ALK融合基因的转录子,进而判断是否存在ALK融合基因。初步研究结果显示,在无背景RNA干扰情况下,该方法的检测灵敏度高达10 拷贝/l。在500 拷贝/l的野生型背景RNA下,其敏感性达1%,在5000 拷贝/l的野生型背景RNA下,其敏感性达0.5%。而且对正常人白细胞RNA以及血浆RNA检测,均未见非特异性扩增,显示该方法具有较高特异性。在对3例FISH阳性标本进行检测时,2例出现阳性,显示qRT-PCR和FISH检测结果具有高度可比性。另1例未检出,原因与RNA提取失败有关。对于石蜡组织标本,RNA在标本制备和保存过程中降解明显,因此可能导致RNA提取失败,无法采用qRT-PCR法进行检测。因此,与文献报道和指南推荐一致[12- 13],使用qRT-PCR检测EML4-ALK融合基因时优先推荐新鲜标本,其次为冰冻标本,最后为石蜡组织标本。目前,国内外报道的qRT-PCR方法的检测灵敏度为1~100 拷贝/l[14- 16],本研究建立的方法亦具有相似甚至更高的检测灵敏度,达到10 拷贝/l,并且涵盖EML4-ALK融合基因的类型高达15种(V1、V2、V3a、V3b、V4、V4’、V5a、V5b、V5’、V6、V7、V8a、V8b、COSF731、COSF733),占ALK融合基因70%以上,高于国家食品药品监督管理局批准的厦门艾德EML4-ALK融合基因试剂盒所覆盖的类型。与测序法相比,该方法仅能检测已知融合类型,不能探索和发现新的融合类型,此为局限。同时在下一步研究中,拟新设反应管,加入KIF5B-ALK[17]、TRK-ALK[18]、KLC1-ALK[19]、PTPN3-ALK[20]以及STRN-ALK[20]融合基因检测,以涵盖目前文献所报道的全部ALK融合基因类型。另外,本研究临床样本检测少,下一步需要进行更大规模的临床样本检测,并与厦门艾德EML4-ALK试剂盒、ALK-D5F3 Ventana IHC以及雅培FISH法相比较,更加全面系统评价该方法的优劣。
综上,本研究构建的qRT-PCR法是一种高灵敏度和特异性的EML4-ALK融合基因检测方法,使用方便、价格低廉,值得在临床上进一步推广。
[1]Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer [J]. N Engl J Med, 2013,368(25): 2385- 2394.
[2]Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer [J]. N Engl J Med, 2014,371(23): 2167- 2177.
[3]Wu YC, Chang IC, Wang CL, et al. Comparison of IHC, FISH and RT-PCR methods for detection of ALK rearrangements in 312 non-small cell lung cancer patients in Taiwan [J]. PLoS One, 2013,8(8): e70839.
[4]Sasaki T, Rodig SJ, Chirieac LR, et al. The biology and treatment of EML4-ALK Non-small cell lung cancer [J]. Eur J Cancer, 2010,46(10): 1773- 1780.
[5]Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK-rearranged non-small-cell lung cancer [J]. N Engl J Med, 2014,370(13): 1189- 1197.
[6]Gadgeel SM, Gandhi L, Riely GJ, et al. Safety and activity of alectinib against systemic disease and brain metastases in patients with crizotinib-resistant ALK-rearranged non-small-cell lung cancer (AF- 002JG): results from the dose-finding portion of a phase 1/2 study [J]. Lancet Oncol, 2014,15(10): 1119- 1128.
[7]Camidge DR, Skokan M, Kiatsimkul P, et al. Native and rearranged ALK copy number and rearranged cell count in non-small cell lung cancer: implications for ALK inhibitor therapy [J]. Cancer, 2013, 119(22): 3968- 3975.
[8]Wang J, Cai Y, Dong Y, et al. Clinical characteristics and outcomes of patients with primary lung adenocarcinoma harboring ALK rearrangements detected by FISH, IHC, and RT-PCR [J]. PLoS One, 2014,9(7): e101551.
[9]Minca EC, Portier BP, Wang Z, et al. ALK status testing in non-small cell lung carcinoma: correlation between ultrasensitive IHC and FISH [J]. J Mol Diagn, 2013, 15(3): 341- 346.
[10]Wynes MW, Sholl LM, Dietel M, et al. An international interpretation study using the ALK IHC antibody D5F3 and a sensitive detection kit demonstrates high concordance between ALK IHC and ALK FISH and between evaluators [J]. J Thorac Oncol, 2014,9(5): 631- 638.
[11]Ali G, Proietti A, Pelliccioni S, et al. ALK rearrangement in a large series of consecutive non-small cell lung cancer: comparison between a new immunohistochemical approach and fluorescence in situ hybridization for the screening of patients eligible for crizotinib treatment [J]. Arch Pathol Lab Med, 2014,138(11): 1449- 1458.
[12]张绪超, 陆舜, 张力, 等. 中国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊断专家共识(2013版) [J]. 中华病理学杂志, 2013,42(6): 402- 406.
[13]冯勤, 杨欣, 林冬梅. ALK阳性非小细胞肺癌的诊断 [J]. 中国肺癌杂志, 2015,18(2): 61- 68.
[14]Robesova B, Bajerova M, Liskova K, et al. TaqMan based real time PCR assay targeting EML4-ALK fusion transcripts in NSCLC [J]. Lung Cancer, 2014, 85(1): 25- 30.
[15]Fu S, Wang F, Shao Q, et al. Detection of EML4-ALK fusion gene in Chinese non-small cell lung cancer by using a sensitive quantitative real-time reverse transcriptase PCR technique [J]. Appl Immunohistochem Mol Morphol, 2015, 23(4): 245- 254.
[16]Soda M, Isobe K, Inoue A, et al. A prospective PCR-based screening for the EML4-ALK oncogene in non-small cell lung cancer [J]. Clin Cancer Res, 2012,18(20): 5682- 5689.
[17]Takeuchi K, Choi YL, Togashi Y, et al. KIF5B-ALK, a novel fusion oncokinase identified by an immunohistochemistry-based diagnostic system for ALK-positive lung cancer [J]. Clin Cancer Res, 2009,15(9): 3143- 3149.
[18]Rikova K, Guo A, Zeng Q, et al. Global survey of phosphotyrosine signaling identifies oncogenic kinases in lung cancer [J]. Cell, 2007,131(6): 1190- 1203.
[19]Togashi Y, Soda M, Sakata S, et al. KLC1-ALK: a novel fusion in lung cancer identified using a formalin-fixed paraffin-embedded tissue only [J]. PLoS One, 2012,7(2): e31323.
[20]Hallberg B, Palmer RH. Mechanistic insight into ALK receptor tyrosine kinase in human cancer biology [J]. Nat Rev Cancer, 2013,13(10): 685- 700.
Detection of Echinoderm Microtubule Associated Protein Like 4-Anaplastic Lymphoma Kinase Fusion Genes in Non-small Cell Lung Cancer Clinical Samples by a Real-time Quantitative Reverse Transcription Polymerase Chain Reaction Method
ZHAO Jing1, ZHAO Jin-yin2, CHEN Zhi-xia1, ZHONG Wei1, LI Long-yun1, LIU Li-cheng2, HU Xiao-xu2, CHEN Wei-jun2, WANG Meng-zhao1
1Department of Respiratory Medicine, PUMC Hospital, CAMS and PUMC, Beijing 100730, China2Key Laboratory of Genome Sciences and Information, Beijing Institute of Genomics,Chinese Academy of Sciences, Beijing 100029, China
WANG Meng-zhao Tel: 010- 69155039, E-mail: mengzhaowang@sina.com
Objective To establish a real-time quantitative reverse transcription polymerase chain reaction assay (qRT-PCR) for the rapid, sensitive, and specific detection of echinoderm microtubule associated protein like 4-anaplastic lymphoma kinase (EML4-ALK) fusion genes in non-small cell lung cancer. Methods The specific primers for the four variants of EML4-ALK fusion genes (V1, V2, V3a, and V3b) and Taqman fluorescence probes for the detection of the target sequences were carefully designed by the Primer Premier 5.0 software. Then, using pseudovirus containing EML4-ALK fusion genes variants (V1, V2, V3a, and V3b) as the study objects, we further analyzed the lower limit, sensitivity, and specificity of this method. Finally, 50 clinical samples, including 3 ALK-fluorescence in situ hybridization (FISH) positive specimens, were collected and used to detect EML4-ALK fusion genes using this method. Results The lower limit of this method for the detection of EML4-ALK fusion genes was 10 copies/l if no interference of background RNA existed. Regarding the method’s sensitivity, the detection resolution was as high as 1% and 0.5% in the background of 500 and 5000 copies/l wild-type ALK gene, respectively. Regarding the method’s specificity, no non-specific amplification was found when it was used to detect EML4-ALK fusion genes in leukocyte and plasma RNA samples from healthy volunteers. Among the 50 clinical samples, 47 ALK-FISH negative samples were also negative. Among 3 ALK-FISH positive samples, 2 cases were detected positive using this method, but another was not detected because of the failure of RNA extraction. Conclusion The proposed qRT-PCR assay for the detection of EML4-ALK fusion genes is rapid, simple, sensitive, and specific, which is deserved to be validated and widely used in clinical settings.
non-small cell lung cancer; echinoderm microtubule associated protein like 4-anaplastic lymphoma kinase fusion gene; real-time quantitative reverse transcription polymerase chain reaction
王孟昭 电话:010- 69155039,电子邮件:mengzhaowang@sina.com
R734.2
A
1000- 503X(2016)06- 0643- 07
10.3881/j.issn.1000- 503X.2016.06.004
2015- 10- 10)

