顺铂肾损害大鼠三七总皂苷干预前后尿液的核磁共振代谢组学分析
黄振光,杨玉芳,邹小琴,黄春,周金玲
(广西医科大学第一附属医院,南宁530021)
·论著·
顺铂肾损害大鼠三七总皂苷干预前后尿液的核磁共振代谢组学分析
黄振光,杨玉芳,邹小琴,黄春,周金玲
(广西医科大学第一附属医院,南宁530021)
目的 应用核磁共振(NMR)代谢组学方法,分析三七总皂苷(PNS)干预顺铂肾损害大鼠前后的尿液代谢物变化,为研究PNS防治顺铂肾损害的机制提供依据。方法 选择雄性SD大鼠45只,分为正常对照组、顺铂组及PNS组各15只。顺铂组、PNS组第1天先给予腹腔注射单剂量顺铂5 mg/kg制备顺铂肾损害模型。PNS组第1天腹腔注射单剂量顺铂后再给予腹腔注射PNS 31.35 mg/kg,第2~8天继续腹腔注射PNS 31.35 mg/kg。正常对照组第1~8天予腹腔注射生理盐水31.35 mg/kg。应用NMR代谢组学方法,取各组第1、4、8天的尿液标本500 μL,离心后取上清500 μL置于核磁管中,使用Varian 600磁谱仪检测尿液,得到NMR图谱。对归一化后的NMR图谱数据采用SIMCA-P+软件进行模式识别多变量分析,采用中心化换算的数据标度换算方式进行主成分分析(PCA),采用自适换算的数据标度换算方式进行偏最小二乘判别分析(PLS-DA),采用正交偏最小二乘法-判别分析(OPLS-DA)对PLS-DA 模型进行正交校正处理。通过对OPLS-DA的分析以及通过分析各代谢物相应的相关系数,筛选有统计学意义的差异代谢物。根据差异代谢物的KEGG数据库ID在KEGG数据库中进行映射,得到差异性代谢物的代谢通路。结果 正常对照组、顺铂组和PNS组的尿液NMR图谱包含有一系列的代谢物,包括乙酰乙酸、丙酮、甲酸、柠檬酸、葡萄糖等。PCA、PLS-DA和OPLS-DA等多元分析显示,第1、4和8天,顺铂组、PNS组均与正常对照组有显著差异,而顺铂组与PNS组之间有部分重叠。第8天,顺铂组β-葡萄糖、α-葡萄糖、麦芽糖和乙醇胺低表达,而丙酮酸、琥珀酸和α-酮戊二酸高表达;与顺铂组比较,PNS组β-葡萄糖、α-葡萄糖、麦芽糖和乙醇胺高表达,而丙酮酸、琥珀酸和α-酮戊二酸低表达,PNS将表达异常的代谢物回调。各组间的尿液差异代谢物涉及氨基酸的生物合成、柠檬酸循环、糖酵解/糖异生途径、戊糖磷酸途径、甘油磷脂代谢、丙酮酸代谢、酮体合成和降解、苯丙氨酸代谢等代谢通路。结论 顺铂肾损害大鼠尿液中的代谢物发生改变,PNS可改善其中部分代谢物的变化,涉及能量代谢、糖代谢、氨基酸代谢和脂肪代谢等多个通路,可能是PNS对顺铂肾损害大鼠发挥防治作用的机制之一。
三七总皂苷;顺铂;肾损害;核磁共振;差异代谢物;尿液;代谢组学
顺铂是治疗各种恶性肿瘤尤其是实体瘤的首选药物之一,但顺铂的肾毒性严重影响其在临床上的应用。目前,顺铂诱导肾损害的分子机制尚未阐明,临床尚缺乏防治顺铂肾损害的有效措施。研究发现,顺铂诱导肾损害可能涉及多种机制,如DNA损伤、炎症反应、氧化应激[1]、细胞凋亡等[2]。三七总皂苷(PNS)提取自传统中草药三七,具有抗凋亡[3]、改善免疫功能和增强顺铂抗肿瘤的作用[4],对肾脏疾病具有保护作用[5,6]。研究发现,PNS可降低顺铂诱导的血清Scr和BUN水平[7],其保护顺铂肾损害作用可能与其降低氧化损伤有关[8]。目前,PNS保护顺铂肾损害的分子机制尚未明确,PNS干预后的尿液代谢物变化情况尚不明确。高通量技术是一类可快速检测和处理大量样本和信息的技术,具有信息量大、敏感性高、可自动化分析复杂多因素等优势,可从整体水平上较全面、完整地阐述肾损害发生、发展的机制。因此,采用高通量技术研究顺铂肾损害的分子机制,有助于对顺铂肾损害可能涉及的多种通路进行研究。核磁共振图谱法(NMR)是代谢组学的一种技术,是基于具有自旋性质的原子核在核外磁场作用下,吸收射频辐射而产生能级跃迁的一种谱学技术。NMR以高通量检测和数据处理为手段,可系统地研究生物标本中的代谢产物,用以探讨药物毒性或治疗作用及其机制,已广泛用于疾病诊断和进展预测、药物治疗作用及其机制的研究等[9]。2013年9月~2014年12月,我们采用NMR代谢组学方法,分析PNS干预顺铂肾损害大鼠后的尿液代谢物变化,为研究PNS防治顺铂肾损害的机制提供依据。
1 材料与方法
1.1 动物、试剂及仪器 雄性SD大鼠15只,体质量(200±20)g,由广西医科大学实验动物中心提供,经广西医科大学动物伦理委员会批准。顺铂粉针剂购自齐鲁制药有限公司;三七总皂苷粉针剂购自广西梧州制药(集团)股份有限公司;尿素氮(BUN)、肌酐(Scr)、β-N-乙酰胺基葡萄糖苷酶(NAG)试剂盒购自南京建成生物工程研究所;氘代氯仿(CDCl3)、重水(D2O)、三甲基硅基丙酸钠(TSP)购自Cambridge Isotope Laboratories公司(USA)。核磁共振光谱仪Varian 600型 (An INOVA,600 MHz)为美国 Varian INOVA公司产品;核磁共振管为美国Wilmad-Labglass公司产品。
1.2 动物分组、模型制备及干预方法 SD大鼠随机分为正常对照组、顺铂组及PNS组,每组各45只。均自由进食、饮水,适应性饲养1周。顺铂、PNS给药剂量参照成人临床常用剂量换算标准及本课题组前期研究结果[10]确定。顺铂组第1天先给予腹腔注射单剂量顺铂5 mg/kg,再腹腔注射生理盐水31.35 mg/kg,第2~8天继续腹腔注射生理盐水31.35 mg/kg,制备顺铂肾损害模型。PNS组第1天先给予腹腔注射单剂量顺铂5 mg/kg,再给予腹腔注射PNS 31.35 mg/kg,第2~8天继续腹腔注射PNS 31.35 mg/kg。正常对照组第1~8天予腹腔注射生理盐水31.35 mg/kg。各组腹腔注射均为1次/d。基于本课题组前期研究数据[3],各组腹腔注射后第1、4、8天顺铂组血清Cr、BUN水平和尿液N-乙酰-β-D-氨基葡萄糖苷酶(NAG)水平升高,肾组织病理检查示肾组织损伤明显,证实顺铂肾损害的大鼠模型制作成功;PNS组血清Cr、BUN水平和尿液NAG水平较顺铂组下降,肾组织损伤明显改善,证实PNS对其有一定保护作用。
1.3 尿液NMR图谱数据采集 取各组第1、4、8天的尿液标本500 μL,置于1.5 mL离心管中,加入100 μL的1 000 mmol/L PB溶液,涡旋混匀,室温放置5 min后,4 ℃ 12 000 r/min离心10 min,取上清500 μL置于核磁管中检测。使用Varian 600磁谱仪检测尿液,1H共振频率为599.91 Hz,横向弛豫加权采用NOESY序列,弛豫延迟2 s,采集时间1.113 6 s,谱宽7 183.9 Hz,温度25 ℃,得到NMR图谱。
1.4 尿液NMR图谱数据处理 所有NMR图谱均采用MestReNova软件(V7.1)进行傅立叶变换、相位调整、基线校正和定标等归一化处理。为提高信噪比,图谱在进行傅立叶变换时均乘以增宽因子为1 Hz的指数窗函数。对于尿液CPMG脉冲序列数据,积分区间设为0.5~9.5 ppm,积分间距设为0.005 ppm,同时去除区间6.60~4.22 ppm的尿素峰和水峰。
1.5 尿液NMR图谱数据多变量分析 对归一化后的图谱数据采用SIMCA-P+软件进行模式识别多变量分析。采用中心化换算的数据标度换算方式进行主成分分析(PCA),采用自适换算的数据标度换算方式进行偏最小二乘判别分析(PLS-DA),采用12折交叉验证法对模型的质量进行验证,并用验证得到的模型可解释变量(R2X、R2Y)和可预测度(Q2)评判模型的有效性。以解释模型的变异和预测能力的模型参数R2和Q2显著升高(R2及Q2均>0.5),表明是优秀的模型。采用正交偏最小二乘法-判别分析(OPLS-DA)对PLS-DA 模型进行正交校正处理,并使用自适换算的数据标度换算方式。
1.6 尿液差异代谢物的筛选与鉴定 通过对OPLS-DA的分析以及通过分析各代谢物相应的相关系数,对有统计学意义的代谢物进一步归纳。在相关系数图中,将每一个变量的载荷值与其标准偏差的平方根值相乘,然后进行数据的回溯转换,并与相应的相关系数临界值表进行比对,以相关系数r的绝对值>0.553认为是有意义的差异物,得到差异代谢物。根据差异代谢物的KEGG数据库ID在KEGG数据库中进行映射,整理出代谢物映射到的所有代谢通路,将代谢物按通路分类,整理出某一通路中所有的差异代谢物。
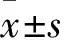
2 结果
2.1 各组尿液NMR图谱分析 通过大鼠尿液NMR谱分析,检测到的代谢物类型包括氨基酸如异亮氨酸(Ile)、缬氨酸(Val)、丙氨酸(Ala)、甘氨酸(Gly)等,糖类如葡萄糖(Glc)和麦芽糖(Mal),盐类如乙酰乙酸(AA)、丙酮(Act)、柠檬酸(Cit)、甲酸(For)等。
2.2 尿液NMR图谱PCA分析结果 尿液样本代谢数据PCA分析示,顺铂暴露1d后,R2X=67.4%,Q2=-0.195,三组标本的分布均有重叠,组间区分不明显;其中,正常对照组标本分布较集中,主要分布在第2和第4象限;顺铂组和PNS组标本分布比较分散,两组之间的差异较小。顺铂暴露第4天,R2X=67.4%,Q2=0.512,顺铂组、PNS组均与正常对照组有明显区分,而顺铂组和PNS组之间有部分重叠。第8天,R2X=74.7%,Q2=0.474,正常对照组和其他两组间有显著差异,顺铂组和PNS组间虽有少数标本重叠,但两组之间分布仍有显著差异。
2.3 尿液NMR图谱PLS-DA分析结果PLS-DA模型显示,第1天,3组间均存在明显差异。第4、8天,顺铂组、PNS组均与正常对照组有明显差异;PNS组少数标本混合到顺铂组的集群,表明这两个组的代谢有部分重叠。第4、8天时PLS-DA模型得分图、验证图见图1、2。
2.4 尿液NMR图谱OPLS-DA分析结果 经OPLS-DA分析,第1天各组之间均有明显差异。第4、8天顺铂组、PNS组均与正常对照组有显著差异;第4、8天虽然PNS组有个别样本混合到顺铂组的样本集群中,但两组间仍有明显区分。PLS-DA和OPLS-DA模型质量评估参数见表1。
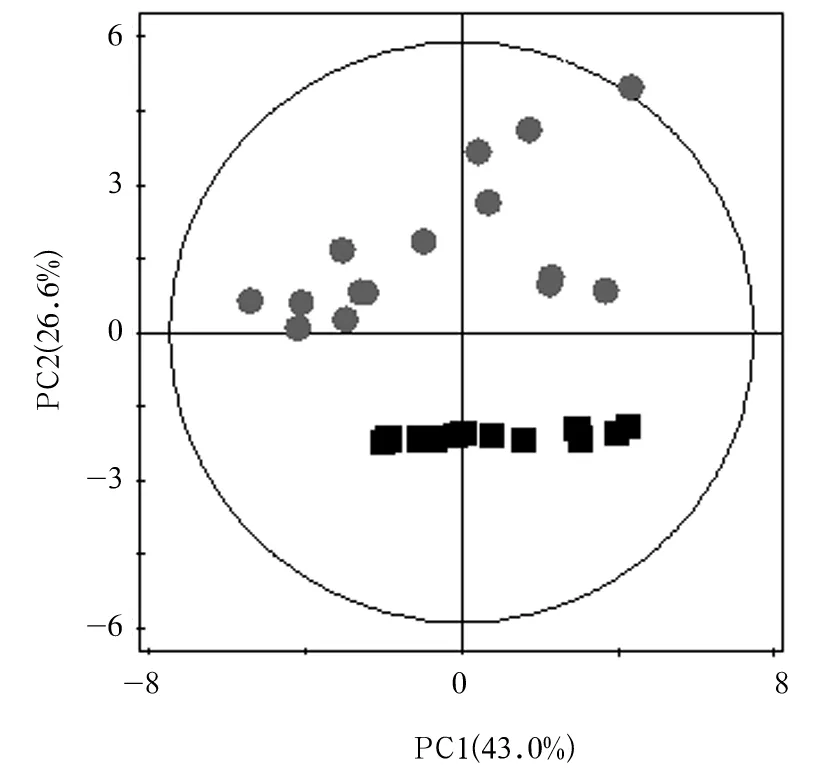
注:■示正常对照组,● 示顺铂组。PC1为第一主成分,PC2为第二主成分。
图1 第4天时尿液PLS-DA得分图
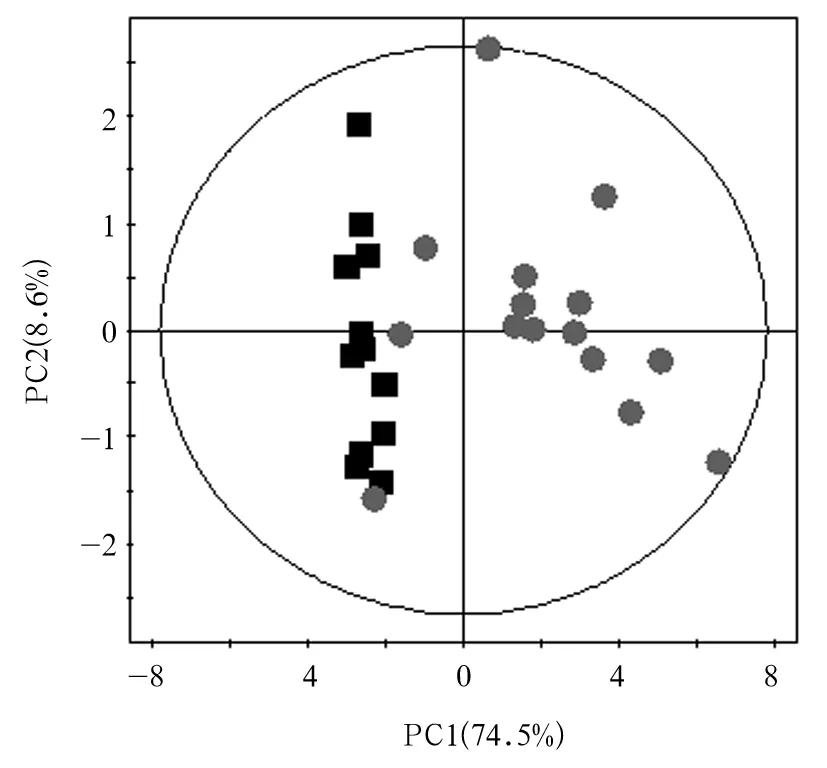
注:■示正常对照组,●示PNS组。PC1为第一主成分,PC2为第二主成分。
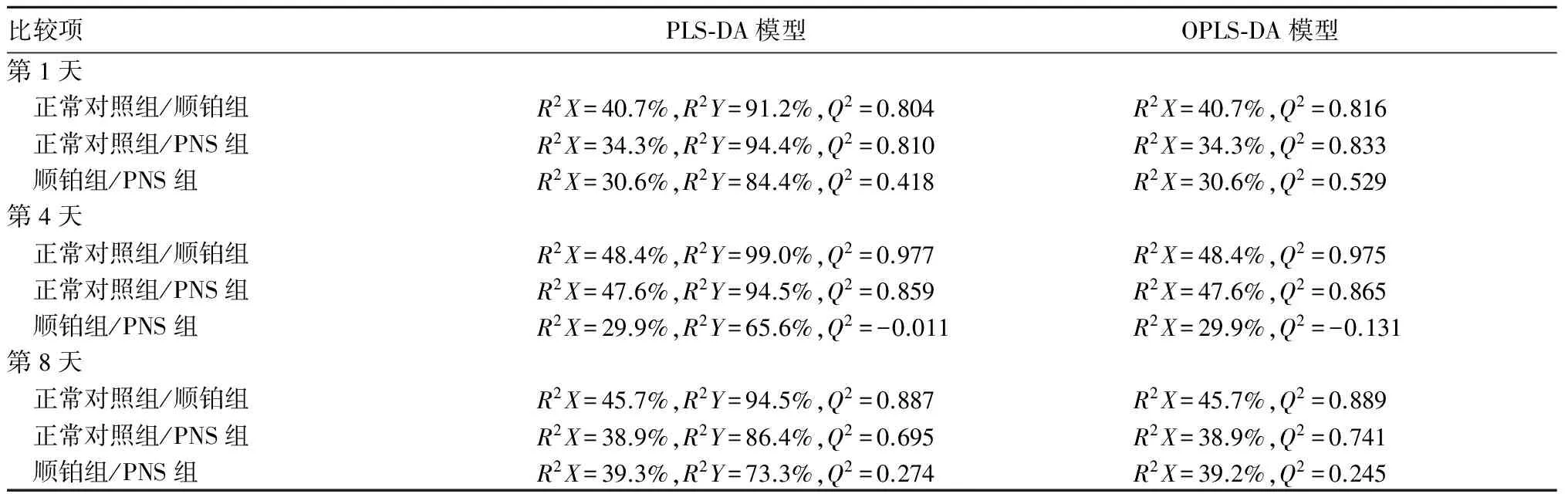
图2 第8天时尿液PLS-DA得分图
2.5 差异代谢物的筛选与鉴定 根据OPLS-DA分析结果,得出各组之间的差异代谢物。各组间的主要差异性代谢物相关系数见表2。顺铂暴露后第1、4、8天,各组大鼠之间的尿液代谢成分均存在差异。
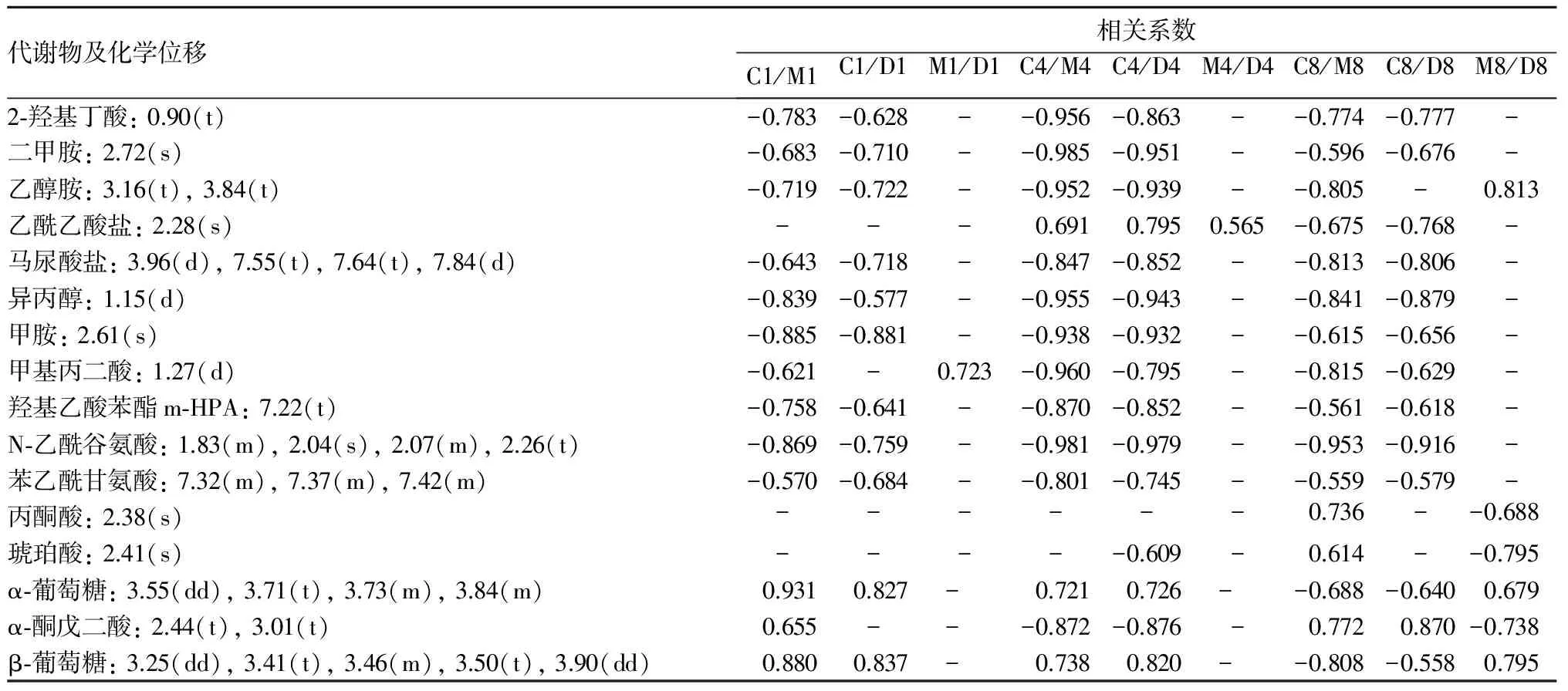
表2 各组间存在的主要差异代谢物相关系数
注:“-”为相关系数绝对值小于0.553。C、M、D分别代表正常对照组、顺铂组、PNS组,其后的数字代表天数。
2.6 差异代谢物涉及的代谢通路分析 基于KEGG数据库,各组之间的尿液差异代谢物涉及的代谢通路包括氨基酸的生物合成、柠檬酸循环(TCA循环)、糖酵解/糖异生途径、戊糖磷酸途径、甘油磷脂代谢、丙酮酸代谢、酮体合成和降解、苯丙氨酸代谢等,涉及能量代谢、糖代谢、氨基酸代谢和脂肪代谢等多个通路。
3 讨论
顺铂属于周期非特异性、高效广谱抗肿瘤药物,是临床上应用最广泛的化疗药物之一,当前临床采用的多数联合化疗方案中均有顺铂。但顺铂的疗效和肾毒性均与顺铂的剂量成正比,其肾损害严重时可致急性肾功能衰竭,而顺铂减量或停药将影响患者化疗的连续性,导致患者生活质量严重恶化。目前,尚缺乏有效的保护顺铂肾损害的药物。因此在保留顺铂抗肿瘤作用的同时,如何降低其肾毒性是临床上急需解决的难题。PNS含有三七皂苷Rl和人参皂苷Rg1、Rb1、Re等多种有效成分,故具有多种药理作用,包括抗氧化、抗凋亡[11]、提高免疫功能、增强顺铂的抗肿瘤作用[4]。近年发现,PNS对肾脏疾病[5,6]包括顺铂肾损害有防治作用[7,8]。因此研究PNS对顺铂肾损害的保护有重要的意义。
顺铂诱导肾损伤的分子机制及PNS的防治作用机制均涉及多个通路、多个环节,如炎症反应、氧化应激[1,8]、凋亡等[2,3]。代谢组学方法是研究生物体受到内、外界刺激时代谢产物变化的一种高通量分析技术。代谢组学技术检测到的生化变化可以很容易地与传统的检测结果相联系,从而更全面地评价药物或毒物对靶器官的作用。NMR是利用原子核在磁场中的能量变化而获得相关核信息的代谢组学技术,参照一定的规则或标准的氢谱比照,可直接鉴定出代谢物的化学成分,而信号的相对强弱则反映各成分的相对含量。NMR以高通量检测和数据处理为手段,具有无损伤性、不破坏样品的结构和性质、可在一定的温度和缓冲范围内进行生理条件或接近生理条件的实验等优势,可用于研究药物治疗作用及其机制[12]等。本研究发现,经PCA、PLS-DA和OPLS-DA等多变量模式识别分析可见,顺铂暴露后第1、4、8天,顺铂组、PNS组均与正常对照组有明显的区分;与正常对照组比较,顺铂组和PNS组尿液的差异代谢物特点是低水平的2 -羟基丁酸酯、乙酰胺、苯甲酸、乙醇胺、马尿酸、异丙醇、甲胺、甲基胍、丙二酸二甲酯、N-乙酰谷氨酸等,以及高水平的丙氨酸、乳酸、甘氨酸、氧化三甲胺等;虽然在顺铂组和PNS组之间有部分重叠,但仍可看到这两个组之间存在差异,出现一系列差异代谢物,提示PNS组与顺铂组部分代谢通路相同。以上结果说明,采用NMR代谢组学方法研究尿液代谢物变化有助于区分顺铂组、PNS组和正常对照组。
丙酮酸是重要的能量物质和生理抗氧剂,在糖、脂肪和氨基酸三大营养物质的代谢中发挥关键作用。丙酮酸可升高肝脏的琥珀酸、乳酸等水平,以增强糖酵解,维持肝脏高水平的ATP,改善氧化还原状态[13];而且丙酮酸能快速提供ATP和GTP,从而改善酒精性肝病患者的肝功能[10],以及能够改善多种组织的缺血再灌注损伤[13]。另外,丙酮酸、琥珀酸和α-酮戊二酸通过三羧酸循环或糖酵解参与ATP 生成,维持细胞的基本功能。本研究发现,第8天时,与正常对照组比较,顺铂组和(或)PNS组的丙酮酸、琥珀酸和α-酮戊二酸水平升高,而β-葡萄糖、α-葡萄糖和麦芽糖水平下降;丙酮酸、琥珀酸和α-酮戊二酸在PNS组比顺铂组显著下降,而PNS组β-葡萄糖、α-葡萄糖和麦芽糖比顺铂组显著升高,即PNS可使顺铂诱导改变的代谢物向正常对照组的水平回调。以上研究结果提示,大鼠暴露于顺铂后,可出现能量代谢障碍,尤其是线粒体三羧酸循环能量生成不足,可能是顺铂肾损害的主要机制之一。
乙醇胺是哺乳动物和细菌的细胞膜中的主要成分,可来自于食物或体内丝氨酸的转换。乙醇胺和甘油二酯一起合成磷脂酰乙醇胺(PE),PE甲基化后可以转换为磷脂酰胆碱(PC)。PE 和PC 是细胞膜、线粒体膜和内质网等细胞的各种膜结构的主要成分[14];PE和肌醇浓度的光谱变化反映细胞膜的周转。有报道在体内外肝细胞增殖需要有足够的PE,而乙醇胺是合成PE所需的营养因子,乙醇胺可显著提高肝细胞膜的PE水平,从而刺激肝细胞增殖[15]。由此可见,乙醇胺可影响细胞的增殖。本研究发现,在第1、4和第8天,与正常对照组比较,在顺铂组、PNS组乙醇胺低表达;而第8天乙醇胺在PNS组比在顺铂组表达升高,即PNS可升高顺铂诱导下降的乙醇胺,提示顺铂使乙醇胺表达下降,可影响细胞的膜代谢,尤其是线粒体膜合成的损伤,最终导致线粒体再生和能量合成受到损害。本研究发现,PNS 能升高乙醇胺表达,在第8天使之回调到正常对照组的水平,可能是顺铂肾损害和PNS防治作用的机制之一。
在代谢通路分析方面,本研究发现,各组出现的尿液差异代谢物所涉及的代谢通路主要包括TCA循环、碳水化合物的消化和吸收、糖酵解/糖异生途径、磷酸戊糖途径、酮体的生成和降解、淀粉和蔗糖代谢、丙酮酸代谢、氨基酸生物合成、蛋白质消化吸收等,这些差异代谢物及其所涉及的代谢通路主要集中在能量代谢过程,反映了代谢变化的广泛性和复杂性,提示能量代谢模式发生改变以及线粒体功能受损伤可能是顺铂肾损害的主要机制。
综上所述,采用NMR代谢组学方法可对顺铂肾损害大鼠经PNS干预后的尿液代谢特点进行分析,顺铂肾损害大鼠尿液中的代谢物发生明显改变,尤其是与细胞能量代谢的改变有关;PNS干预对顺铂肾损害大鼠有一定的保护作用,可体现在改善尿液代谢物的变化,尤其是使丙酮酸、琥珀酸等向正常水平回调。
[1] Kodama A, Watanabe H, Tanaka R, et al. Albumin fusion renders thioredoxin an effective anti-oxidative and anti-inflammatory agent for preventing cisplatin-induced nephrotoxicity[J]. Biochim Biophys Acta, 2014,1840(3):1152-1162.
[2] Domitrovi R, Cvijanovi O, Pernjak-Pugel E, et al. Berberine exerts nephroprotective effect against cisplatin-induced kidney damage through inhibition of oxidative/nitrosative stress, inflammation, autophagy and apoptosis[J]. Food Chem Toxicol, 2013,62:397-406.
[3] Liu X, Huang Z, Zou X, et al. Panax notoginseng saponins attenuates cisplatin-induced nephrotoxicity via inhibiting the mitochondrial pathway of apoptosis[J]. Int J Clin Exp Pathol,2014,7(12):8391-8400.
[4] Zhang C, Tong X, Qi B,et al. Components of panax notoginseng saponins enhance the cytotoxicity of cisplatin via their effects on gap junctions[J]. Mol Med Rep, 2013,8(3):897-902.
[5] Liu WJ, Tang HT, Jia YT, et al. Notoginsenoside R1 attenuates renal ischemia-reperfusion injury in rats [J].Shock, 2010,34(3):314-320.
[6] 冯胜刚,李光明,谢席胜,等. 三七总皂甙对UUO大鼠肾小管间质病理损害的作用[J].现代预防医学, 2007,34(18):3449-3452.
[7] Xinwen L, Zhenguang H, Xiaoqin Z, et al. Possible mechanism of PNS protection against cisplatin-induced nephrotoxicity in rat models[J]. Toxicol Mech Methods, 2015,25(5):347-354.
[8] 席加喜,刘晓霞,杨玉芳,等.血栓通对顺铂肾损伤大鼠的肾功能和氧化指标的影响[J]. 中国实验方剂学杂志,2012,18(10):263-266.
[9] 李修阳,张宁,任健,等.多囊卵巢综合征痰湿证患者血清代谢组学分析及其生物标志物筛选[J].山东医药,2015,55(37):15-18.
[10] Petkova I, Mateva L, Beniozef D, et al. Sodium pyruvate infusions in patients with alcoholic liver disease. Preliminary report[J]. Acta Physiol Pharmacol Bulg, 2000,25(3-4):103-108.
[11] Chen S, Liu J, Liu X,et al. Panax notoginseng saponins inhibit ischemia-induced apoptosis by activating PI3K/Akt pathway in cardiomyocytes[J]. J Ethnopharmacol, 2011,137(1):263-270.
[12] Kwon HN, Kim M, Wen H, et al. Predicting idiopathic toxicity of cisplatin by a pharmacometabonomic approach[J]. Kidney Int, 2011, 79(5): 529-537.
[13] So PW, Fuller BJ. Enhanced energy metabolism during cold hypoxic organ preservation: studies on rat liver after pyruvate supplementation[J]. Cryobiology, 2003,46(3):295-300.
[14] Griffin JL, Pole JC, Nicholson JK, et al. Cellular environment of metabolites and a metabonomic study of tamoxifen in endometrial cells using gradient high resolution magic angle spinning 1H NMR spectroscopy[J]. Biochim Biophys Acta, 2003,1619(2):151-158.
[15] Kume H, Sasaki H. Ethanolamine modulates DNA synthesis through epidermal growth factor receptor in rat primary hepatocytes[J]. In Vitro Cell Dev Biol Anim, 2006,42(1-2):20-26.
Nuclear magnetic resonance metabonomics analysis of urine from rat with cisplatin-incuced nephrotoxicity before and after Panax notoginseng saponins intervention
HUANGZhenguang,YANGYufang,ZOUXiaoqin,HUANGChun,ZHOUJinling
(TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To metabonomically analyze the urine samples from rats with cisplatin-induced nephrotoxicity before and after Panax notoginseng saponins (PNS) treatment by 1H nuclear magnetic resonance-based metabonomics (1H NMR), in order to provide basis for the study of PNS protecting cisplatin-induced renal injury.Methods Forty-five male SD rats were randomly divided into the normal control group, the cisplatin-only group and the cisplatin-PNS group (n=15, in each group). Rats in the cisplatin-only group and the cisplatin-PNS group were exposed to a single dose of cisplatin 5 mg/kg to induce renal damage. Rats in the cisplatin-PNS group were injected with 31.35 mg/kg PNS from day 1 to day 8. After exposure to cisplatin for 1, 4 and 8 days, the urine samples were analyzed using 1H NMR combined with multivariate pattern recognition. After centrifugation, 500 μL of the supernatant was placed in a nuclear magnetic tube, and urine was detected using a Varian 600 magnetic spectrometer to obtain an NMR spectrum. The normalized NMR data were analyzed by SIMCA-P+software for pattern recognition. The principal component analysis (PCA) was carried out with centralization conversion. Partial least-squares discriminant analysis (PLS-DA) was carried out by using the adaptive conversion. Orthogonal partial least squares-discriminant analysis (OPLS-DA) was applied to orthogonally correct PLS-DA model. We screened the statistically significant metabolites through the analysis of OPLS-DA and by analyzing the corresponding correlation coefficient of each metabolite. The metabolic pathways of different metabolites were obtained by mapping ID in the KEGG database of different metabolites.Results The urine 1H NMR spectra from the normal control group, the cisplatin-only group and the cisplatin-PNS group contained many metabolites, including acetoacetate, acetone, citrate, formate and glucose. Additionally, the Multivariate analysis in PCA, PLS-DA and OPLS-DA showed that there was a significant difference between the normal control group and cisplatin-only group, cisplatin-PNS group, and there was a part overlap between the cisplatin-PNS group and the cisplatin-only group on day 1, 4 and 8. Moreover on day 8, the expression of β-glucose, α-glucose, maltose and ethanolamine was lower, while the expression of pyruvate, succinate and α-ketoglutarate was higher in the cisplatin-only group. However, the expression of β-glucose, α-glucose, maltose and ethanolamine was higher, while the expression of pyruvate, succinate and α-ketoglutarate was lower in the cisplatin-PNS group as compared with that of the cisplatin-only group, and PNS could significantly callback the metabolites with abnormal expression.The alterations of metabolic pathways mainly included biosynthesis of amino acids, citrate cycle, glycolysis/gluconeogenesis, pentose phosphate pathway, glycerol phospholipid metabolism, pyruvate metabolism, synthesis and degradation of ketone bodies and phenylalanine metabolism. Conclusion The metabolites in urine change after exposure to cisplatin in rats. PNS could improve some metabolites, such as energy metabolism, glucose metabolism, amino acid metabolism and fat metabolism, these may be important mechanisms in PNS protecting against cisplatin-induced renal injury.
Panax notoginseng saponins; Cisplatin; renal injury; nuclear magnetic resonance; differences metabolites; urine; metabonomics
国家自然科学基金资助项目(81260598,81560729)。
黄振光(1969-),男,本科,副主任药师,主要研究方向为药物不良反应监测。E-mail: 137109320@qq.com
简介:杨玉芳(1968-),女,研究生,主任药师,主要研究方向为药源性肾脏疾病的防治。E-mail: yyf_69@163.com
10.3969/j.issn.1002-266X.2016.46.001
R445.2;R446.12
A
1002-266X(2016)46-0001-06
2016-06-21)

