布鲁菌Ⅳ型分泌系统效应蛋白DK63-887基因缺失株的构建及鉴定
江雅丽,陈创夫,李志强,李 默,李 爽,王 震,张 欢,张 辉 ,郭 飞*
(1.新疆石河子大学生命科学学院,新疆石河子 832003;2.新疆石河子大学动物科技学院,新疆石河子 832000;3. 新疆石河子大学医学院,新疆石河子 832003)
布鲁菌Ⅳ型分泌系统效应蛋白DK63-887基因缺失株的构建及鉴定
江雅丽1,陈创夫2*,李志强2,李 默3,李 爽2,王 震2,张 欢2,张 辉2,郭 飞3*
(1.新疆石河子大学生命科学学院,新疆石河子 832003;2.新疆石河子大学动物科技学院,新疆石河子 832000;3. 新疆石河子大学医学院,新疆石河子 832003)
为了构建羊布鲁菌16M(简称16M)的DK63-887基因缺失株(16MΔDK63-887),探讨该基因与16M介导自噬的关系。利用同源重组和抗性替换的方法,以卡那基因替换DK63-887基因,获得突变株16MΔDK63-887。将亲本株16M、疫苗株M5-90、突变株16MΔDK63-887在相同条件下振荡培养,观察其生长趋势变化;将各菌株置于不同外界环境中,观察其生存率;将各菌株侵染小鼠巨噬细胞,比较它们在宿主细胞内的生存能力及RT-qPCR检测自噬相关基因的表达。成功获得了布鲁菌DK63-887基因缺失株且在20代内未发生回复性突变现象。与亲本株相比,16MΔDK63-887在体外培养生长趋势与亲本株相似,只是细菌的浓度存在一定差异;突变株在外界应激条件下生存能力低于亲本株;侵染4 h后缺失株胞内细菌数量明显下降;RT-qPCR检测到突变株的ULKI、Beclin1表达量均显著降低(P<0.01),结果表明,布鲁菌Ⅳ型分泌系统效应蛋白与16M介导的细胞自噬密切相关,为16M胞内寄生机制的研究奠定了基础。
布鲁菌;DK63-887基因;缺失株;自噬相关基因
布鲁菌病(Brucellosis)简称布病,是由布鲁菌(Brucella)引起的一种危害严重的人兽共患病,在世界各地都有广泛流行[1]。近年来其发病率在部分地区明显上升,特别是一些发展中国家[2]。布病严重危害畜牧业的发展,牛、羊、猪等主要家畜感染布鲁菌后,可造成大量流产、不孕、不育、死胎等,致使牲畜数量锐减,如新疆每年因布病流产、空怀等少生幼畜达100 万~140万头[3]。布鲁菌属于胞内寄生菌,其致病力主要表现在通过某些机制逃避或抑制巨噬细胞的杀菌作用,适应胞内环境并导致慢性感染[4-7]。
Ⅳ型分泌系统(type Ⅳ secretion systems,T4SS)是布鲁菌关键的毒力因子之一,该系统是由12个跨越细菌被膜的多蛋白复合物VirB1-12构成,在布鲁菌膜上形成一个“管道”。T4SS与布鲁菌胞内生存密切相关,布鲁菌一旦进入宿主细胞,新的环境就会刺激布鲁菌合成效应蛋白,随后就会通过T4SS向感染的宿主细胞“注射”效应蛋白。有研究发现,一些病原微生物分泌系统的效应蛋白与这些病原微生物激活的宿主细胞自噬密切相关[8],如贝氏柯克斯菌在感染巨噬细胞过程中可利用T4SS调节自噬体的形成以及影响自噬相关蛋白LC3和p62的表达[9]。目前,布鲁菌T4SS与自噬之间的关系还未见有报道。近年来,Myeni S等[10]已经鉴定出5种布鲁菌Ⅳ型分泌系统效应蛋白。随后,Döhmer P H等[11]利用牛布鲁菌(Brucellaabortus)感染巨噬细胞,感染后4 h检测到BAB1-1492基因编码sepA蛋白,并证明其是Ⅳ型分泌系统效应蛋白,推测sepA蛋白参与布鲁菌早期胞内生存途径的选择,从而改变含有布鲁菌的液泡(Brucella-containing vacuole,BCV)到达最终目的地。但这一分子机制还不清楚,此外该蛋白没有同源的已知蛋白使得研究更加困难。
根据GenBank公布的牛布鲁菌国际标准株2308的BABA1-1492基因序列通过Blast分析,我们发现羊布鲁菌16M的DK63-887的基因序列与其同源性达100%,本研究构建DK63-887基因缺失株,对其在体外应激和胞内生存进行评估并检测了自噬相关基因的表达。进一步揭示效应蛋白SEPA的功能,为16M胞内寄生机制的研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 羊布鲁菌(Brucellamelitensis,16M)为布鲁菌标准株,大肠埃希菌(Escherichiacoli)DH5α,由石河子大学人畜共患病实验室保存;pMD18-T simple载体,购自TaKaRa 公司;pUC19K质粒,军事医学科学院疾病预防控制所陈泽良研究员馈赠。
1.1.2 培养基与主要试剂BucellaBroth培养基及BucellaBroth Agar培养基,美国BD公司产品;胰蛋白胨(tryptone)、酵母提取物(yeast),英国Oxoid公司产品; T4 DNA连接酶、DNA Marker,TaKaRa公司产品;TaqDNA 聚合酶、dNTP、Mix、琼脂糖凝胶DNA胶回收试剂盒、高纯度质粒小提中量试剂盒,天根生化(北京)科技有限公司产品;其他均为国产分析纯试剂。
1.2 方法
1.2.1 引物合成 所用引物均由上海生工生物工程技术服务有限公司合成(表1)。
表1 PCR引物序列
Table 1 Sequences of PCR primers

引物Primer序列Sequences(5'→3')DK63-887-N-FCCTCGTTGACGCACCACCTTCDK63-887-N-RGACATTCATCCCAGGTGGCGGCTCTCTCCGCTCAAGGDK63-887-C-FTCTGGGGTTCGAAATGACCGAGGTCACGCAGGCAGCTTCDK63-887-C-RCGTTTGCTTTTTGCCAGAGDK63-887-N-FAGTGGAGCAGCGCCATAAADK63-887-FGAAACCATTGACCGGATTGTGCGDK63-887-RGCGCCTTAGGGTTCTGCTTCCACKan-FGCCACCTGGGATGAATGTCKan-RCGGTCATTTCGAACCCCAGABeclin1-FTACCGACTTGTTCCCTATGGBeclin1-RGGTCAAACTTGTTGTCCCAGULK1-FCTTCTTTCTGGACAAACAACGULK1-RGGTGCTGGAACATCTCATCAβ-actin-FGCTCTTTTCCAGCCTTCCTTβ-actin-RCAGCACTGTGTTGGCATAGA
1.2.2 DK63-887基因突变株载体的构建 根据DK63-887基因两侧的序列设计N端和C端同源臂引物。N端引物为:DK63-887-N-F和DK63-887-N-R;C端引物为:DK63-887-C-F和DK63-887-C-R。以布鲁菌标准株16M的基因组DNA为模板,扩增DK63-887基因的N端和C端同源臂。以pUC19质粒为模板,用引物Kan-F和Kan-R扩增卡那霉素抗性片段。利用融合PCR技术,将DK63-887基因的N端同源臂、卡那霉素抗性片段和C端同源臂进行融合扩增。然后将扩增后的PCR产物回收,连接pMD18-T simple载体,获得含有卡那霉素抗性替换的突变载体pMD-DK-Kan,转化DH5α,经PCR鉴定正确后,送测序公司测序。
1.2.3 DK63-887基因突变株的构建 将质粒pMD-DK-Kan电转化至16M的感受态细胞中,活化后涂布含氨苄和卡那霉素抗性的布鲁菌固体培养基上,37℃培养24 h~72 h,筛选单克隆。利用卡那替换目的基因的外部鉴定引物(DK63-887-N-F和DK63-887-C-R)进行PCR鉴定,以16M亲本株作为对照。并采用目的基因的内部鉴定引物(DK63-887-F和DK63-887-R)进行PCR鉴定,以16M亲本株作为对照。如果亲本株中不能扩增出目的片段,而克隆菌中能够扩增出预期大小的片段,则表明突变株构建正确。对于获得的重组突变株命名为16MΔDK63-887。
1.2.4 布鲁菌16MΔDK63-887遗传稳定性检测 将上述菌液PCR鉴定正确的布鲁菌16MΔDK63-887连续培养传至20代,在传代过程中对布鲁菌16MΔDK63-887的每代都分别以引物DK63-887-N-F、DK63-887-C-R和DK63-887-F、DK63-887-R依次进行菌液PCR检测,同时,以布鲁菌16M亲本株作为阳性对照,检测缺失株有没有发生回复性突变现象,并对其进行常规的生态学观察。
1.2.5 突变株和亲本株的生长曲线分析 从布鲁菌固体培养基平板上挑取新鲜单克隆菌落16M、M5-90、16MΔ DK63-887接种于 20 mL布鲁菌液体培养基中,37℃、180 r/min摇床培养至OD 600 nm≈0.6,然后将菌液稀释至 OD 600 nm≈0.2,置于 37℃、180 r/min摇床中培养。培养过程中每2 h取一次样,每次取100 μL,用终浓度为1 g/mL的甲醛固定灭活10 min,检测OD 600 nm的变化,直至细菌生长进入平台期,绘制 16M、M5-90、16MΔ DK63-887的生长曲线。
1.2.6 外界应激试验 将培养至对数生长期的16M、M5-90、16MΔ DK63-887菌液 12 000 r/min离心5 min,PBS漂洗3遍,进行细菌计数,取108CFU的细菌置于:①含1.5 mol/L(0.09 g/mL) NaCl的1 mL布鲁菌液体培养基中,37℃培养30 min;②pH2.5的1 mL布鲁菌液体培养基中,37℃培养30 min;③pH11.5的1 mL布鲁菌液体培养基中,37℃培养30 min;④pH7.0的1 mL布鲁菌液体培养基中,50℃条件下培养30 min。离心后弃去培养基,加入1 mL PBS吹打菌体,10倍梯度稀释后涂布布鲁菌固体培养基,CFU计数,观察16M、M5-90、16MΔDK63-887在高盐、低pH、高pH和热休克环境中的存活力,以正常培养的细菌作为对照。
1.2.7 布鲁菌16MΔDK63-887缺失株胞内生存试验 RAW264.7小鼠巨噬细胞在6孔板中培养,直至形成单层细胞,即细胞生长至80%的覆盖率(2.5×106个/mL),将16M、M5-90、16MΔDK63-887 以100∶1的MOI侵染细胞,在 37℃、体积分数为5%的CO2的培养箱中孵育45 min,弃去培养基,PBS漂洗3遍,洗去培养基中未感染的细菌,然后在含有50单位庆大霉素的培养基中继续孵育60 min杀死胞外菌,PBS漂洗3遍,然后在含有 25单位庆大霉素的培养基中继续孵育,于孵育后不同时间点(0、4、12 、24、48 h)弃去培养基,PBS漂洗3遍,用Triton X-100 (0.1 mL/L )裂解细胞,室温静置10 min,释放出胞内菌,将裂解液10倍梯度稀释后,每
个梯度取100 μL均匀涂布至无抗性的布鲁菌固体培养基上,记录平皿中细菌的数量。比较16M、M5-90、16MΔDK63-887在巨噬细胞内的生存能力。
1.2.8 RT-qPCR检测细胞自噬相关基因ULK1、Beclin1的mRNA表达水平 用16M、16MΔDK63-887侵染RAW264.7巨噬细胞,细菌:细胞按50∶1的个数比进行侵染细胞,并将侵染的RAW264.7细胞继续置于37℃、体积分数为5%的CO2培养箱中培养24 h;进行细胞总RNA的提取及反转录;并通过实时荧光定量PCR检测自噬相关基因表达。qPCR采用20 μL体系,PCR反应条件:95℃ 5 min;95℃ 15 s,58℃ 30 s,72℃ 30 s,40个循环。每孔设置3个重复对照,每组细胞每个时间点的细胞做3个重复,试验完成后用2-ΔΔCt法对试验数据进行分析。
2 结果
2.1 DK63-887基因突变株载体的构建
2.1.1 DK63-887基因同源臂及卡那霉素抗性基因PCR扩增 以16M强毒株为模板,扩增出DK63-887基因N端同源臂目的条带大小为604 bp和C端同源臂目的条带大小为757 bp(图1A,图1B);以pUC19K质粒为模板,扩增出卡那霉素抗性基因的目的条带大小为1 093 bp(图1C);所得到的目的条带大小均与预期相符。
2.1.2 DK63-887基因同源臂以及卡那霉素抗性基因融合PCR扩增 采用融合PCR方法将DK63-887基因的N端和C端同源臂与卡那霉素抗性基因融合到一起,扩增出的目的条带大小为2 454 bp(图2),结果与理论值相符。

A.基因N端;1~4.DK63-887基因;5.阴性对照;M.DNA 标准DL 2 000;B.基因C端;1~4.DK63-887基因;5.阴性对照;M.DNA 标准DL 2 000;C.卡那霉素抗性基因;1~6.卡那霉素抗性基因;7.阴性对照;M.DNA 标准DL 2 000
A.N-terminal of DK63-887 genes;1-4.DK63-887 gene;5.Negative control;M.DNA Marker DL 2 000;B.C-terminal of DK63-887 genes;1-4.DK63-887 genes;5.Negative control;M.DNA Marker DL 2 000;C.Kanamycin resistance gene;1-6.Kanamycin resistance gene;7.Negative control;M.DNA Marker DL 2 000
图1 DK63-887基因同源臂及卡那霉素抗性基因PCR扩增
Fig.1 PCR amplification of DK63-887 gene homologous arms and kanamycin resistance gene

M.DNA 标准DL 5 000;1~6.融合PCR产物;7.阴性对照
M.DNA Marker DL 5 000;1-6.Fusion PCR products;7.Negative control
图2 DK63-887基因同源臂与卡那霉素抗性基因融合PCR扩增
Fig.2 The PCR amplification of fusion DK63-887 gene homologous arms and kanamycin resistance gene
2.1.3 DK63-887基因突变株载体的构建及鉴定 用引物DK63-887-N-F和DK63-887-C-R对阳性单克隆菌落进行菌液PCR鉴定,扩增出预期大小为2 454 bp的目的条带(图3);将菌液PCR鉴定正确的菌株进行增殖培养,并将菌液PCR鉴定正确的菌送北京六合华大基因生物技术有限公司测序。
2.2 DK63-887基因突变株的构建
通过采用外部鉴定引物(DK63-887-N-F和DK63-887-C-R引物组合)对目的基因敲除后的抗性克隆进行鉴定,结果均扩增出2 454 bp大小的片段,而敲除前的羊布鲁菌16M只能扩增出1 934 bp大小的片段(图4);同时采用目的基因的内部鉴定引物DK63-887-F、DK63-887-R对抗性克隆进行鉴定,不能扩增出573 bp 的DK63-887基因全长片段,而布鲁菌16M亲本株能够扩增出573 bp 的DK63-887基因全长片段(图5)。这表明重组克隆发生正确重组,成功构建了DK63-887基因的缺失株,将其命名为16MΔDK63-887。

M.DNA 标准DL 5 000;1~6.DK63-887重组质粒;7.阴性对照
M.DNA Marker DL 5 000;1-6.DK63-887 reconstruction plasmid;7.Negative control
图3 DK63-887重组质粒的菌液PCR鉴定
Fig.3 PCR verification of DK63-887 reconstruction plasmid

M.DNA 标准DL 5 000;1~12.16MΔDK63-887;13.DK63-887重组质粒;14.羊布鲁菌16M;15.阴性对照M.DNA Marker DL 5 000;1-12.16MΔDK63-887;13.DK63-887 reconstruction plasmid;14.Brucellamelitensis16M;15.Negative control
图4 DK63-887-F和DK63-887-R引物菌液PCR鉴定
Fig.4 PCR verification of DK63-887-F and DK63-887-R by using primers

M.DNA 标准DL 1 000;1~13.16MΔDK63-887; 14.羊布鲁菌16M;15.阴性对照
M.DNA Marker DL 1 000;1-13.16MΔDK63-887;14.Brucellamelitensis16M;15.Negative control
图5 DK63-887-F和DK63-887-R引物菌液PCR鉴定
Fig.5 PCR verification of DK63-887-F and DK63-887-R by using primers
2.3 布鲁菌16MΔDK63-887遗传稳定性检测
将布鲁菌16MΔDK63-887连续培养传代至20代,在传代过程中对每一代都采用DK63-887-N-F、DK63-887-C-R和DK63-887-F、DK63-887-R两组引物依次进行菌液PCR检测,发现本试验所构建的布鲁菌16MΔDK63-887缺失株在传代培养过程中均没有发生回复性突变的现象,遗传性稳定(图6和图7);并对其进行常规的生态学观察,发现DK63-887基因的缺失株在菌落的形态、大小以及所需要的培养条件等方面的变化与16M亲本株相比,均没有明显差异。
2.4 突变株和亲本株的生长曲线分析
从亲本株16M、疫苗株 M5-90、突变株16MΔDK63-887的生长曲线可以看出,亲本株和疫苗株的生长情况不同于突变株,但总体生长趋势一致。所有菌株在相同的初始浓度下,大约培养10 h~12 h后,进入对数生长期。大约在28 h后,进入
平台期。与亲本株和疫苗株相比,突变株在同一时间点的浓度较低,但进入平台期后,浓度与 M5-90 相近(图8)。

M.DNA 标准DL 5 000;1~10.16MΔDK63-887;11.DK63-887重组质粒;12.羊布鲁菌16M;13.阴性对照
M.DNA Marker DL 5 000;1-10.16MΔDK63-887 mutant strain;11.DK63-887 reconstruction plasmid;12.Brucellamelitensis16M;13.Negative control
图6 羊布鲁菌16MΔDK63-887的遗传稳定性检测
Fig.6 Genetic stability detection ofB.melitensis16MΔDK63-887

M.DNA 标准DL 1 000;1~11.16MΔDK63-887;12.羊布鲁菌16M;13.阴性对照
M.DNA Marker DL 1 000;1-11.16MΔDK63-887;12.Brucellamelitensis16M;13.Negative control
图7 布鲁菌16MΔDK63-887的遗传稳定性检测
Fig.7 Genetic stability detection ofB.melitensis16MΔDK63-887

图8 16M、M5-90和16MΔDK63-887生长曲线
2.5 布鲁菌在外界应激条件下的生存能力
通过对亲本株16M、疫苗株 M5-90、突变株16MΔDK63-887在强酸、强碱、高盐、热休克等应激条件下存活率的检测可以发现,与亲本株16M和疫苗株M5-90相比,突变株16MΔDK63-887在各应激条件下生存率降低程度各有不同(图9)。在高盐环境和低pH环境中,突变株存活率下降程度较高(图9)。这些结果表明,基因DK63-887调控布鲁菌对体外应激条件的适应和抵抗。
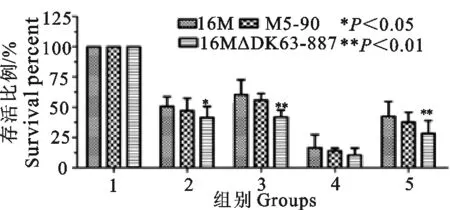
1.pH7.0;2.50℃热应激;3.1.5 mol/L NaCl;4.pH11.5;5.pH2.5
1.pH7.0;2.50℃ heat stress;3.1.5 mol/L NaCl;4.pH11.5;5.pH2.5
图9 16M、M5-90、16MΔDK63-887
在体外应激条件下的存活率
Fig.9 The survival percent of 16M,M5-90,16MΔDK63-887 under stress conditionsinvitro
2.6 布鲁菌在巨噬细胞内的存活试验
布鲁菌亲本株16M、疫苗株 M5-90、突变株16MΔDK63-887在巨噬细胞内的存活能力有所不同。如图10所示,亲本株16M侵染细胞时,侵染4 h以后细菌数逐渐增加,呈上升趋势,说明16M进入到细胞以后,一部分细菌被细胞杀死,另一部则存活下来,而存活下来的细菌开始在巨噬细胞内复制繁殖,所以4 h以后胞内细菌数逐渐增加。当用M5-90和突变株16MΔDK63-887侵染细胞时,在侵染4 h以后,胞内细菌的数目呈下降的趋势,尤其是16MΔDK63-887的数量持续下降。由此可以发现,16MΔDK63-887突变株在巨噬细胞内的复制能力是较弱的,表明基因DK63-887调控布鲁菌在巨噬细胞内的复制与繁殖。
2.7 RT-qPCR 检测细胞自噬相关基因ULK1、Beclin1的mRNA表达水平
用16M和突变株16MΔDK63-887分别侵染巨噬细胞8、12、24 h后,对细胞自噬相关基因(ULK1和Beclin1)表达水平的检测结果发现,在12 h、24 h时,16MΔDK63-887组细胞中ULK1 mRNA相对表达量分别为1.85、0.03和2.62、0.06;16M组细
胞中ULK1 mRNA相对表达量分别为1.12、0.14和2.67、0.05。经统计学分析表明,16MΔDK63-887组细胞中ULK1 mRNA相对表达量显著低于16M组细胞(P<0.01)(图11A); Beclin1的mRNA的相对表达水平与ULK1的表达趋势相似,16MΔDK63-887细胞中Beclin1的mRNA相对表达量也显著低于16M组细胞(P<0.01)(图11B)。结果表明,16MΔDK63-887削弱了16M介导的自噬相关基因的表达,从而抑制了16M介导的细胞自噬。

图10 16M、M5-90、16MΔDK63-887在巨噬细胞内的存活能力

A.ULK1基因mRNA的表达;B.Beclin1基因mRNA的表达
A.The relative expression of ULK1 mRNA;B.The relative expression of beclin1 mRNA
图11 实时荧光定量PCR检测ULK1和Beclin1的相对表达量
Fig.11 Detection of relative expression levels of ULK1 and Beclin1 by RT-qPCR
3 讨论
布鲁菌是一种兼性胞内寄生革兰阴性菌,它们主要寄生于机体的单核细胞(包括巨噬细胞)内。布鲁菌在这些细胞中表现出很强的生存和繁殖能力。巨噬细胞内微环境包含有多种杀(抑)菌机制,比如酸、过氧化物、溶菌酶、抗菌肽等。这些机制的存在,理论上可以有效杀灭或抑制进入巨噬细胞的外来微生物。但是,布鲁菌具备抵抗和适应这些杀(抑)菌机制的能力,并且能利用细胞的某些功能,实现在巨噬细胞内的大量繁殖[12-14]。布鲁菌在细胞内可以利用Ⅳ 型分泌系统分泌多种效应蛋白进入宿主细胞,这些效应蛋白能够改变BCV在感染细胞内的转运,避免最终被杀死;也能调控感染细胞的免疫监视功能,维持其在细胞内的持续存在。缺失BAB1-1492基因的布鲁菌在早期胞内增殖过程中就已明显减少,更易被溶酶体标记物LAMP1标记。令人惊讶的是,即使突变株在胞内早期复制阶段被有效地阻止,但它比野生型更有效的侵入宿主细胞,这就暗示该基因在选择吞噬路径中可能发挥作用,从而调控吞噬体到达最终目的地[9]。这一假说有待探讨并探究该效应蛋白到底是如何在体内发挥作用的。
基因敲除[15]主要是应用DNA同源重组的基本原理,用设计的同源片段替代机体特定的靶基因片段,从而达到基因敲除的目的。目前,该技术已经成为一种比较理想的改造生物遗传物质的生物学技术,尤其是未知基因功能的探索。本研究就是采用该方法通过同源重组的原理构建了羊布鲁菌16M△DK63-887基因的缺失株,此方法不同于传统布鲁菌缺失株构建方法的是:在一定程度上避免了传统方法中经典自杀质粒的整合所带来的如构建所需的时间较长、分子操作需要在特殊的宿主菌体中来进行、操作较为繁琐、克隆的效率又比较低等问题;不同于传统方法中所选用的ScB筛选标记,即以卡那霉素抗性基因作为筛选标记,它能够通过一次筛选就可得到DK63-887基因的缺失株,而且,还能够大大降低以ScB基因作为筛选标记所带来的假阳性检出概率。因此,使用该方法来构建羊布鲁菌DK63-887基因的缺失株不仅具有操作简单快捷、节省时间、降低假阳性的检出概率等优点,还可大幅提高研究DK63-887 基因功能的效率。
在布鲁菌感染的早期,T4SS 可以调控大量毒力基因的诱导表达,从而使细菌适应宿主胞内环境并得以生存,而T4SS的调控作用主要是通过分泌这些效应蛋白实现的。杨羽等[16]通过运用生物学的方法预测布鲁菌16M菌株的分泌蛋白,得到了191个具有信号肽的蛋白;张沾等[17]通过对Ⅳ型分系统效应子VceC的研究表明,VceC在侵染胚胎滋养层细胞过程中具有毒性作用。牛布鲁菌Ⅳ型分泌系统效应蛋白BAB1-1492基因与羊布鲁菌的DK63-887基因同源性达100%,因此,本研究通过基因敲除的方法构建布鲁菌16MΔDK63-887缺失株,发现其在传代培养20代过程中均没有发生回复性突变的现象,遗传性稳定;对其生长特性分析,与亲本株16M,疫苗株M5-90的生长趋势一样,然而突变株在同一时间点的浓度较低,表明DK63-887基因调控布鲁菌生长相关基因的表达;在体外应激试验中发现,各菌株在热休克、强酸、强碱和高盐环境中的生存能力均降低。DK63-887 缺失后,布鲁菌抵抗外界环境刺激的能力有所减弱,这可能是由于在这些应激条件下,布鲁菌通过DK63-887基因调控细菌适应应激条件所必须的基因表达;缺失株在胞内存活随着时间增长不断减弱,这就暗示了DK63-887 调控布鲁菌在胞内生存。16MΔDK63-887诱导自噬相关基因ULK1、Bcelin1的表达明显低于亲本株,提示DK63-887基因与16M诱导巨噬细胞的自噬密切相关。本研究结果为布鲁菌致病机制的研究奠定了基础。
[1] Pappas G,Papadimitriou P,Akritidis N,et al.The new global map of human brucellosis[J].Lancet Infect Dis,2006,6(2):91-99.
[2] Martins R D C,Irache J M,Blasco J M,et al.Evaluation of particulate acellular vaccines againstBrucellaovisinfection in rams[J].Vaccine,2010,28(17):3038-3046.
[3] 尚德秋.中国布鲁氏菌病防治科研50年[J].中华流行病学杂志,2000,21(1):55-57.
[4] 潘 文,王佳莹,赵明秋,等.布鲁氏菌bp26基因缺失株的构建[J].中国兽医科学,2011,41(3):280-286.
[5] 黄小强,王 慧,葛阳春,等.布鲁氏菌外膜蛋白omp31基因与EGFP基因融合表达载体的构建及其在巨噬细胞中的表达[J].石河子大学学报:自然科学版,2013,30(4):444-447.
[6] De Jong M F,Sun Y H,Den Hartigh A B,et al.Identification of VceA and VceC, two members of the VjbR regulon that are translocated into macrophages by theBrucellatype Ⅳ secretion system[J].Mol Microbiol,2008,70(6):1378-1396.
[7] Marchesini M I,Herrmann C K,Salcedo S P,et al In search ofBrucellaabortustype Ⅳ secretion substrates:screening and identification of four proteins translocated into host cells through VirB system[J].Cell Microbiol,2011,13(8):1261-1274.
[8] Hubber A,Roy C R.Modulation of host cell function byLegionellapneumophilatype Ⅳ effectors[J].Annu Rev Cell Dev Biol,2010,26:261-283.
[9] Winchell C G,Graham J G,Kurten R C,et al.Coxiellaburnetiitype Ⅳ secretion-dependent recruitment of macrophage autophagosomes[J].Infect Immun,2014,82(6):2229-2238.
[10] Myeni S,Child R,Ng T W,et al.Brucellamodulates secretory trafficking via multiple type Ⅳ secretion effector proteins[J].PLoS Pathog,2013,9(8):e1003556.
[11] Döhmer P H,Valguarnera E,Czibener C,et al.Identification of a type Ⅳ secretion substrate ofBrucellaabortusthat participates in the early stages of intracellular survival[J].Cell Microbiol,2014,16(3):396-410.
[12] Arenas G N,Staskevich A S,Aballay A,et al.Intracellular trafficking ofBrucellaabortusin J774 macrophages[J].Infect Immun,2000,68(7):4255-4263.
[13] Pizarro-Cerdá J,Méresse S,Parton R G,et al.Brucellaabortustransits through the autophagic pathway and replicates in the endoplasmic reticulum of nonprofessional phagocytes[J].Infect Immun,1998,66(12):5711-5724.
[14] Gross A,Terraza A,Ouahrani-Bettache S,et al.InvitroBrucellasuisinfection prevents the programmed cell death of human monocytic cells[J].Infect Immun,2000,68(1):342-351.
[15] Tsien J Z,Chen D F,Gerber D,et al.Subregion-and cell type-restricted gene knockout in mouse brain[J].Cell,1996,87(7):1317-1326.
[16] 杨 羽,吴清民.羊布鲁氏菌16M基因组分泌蛋白的生物信息学分析[J].畜牧兽医学报,2009,40(7):1059-1062.
[17] 张 沾,陈创夫,张 辉,等.布鲁氏菌Ⅳ型分泌系统效应子VceC 功能的初步研究[J].中国预防兽医学报,2011,33(9):685-688.
′
Construction and Identification of Ⅳ Secretion System Effector Protein DK63-887 Gene Deletion Mutant ofBrucella
JIANG Ya-li1,CHEN Chuang-fu2,LI Zhi-qiang2,LI Mo3,LI Shuang2,WANG Zhen2,ZHANG Huan2,ZHANG Hui2,GUO Fei3
(1.CollegeofLifeTechnology,ShiheziUniversity,Shihezi,Xinjiang,832003,China;2.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi,Xinjiang,832000,China;3.SchoolofMedicine,ShiheziUniversity,Shihezi,Xinjiang,832003,China)
To construct the DK63-887 gene deletion mutant (16MΔDK63-887) ofBrucellamelitensis16M (referred to as 16M),and explore the relationship between the gene and 16M-mediated autophagy, the methods of homologous recombination and replacement were applied, and the kanamycin gene was used to replace DK63-887 gene obtaining mutant 16MΔDK63-887.Under the same conditions of shaking culture,we observed growth of the parental strain 16M,vaccine strain M5-90,mutant 16MΔDK63-887,and then,each strain was placed in different environments,the survival rate of which was observed.Mouse macrophages were infected with parental and mutant strains,then we compared their ability of surviving in host cells and detected autophagy-related genes using RT-qPCR.The 16MΔDK63-887 mutant strain was successfully obtained.The mutants were genetically stable within 20 passages.Compared with the parental strain,the growing trends of mutant and parent strains were coincidentinvitro,but there were some differences in the concentration of bacteria.The mutants had decreased survival rate under the stress conditions. After 4h post-infection,the numbers of the mutant strains in host cells significantly decreased.ULK1 and beclin1 expression levels of the mutants significantly reduced which were detected by RT-qPCR(P<0.01).The results of this study showed thatBrucellatype Ⅳ secretion system effector proteins associated with 16M mediated-cell autophagy,the research laid the foundation for the study on 16M intracellular parasitism mechanisms.
Brucella;DK63-887 gene;gene deleted mutant;autophagy-related gene
2015-10-08
国家国际科技合作项目(2013DFA32380);国家科技支撑计划子课题(2013BAI05B05);国家自然科学基金项目(31572491;31502067);自治区研究生教育创新计划科研创新项目(XJGRI2015040)
江雅丽(1989-),女,新疆伊犁人,硕士,主要从事动物基因工程研究。*通讯作者
S852.614
A
1007-5038(2016)05-0030-08

