鸡MHCⅠα和β2m的原核表达与多克隆抗体的制备
戴 银,王承志,刘生杰,沈学怀,赵瑞宏,胡晓苗,张丹俊*
(1.安徽省农业科学院畜牧兽医研究所,安徽合肥 230031;2.安徽农业大学动物科技学院,安徽合肥 230036;3.阜阳师范学院生物与食品工程学院,安徽阜阳 236041)
鸡MHCⅠα和β2m的原核表达与多克隆抗体的制备
戴 银1,王承志2,刘生杰3*,沈学怀1,赵瑞宏1,胡晓苗1,张丹俊1*
(1.安徽省农业科学院畜牧兽医研究所,安徽合肥 230031;2.安徽农业大学动物科技学院,安徽合肥 230036;3.阜阳师范学院生物与食品工程学院,安徽阜阳 236041)
为制备MHCⅠ基因工程疫苗的基础材料,构建了鸡MHCⅠ分子重组质粒并进行原核表达,进而制备鸡MHCⅠ分子的多克隆抗体。应用PCR方法,克隆鸡MHCⅠα和β2m基因,构建重组载体pET-MHCⅠα和pET-MHCⅠβ2m,经PCR、双酶切和测序鉴定后,将重组质粒在大肠埃希菌Rosetta中进行诱导表达,融合蛋白纯化后,接种昆明小鼠制备多克隆抗体,血清稀释后用免疫印迹法(Western blot)分析。结果表明,鸡MHCⅠα和β2m基因在大肠埃希菌中成功表达,融合蛋白分子质量分别约为52.1 ku和33.0 ku;制备的鼠抗鸡MHCⅠα和β2m链多克隆抗体,经Western blot检测证实抗体特异性较强,可进一步用于鸡MHCⅠ分子的研究。
鸡MHCⅠ类分子;原核表达;多克隆抗体
主要组织相容性复合体(major histocompatibility complex,MHC)是一组紧密连锁、高度多态的基因群,具有辨别自身与非己的独特功能,同时又直接参与抵抗病原体入侵以及自身稳定过程,因此在脊椎动物的移植排斥反应、机体抗病力和免疫应答等相关方面起极其重要的作用[1-4]。虽然不同个体、不同种属的MHC分子结构不同,但其编码的分子在化学结构、组织分布及功能上均十分相近,分为MHCⅠ类、MHCⅡ类和MHC Ⅲ类分子。其中MHCⅠ类分子主要识别并结合内源性肽段,而外源性抗原的呈递则由MHCⅡ类分子启动。MHCⅠ类分子是一种由重链(α)和轻链(β2m)微球蛋白两部分以非共价键结合组成的膜结合糖蛋白,在细胞介导的机体免疫应答中起重要作用[5]。成熟的α链由胞外区域(α1、α2、α3)、以及跨膜区和胞质尾区组成,其中α1和α2区是MHCⅠ类分子抗原抗原结合区域,具有高度的多态性[6-9]。β2m不直接参与MHCⅠ类分子的抗原递呈过程,基因也较为保守,但能促进内质网中新合成的MHCⅠ类分子向细胞表面运输,并对稳定MHCⅠ类分子的结构具有一定作用,使其发挥生物学功能具有重要意义[10-11]。为进一步研究MHCⅠα和β2m分子特征,以及MHCⅠ类分子作为疫苗载体的可能性,本研究构建了鸡MHCⅠα和β2m基因原核表达载体,并将表达的融合蛋白免疫小鼠,获得了具有特异性的多克隆抗体。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄~10周龄SPF级昆明鼠雌鼠12只,购自安徽医科大学实验动物中心。
1.1.2 菌株、质粒和主要试剂 淮南麻黄鸡MHCⅠα、β2m链重组质粒pMD18-T-MHCⅠα、pMD18-T-MHCⅠβ2m,原核表达载体pET-32a,Rosetta(DE3)菌株均由安徽省农业科学院畜牧兽医研究所提供;Premix ExTaqDNA聚合酶、DNA Marker DL 2 000、T4 DNA连接酶、SalⅠ、EcoR V 、EcoRⅠ均为宝生物工程(大连)有限公司产品;IPTG、DTT、弗氏完全和不完全佐剂、小牛血清白蛋白(BSA)等为Sigma公司产品;羊抗鼠IgG为博士德生物技术有限公司产品;其他试剂为国产分析纯。
1.2 方法
1.2.1 引物设计 参照GenBank数据库中已公布的鸡MHCⅠα、β2m链cDNA序列(GenBank登陆号分别为:S78682、M84767),用SingnalP 3.0 Serv 软件分析蛋白信号肽,MEGA4软件比对序列保守性,DNA Star软件包分析鸡MHCⅠα、β2m链基因抗原性、亲疏水性及表面暴露性,同时参考原核表达载体pET-32a序列特征,用Primer Premier 5.0软件设计2对特异性引物。pET-α-F,5′-ATGAATTCGCCGAGCTCCATACCCTG-3′(EcoR I);pET-α-R,5′-ATGTCGACTGGCGGCTCCCACGAGTAGA -3′(SalI)。pET-β-F,5′-ATGGATATC AAGGCCGACCTGACGC-3′(EcoR V);pET-β-R,5′-ATGAATTCGAACTCGGGATCCCACT-3′(EcoR I)。两对引物分别扩增882 bp和300 bp的鸡MHCⅠα的3个胞外区域(α1、α2、α3)和成熟的β2m链基因。
1.2.2 鸡MHCⅠα、β2m基因片段的扩增 分别以重组质粒pMD18-T-MHCⅠα、pMD18-T-MHCⅠβ2m为模板,扩增MHCⅠα、β2m基因片段。反应体系:10× PCR buffer 5.0 μL,dNTP Mixture 3.0 μL, 上、下游引物各1.0 μL,质粒DNA 1.0 μL,TaqDNA 聚合酶0.5μL,加双蒸水补足60μL。按以下程序进行扩增:95℃ 5 min;94℃ 1min,60℃(56 ℃) 1 min,72 ℃ 2 min,30 个循环;72 ℃延伸8 min。
1.2.3 重组质粒的构建与鉴定 将PCR扩增产物经琼脂糖凝胶电泳鉴定,用DNA凝胶回收试剂盒回收,酶切后连入pET-32a载体,16℃水浴过夜,转化感受态大肠埃希菌Rosetta,涂布于含氨苄青霉素(Amp)的LB琼脂平板上,37℃培养过夜,初步筛选阳性克隆,用小量碱法提取质粒。分别用EcoR I和SalI,EcoR I和EcoR V双酶切鉴定重组质粒,同时用设计的引物进行PCR鉴定。重组质粒分别命名为pET-MHCⅠα和pET-MHCⅠβ2m。阳性重组质粒进行测序,用Blast软件与已报道的相应基因序列比对。
1.2.4 重组质粒的原核表达与纯化 分别挑取重组单菌落,按比例接入含氨苄青霉素的LB培养液,37℃静置过夜培养。取上述培养物按比例接入含氨苄青霉素(Amp)的LB培养液中,37℃培养至对数中期。取1 mL培养物为未诱导菌对照。加IPTG至终浓度1.0 mmol/L,继续培养,4 h后收集菌体进行超声破碎。将菌体裂解物进行SDS-PAGE鉴定。样品全部处理后进行SDS-PAGE 电泳,切取目的蛋白透析袋中,洗脱至无色,取出胶条,放于PBS 中过夜。次日收集纯化的蛋白,用Folin-酚法检测各融合蛋白的浓度。
1.2.5 多克隆抗体的制备 将已纯化的抗原分别免疫8周龄~10周龄雌性昆明系SPF小鼠,共3组,包括试验组2个,对照组1个,4只/组。初免用融合蛋白(50 μg)与等体积的弗氏完全佐剂乳化后,背部多点皮下注射,对照组注射等体积的生理盐水;10 d后二免使用弗氏不完全佐剂乳化抗原,剂量同一免,对照组注射等量灭菌生理盐水;7 d后三免,方法与剂量同二免。三免1周后,眼球摘除法收集小鼠血液至灭菌不含抗凝剂的离心管中。4℃静置过夜,收集血清于-20℃保存备用。
1.2.7 抗体检测 用Western blot鉴定抗体特异性,将表达的融合蛋白用SDS-PAGE后转印至硝酸纤维素膜上,用制备的抗血清1∶100稀释后作为一抗37℃孵育2 h,1∶5 000稀释的HRP-羊抗鼠IgG为二抗孵育2 h,充分洗涤后,加入3,3-二氨基联苯胺(DAB)显色,并拍照记录。
2 结果
2.1 MHCⅠα、β2m基因片段的扩增
以构建的质粒pMD18-T-MHCⅠα、 pMD18-T-MHCⅠβ2m为模板,进行扩增后电泳检测。分别获得了与预期条带大小相符的约822 bp和300 bp的DNA片段,而阴性对照未见扩增条带(图1)。
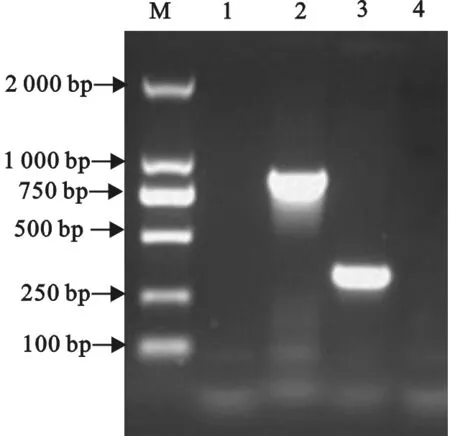
M. DNA 标准DL 2 000;1. MHCⅠα的PCR阴性对照; 2. MHCⅠα的PCR产物; 3. MHCⅠβ2m的PCR产物;4 MHCⅠβ2m的PCR阴性对照
M. DNA Marker DL 2 000;1. Negative control of MHCⅠα; 2. PCR products of MHCⅠα; 3. PCR products of MHCⅠβ2m; 4.Negative control of MHCⅠβ2m
图1 鸡MHCⅠα、β2m的PCR扩增
Fig.1 PCR amplification of MHCⅠα and β2m gene
2.2 重组质粒的构建及鉴定
以筛选的阳性重组质粒pET-MHCⅠα和pET-MHCⅠβ2m为模板,采用各自引物进行PCR扩增,初步鉴定重组质粒。阳性重组质粒分别用内切酶EcoRⅠ、SalⅠ和EcoRⅠ、EcoR V双酶切,电泳结果可见相应目的条带(图2)。重组质粒经生物公司测序后,使用生物软件进行比较,结果与目的序列完全一致,说明重组质粒构建成功。
2.3 融合蛋白的表达
将鉴定为阳性的重组质粒pET-MHCⅠα、pET-MHCⅠβ2m和pET-32a空质粒转化入大肠埃希菌Rosetta。用IPTG诱导表达,然后进行SDS-PAGE分析。结果显示经诱导的pET-MHCⅠα、pET-MHCⅠβ2m和空载体菌分别在约52.1、33.0、22.0 ku处有一特异性条带,与预期的载体标签His蛋白及其融合蛋白大小一致(图3)。超声波裂解诱导表达后的菌液,离心分离上清液及沉淀,可见融合蛋白His- MHCⅠα主要存在于沉淀中,而His- MHCⅠβ2m蛋白则在上清和沉淀中均大量存在(图4)。进一步检测纯化后融合蛋白His- MHCⅠα和His- MHCⅠβ2m的浓度,分别为1.02 mg/mL和0.98 mg/mL。

M. DNA 标准DL 2 000;1. MHCⅠα的PCR产物; 2. 重组质粒pET-MHCⅠα/EcoRⅠ+SalⅠ; 3. MHCⅠβ2m的PCR产物; 4. 重组质粒pET-MHCⅠβ2m /EcoR V+EcoRⅠ
M. DNA Marker DL 2 000;1. PCR products of MHCⅠα; 2. Recombinant plasmid pET-MHCⅠα digested byEcoRⅠandSalⅠ; 3. PCR products of MHCⅠβ2m; 4. Recombinant plasmid pET-MHCⅠβ2m digested byEcoR V andEcoRⅠ
图2 重组质粒的鉴定
Fig.2 Identification of the recombinant plasmids

M.蛋白分子质量标准; 1.未诱导His/Rosetta; 2.诱导His/ Rosetta; 3. 未诱导His-MHCⅠα/Rosetta; 4. 诱导His -MHCⅠα/Rosetta; 5. 未诱导His-MHCⅠβ2m/Rosetta; 6. 诱导His-MHCⅠβ2m/Rosetta
M.Protein molecular weight Marker; 1. Uninduced His/Rosetta; 2. His/ Rosetta induced by IPTG;3.Uninduced His-MHCⅠα/Rosetta; 4. His -MHCⅠα/Rosetta induced by IPTG; 5.Uninduced His-MHCⅠβ2m/Rosetta; 6. His-MHCⅠβ2m/Rosetta induced by IPTG
图3 表达产物的SDS-PAGE
Fig.3 SDS-PAGE map of expression products
2.4 Western blot 结果分析
利用免疫印迹技术分析确定融合蛋白的活性,分别以纯化的融合蛋白His- MHCⅠα、His- MHCⅠβ2m,及其免疫小鼠的抗血清作为反应一抗,进行Western blot检测。为了排除His蛋白标签对反应结果的影响,使用His标签蛋白为反应抗原设对照组,一抗为上述获得的2种抗血清。结果可见2个MHCⅠ融合蛋白在相应位置均有特异性反应带,而His标签蛋白则无(图5);表明融合蛋白与相应的多克隆抗体发生了特异性结合,具有免疫活性。

1.诱导的His-MHCⅠα/Rosetta; 2. 裂解液上清/His- MHCⅠα; 3. 裂解液沉淀/His- MHCⅠα; 4. 纯化的His-MHCⅠα融合蛋白; 5.诱导的His-MHCⅠβ/Rosetta; 6. 裂解液上清/His- MHCⅠβ;7. 裂解液沉淀/His- MHCⅠβ; 8. 纯化的His-MHCⅠβ融合蛋白
1.Induced His-MHCⅠα/Rosetta; 2. Lysate supernatant of Rosetta/His-MHCⅠα; 3. Lysate precipitate of Rosetta/His-MHCⅠα; 4. Purified protein of His-MHCⅠα; 5.Induced Rosetta/His- MHCⅠβ; 6. Lysate supernatant of Rosetta/His-MHCⅠβ; 7. Lysate precipitate of Rosetta/His- MHC I β; 8. Purified protein of His- MHCⅠβ
图4 融合蛋白的可溶性鉴定与纯化
Fig.4 Solubility identification and purification of fusion proteins
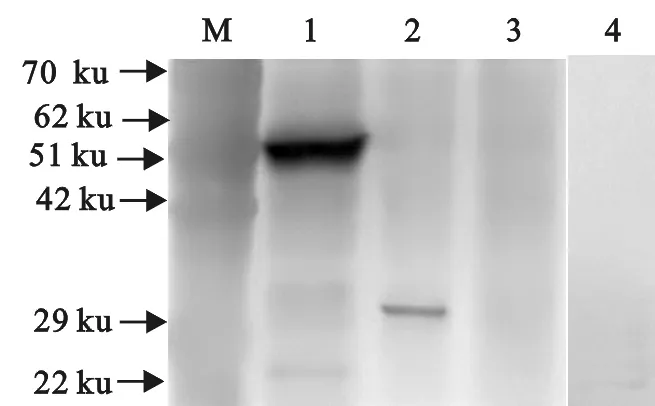
M.蛋白分子质量标准; 1.His-MHCⅠα融合蛋白; 2.His-MHCⅠβ2m 融合蛋白; 3.阴性对照(MHCⅠα抗血清); 4.阴性对照(MHCⅠβ2m抗血清)
M. Protein molecular weight Marker; 1. Fusion protein of His-MHC Iα; 2. Fusion protein of His-MHC I β2m; 3. Negative control(MHCⅠα antiserum); 4. Negative control(MHCⅠβ2m antiserum)
图5 His-MHCⅠα和His-MHCⅠβ2m蛋白Western blot鉴定
Fig.5 Identification of His-MHC I α and His-MHCⅠβ2m proteins by Western blot
3 讨论
研究表明,大肠埃希菌表达系统具有菌体生长快、易操作和成本低等优点,在体外重组蛋白制备中被广泛应用[12]。大肠埃希菌表达系统虽优点颇多,但目的蛋白容易形成包涵体。包涵体主要含有重组蛋白和一些菌体杂质等,是不可溶的,内部的蛋白多是杂乱无章地错误折叠,因此对重组蛋白的活性影响较大。为获得稳定且可溶的重组蛋白,我们通过对鸡MHCⅠα、β2m链基因序列的信号肽、抗原性、亲疏水性及表面暴露性等进行分析,去除基因信号肽及疏水区域等,其中MHCⅠα基因片段仅包含3个功能区域α1、α2和α3,尽可能的避免其对后续蛋白表达的影响。同时尝试调低诱导温度,降低诱导剂的量,以及减短诱导时间等方法,降低菌体产生包涵体。但结果发现表达的His-MHCⅠα融合蛋白仍然主要以包涵体形式存在,His-MHCⅠβ2m融合蛋白则以包涵体和上清两种形式出现。融合蛋白难以避免以包涵体的形式大量存在,这与其他学者的研究相似,分析其原因可能与蛋白表达量较大,且速度太快等因素有关[13-14]。
MHC分子是抗原呈递的关键分子,因其具有重要免疫功能,而备受关注。但由于自然选择平衡的因素,MHC分子具有高度的多态性,迄今为止人类MHC分子的等位基因总数已经达到上千个[15]。因此,MHC分子的多样和复杂性导致其相关的研究较为困难。禽类系统被认为是研究MHC分子遗传进化的潜力候选载体,而鸡MHC基因则是与适应性免疫密切相关的典型基因家族[16-17]。与哺乳动物相比,鸡MHC分子结构简单、分子小且紧密,具有最低限度的功能基本单元[18],因此吸引了众多对MHC分子感兴趣的学者。研究前期我们获得了大量地方品种鸡的MHCⅠα和β2m基因,并进行了序列比对分析,证实α链基因较为多态,而β2m 链则相对较为保守[5,11]。本研究通过构建鸡MHCⅠα和β2m基因原核表达载体,成功获得了其活性蛋白,并通过免疫小鼠得到了具有特异性的多克隆抗体,为进一步研究MHCⅠα和β2m分子结构特征,以及MHCⅠ类分子靶向性疫苗的研究奠定了基础。
[1] Boehm T, Zufall F. MHC peptides and the sensory evaluation of genotype[J]. Acta Paediatrica, 2006, 29(2):100-107.
[2] Hughes A L, Yeager M. Natural selection at major histocompatibility complex loci of vertebrates [J]. Annu Rev Genet, 1998, 32:415-435.
[3] Otting N, de Vos-Rouweler A J, Heijmans C M, et al. MHC class I A region diversity and polymorphism in macaque species [J]. Immunogenetics, 2007, 59:367-375.
[4] 戴 银,王承志,沈学怀,等.淮南麻黄鸡MHCⅠα链基因的克隆及序列分析[J]. 动物医学进展, 2015,36(2):34-38.
[5] Zhou H, Lamont S J. Chicken MHC class I and II gene effects on antibody response kinetics in adult chickens[J]. Immunogenetics, 2003, 55(3):133-140.
[6] Cloutier A, Mills J A, Baker A J. Characterization and locus-specific typing of MHC class I genes in the red-billed gull (Larusscopulinus) provides evidence for major, minor, and nonclassical loci vertebrate populations [J]. Immunogenetics, 2011, 63:377-394.
[7] Mc Cairns R J, Bourget S, Bernatchez L. Putative causes and consequences of MHC variation within and between locally adapted stickleback demes [J]. Mol Ecol, 2011, 20(3):486-502.
[8] Shaw I, Powell T J, Marston D A, et al. Different evolutionary histories of the two classical class I genes BF1 and BF2 illustrate drift and selection within the stable MHC haplotypes of chickens[J]. J Immunol, 2007, 178:5744-5752.
[9] Livant E J, Brigati R, Ewald S J. Diversity and locus specificity of chicken MHC B class I sequences[J]. Anim Genet, 2004, 35:18-27.
[10] 戴 银,张丹俊,胡晓苗,等.鸡主要组织相容性复合体Ⅰβ微球蛋白(β2m)基因的克隆及序列分析[J].中国畜牧兽医, 2014, 41 (10):28-32.
[11] Kaufman J, Andersen R, Avila D, et al. Different features of the MHC class I heterodimer have evolved at different rates. Chicken B-F and beta 2-microglobulin sequences reveal invariant surface residues [J]. J Immunol, 1992, 148:1532-1546.
[12] 陈 涛.猪Ⅰ型干扰素基因的克隆及其在大肠埃希菌中的表达[D].江苏南京:南京师范大学,2002.
[13] Selleck W,Tan S. Recombinant protein complex expression inE.coli[J].Curr Protoc Protein Sci, 2008, 21(5):324-321.
[14] 张舒婕,龚炎长,俸艳萍,等.鸭MHCⅡβ基因的克隆、表达及多克隆抗体的制备[J]. 畜牧兽医学报,2008,39(11):1612-1615.
[15] 裴梓峰, 李 岩, 马 威,等. HLA基因多态性与原发性高血压的相关性研究进展[J]. 大连医科大学学报,2009, 3(6):259-363.
[16] Westerdahl H. Passerine MHC: genetic variation and disease resistance in the wild [J]. J Ornithol, 2007, 148: S469-S477.
[17] Kaufman J. The simple chicken major histocompatibility complex: life and death in the face of pathogens and vaccines [J]. Phil Trans R Soc Lond B, 2000, 355: 1077-1084.
[18] Eimes J A, Bollmer J L, Dunn P O, et al. Mhc class II diversity and balancing selection in greater prairie-chickens [J]. Genetica, 2010, 138: 265-271.
Prokaryotic Expression and Polyclonal Antibody Preparation of Chicken MHC Ⅰα and β2m Genes
DAI Yin1, WANG Cheng-zhi2, LIU Sheng-jie3, SHEN Xue-huai1,ZHAO Rui-hong1, HU Xiao-miao1, ZHANG Dan-jun1
(1.InstituteofAnimalHusbandryandVeterinaryScience,AnhuiAcademyofAgriculturalScience,Hefei,Anhui,230031,China; 2.CollegeofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei,Anhui, 230036,China; 3.SchoolofBiologyandFoodEngineering,FuyangNormalCollege,Fuyang,Anhui,236041,China)
To explore MHCⅠfunction as DNA vaccine,chicken MHCⅠgenes were expressed by usingEscherichiacoliprokaryotic expression system,and polyclonal antibodies against the recombinant protein MHCⅠwere prepared. Chicken MHCⅠα and β2m genes were cloned,the recombinant plasmid pET-MHCⅠα, pET-MHCⅠβ2m were constructed,and confirmed by PCR amplification,double enzyme digestion and DNA sequencing.Next, the recombinant plasmids were expressed inE.coliRosetta induced by using IPTG.After purification of the recombinant protein,the polyclonal antibodies against the recombinant protein were prepared in Kunming mice. The reactivity of the prepared polyclonal antibodies were determined by Western blot. The results revealed that the MHCⅠα and β2m genes were successfully expressed inE.coli,and the fusion proteins were about 52.1 ku and 33.0 ku, respectively. The polyclonal antibodies had the specific reactinogenicity, it was proved by Western blot. All this made it possible to do further studies on chicken MHCⅠmolecule.
chicken MHC I molecule; prokaryotic expression; polyclonal antibody
2015-10-07
国家自然科学基金项目(31302044);安徽省科技攻关项目(11010302119);安徽省教育厅自然科学研究重点项目(KJ2013A203)
戴 银(1980-),女,安徽蒙城人,助理研究员,博士,主要从事兽医微生物与免疫学研究。 *通讯作者
S852.4;S858.31
A
1007-5038(2016)05-0038-05

