狂犬病病毒磷蛋白在杆状病毒中的表达及鉴定
郑光来,卢晓冉,张永武,张静远,陈 腾,王东方,严 妍,3,张守锋,扈荣良*
(军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,吉林长春 130122)
狂犬病病毒磷蛋白在杆状病毒中的表达及鉴定
郑光来1,卢晓冉2,张永武2,张静远2,陈 腾2,王东方2,严 妍2,3,张守锋2,扈荣良1*
(军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,吉林长春 130122)
采用RT-PCR方法扩增出狂犬病病毒BD06株的磷蛋白(P)基因片段,将其插入杆状病毒穿梭载体pFastBac 1获得的pFastBac 1-P重组质粒,转化E.coliDH10Bac成功构建出杆状病毒表达质粒Bacmid-P,用脂质体介导Bacmid-P转染Sf9细胞获得重组杆状病毒(AcMNPV-P)。经SDS-PAGE、Western blot和直接免疫荧光分析鉴定,BD06-P蛋白在杆状病毒中成功表达,且具有良好的反应原性,为进一步研究狂犬病病毒磷蛋白的结构和功能奠定了基础。
狂犬病病毒;杆状病毒表达系统;磷蛋白
狂犬病(Rabies)是一种古老而又持续流行的人兽共患传染病。由于狂犬病病毒(Rabies virus,RV)在感染人或动物脑组织以后才会表现出临床症状,因此一旦发病,病死率几乎为100%,全世界每年因为狂犬病感染而死亡的人数约有50 000人~70 000人,给人类的生命带来了巨大的安全隐患[1]。
狂犬病病毒属于弹状病毒科(Rhabdoviridae)狂犬病病毒属(Lyssavirus)的成员,其基因组由11 928(有些毒株为11 932)个核苷酸组成,为单股不分节段的负链RNA病毒。自基因组的3′端至5′端依次编码着N(核蛋白)、P(磷蛋白)、M(基质蛋白)、G(糖蛋白)、L(大转录酶蛋白)5种蛋白。磷蛋白是狂犬病病毒所有结构蛋白中变异最大的一种蛋白,同时也是功能最为复杂的一种蛋白。磷蛋白可以通过和N、L两个蛋白共同作用,促进病毒RNA的转录和翻译[2-3];同时磷蛋白还具有阻止干扰素调控因子3(interferon regulatory factor 3,IRF3)激活,从而阻止干扰素的表达等功能[4]。
磷蛋白具有功能多样性,目前虽然磷蛋白的研究相对广泛,但仍不完善。本试验通过pFast-Bac-to-Bac杆状病毒表达系统成功克隆表达了狂犬病病毒BD06株的磷蛋白,为深入研究RABV的感染机制、P蛋白结构和功能以及狂犬病ELISA诊断试剂盒的研发奠定了基础。
1 材料与方法
1.1 材料
RV BD06毒株、E.coliDH10BacTM感受态、昆虫细胞Sf9、杆状病毒表达载体pFastBacTM1、磷蛋白单抗1C9、FITC标记的磷蛋白单抗1C9均由吉林省人兽共患病预防与控制重点实验室保存;E.coliDH5α感受态、ExTaq酶、DNA和蛋白质分子质量标准为宝生物工程(大连)有限公司产品;限制性内切酶、T4DNA连接酶为NEB公司产品;总RNA提取试剂盒为BioFlux公司产品;小量质粒提取试剂盒和小量DNA凝胶回收试剂盒均为AxyGen公司产品。
1.2 方法
1.2.1 引物的设计 根据GenBank:EU549783.1中RV BD06毒株的磷蛋白基因序列设计PCR引物,并在上、下游引物中引入BamH I和KpnI两个酶切位点,上、下游引物分别为BD06-P-F:5′-CGCGGATCCATGAGCAAGATCTTCGT-3′(BamH I)和BD06-P-R:5′-CGGGGTACCTCAGCAGGATGTATA-3′(Kpn I)。磷蛋白基因片段长度为894 bp。
1.2.2 重组杆状病毒表达质粒的构建 取RV BD06的细胞毒100 μL用总RNA提取试剂盒提取病毒RNA,然后用磷蛋白上游引物反转录成cDNA。再用磷蛋白的特异性引物进行PCR扩增,扩增条件为:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 40 s,共30个循环;72 ℃延伸7 min。然后将PCR产物和杆状病毒表达载体pFastBacTM1分别用BamH I和KpnI双酶切、回收,T4连接酶16 ℃连接过夜。连接产物转化E.coliDH5α感受态以获得重组杆状病毒表达载体pFastBacTM1-P,随后用双酶切鉴定,并送至吉林省库美生物技术有限公司测序。
将经鉴定正确的重组杆状病毒表达载体转化入E.coliDH10BacTM感受态中进行蓝白斑筛选,挑选较大的白斑并纯化一次。然后挑取大个的白斑用Bacmid质粒上的通用引物M13F/M13R进行PCR鉴定。最终得到含有BD06-P基因的重组杆状病毒表达质粒Bacmid-P。
1.2.3 重组杆状病毒(AcMNPV-P)的获得与扩增 用CellfectinⅡReagent脂质体介导Bacmid-P转染六孔板里汇合度达到80%左右的Sf9细胞,并设立空白对照。待细胞出现病变(约96 h)后收集细胞上清即为P1代AcMNPV-P。经2次传代后,获得大量的P3代AcMNPV-P,用于后期蛋白表达及鉴定,并用Reed-Muench法计算第3代AcMNPV-P病毒滴度。
1.2.4 重组磷蛋白的鉴定
1.2.4.1 直接免疫荧光试验(DIFA) 用第3代AcMNPV-P感染六孔板里的正常Sf9细胞,设立未接毒的空白对照。28 ℃培养72 h后弃去培养基,PBS洗涤2次,800 mL/L的丙酮于4 ℃固定20 min,然后弃去丙酮,风干,加入FITC标记的小鼠抗磷蛋白单抗1C9(1∶800),37 ℃孵育1 h,用PBST洗涤3次,5 min/次。滴加2滴800 mL/L的甘油,置于荧光显微镜下观察。
1.2.4.2 SDS-PAGE和Western blot检测 收集感染AcMNPV-P的Sf9细胞,用PBS洗涤2遍,然后加入适量的PBS。反复冻融3次后离心取上清,加入5×的SDS-Loading buffer,煮沸10 min。处理好的样品跑两份SDS-PAGE胶,一份用于考马斯亮蓝染色,另一份用半干式转膜法电转印至PVDF膜上。转印好的PVDF膜用10 g/L的酪蛋白室温振荡封闭2 h,PBST洗涤3次,10 min/次;用小鼠抗磷蛋白的单抗1C9(1∶200)室温孵育1 h,PBST洗涤3次,10 min/次;用HRP标记的山羊抗小鼠IgG二抗室温孵育1 h,PBST洗涤3次,10 min/次;TMB显色10 min。1.2.5 重组Ac-MNPV-P的电镜观察 用重组Ac-MNPV-P感染Sf9细胞,待细胞完全病变后(约96 h)收集细胞悬液于离心管中,室温下1 000 r/min,离心5 min,取上清进行电镜观察。
不断推进人员本土化进程。保加利亚公司高度重视生产与管理的本土化,聘请保籍农业专家担任执行经理,聘请培育、种植、加工、病虫害防治的农艺专家和技术骨干,组成以农业院校、种植专家、科技机构相结合的中保方人员参与的技术管理团队,目前绝大多数的中层岗位由保加利亚人员担任。同时不断加强中方管理人员与基地保方负责人、农业技术人员的沟通、交流,将中国先进的农业生产技术与保加利亚丰富的自然资源相结合,实现了资源、技术等多项优势互补,农业种植、田间管理的经验共享与提高。
2 结果
2.1 磷蛋白基因PCR产物鉴定
从RV BD06株感染的BHK细胞上清液里提取病毒的总RNA,并以此为模板进行RT-PCR,然后用磷蛋白的特异性引物扩增出磷蛋白基因片段(图1)。

1~2.磷蛋白基因;M.DNA标准DL 1 0001-2.BD06-P gene fragment;M.DNA Marker DL1 000
2.2 重组杆状病毒表达质粒的鉴定
利用通用引物M13F/R对重组杆状病毒表达质粒进行鉴定,若没有重组成功则只会出现300 bp的条带,若重组成功则会扩增出3 196 bp(2 300 bp+894 bp)的条带。试验成功扩增出了3 200 bp左右的条带(图2),证明重组杆状病毒表达质粒构建成功。

M.DNA标准 DL 5 000;1~2.重组质粒Bacmid-P的PCR产物
M.DNA Marker DL 5 000;1-2:PCR products of recombinant plasmid Bacmid-P
图2 重组表达质粒Bacmid-P的PCR鉴定
Fig.2 Identification of recombinant plasmid Bacmid-P by PCR
2.3 重组杆状病毒的获得
感染AcMNPV-P的Sf9细胞72 h后可以观察出明显的细胞病变,与正常细胞相比,病变细胞的直径变大,细胞内部出现许多颗粒物,随着时间延长,病变细胞慢慢脱落。而正常细胞的直径则大小均匀,形状规则(图3)。
2.4 重组磷蛋白的直接免疫荧光(DIFA)检测
用FITC标记的磷蛋白单克隆抗体1C9对重组杆状病毒表达的磷蛋白进行间接免疫荧光检测。结果显示(图4),表达的重组磷蛋白能够和磷蛋白单抗发生特异性的反应。证明重组磷蛋白在Sf9细胞中成功表达且具有良好的反应原性。

A.Sf9细胞;B.感染AcMNPV-P 72 h后的Sf9细胞
A.Sf9 cells;B.Sf9 cells infected with AcMNPV-P after 72 h
图3 正常Sf9细胞和感染AcMNPV-P的Sf9细胞(100×)
Fig.3 Control Sf9 cells and Sf9 cells infected with AcMNPV-P (100×)

A.感染AcMNPV-P 72 h后的Sf9细胞;B.Sf9细胞
A.Sf9 cells infected with AcMNPV-P after 72 h;B.Sf9 cells
图4 直接免疫荧光鉴定重组磷蛋白的表达(100×)
Fig.4 Detection of recombinant phosphoprotein by DIFA(100×)
2.5 SDS-PAGE和Western blot分析重组磷蛋白
用SDS-PAGE分析Sf9细胞和重组杆状病毒感染的Sf9细胞的细胞裂解上清,在40 ku左右出现了一个条带。Western blot显示在40 ku左右出现了特异性的条带,与预期蛋白大小一致,而正常Sf9细胞的裂解上清未出现条带。

M.蛋白分子质量标准;1、4.Sf9细胞裂解上清;2、3.感染AcMNPV-P的Sf9细胞裂解上清
M.Protein molecular weight Marker;1,4.The supernatant of lysed Sf9 cells;2,3.The supernatant of lysed Sf9 cells infected with AcMNPV-P
图5 表达产物的SDS-PAGE和Western blot分析
Fig.5 Analyses of the expressed proteins by SDS-PAGE and Western blot
2.6 重组AcMNPV-P的电镜观察
用重组AcMNPV-P感染Sf9细胞,待细胞完全病变后,收集细胞培养上清进行电镜观察(图6)。在病变的细胞上清中观察到了重组杆状病毒。
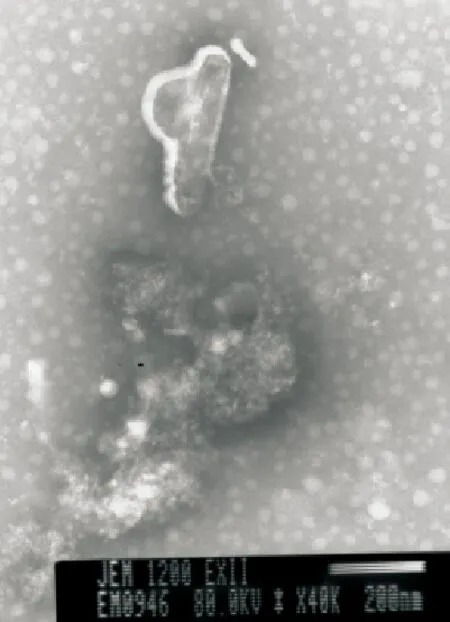
图6 重组AcMNPV-P的电镜观察
3 讨论
杆状病毒表达系统作为四大表达系统之一,与其他表达系统相比,杆状病毒表达系统具有安全性高,对外源基因克隆容量大,重组病毒易于筛选,具有对重组蛋白进行翻译后的加工和修饰功能,且重组蛋白易从无血清的培养集中纯化,无内毒素等优点[5]。目前,杆状病毒表达系统已广泛应用于重组蛋白的获取、基因治疗、疫苗研制和药物开发等多个领域[6]。
目前,不同狂犬病病毒毒株的磷蛋白已在多个表达系统中获得成功表达。张金阳等[7]利用真核细胞表达系统表达了狂犬病毒Flury-HEP毒株磷蛋白,但真核细胞表达系统表达量有限,且不易实现大规模培养。靳红亮等[8]利用人腺病毒5型表达了狂犬病病毒BD06株磷蛋白,但这种腺病毒载体存在一定的安全风险。许运斌等[9]利用杆状病毒表达系统表达了狂犬病病毒 ERA 株磷蛋白,而狂犬病病毒ERA株属于弱毒株。本试验利用杆状病毒表达系统表达了狂犬病病毒 BD06 株的磷蛋白。与狂犬病病毒ERA株不同的是狂犬病病毒BD06株属于强毒株,因此对其蛋白组分中的磷蛋白进行克隆表达,为探讨强毒株磷蛋白的生物功能及研究狂犬病病毒致病机制奠定了基础。
磷蛋白是一种磷酸化的蛋白,在SDS-PAGE中呈现的约为40 ku的磷酸化形式[10-11]。通过Western blot和直接免疫荧光试验对重组磷蛋白进行反应原性的研究,发现重组磷蛋白能够和狂犬病病毒磷蛋白单克隆抗体1C9产生良好的反应,且相对分子质量约为40 ku,与预期相符。证明利用杆状病毒表达系统成功的表达了具有反应原性的重组RV-BD06-P蛋白,为深入研究狂犬病病毒的感染机制和狂犬病ELISA诊断试剂盒奠定了基础。
[1] Fooks A R,Banyard A C,Horton D L,et al.Current status of rabies and prospects for elimination[J].Lancet,2014,384(9951):1389-1399.
[2] Manos M,Frédéric I,Catherine M,et al.Isolation and characterisation of the rabies virus N degrees-P complex produced in insect cells[J].Virology,2003,305(2):406-414.
[3] Guillaume C,Mohamed C,Grégory C,et al.Peptides that mimic the amino-terminal end of the rabies virus phosphoprotein have antiviral activity[J].J Virol,2009,83(20):10808-10820.
[4] Brzózka K,Finke S,Conzelmann K K.Identification of the rabies virus alpha/beta interferon antagonist:phosphoprotein P interferes with phosphorylation of interferon regulatory factor 3[J].J Virol,2005,79(12):7673-7681.
[5] Jong Seok L,Young-Man K,Hye Suk H,et al.Baculovirus-expressed virus-like particle vaccine in combination with DNA encoding the fusion protein confers protection against respiratory syncytial virus[J].Vaccine,2014,32(44):5866-5874.
[6] 孙新宽,宋丽丽,韦 平,等.昆虫杆状病毒表达系统在病毒性家禽疾病研究中的应用进展[J].中国家禽,2014,36(1):39-41.
[7] 张金阳,李贞景,宋玉竹,等.狂犬病毒磷蛋白的生物信息学分析及其真核表达[J].昆明理工大学学报:自然科学版,2014,(6):82-88.
[8] 靳红亮,王述超,张守峰,等.狂犬病病毒磷蛋白重组人 5 型腺病毒的构建及鉴定[J].生物制品学杂志,2015,28 (10):1023-1025.
[9] 许运斌,徐洁萍,张金阳,等.狂犬病病毒磷蛋白在杆状病毒系统的表达及鉴定[J].中国动物传染病学报,2012(2):17-22.
[10] Gupta A,Blondel D S,Banerjee A.The phosphoprotein of rabies virus is phosphorylated by a unique cellular protein kinase and specific isomers of protein kinase C[J].J Virol,2000,74(1):91-98.
[11] Moseley G W,Filmer R P,Dejesus M A,et al.Nucleocytoplasmic distribution of rabies virus P-protein is regulated by phosphorylation adjacent to C-terminal nuclear import and export signals[J].Biochemistry,2007,46(43):12053-12061.
Expression and Characterization of Rabies Virus Phosphoprotein in Baculovirus
ZHENG Guang-lai1,LU Xiao-ran2,ZHANG Yong-wu2,ZHANG Jing-yuan2,CHEN Teng2,WANG Dong-fang2,YAN Yan2,3,ZHANG Shou-feng2,HU Rong-liang1
(AcademyofMilitaryMedicalSciences,KeyLaboratoryofJinlinProvincialZoonosis,VeterinaryResearchInstitute,Changchun,Jilin,130122,China)
The phosphoprotein gene of rabies virus BD06 stain was amplified by RT-PCR and cloned into the baculovirus shuttle vector pFastBac 1,then the recombinant vector pFastBac 1-P was transformed intoE.coliDH10Bac to obtain the recombinant expression plasmid Bacmid-P. The recombinant baculovirus AcMNPV-P was obtained by transfecting the Bacmid-p into Sf9 cells.The expressed recombinant phosphoprotein was identified by SDS-PAGE,Western blot and direct immunofluoresence assay.The results showed that the BD06-P was expressed in recombinant baculovirus successfully and had a good antigenicity,it would be potentially used for further study on the structures and functions of the phosphoprotein of rabies virus.
Rabies virus;baculovirus expression systerm;phosphoprotein
2015-11-23
国家863计划项目(2011AA10A212)
郑光来(1989-),男,河南许昌人,硕士研究生,主要从事分子病毒学研究。*通讯作者
S852.655
A
1007-5038(2016)05-0026-04

