麻风分枝杆菌qPCR鉴定方法的建立及评价
温 晶 王 川 孙乐乐 陈明飞,2 付希安 王建文,2 刘 红,2 张福仁,2
·技术与方法·
麻风分枝杆菌qPCR鉴定方法的建立及评价
温 晶1王 川1孙乐乐1陈明飞1,2付希安1王建文1,2刘 红1,2张福仁1,2
目的: 建立麻风分枝杆菌qPCR鉴定方法并评价该方法的敏感性和特异性。方法: 应用qPCR对135例麻风及其他疾病组织蜡块样本中麻风分枝杆菌特异性基因Ag85B和SodA进行检测,建立结果判定标准;对99例病种未知组织腊块样本和89例病种未知新鲜皮肤组织样本以qPCR检测麻风特异性基因Ag85B和SodA,评价该检测方法的特异性和敏感性。结果: qPCR技术检测新鲜皮肤组织麻风特异性基因Ag85B和SodA的特异性和敏感性分别为100%和91.7%,高于组织蜡块样本。结论: qPCR技术可用于麻风菌的检测。
麻风; 麻风分枝杆菌; qPCR; 评价
麻风(leprosy)是麻风分枝杆菌感染易感个体,特异性侵犯皮肤和周围神经组织,晚期可致残的一种慢性传染病,可根据查菌指数分为多菌型(multibacillary, MB)和少菌型(paucibacillary, PB)两个亚型[1]。该病曾在全球广泛流行,严重危害人民的身心健康。目前全球每年仍有逾20万的新登记病例,我国每年新登记病例数始终在1000例左右[2,3]。
由于麻风分枝杆菌无法体外培养,此病的诊断主要为组织涂片查菌结合组织病理学与临床表现的方法。有报道显示,每克组织中含有104个病原菌才能通过抗酸染色的方式被检测到,足以说明查菌方式灵敏度的不足[4,5]。同时,抗酸染色的原理基于分枝杆菌中的分枝菌酸与染料的结合而显色,没有种属的特异性,存在误诊的可能性[6]。传统组织病理学依据组织形态学改变,如肉芽肿病变、有无明显“浸润带”特点等,在缺乏典型的组织形态特点时往往难以确诊,不能及时有效地为临床治疗提供有力的诊断依据。
近年来,将实时荧光定量与普通 PCR技术相结合的qPCR 技术的快速发展,以其能够对目标微生物进行特异性定量及定性检测,已被成功用于微生物快速检测[7,8]。麻风分枝杆菌基因组中种属特异性的36kDa抗原、18kDa抗原、65kDa抗原、groEL、Ag85B、SodA、16S rRNA基因为此方法在检测麻风分枝杆菌中的应用提供了基础[9-14]。
本研究旨在以特异性基因为基础,建立麻风分枝杆菌qPCR检测技术,然后通过对其灵敏度和特异度进行评价,为临床上辅助麻风诊断提供一种快捷有效的手段。
1 对象与方法
1.1 研究对象
1.1.1 蜡块组织样本 均来自我院病理科蜡块组织样本库,选取1990-2009年麻风患者85例,其中多菌型(MB)65例,少菌型(PB)20例,其他疾病患者50例。以上样本用于qPCR方法建立。再次选取蜡块组织99例,所选病例疾病未知,用于qPCR方法灵敏性与特异性评价。所有组织均切取厚度为8 μm蜡片,每例组织切取8片。上述麻风的诊断均符合国家GB15973-1995麻风诊断标准和分型标准。
1.1.2 临床病例组织样本 皮损组织样本(6 mm3)均来自2014-2015年我院门诊疑似麻风患者,共计89例。以上该研究的参与者均签署了知情同意书。
1.2 组织DNA的提取
1.2.1 蜡块组织DNA的提取 切取的8片组织蜡片立即放置于1.5 mL灭菌EP管中,然后向管中加入1 mL二甲苯中,充分溶解并置换石蜡。弃去上清后加入30 μL蛋白酶K,90℃条件下解交联裂解组织,然后按照蜡块组织DNA提取试剂盒(德国Qiagen公司)操作说明书进行操作,最后DNA溶解于TE缓冲液中备用。
1.2.2 皮损组织DNA的提取 临床收取的新鲜皮损组织(6 mm3)在生物安全柜中利用手术刀片切成很小的碎块,将组织碎块转移至1.5 mL无菌EP管中加入30 μL蛋白酶K,56℃条件下裂解组织,然后按照组织和全血DNA提取试剂盒(德国Qiagen公司)操作说明书进行操作,最后DNA溶解于TE缓冲液中备用。
1.3 麻风分枝杆菌qPCR检测 以麻风分枝杆菌特异性基因Ag85B和SodA为检测目标,利用Primer Expess 3.0设计引物及探针。PCR反应体系体积为30 μL,其中包括2xTaqMan Gene Expression Mater Mix15 μL,20 μM上下游引物各0.75 μL,10 μM Taqman探针0.6 μL,模板DNA 2 μL,退火温度为60℃,扩增循环数为40,利用ABI 7300荧光定量PCR系统(美国应用生物系统公司)进行检测。
1.4 统计学方法 麻风分枝杆菌检出率,qPCR灵敏性及特异性等数据均采用SPSS 19.0软件完成。
2 实验结果
2.1 麻风蜡块组织检出率及实验结果的判定 以50份其他疾病蜡块组织中qPCR扩增结果无1例阳性即保证特异性为100%同时最大可能提高灵敏性为原则,同时参考以往同类文献报道[15],将麻风分枝杆菌qPCR检测临界扩增Ct值定为35,判读标准为,当Ag85B和SodA扩增Ct值均≤35时,结果判定为阳性,当Ag85B和SodA扩增Ct值均>35时,结果判定为阴性,若出现一个基因扩增Ct值≤35而另一个基因扩增Ct值>35时,则重新检测,根据重新检测的结果按照上述标准再进行判读。基于以上标准,麻风患者的总体检出率为82.4%,其中MB型患者的检出率为89.2%,PB型患者的检出率为60%见表1。检测阴性的麻风患者样本中,有5例MB型患者(占检测阴性MB型样本的71.4%)和3例PB型患者(占检测阴性PB型样本的37.5%)出现了PCR扩增,但是Ct值>35,综上可见,MB型患者的检出率高于PB型患者,且年代越近的样本的检出率越高,原因可能为蜡块组织保存时间过长造成了病原体DNA的降解,影响了检出率。
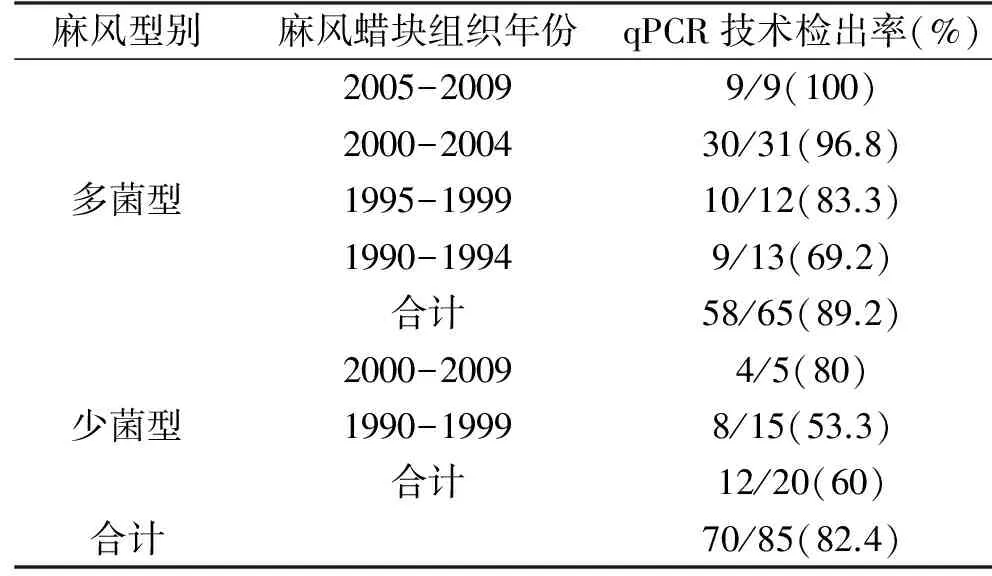
表1 麻风蜡块组织中qPCR技术检出率
2.2 qPCR方法在蜡块样本中的灵敏性及特异性分析 qPCR方法检测病种未知的99例蜡块组织样本,麻风分枝杆菌阳性样本为25例,阴性样本74例;99例蜡块组织样本的病理结合查菌诊断为28例麻风,其余为其他疾病,经对比分析,该方法的检测敏感性为82.1%,特异性为97.2%(表2)。由于蜡块组织保存时间较长及蛋白交联给组织裂解带来的困难,我们推测该方法在新鲜皮损组织中敏感性和特异性会更高。
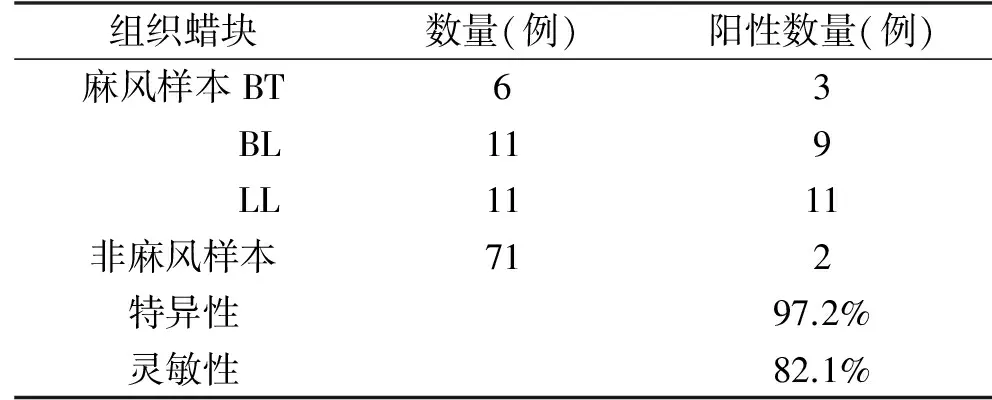
表2 蜡块组织中qPCR技术灵敏性及特异性分析
2.3 qPCR方法在新鲜皮肤样本中的灵敏性及特异性分析 2014-2015年,我院门诊共收集89例疑似麻风患者皮损组织,利用qPCR技术对其均进行了麻风分枝杆菌检测,为消除检测的偏向性,均在病理诊断之前报告检测结果。根据之前制定的检测结果判读标准,判定麻风分枝杆菌阳性样本33例,阴性样本56例;89例临床组织样本病理诊断为36例麻风,53例为其他疾病,具体对比分析结果见表3。可见,qPCR技术在新鲜临床病例样本的检测灵敏度为91.7%,特异度为100%。

表3 新鲜皮肤组织中qPCR技术灵敏性及特异性分析
3 讨论
麻风分枝杆菌不能体外培养,给临床上麻风的诊断带来了较大困难。麻风诊断标准为:①有皮损并伴有浅感觉障碍及闭汗;②周围神经干或皮支粗大;③皮肤切刮组织液及皮肤病理抗酸染色见麻风分枝杆菌;④病理检查见上皮样细胞肉芽肿及巨噬细胞肉芽肿,神经可见肿大及浸润。符合前2项疑似麻风,符合以上4项即可确诊[16]。以上可见,麻风的诊断最核心的指标为查见麻风分枝杆菌和典型的病理表现。对于早期或者PB型麻风,传统的抗酸染色由于受其灵敏度限制查见病原菌比较困难,虽然为了提高该方法的灵敏度,诸如使用特殊包被的载玻片,改良的染色步骤及校准的显微镜等措施被使用,但是特异性方面的缺陷,限制了其在临床诊断的应用[17,18];对于缺乏典型病理表现的病例,病理检查也不能及时提供明确的诊断依据。此外,利用酶联免疫反应(ELISA)技术检测机体针对酚糖脂的IgM抗体等血清学检查手段也被用以麻风的辅助诊断[19,20],该方法是非侵入性的且对抗酸染色检查是一种有效的补充。此方法的检测结果反映的是机体的病原菌载量,可根据其结果对麻风患者作进一步的细化分型[21]。但是,PCR技术,特别是qPCR技术已经被证明在灵敏度方面相对于血清学检查有着无可比拟的优势[22]。
本研究选取麻风分枝杆菌特异性基因Ag85B和SodA作为检测目标,设计特异性引物及探针,对前期85例麻风蜡块组织样本(65例MB型和20例PB型)和50例其他疾病蜡块组织样本进行检测,根据检测PCR的扩增结果及充分保证特异性并最大可能提高灵敏性的原则,我们将PCR扩增临界Ct值定为35。按照此标准,85例麻风蜡块组织样本检出率为82.4%。然后,我们检测了病种未知的99例蜡块组织样本的麻风分枝杆菌,将判读结果与临床诊断结果进行比对后,计算出qPCR方法的特异度为97.2%,灵敏度为82.1%。接下来在89例新鲜皮损组织中进行了麻风分枝杆菌检测,经比对计算后,特异度为100%,灵敏度为91.7%,其中多菌型的灵敏度达100%,而少菌型的灵敏度为50%。以上结果证实了我们对蜡块组织中灵敏度偏低原因的推测;同时,我们的上述研究结果与国内外研究团队研究结果基本保持一致。叶理等[24]利用qPCR方法在52例皮肤组织标本中检测麻风分枝杆菌DNA的检出率为90.38%;覃晓琳等[25]利用单管巢式qPCR在54例疑似麻风组织液标本中检测麻风分枝杆菌DNA,其中多菌性的检出率为96.9%,少菌型检出率为83.3%。另外,Martinez等[15]于2006年利用qPCR技术在69例皮肤组织样本中检测麻风分枝杆菌Ag85B基因的灵敏度达91.3%;而后于2011年再次利用qPCR技术在62例皮肤组织样本中同时检测麻风分枝杆菌Ag85B基因和SodA基因,其灵敏度分别为68.8%和75%;对于Ag85B基因,多菌型的灵敏度为95.2%,而少菌型的灵敏度为36.4%[23]。
本研究结果表明,同时选取麻风分枝杆菌特异性基因Ag85B和SodA作为检测目标的qPCR技术,具有较高的灵敏度和最高的特异度;辅之以蛋白酶K裂解为核心的麻风分枝杆菌DNA提取方法,是一种快捷有效的临床诊断麻风的辅助手段,特别是对于BT型麻风和缺乏典型组织形态学改变的麻风诊断则意义更为明显。
[1]Bennett BH, Parker DL, Robson M. Leprosy: steps along the journey of eradication[J]. Public Health Rep,2008,123(2):198-205.
[2]Goulart LR, Goulart IM. Leprosy pathogenetic background: a review and lessons from other mycobacterial diseases[J]. Arch Dermatol Res,2009,301(2):123-137.
[3]WHO. Global leprosy situation[J]. Weekly Epidemiological Record,2010,85:337-348.
[4]Shepard CC, McRae DH. A method for counting acid-fast bacteria[J]. Int J Lepr Other Mycobact Dis,1968,36:78-82.
[5]Williams DL, Gillis TP, Fiallo P. Detection of Mycobacterium leprae and the potential for monitoring antileprosy drug therapy directly from skin biopsies by PCR[J]. Molecular & Cellular Probes,1992,4:401-410.
[6]谭笑.结核病实验室快速诊断方法的研究[J].湖南师范大学学报(医学版),2007,4(2):58- 59.
[7]Harris KA, Turner P, Green EA. Duplex real-time PCR assay for detection of streptococcus pneumoniae in clinical samples and determination of penicillin susceptibility[J]. J Clin Microbiol,2008,46(8):2751-2758.
[8]Espy MJ, Uhl JR, Sloan LM. Real-time PCR in clinical microbiology: applications for routine laboratory testing[J]. Clin Microbiol Rev,2006,19(1):165-256.
[9]De Wit MYL, Faber WR, Krieg SR, et al. Application of a polymerase chain reaction for the detection of Mycobacterium leprae in skin tissues[J]. J Clin Microbiol,1991,29(5):906-910.
[10]Hartskeerl RA, De Wit MYL, Klatser PR. Polymerase chain reaction for the detection of Mycobacterium leprae[J]. J Gen Microbiol,1989,135:2357-2364.
[11]Williams DL, Gillis TP, JBooth R, et al. The use of a specific DNA probe and polymerase chain reaction for the detection of Mycobacterium leprae[J]. J Infect Dis,1990,162:193-200.
[12]Plikaytis BB, Gelber RH, Shinnick TM. Rapid and sensitive detection of Mycobacterium leprae using a nestedprimer gene amplification assay[J]. J Clin Microbiol,1990,28:1913-1917.
[13]Woods SA, Cole ST. A rapid method for the detection of potentially viable Mycobactenium leprae in human biopsies: a novel application of PCR[J]. FEMS Microbiol Lett,1989,65:305-310.
[14]Woods SA, Cole ST. A family of dispersed repeats in Mycobactenium leprae[J]. Mol Microbiol,1990,4:1745-1751.
[15]Martinez AN, Britto CF, Nery JA, et al. Evaluation of real-time and conventional PCR targeting complex 85 genes for detection of Mycobacterium leprae DNA in skin biopsy samples from patients diagnosed with leprosy[J]. J Clin Microbiol,2006,44(9):3154-3159.
[16]Jardim MR, Antunes SLG, Santos AR. Criteria for diagnosis of pure neural leprosy[J]. J Neurol,2003,250(7):806-809.
[17]Levy L, Ji B. The mouse foot-pad technique for cultivation of Mycobacterium leprae[J]. Lepr Rev,2006,77:5-24.
[18]Job CK, Chacko CJG. A modification of Fite's stain for demonstration of Mycobacterium leprae in tissue sections[J]. Indian Journal of Leprosy,1986,57:17-18.
[19]Torres P, Camarena JJ, Gomez JR, et al. Comparison of PCR mediated amplification of DNA and the classical methods for detection of Mycobacterium leprae in different types of clinical samples in leprosy patients and contacts[J]. Lepr Rev,2003,74:18-30.
[20]Jardim MR, Antunes SL, Simons B, et al. Role of PGL-I antibody detection in the diagnosis of pure neural leprosy[J]. Lepr Rev,2005,76:232-240.
[21]Schuring RP, Moet FJ, Pahan D, et al. Association between anti-pGL-I IgM and clinical and demographic parameters in leprosy[J]. Lepr Rev,2006,77:343-355.
[22]Wichitwechkarn J, Karnjan S, Shuntawuttisettee S, et al. Detection of Mycobacterium leprae infection by PCR[J]. J Clin Microbiol,1995,33:45-49.
[23]Martinez AN, Ribeiro-Alves M, Sarno EN, et al. Evaluation of qPCR- based Assays for leprosy diagnosis directly in clinical specimens[J]. Plos Neglect Trop D,2011,5:1-8.
[24]叶理,吕志成,靳亚丽,等.麻风分支杆菌PCR检测方法的优化与应用[J].皮肤性病诊疗学杂志,2016,23:23-26.
[25]覃晓琳,黄进梅,薛耀华,等.单管巢式实时PCR检测麻风杆菌方法的建立及初步应用[J].中国麻风皮肤病杂志,2014,30:579-582.
(收稿:2016-06-21 修回:2016-06-24)
Establishment and evaluation of quantitative PCR method for detection of Mycobacterium leprae DNA
WENJing1,WANGChuan1,SUNLele1,CHENMingfei1,2,FUXi'an1,WANGJianwen1,2,LIUHong1,2,ZHANGFuren1,2.
1.ShandongProvincialInstituteofDermatologyandVenereology,AcademyofMedicalSciences,Jinan250022,China; 2.ShandongProvincialDermatologyHospital,ShandongUniversity,Jinan250022,China
Correspondenceauthor:ZHANGFuren,E-mail:zhangfuren@hotmail.com
Objective: To establish the detection method of Mycobacterium leprae DNA using quantitative PCR (qPCR) and to analyze the sensitivity and specificity of qPCR in identifyingMycobacteriumlepraeDNA. Methods: The special gene sequences Ag85B and soda ofMycobacteriumlepraeDNA were detected in 135 formalin-fixed, paraffin-embedded skin tissues of leprosy or non-leprosy patients using qPCR to establish the criterion for this method. Then the special gene sequences Ag85B and sodA ofMycobacteriumlepraeDNA were also detected in 99 formalin-fixed, paraffin-embedded skin tissues of unknown disease and 89 frozen skin tissues of unknown diseases to evaluate the sensitivity and specificity of qPCR. Results: The specificity and sensitivity of qPCR were 100% and 91.7% in frozen skin tissues and higher than those in formalin-fixed, paraffin-embedded skin tissues. Conclusion: qPCR is an useful method in detectingMycobacteriumlepraeDNA.
leprosy;Mycobacteriumleprae; qPCR; evaluation
山东省自然科学基金青年基金(编号:ZR2013HQ041)
1山东省医学科学院,山东省皮肤病性病防治研究所,济南,250022
2山东省皮肤病医院,山东大学,济南,250022
张福仁,E-mail:zhangfuren@hotmail.com
——以“蜡块的运动”演示实验为例

