XIAP和caspase-9在尖锐湿疣组织中的表达
李 晶 徐洪玉 吴振涛
·论著·
XIAP和caspase-9在尖锐湿疣组织中的表达
李 晶1徐洪玉1吴振涛2
目的: 检测XIAP和caspase-9在CA组织中的表达。方法: 采用免疫组化方法分别检测72例CA组织和20例正常包皮组织中XIAP和caspase-9蛋白的表达。结果: CA组织中XIAP蛋白的阳性表达率(56.94%)高于对照组(15.00%),其差别有统计学意义(P<0.05);而caspase-9蛋白的阳性表达率(37.50%)较对照组(70.00%)低,其差别亦有统计学意义(P<0.05)。两种蛋白在CA组织中的表达呈负相关(r=-0.83,P<0.05)。结论: XIAP抑制caspase-9的活性和表达,两者共同参与CA的发病过程。
尖锐湿疣; XIAP; caspase-9; 凋亡
尖锐湿疣(Condyloma Acuminatum, CA)是由人乳头瘤病毒(Human Papilloma virus, HPV)感染引起的一种慢性良性增殖性疾病,临床上易反复发作,平均复发率高达40%[1]。角质形成细胞感染HPV后失去正常凋亡的功能,CA的发病和复发与此密切相关。其生物学行为类似良性肿瘤。Caspase家族的激活是细胞凋亡过程中的中心环节,X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)是凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族中抑制凋亡最有力的成员,可直接结合并抑制凋亡起始因子caspase-9,caspase-9是线粒体凋亡通路中重要的启动者,可激活其下游的效应caspase,从而启动细胞死亡程序[2,3]。目前,有关XIAP 、caspase-9与CA的关系国内外报道鲜见。本研究采用免疫组化方法检测CA皮损中XIAP和caspase-9的表达,初步探讨其在CA发生、发展中的作用。
1 资料与方法
1.1 资料及分组 72例CA标本均来源于2014年6月至2015年4月山东省交通医院性病门诊就诊患者,皮损位于外生殖器部位。患者均为初次发病,就诊前未做任何治疗,无系统性疾病史,不合并有其他外生殖器疾病或性病。其中男42例,女30例,年龄20~45岁,平均年龄27.6岁,病程0.5~6个月,平均2.3个月。临床表现典型,醋酸白试验阳性,组织病理证实为CA(图1)。20例包皮标本作为对照组,取自我院泌尿外科行包皮环切术者,患者系健康男性,既往无CA等外生殖器疾病,经组织病理学检查证实为正常上皮。
1.2 试剂 兔抗人XIAP多克隆抗体、兔抗人caspase-9多克隆抗体及SV超敏两步法免疫组化试剂盒均购自武汉博士德生物工程有限公司。
1.3 免疫组织化学染色 所有标本均连续切片3张,切片厚度4 μm,2张用于免疫组化研究,1张行HE染色,进行组织病理确诊。免疫组化操作均严格按照说明书步骤进行。用已知阳性标本做阳性对照,PBS代替一抗做空白对照(图2)。
1.4 结果判定标准 XIAP蛋白阳性染色定位于细胞浆或细胞膜,caspase-9蛋白阳性染色定位于细胞浆或细胞核。细胞阳性表达强度按照以下方法进行半定量分析:①按细胞着色强度:浅黄色为1分,棕黄色为2分,棕褐色为3分;②按阳性细胞百分比:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分,两者分值的乘积即为细胞阳性表达强度,其分级方法为:0分为阴性(-),1~4分为弱阳性(+),6~8分为阳性(++),9~12分为强阳性(+++),采用单盲法,每张切片任选两个皮片,每个皮片随机选取表皮层5个高倍(400倍)视野进行评分,取其得分的平均数作为该标本分值,将(+)-(+++)归为阳性表达组计算阳性率[4]。
1.5 统计学方法 运用SPSS 17.0统计软件,不同组间阳性率比较用Fisher确切概率法,两蛋白表达的相关性采用Spearman非参数相关分析,检验水准a=0.05。
2 结果
2.1 XIAP在正常皮肤与CA组织中的表达 XIAP蛋白的表达情况见表1,CA组XIAP蛋白的阳性表达率(56.94%)较对照组(15.00%)高,其差别具有统计学意义(χ2=11.036,P<0.05)。
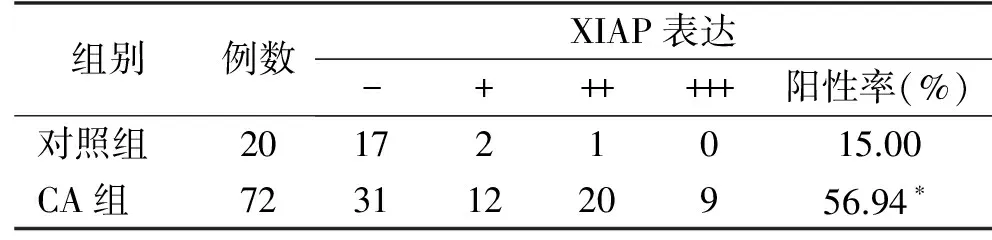
表1 XIAP在正常皮肤与CA组织中的表达
注:*与对照组相比,P=0.001
2.2 Caspase-9在正常皮肤与CA组织中的表达 caspase-9蛋白的表达情况见表2,CA组caspase-9蛋白的阳性表达率(37.50%)低于对照组(70.00%),其差别具有统计学意义(χ2=6.692,P<0.05)。

表2 Caspase-9在正常皮肤与CA组织中的表达
注:*与对照组相比,P=0.012
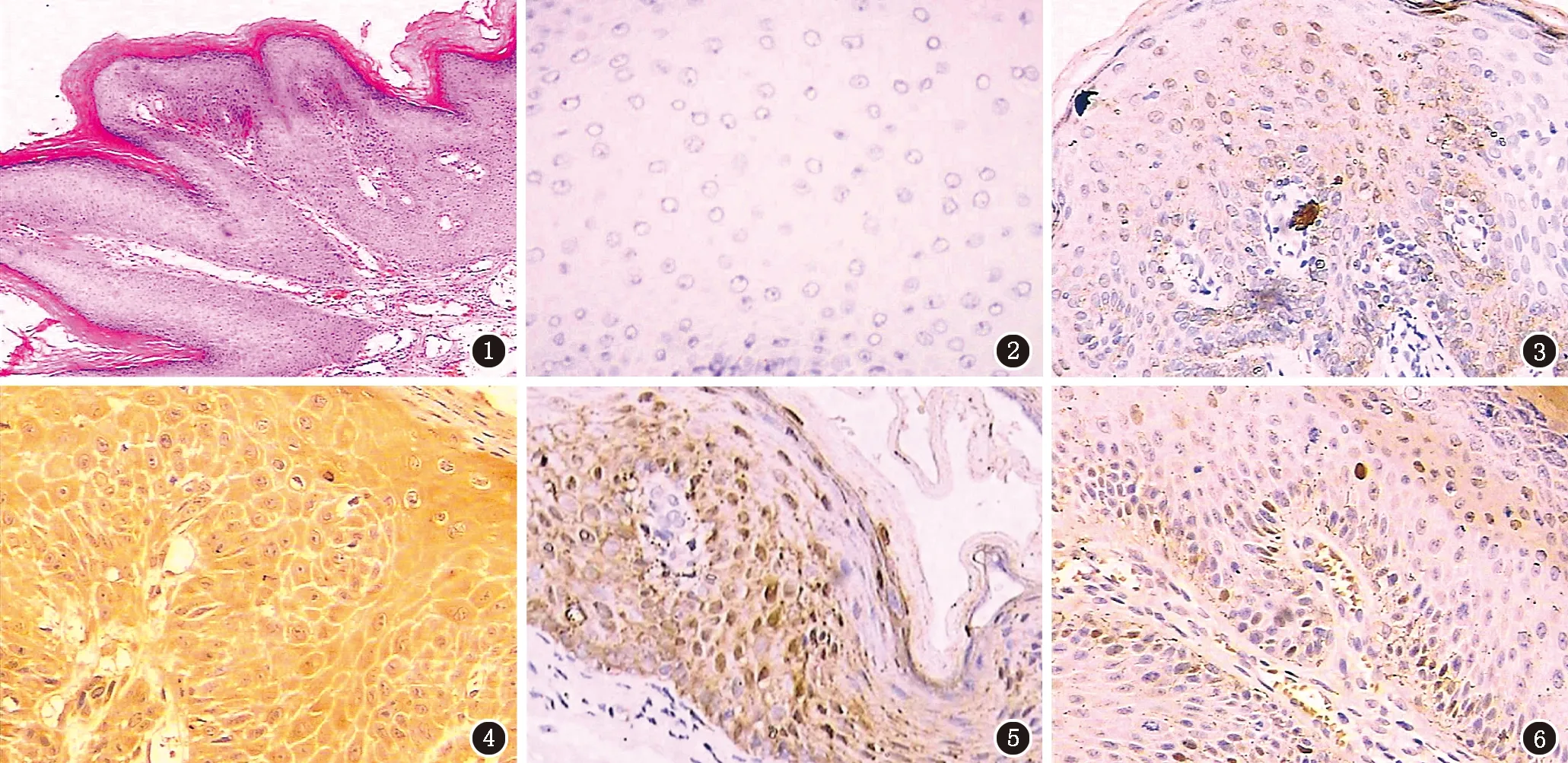
图1 CA组织(HE,×100) 图2 CA组织的空白对照(×400) 图3 XIAP在正常皮肤组织中的表达,阳性细胞主要位于基底层及棘层中下部,数目较少,染色较浅,呈灶状分布(×400) 图4 XIAP在CA组织中的表达,阳性细胞分布于表皮全层,以棘层为主,染色较强(×400) 图5 Caspase-9在正常皮肤组织中的表达,阳性细胞主要位于增生上皮的基底层及棘层中下部,染色较强(×400) 图6 Caspase-9在CA组织中的表达,染色浅,表达较少(×400)
2.3 XIAP和caspase-9蛋白定位表达情况 XIAP蛋白阳性着色主要位于细胞浆或细胞膜。在正常皮肤组织中,阳性细胞主要位于基底层及棘层中下部,数目较少,染色较浅,呈灶状分布(图3);而在CA组织中,阳性细胞分布于表皮全层,以棘层为主,染色较强(图4)。Caspase-9蛋白阳性着色在细胞浆或细胞核。在正常皮肤组织中,阳性细胞主要位于增生上皮的基底层及棘层中下部,染色较强(图5);在CA组织中表达较少,着色较浅(图6)。
2.4 CA组织中XIAP和caspase-9蛋白表达的相关性分析 采用Spearman相关分析对二者在CA组织中的表达进行相关性分析,结果显示XIAP和caspase-9的表达呈负相关(r=-0.83,P<0.05)。见表3。

表3 XIAP和caspase-9蛋白表达的相关性
3 讨论
XIAP是Peter等于1996年在人的胚胎脑细胞中克隆出的IAP家族新成员,在体内除外周血淋巴细胞以外的所有组织中广泛表达[5]。XIAP分子N-端的3个BIR结构域可以直接结合和抑制caspases-3、caspases-7、caspases-9,是唯一能同时抑制起始阶段和效应阶段的凋亡抑制蛋白[6]。本研究发现,XIAP 在CA组织中表达高于正常皮肤组织,推测HPV感染宿主细胞后,可能激活了XIAP基因的转录、翻译,使XIAP蛋白过度表达,阻碍凋亡信号的传导,从而导致被感染的角质形成细胞避开凋亡、逃离生长监控,继而保护病毒自身的复制,促进CA的生长和发展。Yin等[7]报道XIAP在CA组织中表达的阳性率为80%,且均为较高水平表达,以棘层最为明显,本实验阳性率低于该报道。近年来,HPV的致癌性已得到证实,被HPV感染角质形成细胞的凋亡具有控制CA进一步发展的作用,Cillessen等在弥漫性大B细胞淋巴瘤细胞中发现,XIAP的拮抗剂能恢复caspase-9介导的凋亡[8],提示能够通过XIAP作为靶标研发治疗CA的新药物。
Caspases是一类半胱氨酸天冬氨酸特异性蛋白酶家族,该家族是执行细胞凋亡的主要酶类。其中caspases-9是线粒体通路中凋亡的启动者,激活其下游的效应caspases,最终导致细胞死亡。Caspases-9广泛表达于人类的正常组织如神经、肌肉等,在多种肿瘤组织中均发现caspase-9基因转录和翻译水平的下调[9,10]。本实验结果显示caspase-9在CA组织中低表达,与对照组相比差异具有统计学意义,提示caspase-9也参与了CA的发病过程。本实验还发现caspase-9与高表达的XIAP呈明显的负相关。我们推测,一方面,CA中caspase-9部分表达,可以使少数细胞发生凋亡,限制HPV的复制,这可能是机体的一种自我保护机制;另一方面,caspase-9的活性受到高表达的XIAP的抑制,细胞凋亡不能有效进行,HPV仍能保持较高水平的复制和繁殖,使越来越多的角质形成细胞被感染,促进病变组织不断生长。
综上所述,我们认为XIAP高表达及caspase-9活性降低共同参与CA的发生发展过程,它们之间的相互作用关系可能是细胞凋亡通路中重要的一个环节。已有研究报道,通过慢病毒介导的shRNA稳定抑制XIAP的表达,可以显著减少肿瘤细胞的增长、诱导凋亡并增加肿瘤细胞对化疗和放疗的敏感性[11-13]。因此,随着分子生物学技术的进一步发展,阻断XIAP的表达及上调caspase-9可能成为防止CA发生、复发的新靶点。
[1] 杨戈,林昭春,杨建文.PCNA和caspase-3在初复发尖锐湿疣组织中的表达[J].中国麻风皮肤病杂志,2009,25(7):820-822.
[2] Obexer P, Ausserlechner MJ. X-linked inhibitor of apoptosis protein - a critical death resistance regulator and therapeutic target for personalized cancer therapy[J]. Front Oncol,2014,4(197):1-8.
[3] Mahdavi M, Davoodi J, Zali MR, et al. Concomitant activation of caspase-9 and down-regulation of IAP proteins as a mechanism of apoptotic death in HepG2, T47D and HCT-116 cells upon exposure to a derivative from 4-aryl-4H-chromenes family[J]. Biomed Pharmacother,2011,65(3):175-182.
[4] 李晶,徐洪玉,郭淑兰.Maspin蛋白在尖锐湿疣组织中的表达[J].中国麻风皮肤病杂志,2012,28(5):324-326.
[5] Liston P, Roy N, Tamai K, et al. Suppression of apoptosis in mammalian cells by NAIP and a related family of IAP genes[J]. Nature,1996,379(6563):349-353.
[6] 蔡增琰,潘亚文,尚银武,等.XIAP、Smac的研究进展[J].中国肿瘤外科杂志,2014,6(1):51-53.
[7] Yin GW, Guo Y, Huang YH, et al. The expression and significance of XIAP and C-jun on Condyloma acuminatum[J]. Pak J Pharm Sci,2015,28(4suppl):1551-1553.
[8] Maxwell SA, Mousavi-Fard S. Non-Hodgkin's B-cell lymphoma: advances in molecular strategies targeting drug resistance[J]. Exp Biol Med (Maywood),2013,238(9):971-990.
[9] Lemaire C, Godefroy N, Costina-Parvu I, et al. Caspase-9 can antagonize p53-induced apoptosis by generating a p76(Rb) truncated form of Rb[J]. Oncogene,2005,24(20):3297-3308.
[10] Bolton-Gillespie E, Schemionek M, Klein HU, et al. Genomic instability may originate from imatinib-refractory chronic myeloid leukemia stem cells. Blood,2013,121(20):4175-4183.
[11] Wang R, Li B, Wang X, et al. Inhibiting XIAP expression by RNAi to inhibit proliferation and enhance radiosensitivity in laryngeal cancer cell line[J]. Auris Nasus Larynx,2009,36(3):332-339.
[12] Dai Y, Qiao L, Chan KW, et al. Adenovirus-mediated down-regulation of X-linked inhibitor of apoptosis protein inhibits colon cancer[J]. Mol Cancer Ther,2009,8(9):2762-2770.
[13] Qu Y, Xia P, Zhang S, et al. Silencing XIAP suppresses osteosarcoma cell growth, and enhances the sensitivity of osteosarcoma cells to doxorubicin and cisplatin[J].Oncol Rep,2015,33(3):1177-1184.
(收稿:2016-06-24 修回:2016-08-16)
The expression of XIAP and caspase-9 in condyloma acuminatum
LIJing1,XUHongyu1,WUZhentao2.
1.DepartmentofDermatology,ShandongJiaotongHospital,Jinan250031China; 2.QingzhouSkinDiseaseControlStation,Qingzhou262500,Sandong,China
LIJing,E-mail:lijing810222@126.com
Objective: To detect the expression of XIAP and caspase-9 in condyloma acuminatum. Methods: The immunohistochemistry method was used to detect the expression of XIAP and caspase-9 in the tissues of 72 patients with condyloma acuminatum and prepuce tissues of 20 healthy persons. Results: The positive rate of XIAP protein in condyloma acuminatum was significantly higher than that in normal prepuces (56.94% vs 15%,P<0.05), while the positive rate of caspase-9 protein in condyloma acuminatum was lower than that in normal prepuces (37.5% vs 70%,P<0.05). There was a negative correlation between the expression of XIAP and caspase-9 (r=-0.83P<0.05). Conclusion: XIAP may promote the development of condyloma acuminatum by inhibiting the activity of caspase-9. The abnormal expression of XIAP and caspase-9 may be involved in the progression of condyloma acuminatum.
condyloma acuminatum; XIAP; caspase-9; apoptosis
1山东省交通医院皮肤科,济南,250031 2山东省青州市皮肤病防治站,青州,262500
李晶,E-mail: lijing810222@126.com

