耐酸产蛋白酶芽孢杆菌菌株的筛选及其生料固体发酵豆粕效果评价
■董伟洁 朱永明 姜军坡王梓竹 王世英 朱宝成
(河北农业大学生命科学学院,河北保定 071001)
发酵豆粕富含小分子肽、游离氨基酸、乳酸、益生菌等多种营养成分,日益被饲料企业及养殖户所青睐(张连慧等,2017)。固态发酵技术较为简单,适宜于大规模生产,且能耗低、废液污染较少,投资成本与生产成本相对较低,是发酵豆粕适宜的方式(朱平军,2011)。北方地区冬季气候寒冷,若豆粕发酵过程所需温度越低,则越有利于节省能耗,降低生产成本。关于以混菌的方式发酵豆粕,国内研究人员做了大量工作。如王德培等(2011)利用枯草芽孢杆菌、凝结芽孢杆菌、乳酸杆菌发酵豆粕,当枯草芽孢杆菌与乳酸菌之比为2.2∶1、发酵温度30℃、外加水量46.5%、总接种量15 ml(在豆粕72 g、麸皮8 g的发酵基质中)、拌料水pH值自然,发酵84 h后,发酵豆粕中三氯乙酸可溶性氮含量可达12.78%。混菌发酵的原理主要是利用芽孢杆菌可产生蛋白酶,酵母菌和曲霉菌可降解抗营养因子,乳酸菌可调节pH值,通过协调各个菌株之间的作用来提高豆粕的营养价值。若是能筛选出一株能在酸性环境中生长,可在胞外产生蛋白酶并降解豆粕中大豆球蛋白、β-伴大豆球蛋白等主要抗营养因子的菌株,则可事半功倍。芽孢杆菌属(Bacillus)细菌可在胞外产生多种消化酶,耐受酸性环境,极具开发潜力(潘迪子等,2016)。农业部发布的发酵豆粕质量标准中规定,发酵豆粕中粗蛋白质含量不得低于45%,酸溶蛋白占粗蛋白质的含量(即酸溶蛋白相对含量)不得低于8.0%。因此,本研究拟以酸性脱脂牛奶培养基为限制性培养基,结合透明圈法进行初筛,以酸性蛋白酶活力为指标进行复筛;通过菌落及菌体形态观察、生理生化特性测定、16S rDNA序列系统发育分析相结合的方法鉴定供试菌株种属;通过室温18℃下固体发酵豆粕试验,探索供试菌株低温下降解大分子抗营养因子、提高酸溶蛋白相对含量的可行性,并以酸溶蛋白相对含量为指标,采用正交试验设计考察料水比、玉米粉含量、硫酸铵含量、菌株接种量4个因素,优化固体发酵豆粕的条件,为供试菌株的应用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 样品
土壤样品采集于保定市生态园和保定市植物园中各类植物根际土壤(地面10 cm以下)。酸菜样品购于保定市沃尔玛超市、惠友超市。粪便样品采集于保定市固德生态农业发展有限公司特种野猪繁育中心、保定市谢庄村永生养殖场、保定市满城区睿德养殖场。
1.1.2 试剂、培养基与试液
膨化豆粕:粗蛋白质≥(43.0±0.5)%,水分≤13.0%,由中储粮油脂(唐山)有限公司生产。
NB培养基、NA培养基的配制方法参见周德庆等(2013)。
富集培养基为NB培养基。
初筛培养基:脱脂牛奶100 ml、酵母浸粉5.0 g、NaCl 5.0 g、琼脂20.0 g、pH值5.0的磷酸氢二钠-柠檬酸缓冲液900 ml。
NB培养基(pH值5.0):除以pH值5.0的磷酸氢二钠-柠檬酸缓冲液代替水外,其余组分同NB培养基。
豆粕培养基(pH值5.0):豆粕含量5.0 g、葡萄糖1.0 g、MgCl20.1 g、硫酸铵2.0 g、pH值5.0的磷酸氢二钠-柠檬酸缓冲液配制100 ml。
10 mmol/l 2,4,6-三吡啶基三嗪(TPTZ)溶液:称取0.031 2 g的TPTZ,用0.04 mol/l的盐酸溶液定容至10 ml,4 ℃保存。
TPTZ工作液:将10 mmol/l TPTZ溶液、20 mmol/l FeCl3溶液、0.2 mol/l乙酸-乙酸钠缓冲液按照10∶1∶1的比例混合,35℃水浴孵化60 min。
1%脱脂牛奶(pH值5.0):取伊利脱脂牛奶33.3 ml,加入100 ml容量瓶中,用pH值5.0的磷酸氢二钠-柠檬酸缓冲液定容至100 ml,即得。
1.1.3 固体发酵容器
8 L食品级塑料桶(压扣盖):上口直径225 mm,下口直径210 mm,高235 mm。
1.2 试验方法
1.2.1 富集培养
取样品10.0 g置于无菌水中,装瓶量为100 ml/250 ml,于180 r/min振荡20 min后再静置5 min,取上清待用。按10%的接种量接种于NB培养基,37℃于180 r/min培养48 h。
1.2.2 耐酸产蛋白酶菌株的初筛
将富集培养得到的菌液于80℃水浴20 min后,梯度稀释。分别取10-4、10-5、10-6梯度稀释液100 μl,涂布于初筛培养基表面,于37℃培养24 h。挑取生长良好、有明显透明圈的单菌落,NA斜面保藏,即为初筛菌株。
1.2.3 耐酸产蛋白酶菌株复筛
将初筛菌株接种于豆粕培养基,37℃下于180 r/min培养48 h,将发酵液离心(10 000 r/min,4 ℃)10 min,取上清作为粗酶液,参考GB/T 28715—2012方法测定酸性蛋白酶活性,其中底物采用1%脱脂牛奶(pH值5.0)。以复筛菌株中酸性蛋白酶活力最高者为供试菌株。
1.2.4 供试菌株的菌落、菌体形态观察
采用平板划线法将供试菌株于37℃下培养24 h后,观察菌落形态。采用革兰氏染色观察供试菌株的菌体形态。
1.2.5 供试菌株生理生化特性测定
对供试菌株的生理生化特性进行测定,参照车秀珠等(2001)方法。
1.2.6 16S rDNA序列测定
参考吕纪涛(2015)的方法提取供试菌株DNA并扩增其16S rDNA序列。扩增产物送深圳华大基因股份有限公司测序。将测得序列提交到GenBank中进行BLAST比对,利用Mega 5.04按Neighbor-Joining法构建系统发育树。
1.2.7 供试菌株固体发酵豆粕效果评价
1.2.7.1 固体发酵豆粕基础条件
刮取供试菌株斜面菌苔,接种NB培养基中,装瓶量100 ml/250 ml,37 ℃、180 r/min培养12 h,即得供试菌液。
称取12.00 kg豆粕,平铺于地面,加入0.48 kg玉米粉、0.30 kg硫酸铵,混合均匀;对照组仅加水,水的体积按料水比1∶0.6量取;试验组加入水与供试菌液的混合物,水的体积按料水比1∶0.6量取,菌液体积按接种量6.0%量取;pH值自然。对照组、试验组分别混匀后,分装入置于8 L塑料桶内的塑料袋中,装满并压实密封,尽可能排出气体;室温18℃下发酵30 d,塑料桶周围不覆盖保温物质。观察并记录发酵豆粕的感官指标,并测定试验组在0、30 d及对照组在30 d时对应的水分、pH值、粗蛋白质含量、酸溶蛋白相对含量、蛋白质相对分子质量分布、抗氧化活性等指标。
(1)水分含量测定:称取发酵豆粕3.0 g于平皿中,置于50℃的烘箱中干燥至恒重,计算发酵豆粕的水分含量(x,%):
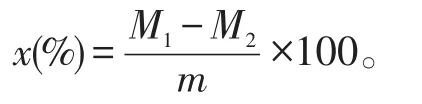
式中:M1——干燥前发酵豆粕与平皿的总质量(g);
M2——干燥后发酵豆粕与平皿的总质量(g);
m——发酵豆粕质量(g)。
(2)发酵物pH值测定:称取发酵豆粕3.0 g于50 ml离心管中,加入30 ml蒸馏水,振荡60 min后,于5 000 r/min下离心10 min,吸取上清液,测量pH值。
(3)粗蛋白质含量测定:参考GB/T 500.9—2016方法。计算发酵豆粕经干燥后的粗蛋白质含量(P,%):
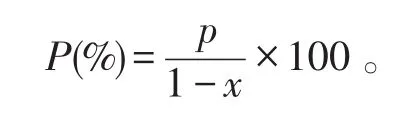
式中:p——发酵豆粕未干燥时的粗蛋白含量(%);
x——发酵豆粕含水量(%)。
(4)酸溶蛋白含量测定:称取发酵豆粕4.0 g置于离心管中,按照1∶5的比例加入15%的三氯乙酸20 ml,振荡60 min。5 000 r/min离心10 min。吸取3 ml上清加入消解管,其余操作同粗蛋白质含量测定方法。计算发酵豆粕经干燥后的酸溶蛋白含量(PAS,%):

式中:pAS——发酵豆粕未干燥时的酸溶蛋白含量(%);
x——发酵豆粕含水量(%)。
酸溶蛋白含量与粗蛋白质含量的比值即为酸溶蛋白相对含量(PAS/P,%)。
(5)蛋白质相对分子质量分布测定:称取样品1.0 g,加入20 ml的0.03 mol/l Tris-HCl(pH值 8.0),在室温下浸提60 min(每隔10 min振荡1 min),10 000 r/min下离心10 min,取上清液40 μl,加入5×上样缓冲液 10 μl,进行沸水浴 10 min,12 000 r/min下离心5 min,离心后即得样品液。采用SDS-PAGE法测定样品液的蛋白质相对分子质量分布情况(王章存等,2013)。
(6)抗氧化活性测定方法(米书梅等,2013;Benzie等,1996):分别取不同浓度(0、25、50、100、150、200、250、300、350、400 mmol/l)的维生素C标准品溶液100 μl,加入TPTZ工作液3 ml,混合均匀后于35℃水浴孵化30 min,在597 nm测定吸光度。以水代替维生素C溶液同法操作,所得孵化液用来调零。维生素C浓度的标准曲线方程为y=2.292 7x-0.035 2(R2=0.999 4)[y——597 nm下吸光度;x——维生素C浓度(mmol/l)]。
称取用研钵碾碎的样品1.0 g,加入5 ml 15%三氯乙酸浸提60 min,10 000 r/min离心10 min,吸取上清液100 μl,加入 TPTZ 工作液3 ml,混合均匀后35℃水浴孵化30 min,于597 nm下测定吸光度。取水100 μl,加入TPTZ工作液3 ml,混合均匀后35 ℃水浴孵化30 min,所得孵化液用来调零。发酵豆粕抗氧化活性以mg AEAC/100 g[与每100 g发酵豆粕的抗氧化能力相当的维生素C的质量(以mg计)]表示。计算发酵豆粕经干燥后的抗氧化活性(Y,mg AEAC/100 g):
运用混合式学习模式的整本书阅读不只在课堂上进行阅读和讨论,而是将阅读延展到家庭、社区等任意空间,且灵活采用线上、线下的学习方式,至少一部分是在线讨论、探究,至少一部分是在实体课堂上由教师介人指导的阅读学习,还有至少一部分是学生的自由自主阅读。课堂学习、在线互动、非课堂非在线自主阅读,至少这三个模块整合在一起,形成完整的整本书阅读体验课程。

式中:y——发酵豆粕未干燥时的抗氧化活性(mg AEAC/100 g);
x——发酵豆粕含水量(%)。
1.2.7.2 正交试验优化固体发酵豆粕条件
以酸溶蛋白相对含量为指标,按照正交试验表L9(34)设计4因素3水平的正交试验考察料水比、玉米粉含量、硫酸铵含量、菌株接种量等因素对供试菌株固体发酵豆粕效果的影响。正交试验的因素水平表如表1所示。
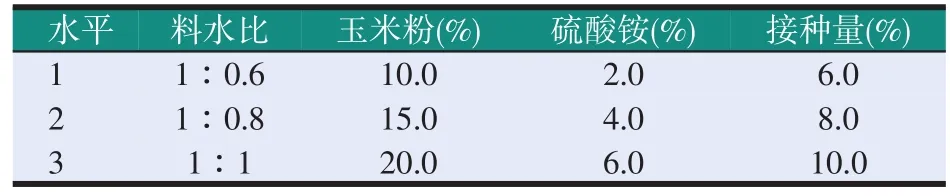
表1 耐酸产蛋白酶菌株固体发酵豆粕正交优化试验因素水平设计
采用供试菌株固体发酵豆粕15、30 d时,于发酵豆粕的顶部、中部和底部分别划十字,每个十字于端点及交叉点取样;将所有样品充分混匀,取混合物按前述方法测定水分含量、pH值、粗蛋白质含量、酸溶蛋白相对含量和抗氧化活性。
以酸溶蛋白相对含量为指标,对豆粕发酵15 d和30 d的正交试验结果分别进行极差分析,比较发酵15 d和30 d时各自最优组合的发酵效果。
2 结果与分析
2.1 耐酸生长产蛋白酶菌株的初筛(见表2)

表2 耐酸生长产蛋白酶菌株初筛结果
经过初筛,共筛选出可在初筛培养基上生长并产生透明圈的菌株133株,其中透明圈直径大于0.80 cm的菌株共21株(如表2所示)。由表2可知,透明圈直径在0.80~2.00 cm之间的菌株共有17株;而透明圈直径>2.00 cm的菌株共有4株,分别是菌株SD47、SD48、SD56和SD62,其中最高者为SD48菌株。故以菌株SD47、SD48、SD56和SD62作为复筛菌株。
2.2 耐酸生长产蛋白酶菌株的复筛

图1 复筛菌株蛋白酶活力测定的结果
2.3 SD48菌株种属鉴定
2.3.1 SD48菌株形态观察结果
SD48菌株的菌落形态如图2(a)所示,呈白色,圆形,火山口状,四周隆起,边缘整齐,中央凹陷,凹陷区域表面光滑。
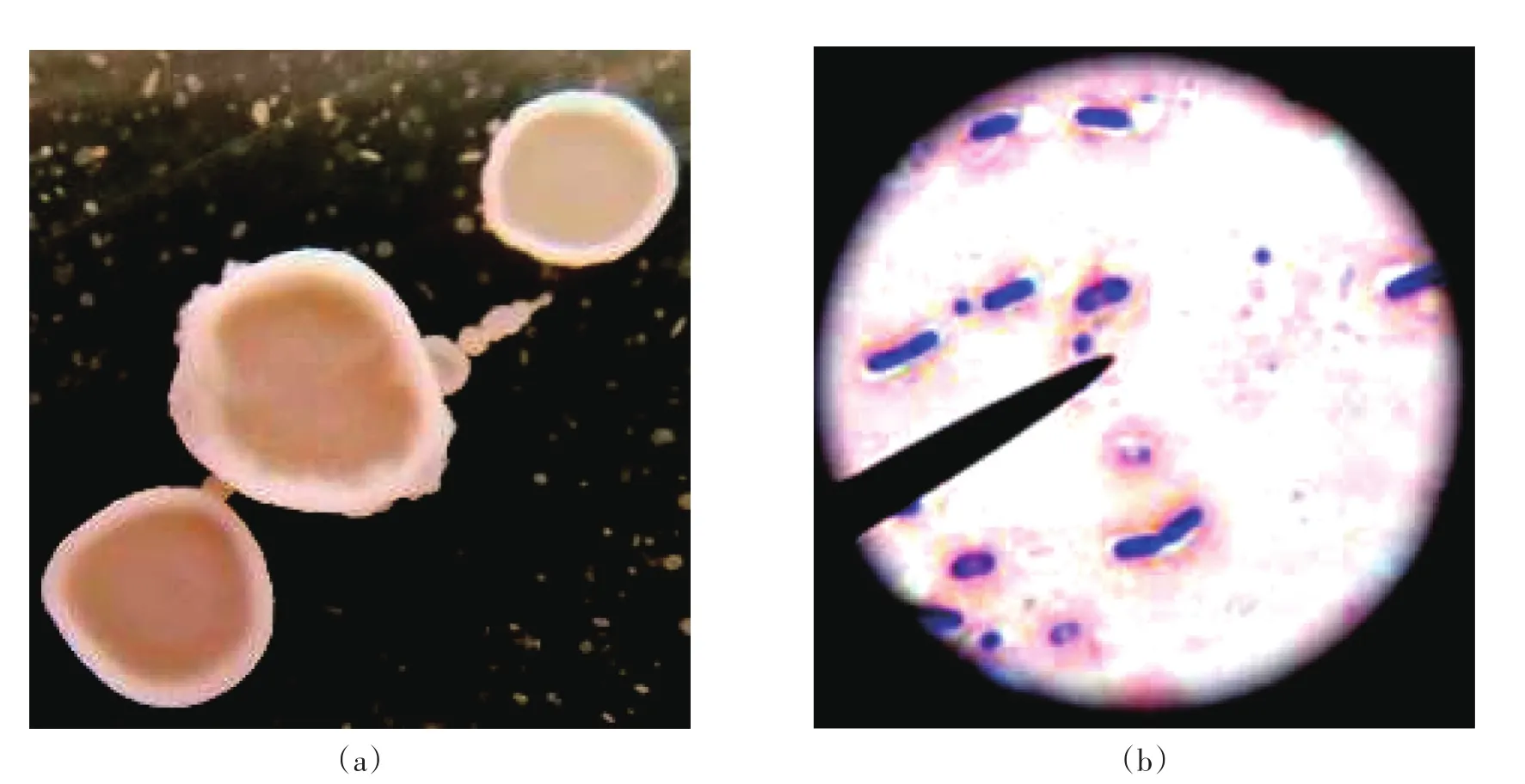
图2 SD48菌株菌落形态和革兰氏染色结果
SD48菌株菌体形态如图2(b)所示,菌体呈杆状,为革兰氏阳性菌,芽孢中生。
2.3.2 SD48菌株生理生化特性的测定结果(见表3)
由表3可知,SD48菌株具有运动性,产接触酶,能利用柠檬酸盐,可水解淀粉、酪朊、牛奶,可利用D-葡萄糖、D-甘露醇产酸,可还原硝酸盐,生长不需要Na⁃Cl和KCl,但能在2%~10%的NaCl中生长,在10~50 ℃范围内可生长。故SD48菌株具有典型的芽孢杆菌属菌株特性,综合其菌落形态和菌体形态,可初步判断SD48菌株属于芽孢杆菌属。
2.3.3 SD48菌株16S rDNA序列系统发育分析
将SD48菌株和与其高同源性的标准菌株构建系统进化树(见图3),并进行相似性比较(见表4)。由结果可知,SD48菌株与甲基营养型芽孢杆菌(Bacil⁃lus methylotrophicus)同源性最高,且相似性为100.00%。故确定SD48菌株属于B.methylotrophicus。2.4B.methylotrophicusSD48菌株固体发酵豆粕效果评价
2.4.1 基础条件发酵效果评价
2.4.1.1 感官指标(见图4)

表3 SD48菌株生理生化试验的结果
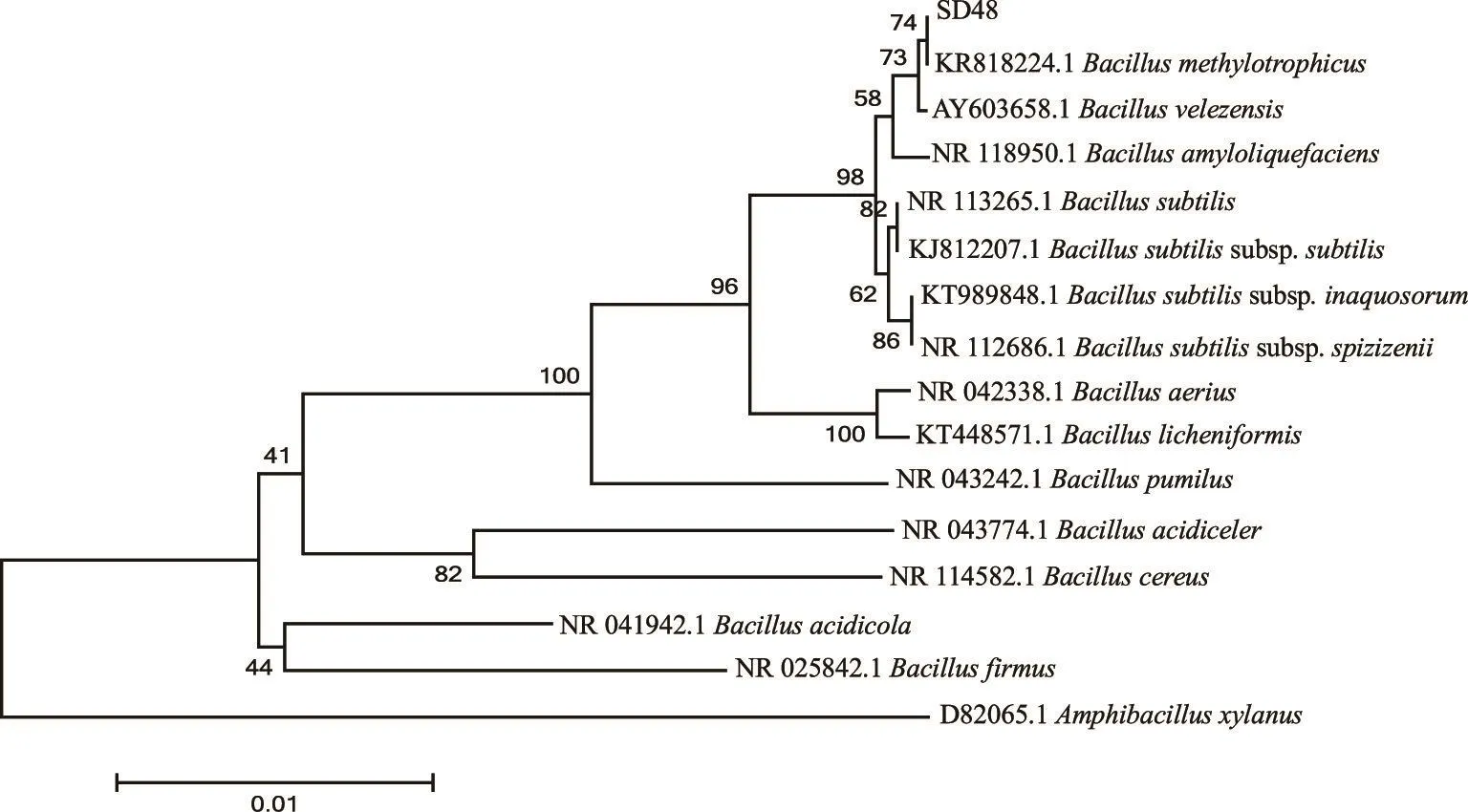
图3 耐酸生长产蛋白酶菌株SD48的系统进化树
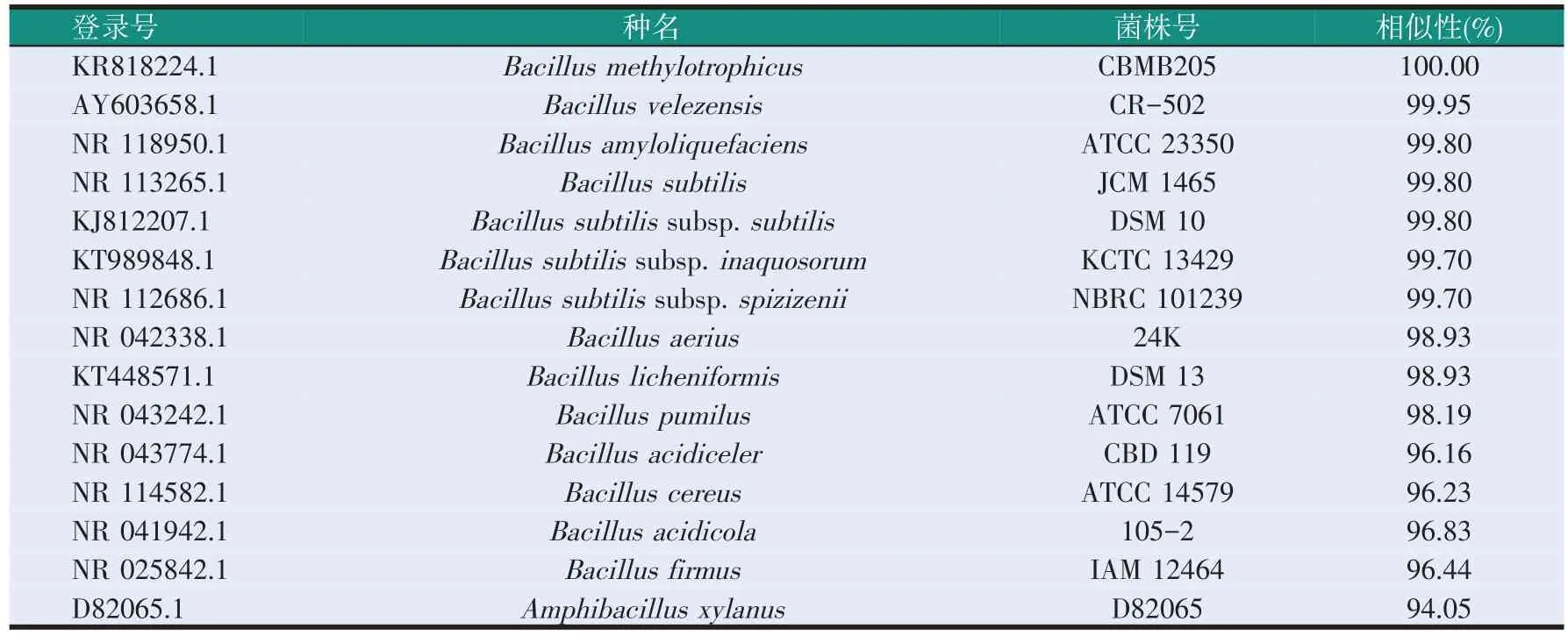
表4 SD48菌株与标准菌株的相似性比较
发酵30 d后,对照组发酵豆粕色泽呈浅黄色,酸味较淡,有结块现象,染有霉菌;试验组的发酵豆粕色泽金黄,具有浓郁酸香味,无结块现象。
2.4.1.2 豆粕发酵效果

图4 基础条件下SD48菌发酵豆粕30 d时的表观情况
B.methylotrophicusSD48菌株在基础条件下发酵豆粕的效果见表5。由表5可知,与对照组相比,发酵30 d时试验组的pH值更低,含水量、粗蛋白质含量无显著差异(P>0.05),酸溶蛋白含量、酸溶蛋白相对含量、抗氧化活性更高。就试验组而言,发酵30 d后pH值显著下降(P<0.05),含水量、粗蛋白质含量无明显变化(P>0.05),酸溶蛋白含量显著增加(P<0.05),酸溶蛋白相对含量显著增加(P<0.05),抗氧化活性显著增加(P<0.05)。故SD48菌株可使发酵豆粕pH值降低,提高其酸溶蛋白含量和抗氧化活性。
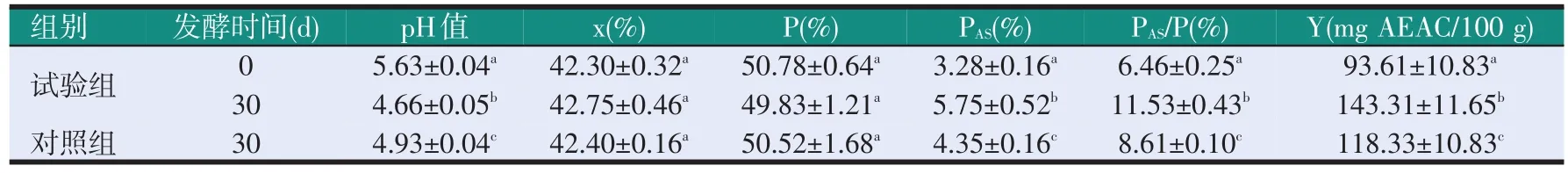
表5 B.methylotrophicusSD48菌株发酵豆粕的效果
2.4.1.3 发酵豆粕的蛋白质相对分子质量分布分析
发酵豆粕的蛋白质相对分子质量分布结果如图5所示。由结果可知,试验组发酵0 d时,β-伴大豆球蛋白(7S)的主要亚基(72 kDa的α亚基、83 kDa的αʹ亚基和50 kDa的β亚基)以及大豆球蛋白(11S)的主要亚基(34 kDa的酸性多肽链和20 kDa的碱性多肽链)均清晰可见。发酵30 d时,对照组对应的95 kDa以上组分含量略有降低,但不明显;对照组对应的β-伴大豆球蛋白含量和大豆球蛋白含量均显著下降,但并未消失,这说明豆粕中存在的微生物也能降解β-伴大豆球蛋白和大豆球蛋白。发酵30 d时,试验组仅在50~80 kDa间可看到5个清晰的蛋白条带;95 kDa以上组分消失,β-伴大豆球蛋白和大豆球蛋白对应条带也基本消失。故SD48菌株可有效去除豆粕中的β-伴大豆球蛋白和大豆球蛋白。
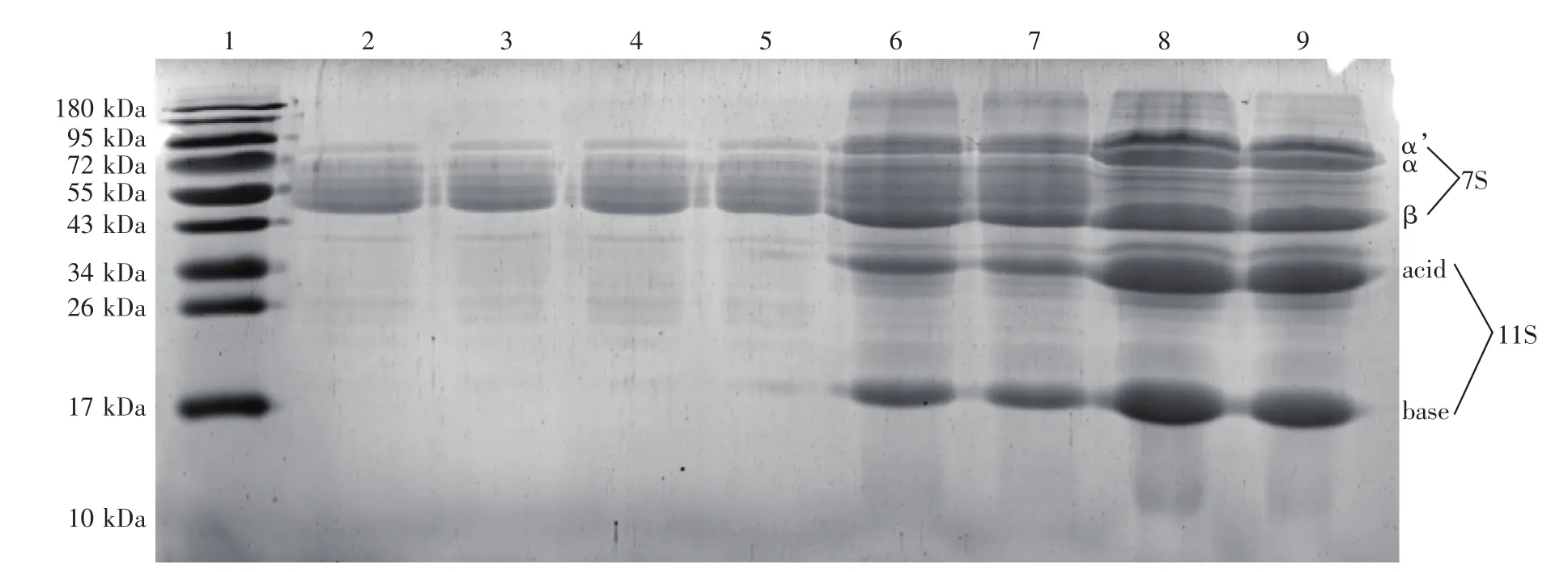
图5 基础条件下发酵豆粕的蛋白质相对分子质量分布
2.4.2B.methylotrophicusSD48菌株固体发酵豆粕条件的正交优化
2.4.2.1 豆粕发酵15 d时的正交优化试验结果
豆粕发酵15 d时的正交优化试验结果和极差分析如表6、表7所示。分析极差R可知,对酸溶蛋白相对含量影响最大的因素是硫酸铵含量,其次是料水比,再次是玉米粉含量,影响最小的因素是菌株接种量。通过均值分析可知,最佳组合为A3B1C3D3,该组合未在正交试验中出现。故将其与正交试验中表现最佳的组合A3B1C3D2进行比较,结果见表8。由表8可知,与A3B1C3D3相比,A3B1C3D2对应的酸溶蛋白相对含量更高,即组合A3B1C3D2对应的发酵效果更好,此条件下发酵豆粕的粗蛋白质含量为49.42%,酸溶蛋白含量为10.53%,酸溶蛋白相对含量为21.30%,抗氧化活性为135.42 mg AEAC/100 g。

表6 SD48菌株固体发酵豆粕15 d时的正交试验结果
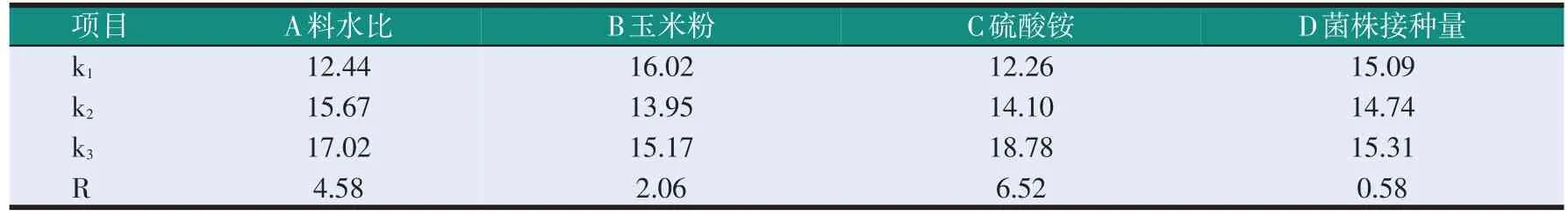
表7 豆粕发酵15 d时正交试验结果的极差分析

表8 豆粕发酵15 d时正交优化结果的验证
2.4.2.2 豆粕发酵30 d时的正交优化试验结果
豆粕发酵30 d时的正交优化试验结果和极差分析如表9、表10所示。分析极差R可知,影响酸溶蛋白相对含量因素的主次排序与发酵15 d时相同,硫酸铵含量>料水比>玉米粉含量>菌株接种量。通过均值分析可知,最佳组合为A3B1C3D1,将其与正交试验中表现最佳的组合A3B1C3D2进行比较,结果见表11。由表11可知,与A3B1C3D1相比,A3B1C3D2对应的酸溶蛋白相对含量更高,即组合A3B1C3D2为对应的发酵效果更好,此条件下发酵豆粕的粗蛋白质含量为51.33%,酸溶蛋白为13.47%,酸溶蛋白相对含量为26.24%,抗氧化活性为409.63 mg AEAC/100 g。
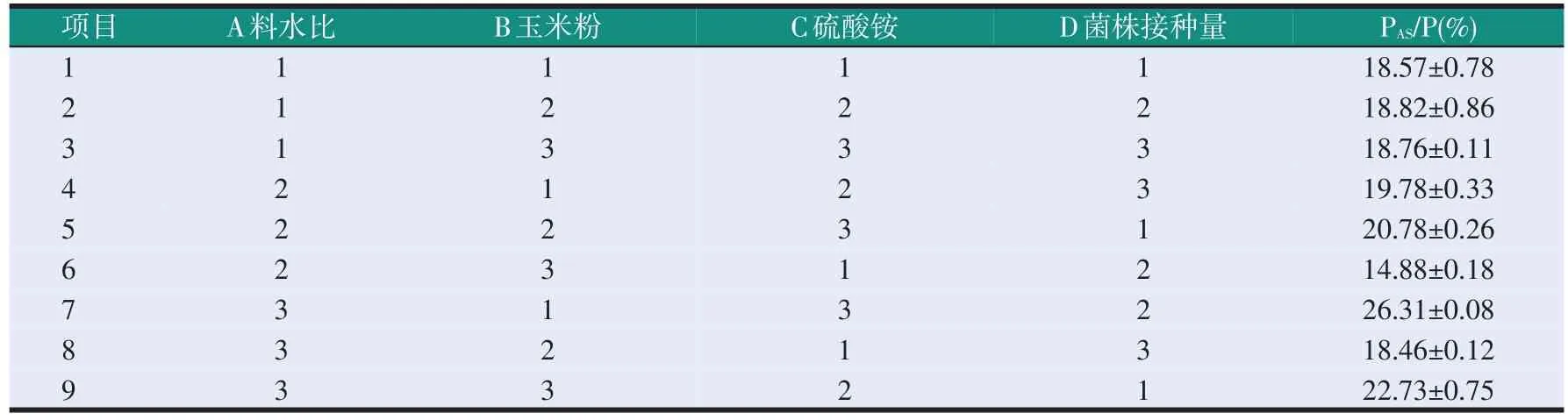
表9 SD48菌株固体发酵豆粕30 d时的正交试验结果

表10 豆粕发酵30 d时正交试验结果的极差分析

表11 豆粕发酵30 d时正交优化结果的验证
综上,B.methylotrophicus SD48菌株固体发酵豆粕的最优条件为料水比1∶1,玉米粉含量10.0%,硫酸铵含量6.0%,接种量8.0%,发酵时间30 d。与基础发酵条件下发酵30 d的结果相比,在最优条件下酸溶蛋白相对含量提高了127.6%,抗氧化活性提高了185.8%。
3 讨论
限于技术条件和成本约束,大规模的豆粕发酵一般采用生料发酵。生料发酵过程中当氧气耗尽时,随着兼性厌氧菌的大量繁殖,伴随着pH值的急剧降低(林文辉等,2010),故发酵菌种若能在酸性条件下存活,则有利于发酵过程的进行。本研究采用酸性条件初筛芽孢杆菌,既保证了菌株对酸性条件的适应性,又保证了菌株可在厌氧条件下生长繁殖。而筛选出的SD48菌株在酸性条件下可产生75.40 U/ml的蛋白酶活力,这为豆粕中蛋白质的降解奠定了基础。
B.methylotrophicus最早发现于田间水稻的根际土壤(Munusamy等,2010);该种细菌可在胞外产生纤维素酶(吴晶晶等,2014;董丹等,2015)、脂肪酶(徐伟芳等,2017)、蛋白酶(熊涛等,2014)等消化酶。国内已有研究人员筛选出该种属菌株并将其应用于发酵豆粕。熊涛等以透明圈法从豆豉中筛选出1株可在厌氧条件下产生蛋白酶的B.methylotrophicus菌株B-1,采用熟料发酵的方式,可使豆粕中小肽含量达到28.37%。唐晓星(2014)筛选到1株兼性厌氧、产蛋白酶的B.methylotrophicus菌株NCU507,发现与单菌发酵相比,混菌发酵时可提高粗蛋白含量,但是会导致小肽含量的降低。
按生产模式,发酵豆粕可分为浅层发酵和深层发酵。浅层发酵所需发酵面积大,只能采用浅盘架式生产,机械化难度高,深层发酵可克服这些缺点,更具研究价值。深层发酵过程多采用混合菌种,工艺一般较为复杂。朱平军采用分阶段发酵模式研究了黑曲霉、枯草芽孢杆菌、酵母菌和植物乳杆菌多菌种固态生料仿生发酵对豆粕营养价值的影响,前48 h用黑曲霉、枯草芽孢杆菌和酵母菌30℃好氧发酵,后48 h用植物乳杆菌和瘤胃微生物37℃厌氧仿生发酵,好氧发酵阶段料水比为1∶0.9,厌氧仿生发酵阶段料水比为1∶1.2,发酵后酸溶蛋白含量可达20.06%,粗蛋白质含量可达52.03%。王国强等(2016)采用正交试验设计,优化了复合益生菌发酵豆粕的条件,当异常汉逊酵母菌∶枯草芽孢杆菌∶干酪乳杆菌为2∶2∶1,接种量5%,发酵时间为48 h时,抗原蛋白降解彻底,酸溶蛋白含量提高了73.9%,有益活菌总数达到8.5×108cfu/g。也有单菌株发酵豆粕粉生料的研究。何勇锦等(2009)采用黏红酵母发酵豆粕粉生料,当发酵温度为30℃,发酵坯含水量为50%,厚度为1 cm,添加糖蜜量为5%,发酵时间为40~44 h时,发酵豆粕中的小肽含量约为27%。何勇锦等(2012)采用乳酸短杆菌KLDS-1菌株发酵豆粕生料,当发酵坯含水量为50%、糖蜜3%、接种量35%,于37℃下厌氧发酵48 h时,发酵豆粕中的小肽含量达26.12%。本研究采用B.methylotrophicusSD48菌株深层发酵豆粕生料,在最优条件下,酸溶蛋白相对含量可达26.24%。
发酵温度除影响豆粕发酵效果外,还会影响到发酵的成本。本研究筛选的B.methylotrophicusSD48菌株具有可在10℃下生长繁殖的特性,发酵启动温度仅为室温18℃,发酵过程未采取保温措施,可极大的降低生产成本,但发酵15 d时酸溶蛋白相对含量可达到21.30%,发酵30 d时酸溶蛋白相对含量可达到26.24%,说明可通过提高发酵温度及保温措施来挖掘该菌株的应用潜力。
豆粕中含有的多种抗营养因子会阻碍营养成分的消化、吸收和利用(高美云,2010)。杨玉娟等(2016)抽取了市售的65批次豆粕和54批次发酵豆粕,采用ELISA法对抗营养因子含量进行分析,发现大豆球蛋白含量最高,其次是β-伴大豆球蛋白。研究发现,微生物发酵豆粕可有效去除豆粕中的抗营养因子(马静,2016)。魏凤仙等(2016)比较了膨化法和微生物发酵法处理豆粕对抗营养因子去除效果的影响,发现微生物发酵法更适宜于豆粕抗营养因子的去除。本研究中SD48菌株可有效去除豆粕中的大豆球蛋白和β-伴大豆球蛋白。
大豆抗氧化肽具有抗疲劳,延缓机体衰老,调节机体免疫等多种功能(徐聪聪,2013)。本研究中采用FRAP法测定豆粕的抗氧化活性。FRAP法操作简便,测定不需要昂贵仪器,该法反映的是样品总的抗氧化活性(陈玉霞,2011)。本研究采用SD48菌株发酵豆粕,在最优条件下,抗氧化活性为409.63 mg AEAC/100 g,即100 g发酵豆粕的抗氧化能力相当于409.63 mg的维生素C。
4 结论
筛选出能在酸性条件下生长并在胞外产酸性蛋白酶的B.methylotrophicus菌株SD48,该菌株可极大地提高发酵豆粕的营养价值,是一株性能优良的发酵豆粕用菌株。

