CaXMT和TCS1突变体基因串联共表达及体外酶活检测分析
武 鑫, 李萌萌, 邓 骋, 邓威威, 张正竹
( 安徽农业大学 茶树生物学与资源利用国家重点实验室, 合肥 230036 )
CaXMT和TCS1突变体基因串联共表达及体外酶活检测分析
武 鑫, 李萌萌, 邓 骋, 邓威威, 张正竹*
( 安徽农业大学 茶树生物学与资源利用国家重点实验室, 合肥 230036 )
咖啡碱和可可碱是茶叶生物碱的主要组分,且咖啡碱是茶叶重要的滋味物质,随着咖啡碱在食品和药物领域的应用愈发广泛,咖啡碱的生物合成成为新的研究热点。目前市场上的咖啡碱主要靠化学合成,为了探索其生物合成途径,该研究将咖啡黄嘌呤核苷甲基转移酶(coffee xanthosine methyltransferase,CaXMT)基因和茶树咖啡碱合成酶(tea caffeine synthase,TCS1)基因的4个突变体分别串联至同一大肠杆菌表达载体pMAL-c5X,诱导融合蛋白共表达,并进行SDS-PAGE凝胶电泳分析。结果表明:目的蛋白成功表达后,应用超声破碎法制备含有目的蛋白的粗酶液,添加底物黄嘌呤核苷(xanthosine,XR)和甲基供体S-腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM)进行体外酶促反应,将反应产物进行高效液相色谱检测。检测结果显示,pMAL-CaXMT-TM2/3/4的体外酶促反应产物仅有可可碱生成,均未见咖啡碱生成。该研究结果为构建生物合成咖啡碱和可可碱的串联共表达载体奠定了基础,也为进一步研究生物合成咖啡碱和可可碱提供了新思路。
咖啡碱, 串联共表达, 体外活性
咖啡碱(1,3,7-三甲基黄嘌呤)和可可碱(3,7-二甲基黄嘌呤)一同被归类为嘌呤生物碱,存在于茶、咖啡以及大部分软饮料中(Ashihara et al,2008)。咖啡碱不但能刺激神经系统和呼吸系统,增强无氧运动时的耐力,而且具有利尿、抗癌的作用(吴命燕等,2010;Panayiotis et al,2013)。咖啡碱的制备方法主要分为人工合成、生物合成、天然提取,其中人工合成是咖啡碱的主要来源,但人工合成具有安全性小、污染环境等问题(李海霞等,2011)。随着咖啡碱广泛应用于食品和医药行业,其生物合成由于低污染、低残留等优点而受到关注。因此探索其生物合成方法具有重要的现实意义。
茶树中的咖啡碱主要分布在新梢部位,其中嫩芽叶中含量最多,而咖啡碱合成的前体物质可可碱仅存在于幼嫩叶片中(宛晓春等,2015;Ashihara & Crozier,1999)。咖啡碱的主要生物合成途径是黄嘌呤核苷(XR)→7-甲基黄嘌呤核苷(7-MXR)→7-甲基黄嘌呤(7-MX)→可可碱(Tb)→咖啡碱(Cf),该反应途径由四步组成,包括三步甲基化反应和一步脱核苷反应(Koshiishia et al,2001;Kato et al,1996)。生物合成途径中催化前两步的酶是咖啡黄嘌呤核苷甲基转移酶,催化后两步反应的酶是茶树咖啡碱合成酶(Ashihara et al,1996;Waldhauser et al,1997;Kato et al,1999)。基于TCS1突变体单独表达基础上,将4个突变体TMX分别与CaXMT基因串联在表达载体pMAL-c5X上,通过SDS-PAGE检测验证了串联基因蛋白的共表达。诱导融合蛋白成功表达后,进一步通过体外酶促反应来验证串联表达载体的活性,并采用HPLC进行检测酶促反应产物,试图通过添加底物黄嘌呤核苷来直接生成咖啡碱。但是结果未见有咖啡碱生成,仅pMAL-CaXMT-TM2/3/4的HPLC检测结果显示有可可碱生成。本研究尝试以黄嘌呤核苷为反应底物,通过串联共表达系统中CaXMT和TMX的共同作用,进行酶促反应生物合成咖啡碱和可可碱,将对探索生物合成咖啡碱和可可碱起到一定作用。
1 材料与方法
1.1 菌株与质粒
菌株E.coliBL21(DE3)pLysS和E.colitransT1购自北京全式金公司;菌株pMAL-CaXMT-TCS1和pMAL-TMX由安徽农业大学茶树生物学与资源利用国家重点实验室提供;质粒pMD19-T 购自TaKaRa公司。
1.2 试剂与仪器
1.2.1主要试剂 rTaq酶、PrimeSTAR©HS DNA Polymerase、T4 DNA Ligase Polymerase购自TaKaRa公司,限制性内切酶SalI、SbfI、NotI购自Fermentas公司,DNA Marker、Protein MarkerⅡ购自北京全式金公司,质粒提取试剂盒、琼脂糖凝胶回收试剂盒购自Axygen公司,氨苄青霉素、氯霉素、IPTG购自上海生工生物工程有限公司。液相色谱所用试剂均为色谱级,其他试剂均为国产分析纯。
1.2.2 主要仪器 高效液相色谱仪、粒径5 μm的ODS 250 mm × 4.6 mm C18反相柱,美国Waters公司;电子分析天平,METILER TOLEDO公司;PCR 仪、凝胶成像系统、Power PAC 3000电泳仪,美国Bio-Rad公司;超声波细胞破碎仪,宁波新芝仪器研究所;高速冷冻离心机,Eppendorf公司;电热恒温培养箱,上海精宏实验设备有限公司。高压灭菌锅,上海申安医疗器械厂。
1.3 方法
1.3.1TCS1突变体TMX基因的克隆与测序 突变体TMX突变位置与TCS1相比,分别为TM1 673CGT→CAT;TM2 949GTT→ATG,TM3 811TTT→TGG;TM4 814GCA→CCA(Jin et al,2014)。据GenBank报道的TCS1基因ORF序列,设计一对扩增引物,在上游引物5′端引入SalI酶切位点,下游引物5′端引入SbfI酶切位点。上游引物TM-F为5′-ATAGTCGACATGGACCTAGCTACTGCGG-3′,下游引物TM-R为5′-CTCCCTGCAGGCTATCCATCAATCTTG-G-3′,分别以提取的TMX质粒为模板,按照PrimeSTAR©HS DNA Polymerase说明书进行PCR扩增。PCR产物用1.2%琼脂糖凝胶检测,用Axygen公司胶回收试剂盒纯化目的基因片段。将目的基因连接到克隆载体pMD19-T上,转化入感受态细胞transT1中经菌落PCR检测,挑取阳性菌落送Invitrogen公司测序。
1.3.2 pMAL-CaXMT-TMX表达载体的构建 测序正确的单菌落和pMAL-CaXMT-TCS1进行培养,提取质粒PMD19-TM1/2/3/4和pMAL-CaXMT-TCS1,用限制性内切酶SalI和SbfI进行双酶切,回收目的基因片段TMX和表达载体片段pMAL-CaXMT。使用T4 DNA Ligase Polymerase 对两个回收片段进行过夜连接,并转入E.colitransT1感受态细胞, 构建重组表达质粒,通过含氨苄青霉素的LB平板进行筛选,挑取阳性菌落送Invitrogen公司测序。使用DNASTAR软件对结果进行序列对比分析。
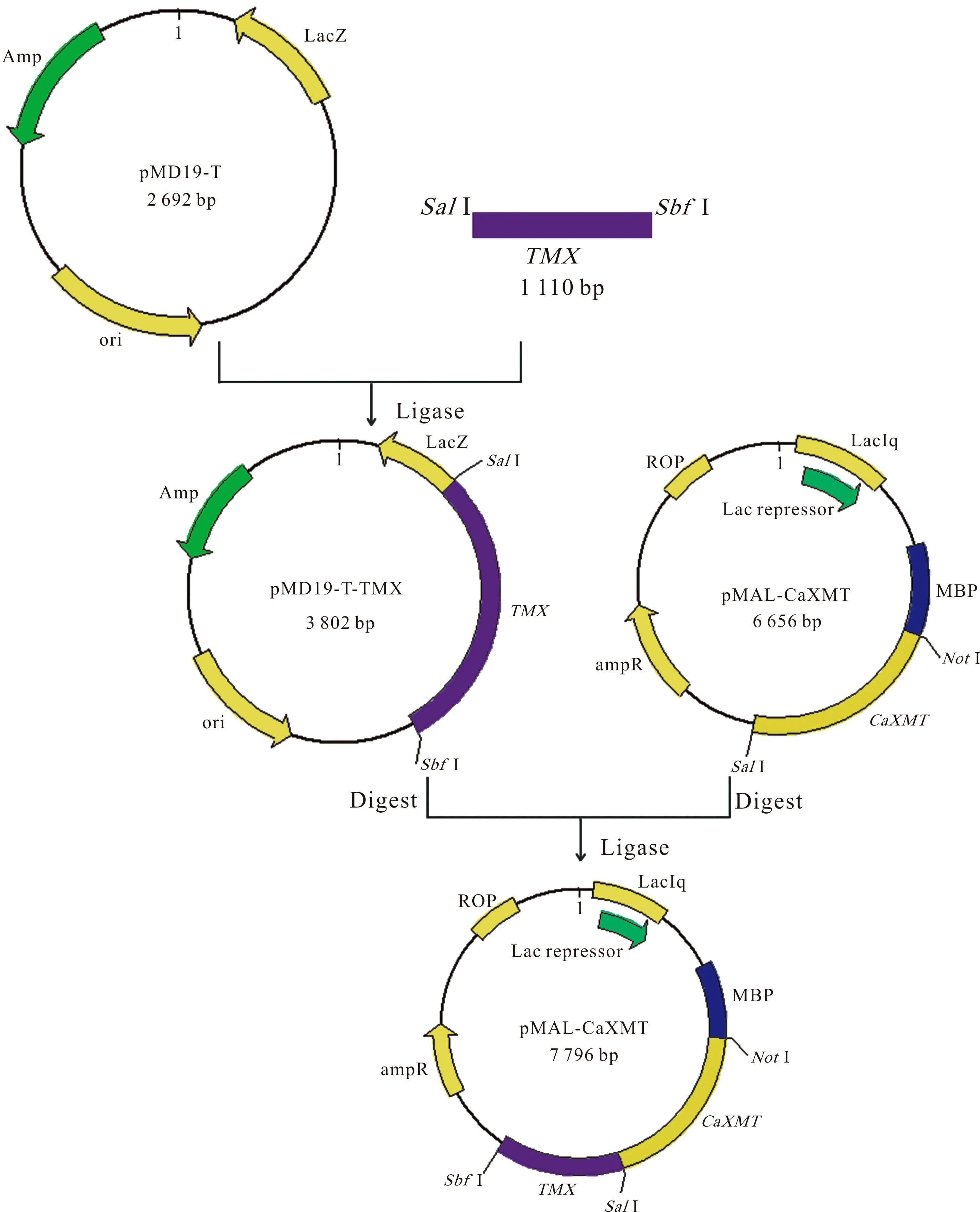
图 1 pMAL-CaXMT-TMX串联表达载体构建流程图Fig. 1 Construction of tandem gene coexpression vector

图 2 pMAL-CaXMT-TM1/2/3/4诱导蛋白SDS-PAGE电泳图 A. pMAL-CaXMT-TM1/2诱导蛋白SDS-PAGE电泳图 [1. 蛋白标准分子量(120 kD); 2, 4, 8. pMAL-c5X、pMAL-CaXMT-TM1、pMAL-CaXMT-TM2诱前总蛋白; 3, 5, 9. MBP、pMAL-CaXMT-TM1、pMAL-CaXMT-TM2诱后总蛋白; 6, 10. pMAL-CaXMT-TM1、pMAL-CaXMT-TM2诱后可溶性蛋白; 7, 11. pMAL-CaXMT-TM1、pMAL-CaXMT-TM2诱后包涵体蛋白]。B. pMAL-CaXMT-TM3/4诱导蛋白SDS-PAGE电泳图 [1. 蛋白标准分子量(120 kD); 2, 6. pMAL-CaXMT-TM3、pMAL-CaXMT-TM4诱导前总蛋白; 3, 7. pMAL-CaXMT-TM3、pMAL-CaXMT-TM4诱导后总蛋白; 4, 8. pMAL-CaXMT-TM3、pMAL-CaXMT-TM4诱后可溶性蛋白; 5,9. pMAL-CaXMT-TM3、 pMAL-CaXMT-TM4诱后包涵体蛋白]。 Fig. 2 SDS-PAGE analysis of the induced pMAL-CaXMT-TM1/2/3/4 expression A. SDS-PAGE analysis of the induced pMAL-CaXMT-TM1/2 [1. Protein Marker Ⅱ 120 kD; 2, 4, 8. Total protein of pMAL-c5X, pMAL-CaXMT-TM1,pMAL-CaXMT-TM2 uninduced; 3, 5, 9. Total protein of MBP, pMAL-CaXMT-TM1, pMAL-CaXMT-TM2 induced; 6, 10. pMAL-CaXMT-TM1, pMAL-CaXMT-TM2 supernatant of lysate after sonication; 7, 11. pMAL-CaXMT-TM1, pMAL-CaXMT-TM2 precipitation of lysate after sonication]. B. SDS-PAGE analysis of the induced pMAL-CaXMT-TM3/4 expression [1. Protein Marker Ⅱ (120 kD); 2,6. Total protein of pMAL-CaXMT-TM3, pMAL-CaXMT-TM4 uninduced; 3, 7. Total protein of pMAL-CaXMT-TM3, pMAL-CaXMT-TM4 induced; 4, 8. pMAL-CaXMT-TM3, pMAL-CaXMT-TM4 supernatant of lysate after sonication; 5, 9. pMAL-CaXMT-TM3, pMAL-CaXMT-TM4 precipitation of lysate after sonication].
1.3.3 串联融合蛋白的诱导表达 表达过程参考金璐(2012),操作过程为提取重组表达载体质粒,转入表达菌株E.coliBL21(DE3)pLysS中,涂布到含氨苄青霉素(50 μg·mL-1)和氯霉素(50 μg·mL-1)的 LB平板上。筛选阳性菌落于3 mL LB培养基中,37 ℃振荡过夜培养。取800 μL过夜菌液接种于40 mL LB培养基,继续37 ℃振荡培养,至检测 OD值为0.6~0.8,取1 mL菌液作为诱前对照,然后加入终浓度为1 mmol·L-1的IPTG,16 ℃下振荡培养20 h。诱导结束后,取菌液在4 ℃,6 000 r·min-1条件下离心20 min,制样进行SDS-PAGE电泳检测。
1.3.4 体外酶促反应活性的检测 诱导结束经冷冻离心得菌体,加4 mL Lysis Buffer(现加DTT,终浓度为5 mmol·L-1) 重悬菌体。冰浴条件下超声破碎后,4 ℃,12 000 r·min-1离心15 min,得上清即为粗酶液。1.5 mL酶反应体系:156 μmol·L-1黄嘌呤核苷,749 μmol·L-1S-腺苷甲硫氨酸,200 μmol·L-1MgCl2,加粗酶液补至1.5 mL。反应在30 ℃下进行,分别于2、4、8 h取反应液500 μL,通过0.22 μm水相滤膜,进行HPLC检测。以pMAL-c5X空载体相同处理做对照。
高效液相色谱检测条件:流速1 ml·min-1;流动相中,A相为0.2 %乙酸,B相为纯乙腈;线性变化范围为0~4 min,A相95%,B相5%;4~10 min,A相40%,B相60%;10~13 min,A相95%,B相5%;13~30 min,A相95%,B相5%。紫外检测器吸收波长为274 nm。
2 结果与分析
2.1 TM1/2/3/4基因的克隆
以质粒为模板,用引物TM-F和TM-R对TMX基因进行PCR扩增,1.2%的琼脂糖凝胶检测。分子量在1 000 bp 偏上出现一条较为明亮的条带,为目的产物条带,其大小与TCS1基因ORF的长度1 110 bp相符。PCR产物经胶回收、连接、转化、测序,测序结果同原TMX相同。
2.2 pMAL-CaXMT-TM1/2/3/4串联表达载体的构建
提取PMD19-TM1/2/3/4质粒和pMAL-CaXMT-TCS1质粒,分别用限制性内切酶SalI和SbfI进行双酶切,并对目的基因片段TMX和表达载体片段pMAL-CaXMT进行胶回收。其中分子量在1 000 bp偏上的条带为TMX条带,分子量在2 000 bp以上的条带为表达载体片段条带。
将目的基因片段连接到表达载体,得重组质粒pMAL-CaXMT-TM1/2/3/4(图1),并转化至transT1感受态细胞,菌落PCR检测,筛选阳性菌落送公司测序。结果通过软件分析,正确即构成pMAL-CaXMT-TM1/2/3/4串联表达载体,可用于之后融合蛋白的诱导表达。
2.3 串联表达载体融合蛋白的诱导表达
重组质粒pMAL-CaXMT-TM1/2/3/4转化至BL21(DE3)pLysS,经初步培养和扩大培养,利用IPTG诱导目的蛋白和载体标签子MBP的融合表达,16 ℃时可使诱导后融合蛋白大量表达在上清中。融合蛋白的SDS-PAGE检测(图2)显示在81 kD左右位置有明显的外源蛋白条带,减去诱导后蛋白大小为40 kD的表达载体pMAL-c5X标签子MBP,可推算出实际蛋白大小为41 kD,与已知CaXMT和TMX的蛋白理论值大小41.8 kD和41.3 kD相符。由于两个串联基因蛋白大小相近,两个目的基因蛋白条带叠加在一起,表现出一条较粗的条带。

图 3 pMAL-CaXMT-TMX体外酶活性的HPLC分析A. 对照组; B. pMAL-CaXMT-TM1; C. pMAL-CaXMT-TM2;D. pMAL-CaXMT-TM3; E. pMAL-CaXMT-TM4。Fig. 3 In vitro activity analysis of pMAL-CaXMT-TMX by HPLC A. Control group; B. pMAL-CaXMT-TM1; C. pMAL-CaXMT-TM2; D. pMAL-CaXMT-TM3; E. pMAL-CaXMT-TM4.
2.4 体外酶活性的HPLC检测
CaXMT基因和TMX基因串联表达的体外酶促反应产物经HPLC检测,结果见图3。对照标品,对照组CK既无7-甲基黄嘌呤生成,也无咖啡碱生成(图3:A)。与对照组相比,样品组添加的XR均减少。样品组pMAL-CaXMT-TM1体外酶促反应产物仅有7-甲基黄嘌呤生成(图3:B),由图3:C、D、E可以看出样品组pMAL-CaXMT-TM2/3/4体外酶促反应产物均有可可碱(Tb)生成,但是产物未见咖啡碱(Cf)生成。
3 讨论
咖啡碱合成酶突变体TMX的单独表达中,体外活性检测结果显示,TM1只能催化7-甲基黄嘌呤生成可可碱,TM2/3/4均能催化7-甲基黄嘌呤生成可可碱和咖啡碱,但是咖啡碱含量较低(李萌萌等,2014)。本研究构建的pMAL-CaXMT-TMX大肠杆菌串联表达系统,成功诱导双基因融合蛋白表达后,HPLC检测活性结果显示,体外酶促反应产物均无咖啡碱生成,但pMAL-CaXMT-TM2/3/4体外酶促反应产物均有可可碱生成。这与预期的结果有一定偏差,可能存在以下原因:一是两个基因的表达不均衡引起,即两个基因串联在同一表达载体中,前一个基因被选择性过表达,后一个基因表达偏低造成的(Lee & khosla, 2007)。Lee & khosla (2007)成功实现了多个基因在大肠杆菌中的共表达,并且通过添加底物和诱导剂进行低温诱导后检测到目的产物,但是产量偏低。刘新平等(1996)构建的双顺反子表达载体,通过减小第一顺反子基因的大小来增加目的蛋白的表达量。二是两个基因串联共用一个启动子,无法实现基因表达的分别调控。何彰华等(2011)构建的多基因串联共表达载体,每个基因带有各自的启动子,利用同尾酶组合实现四个基因串联共表达,且可以通过改变各基因启动子的强弱,进而调节各基因的表达量。
共表达系统包括多质粒共转化系统和多顺反子系统(赵志虎等,2000),该研究中双基因串联共表达系统属于多顺反子系统,是将两个基因通过一个共用酶切位点先后串联到pMAL-c5X表达载体上。该系统中两个基因有各自的翻译起始及终止信号,能独立翻译,实现了双基因在大肠杆菌中融合蛋白的可溶性表达,避免了多质粒共转化系统中需要添加多种抗生素来筛选标记。
目前,有关研究已经明确了咖啡碱在植物中的生物合成途径,但是鲜有关于生物合成咖啡碱应用到实际生产的报道。本研究初步探索了通过添加底物XR和甲基供体SAM,应用大肠杆菌双基因共表达系统来生物合成咖啡碱和可可碱,但是并未达到预期结果,反应产物只检测到可可碱。因此,要达到生物合成咖啡碱的目的,还需要做很多后续研究。接下来可以从改造现有的表达载体,实现多基因共表达,并且促进各基因均衡表达等进行深入研究。
ASHIHARA H, SANO H, CROZIER A, 2008. Caffeine and related purine alkaloids:biosynthesis, catabolism, function and genetic engineering [J]. Phytochemistry, 69:841-856.
ASHIHARA H, CROZIER A, 1999. Biosynthesis and metabolism of caffeine and related purine alkaloids in plants [J]. Adv Bot Res, 30: 117-205.
ASHIHARA H, MONTERIO AM, GILLIES FM, et al, 1996. Biosynthesis of caffeine in leaves of coffee [J]. Plant Physiol, 111: 747-753.
HE ZH, WANG Y, ZHAO J, et al, 2011. Construction of a vector suitable for the tandem coexpression of multiple genes by a single plasmid [J]. Chin Biotechnol, 31(1): 40-45. [何彰华, 王洋, 赵珺, 等, 2011. 一种多基因串联共表达载体的构建 [J]. 中国生物工程杂志, 31(1): 40-45.]
JIN L, 2012. Research on caffeine biosynthesis and molecular regulation of tea [D]. Hefei: Anhui Agricultural University: 20-22. [金璐, 2012. 茶树咖啡碱生物合成途径研究及其分子调控 [D]. 合肥: 安徽农业大学硕士毕业论文: 20-22.]
KOSHIISHIA C, KATOA A, YAMAB S, et al, 2001. A new caffeine biosynthetic pathway in tea leaves: utilisation of adenosine released from the S-adenosyl-L-methionine cycle [J]. FEBS Lett, 499: 50-54.
KATO M, KANEHARA T, SHIMIZU H, et al, 1996. Caffeine biosynthesis in young leaves ofCamelliasinensis:invitrostudies on N-methyltransferase activity involved in the conversion of xanthosine to caffeine [J]. Physiol Plant, 98: 629-636.
KATO M, MIZUNO K, FUJIMURA T, et al, 1999. Purification and characterization of caffeine synthase from tea leaves [J]. Plant Physiol, 120(2): 579-586.
LU JIN, BHUIYA MW, MENGMENG LI, et al, 2014. Metabolic engineering of saccharomyces cerevisiae for caffeine and theobromine production [J]. PLoS ONE, 9(8): 1-11.
LI MM, DENG WW, JIN L, et al, 2014. Site-directed mutagenesis for caffeine synthase gene(tcs1) ofCamelliasinensisand expressioninvitro[C]//SI ZM. The 16th annual meeting of China association for science and technology——proceedings of the 12th forum of young tea science scientists. Kunming: China Association for Science and Technology. [李萌萌, 邓威威, 金璐, 等, 2014. 茶树咖啡碱合成酶基因TCS1的定点突变及体外表达分析) [C]//司智敏. 第十六届中国科协年会——分12茶学青年科学家论坛论文集. 昆明: 中国科学技术协会.]
LEE H Y, KHOSLA C, 2007. Bioassay-guided evolution of glycosylated macrolide antibiotic in escherichia coli [J]. PLoS Biol, 5(2): 243-250.
LIU XP, CHEN SM, CHEN NC, et al, 1996. Construction and application of a dicistronic expression vector [J]. Prog Biochem Biophys, 23(2): 156-159. [刘新平, 陈苏民, 陈南春, 等, 1996. 一种双顺反子表达载体的构建及应用的研究 [J]. 生物化学与生物物理进展), 23(2): 156-159.]
LI HX, CHEN R, ZHOU D, et al, 2011. Research progress on synthesis and pharmacological effects of caffeine [J]. W Chin J Pharm Sci, 43(3):243-253. [李海霞, 陈榕, 周丹, 等, 2011. 咖啡因的合成及其药理作用的研究进展 [J]. 华西药学杂志, 26(2): 182-187.]
PLATRITIS P, ANDREOU E, PAPANDREOU D, 2013. Caffeine effect on exercise performance and disease issues: an updated mini review [J]. Nutri Food Sci, 43(3):243-253.
WALDHAUSER SSW, GILLIES FM, CROZIER A, et al, 1997. Separation of the N-7 methyltransferase, the key enzyme in caffeine biosynthesis [J]. Phytochemistry, 45(7): 1407-1414.
WAN XC, XIA T, ZHANG ZZ, et al, 2015. Secondary metabolism of tea plant [M]. Beijing: Science Press: 65-67. [宛晓春, 夏涛, 张正竹, 等, 2015. 茶树次生代谢 [M]. 北京:科学出版社: 65-67.]WU MY, FAN FY, LIANG YR, et al, 2010. The physiological functions of caffeine and their related mechanisms [J]. Tea Sci, 30(4): 235-242. [吴命燕, 范方媛, 梁月荣, 等, 2010. 咖啡碱的生理功能及其作用机制 [J]. 茶叶科学, 30(4): 235-242.]
ZHAO ZH, ZHANG YS, LIU CX, et al, 2000. New strategy for soluble expression of heterologous proteins inEscherichiacoli[J]. Lett Biotechnol, 11(3): 164. [赵志虎, 张用书, 刘传暄, 等, 2000. 外源蛋白在大肠杆菌中可溶性表达的新策略 [J]. 生物技术通讯, 11(3): 164.]
Tandem coexpression of CaXMT and mutants ofTCS1 and analysis of enzyme activityinvitro
WU Xin, LI Meng-Meng, DENG Cheng, DENG Wei-Wei, ZHANG Zheng-Zhu*
( State Key Laboratory of Tea Plant Biology and Utilization, Anhui Agricultural University, Hefei 230036, China )
Caffeine and theobromine as the major component of alkaloids in tea, while caffeine is the important taste compound. As the application of caffeine increased extensively in the fields of food and medicine, caffeine biosynthesis becomes a new hotspot. Nowadays, exploring the method of caffeine biosynthesis is of great significance, when caffeine synthesis mainly relies on chemical synthesis on the market. This research concatenated coffee xanthosine methyltransferase gene (CaXMT) and four mutants of tea caffeine synthase gene (TCS1) respectively in the same expression vector pMAL-c5X, then induced coexpression of the fusion protein, which was analyzed by SDS-PAGE gel electrophoresis, and chromatography were added into the crude enzyme solution by sonication methionine. At last,invitroenzymatic reaction products were detected by high performance liquid. The results showed that only theobromine generated in the products of pMAL-CaXMT-TM2/3/4 without caffeine. This research provides the information for establishing tandem gene coexpression vector which was used for the biosynthesis of caffeine and theobromine and new ideas to study on caffeine biosynthesis.
caffeine, tandem gene coexpression,invitroactivity
10.11931/guihaia.gxzw201510003
2015-10-07
2015-12-08
国家自然科学基金 (31170649, 31570692) [Supported by the National Natural Science Foundation of China(31170649, 31570692)]。
武鑫(1989-),女,陕西潼关人,硕士研究生,主要从事茶叶生物化学与天然产物研发方面的研究,(E-mail)348778774@qq.com。
*通讯作者: 张正竹,教授,博士生导师,主要从事茶叶化学与加工、食品风味化学领域的研究,(E-mail)zzz@ahau.edu.cn。
Q571.1
A
1000-3142(2016)12-1505-06
武鑫, 李萌萌, 邓骋, 等.CaXMT和TCS1突变体基因串联共表达及体外酶活检测分析 [J]. 广西植物, 2016, 36(12):1505-1510
WU X, LI MM, DENG C, et al. Tandem coexpression ofCaXMTand mutants ofTCS1 and analysis of enzyme activityinvitro[J]. Guihaia, 2016, 36(12):1505-1510

