冬凌草1-脱氧-D-木酮糖-5-磷酸合成酶基因克隆与表达分析
朱畇昊, 苏秀红, 董诚明*, 陈随清, 邵远洋, 张风波
( 1. 河南中医药大学 药学院, 郑州 450006; 2. 河南中医药大学 呼吸疾病诊疗与新药研发河南省协同创新中心, 郑州 450046 )
冬凌草1-脱氧-D-木酮糖-5-磷酸合成酶基因克隆与表达分析
朱畇昊1,2, 苏秀红1,2, 董诚明1,2*, 陈随清1,2, 邵远洋1, 张风波1
( 1. 河南中医药大学 药学院, 郑州 450006; 2. 河南中医药大学 呼吸疾病诊疗与新药研发河南省协同创新中心, 郑州 450046 )
1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose 5-phosphate synthase, DXS)是植物萜类代谢通路中2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径的第一个关键酶,在植物萜类物质的生物合成中发挥重要的作用。为了研究该基因在冬凌草二萜类成分合成中的作用,该研究在冬凌草转录组测序结果的基础上设计一对特异性引物,采用RT-PCR方法得到冬凌草IrDXS基因cDNA全长序列,并对其蛋白进行理化性质分析、信号肽预测、亚细胞定位预测、蛋白质二级结构、三级结构预测分析及跨膜域分析等生物信息学分析,同时利用实时荧光定量PCR的方法检测IrDXS基因在冬凌草不同部位中的表达情况。结果表明:从冬凌草叶片中分离得到了一条编码DXS的全长基因,通过生物信息学软件分析发现,该基因编码全长2 169 bp,编码722个氨基酸,分子量为77.7 kD。多序列比对发现该基因编码的蛋白和其他植物中已知的DXS蛋白序列具有较高的同源性,N端均包含了一段质体转运肽序列,并均具有一个保守的焦磷酸硫胺素结构域和与吡啶结合相关的DRAG结构域。序列进化树分析显示,IrDXS基因属于植物DXS2家族。DXS基因在冬凌草根中表达量最高、愈伤组织中最低。该研究首次获得了IrDXS基因的全长cDNA 序列,并揭示了其在不同组织中的表达差异,为后续的深入研究IrDXS基因在冬凌草二萜类成分合成途径中的功能奠定了基础。
冬凌草,DXS基因, 生物信息学分析, 荧光定量PCR, 二萜
冬凌草(Isodonrubescens),是唇形科香茶菜属植物碎米桠,主产于河南省太行山区,其味甘苦、性微寒,具有清热解表、消炎止痛、健胃活血及抗肿瘤等作用。冬凌草发挥抗肿瘤作用的药效物质基础主要是贝壳杉烯类二萜成分,迄今已分离得到190余种二萜类化合物(冯卫生等, 2008),其中代表性成分冬凌草甲素、乙素等含量较为丰富。冬凌草甲素可明显抑制人宫颈癌、肝癌等多种肿瘤细胞的生长(Bao et al, 2014; Li et al, 2014)。甲羟戊酸(MVA)途径和2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径共同生成植物萜类次生代谢产物的前体物质IPP和DMAPP。1-脱氧木酮糖-5-磷酸合成酶(DXS)作为MEP途径的第一个酶, 也在该途径的合成中发挥重要的调控作用,是萜类化合物合成过程的关键调控位点(陈建和赵德刚, 2004)。
DXS基因的表达与类胡萝卜素、赤霉素等萜类物质合成有密切的关系,DXS基因的过量表达可促进植物体内萜类物质合成(Estevez et al, 2001)。植物DXS基因N端具有典型的质体转运肽序列,决定了DXS定位与质体的基本性质。鱼腥草(魏麟等, 2014)、阳春砂(曾春红等, 2011)、番茄(Lois et al, 2000; Rodriguez et al, 2001)等植物中已经成功克隆了DXS基因序列,而冬凌草MEP途径中相关基因的克隆尚未见报道。本研究首次从冬凌草叶片中克隆得到DXS基因,并对其序列进行生物信息学分析,检测其在不同组织器官中的差异表达,为深入开展该基因的酶学特性及其在冬凌草二萜类成分生物合成中的分子机制研究提供理论依据。
1 材料与方法
1.1 材料与试剂
所用材料冬凌草组培苗、愈伤组织由本实验室继代保存,经董诚明教授鉴定为碎米桠(Isodonrubescens),取样时摘取冬凌草的根、茎、叶等不同组织,用液氮速冻后冻存于-80 ℃冰箱备用。
RNA提取试剂盒、凝胶回收试剂盒购自北京康为世纪生物科技有限公司,pMD19-T 载体、DH5α感受态购自TaKaRa公司。反转录试剂盒RevertAid First Strand cDNA Synthesis Kit购自Fermentas公司。QuantiNova SYBR Green PCR Master Mix购自QIAGEN公司。
1.2 总RNA 提取与单链cDNA 的合成
冬凌草不同组织RNA的提取依照试剂盒说明书进行,RNA的完整性使用1%琼脂糖凝胶电泳检测。cDNA第一链合成根据RevertAid First Strand cDNA Synthesis Kit说明书进行,反转录cDNA冻存于-20 ℃保存备用。
1.3 cDNA全长克隆
以丹参(ACQ66107)DXS基因序列作为探针,对冬凌草转录组数据进行本地BLAST分析,并选取相似性最高的冬凌草DXS基因。使用Primer Premier 5软件从开放阅读框(ORF)两端非编码区设计一对特异性引物,DXS-F :5′-GCACCGAACAACTACTTC -3′; DXS-R :5′-GTTTCAGAGGAGCATATCTTT -3′。 以冬凌草叶片的cDNA 为模板, 以DXS-F,DXS-R为引物进行PCR扩增。扩增条件:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸120 s,反应35个循环;循环结束后72 ℃延伸10 min。PCR产物切胶回收纯化,回收产物克隆至pMD19-T载体中,连接产物转化大肠杆菌DH5α感受态细胞,通过菌落PCR鉴定阳性克隆并送至上海生工进行测序。
1.4 生物信息学分析
用EditSeq软件进行序列分析与拼接,用在线ORF Finder软件查找开放阅读框。用DNAMAN软件进行同源性比较分析。用ClustalW 软件与其他植物DXS蛋白的氨基酸序列进行比较后,用MEGA 4 软件的相邻连接法(neighbor-joining)和泊松模型(poission model)构建系统进化树,bootstrap检验的重复次数为1 000次。IrDXS蛋白理化性质分析采用ProtParam在线工具进行,利用ProtScale对IrDXS蛋白进行亲疏水性分析,采用TMHMM Server. v. 2.0程序对IrDXS蛋白进行跨膜区结构预测,用SignlP 4.1 Server对IrDXS蛋白进行信号肽预测,用在线分析工具ChloroP 对IrDXS蛋白进行亚细胞定位分析,用NPSA server进行IrDXS氨基酸序列二级结构分析和预测,用SWISS-MODEL在线程序对IrDXS蛋白进行三级结构同源建模。
1.5 荧光定量 PCR表达分析
实时荧光定量PCR(Quantitative real-time PCR,qPCR)用来检测IrDXS基因在冬凌草根、茎、叶、花、愈伤等不同组织中的相对表达量。qPCR采用美国Applied Biosystems公司Step One Plus检测系统。qPCR 检测的反应体系如下:10 μL 2x QuantiNova SYBR Green PCR Master Mix(QIAGEN),正反向引物各0.4 μL,cDNA 模板2 μL;加ddH2O 至20 μL,反应程序为95 ℃、3 min,95 ℃、10 s,56 ℃、20 s,72 ℃、30 s,35 个循环;上游引物qDXS-F序列为5′-GCACCGAACAACTACTTC-3′,下游引物 qDXS-R 序列为5′-GTTTCAGAGCATATCTTC-3′。qPCR反应以冬凌草GAPDH基因为内参, IrGAPDH 引物为 qGAPDH-F:5′-AAACGCCTAACTTC GCATCT-3′ 和qGAPDH -R : 5′-CCCGACTGTCCCTGTAATCA-3′,每个反应重复3 次。扩增完成后利用PCR 仪自带的程序进行溶解曲线测定,采用2-ΔΔCt法对IrDXS进行表达量分析。
2 结果与分析
2.1 IrDXS的cDNA 全长克隆
以冬凌草叶片反转录所得到的cDNA第一链为模板,用特异性引物 DXS-F 和 DXS-R 进行 PCR 扩增。琼脂糖凝胶电泳检测发现在2 400 bp左右处有一条亮带,与目的片段大小相似(图1)。将PCR产物克隆至pMD19-T载体后双向测序,系列拼接后经比对发现,目的序列与转录组测序序列一致。经ORF Finder 预测,该序列含有一个大小为2 169 bp的完整的开放阅读框,推测其编码722个氨基酸,开放阅读框位于89~2 257 bp区域,序列的1~88 bp为5′非编码框,2 258~2 348 bp为3′非编码框。
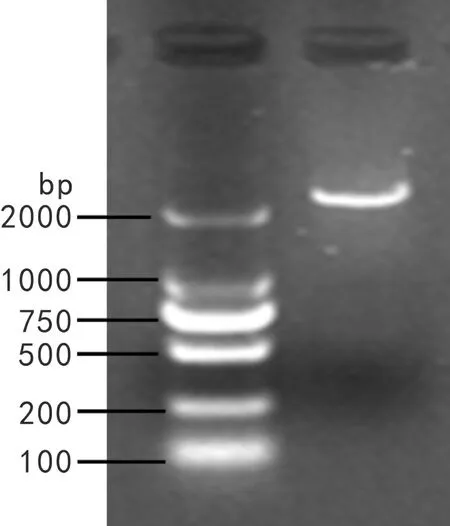
图 1 IrDXS的PCR产物Fig. 1 PCR products of IrDXS
通过BLAST 程序检索,该序列与丹参(Salviamiltiorrhiza,ACQ66107)、薄荷(Mentha×piperita,AAC335130)、金鱼草(Antirrhinummajus,AAW28999)等植物DXS 蛋白序列的同源性分别为90%、90%、87%。由此确定,该序列为冬凌草DXS基因的cDNA 全长序列,将其命名为IrDXS( 注册号KT831764)。
从GenBank中选取丹参(ACQ66107)、薄荷(AAC335130)、蓖麻(XP_002516843.1)、葡萄(XP_002277919.1)3种DXS蛋白与冬凌草IrDXS的氨基酸序列利用DNAman软件进行多序列比对。由图2可知,IrDXS蛋白和其他植物DXS蛋白一样,均具有一个保守的焦磷酸硫胺素结构域,该结构以高度保守的-GDG-残基开始,以-LNDN-残基结束;IrDXS蛋白还具有一段保守的吡啶结合相关的DRAG结构域。不同植物中DXS蛋白的C末端序列较N末端序列保守。植物DXS蛋白N端包含了一段质体转运肽序列,该段序列保守性较差,但仍具备质体转运肽的一般特征,即富含羟基化的丝氨酸和苏氨酸,缺乏天冬氨酸和谷氨酸等酸性的氨基酸。利用在线ChloroP 软件对IrDXS蛋白的定位进行分析,结果表明IrDXS蛋白N端具有一段64个氨基酸的质体转运肽序列。
2.2 IrDXS基因编码蛋白质序列分析
2.2.1 IrDXS蛋白特性分析 利用ExPASy在线软件程序的ProtParam工具对DXS蛋白基本理化性质进行分析。IrDXS基因总共编码了722个氨基酸,理论分子量为77 691.9,等电点为6.71,原分子组成为C3433H5477N959O1032S31,总原子数为10 932,带正电的氨基酸有73个(Arg+Lys),带负电的氨基酸有77个(Asp+Glu),不稳定系数是35.87,推测其为稳定蛋白。

图 2 DXS蛋白的多序列比对 实线部分序列表示焦磷酸硫胺素结合位点; 虚线部分表示与吡啶结合相关的DRAG结构域;箭头标示序列为DXS蛋白转酮酶活性的保守的谷氨酸残基; 五星标示序列为DXS催化作用的组氨酸残基。Fig. 2 Alignment of deduced amino acid sequences of DXS The full line marks the thiamin diphosphate-binding site and the pyridine binding DRAG domain is indicated by the dash line; the invariant Glu residue thought to be specific for transketolase activity is indicated by the arrowhead; the histidine residue for DXS catalysis is marked by a star.
运用TMHMM Server. v. 2.0程序 对IrDXS 蛋白的跨膜结构域进行预测,结果表明该蛋白不存在跨膜区。利用ProtScale工具,计算IrDXS蛋白质的亲疏水性,结果表明其亲水性氨基酸分布多于疏水性氨基酸。结合ProtParam程序预测的总平均亲水性为-0.749。因此,可推测冬凌草IrDXS蛋白是亲水性蛋白。SignalP 程序预测IrDXS蛋白不具有信号肽。
2.2.2 IrDXS 蛋白二级结构、三级结构的预测 利用NPSA在线生物学工具对IrDXS蛋白进行二级结构预测。结果表明IrDXS蛋白包含38.23%的α-螺旋、18.84%的延伸链、11.08%的β-转角和31.86%不规则卷曲。冬凌草IrDXS二级结构中最多的结构元件为α-螺旋,其以不规则卷曲散布于整个肽链中。使用SWISS-MODEL程序对IrDXS蛋白进行三级结构同源模建。在PDB蛋白质数据库中选择与IrDXS序列一致性最高(46.66%)的2o1s.1.A蛋白为模板进行同源模建,得到IrDXS 结构模型(图3) 。

图 3 IrDXS蛋白三级结构预测Fig. 3 Prediction on tertiary structure of IrDXS
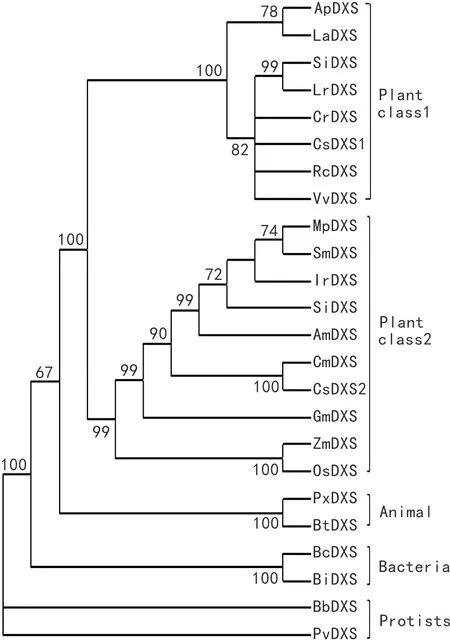
图 4 IrDXS蛋白与其他物种DXS蛋白的系统进化树分析 节点上的数值为通过bootstrap检验次数的百分数。Fig. 4 Phylogenetic tree of IrDXS protein and DXS proteins from other species Bootstrap values of the nodes represent the percentage drawn from the bootstrap test. LaDXS, Lavandula angustifolia(AGQ04154); SmDXS, Salvia miltiorrhiza(ACQ66107); MpDXS, Mentha × piperita(AAC335130); SiDXS, Sesamum indicum(XP_011069878); AmDXS, Antirrhinum majus(AAW28999); CmDXS, Cucumis melo(XP_008453643.1); CsDXS, Cucumis sativus(XP_004146353.2); GmDXS, Glycine max(XP_003550669.1); OsDXS, Oryza sativa Japonica Group (NP_001059086.1); ZmDXS, Zea mays(NP_001295426.1); ApDXS, Andrographis paniculata(AAP14353.1); CrDXS, Catharanthus roseus(AGL40532.1); RcDXS, Ricinus communis(XP_002516843.1); VvDXS, Vitis vinifera(XP_002277919.1); SmDXS, Solanum lycopersicum(CAZ66648.1); Lrdxs, Lycium ruthenicum(AIX87515.1); CsDXS, Cucumis sativus (XP_004144970.1); PxDXS, Plutella xylostella(XP_011567215.1); BtDXS, Bos taurus(XP_001257222.4); BtDXS, Bacillus thuringiensis(EEM94364.1); BcDXS, Bacillus cereus Rock1-15(EEL27081.1); BlDXS, Bacillus licheniformis(KFM90532.1); BbDXS, Babesia bovis(AHA41836.1); PvDXS, Plasmodium vinckei petteri(EUD71692.1).
白修饰的研究提供了参考位点。利用NetPhos 2.0 在线磷酸化位点分析工具对IrDXS蛋白进行预测,分析结果表明整个多肽链存在有30个氨基酸磷酸化位点(>0.5),其中Serine(丝氨酸)19个,Threonine(苏氨酸)6个, Tyrosine(酪氨酸)5个。在这30个磷酸化位点中,丝氨酸的磷酸位点最多。
2.2.4 IrDXS系统进化分析 从GenBank中选取薰衣草(Lavandulaangustifolia)、丹参(Salviamiltiorrhiza)、薄荷(Mentha×piperita)、胡麻(Sesamumindicum)等15种植物;蜡样芽孢杆菌(BacilluscereusRock1-15)、地衣芽孢杆菌(Bacilluslicheniformis)2种细菌;牛巴贝斯虫(Babesiabovis)、疟原虫(Plasmodium)2种原生生物;牛(Bostaurus)、小菜蛾(Plutellaxylostella)2种动物DXS基因氨基酸序列,用ClustalW 软件对序列进行比对后,使用MEGA 4 软件的邻接法(neighbor-joining)系统进化树,bootstrap检验的重复次数为1 000次(图4)。进化树分为4个大的分枝,动物、植物、原生生物、细菌各一支。从图4可以看出,DXS基因植物中可以分为两个家族,其中冬凌草IrDXS属于Class 2家族,与同科的丹参、薄荷等亲缘关系较近。
2.3 IrDXS组织特异性表达分析
选取冬凌草的根、茎、叶、花和愈伤组织作为材料,利用实时荧光定量PCR分析IrDXS表达的组织特异性。图5结果表明,IrDXS在愈伤组织中的转录水平最低,在茎和花中的转录水平较低,而在根和叶中的转录水平最高。
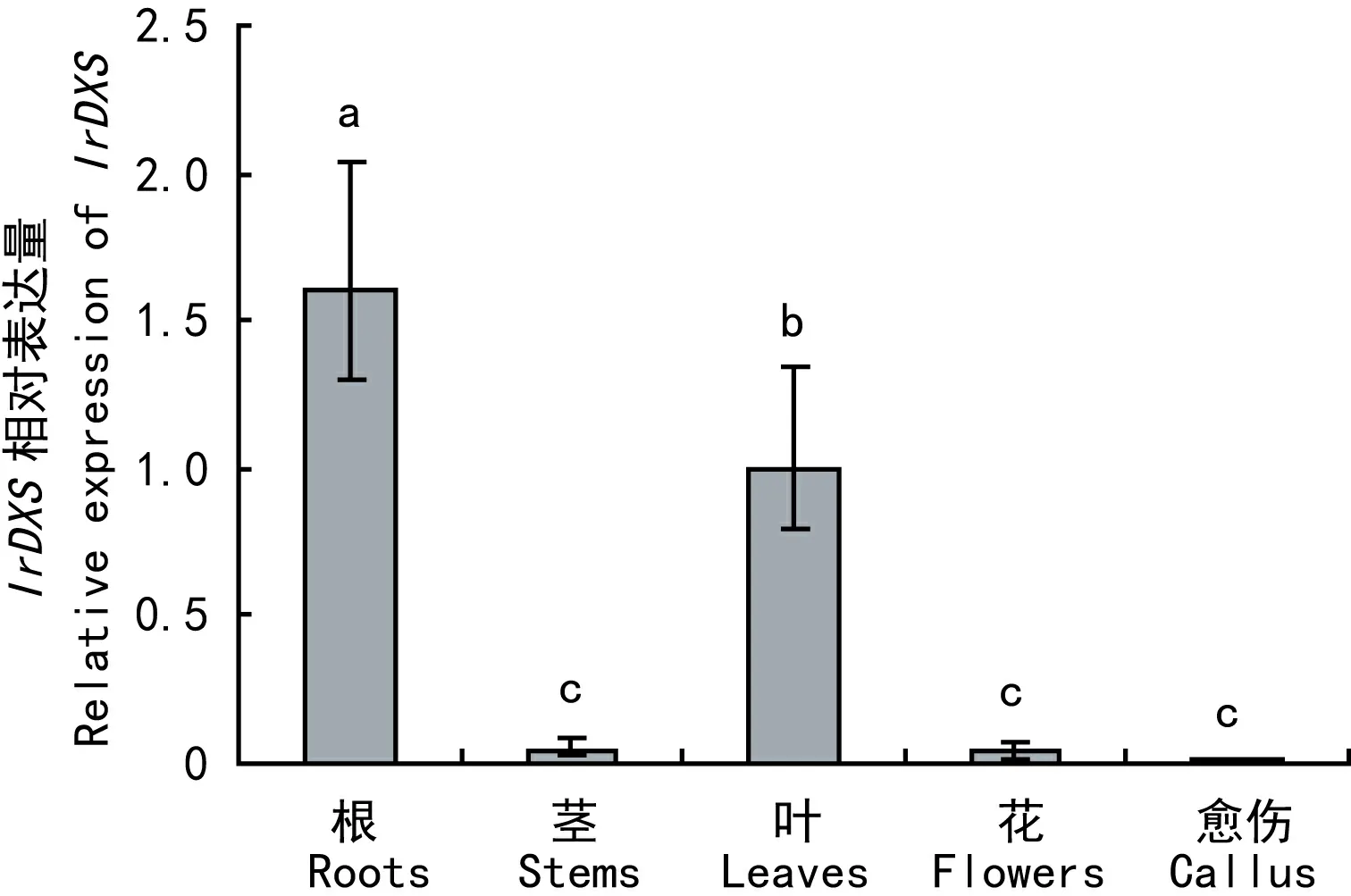
图 5 冬凌草不同组织中IrDXS基因的相对表达量Fig. 5 Relavive expression of IrDXS in different tissues from Isodon rubescens
3 讨论与结论
萜类是一类广泛存在于植物体内的化学物质,其以异戊二烯(Isoprene)为骨架。植物萜类骨架的生物合成主要通过甲羟戊酸途径(MVA)和2-C-甲基-D-赤藓糖醇-4-磷酸途径(MEP)完成,不同的途径均需要大量的不同功能的酶参与复杂的酶促反应。DXS是MEP途径的第1个关键酶,其可将丙酮酸和3-磷酸-甘油醛缩合生成1-脱氧-D-木酮糖-5-磷酸(Estevez et al, 2001)。Estevez et al(2000)发现,在拟南芥中过表达DXS基因,转基因拟南芥表现出胡萝卜素、维生素E、脱落酸和赤霉素等萜类物质含量显著上升的趋势。在番茄和油棕果实中,萜类物质类胡萝卜素含量与DXS基因表达的表达量一致。(Khemvong, 2005; Rodriguez et al, 2001)。将拟南芥DXS基因在宽叶薰衣草中过量表达发现,其叶片和花中单萜及倍半萜类挥发油含量大幅提高。(Munoz et al, 2006)。上述研究表明, DXS在MEP途径中的关键酶,萜类成分积累的多寡与其表达量的高低,活性的有无有着直接的关系。目前,DXS基因已在多种植物中成功克隆,而冬凌草中DXS基因的研究却未见报道。本研究根据测序得到的冬凌草转录组数据库, 成功从冬凌草叶片中克隆了一个DXS基因的全长cDNA (IrDXS),并对其进行生物信息学分析。结果表明冬凌草IrDXS和其他同源的不同植物DXS基因序列具有较高的相似性,且均具有转酮酶和DXP合成酶的3个保守结构域。
MEP途径相关酶均存在于质体中,因此该途径所包含的酶系是否具有质体的导向性是其酶活力的重要评判标准。Zhang et al利用绿色荧光蛋白(GFP)作为报道基因,将大豆GmDXS基因与GFP基因共表达,荧光显微镜观察发现,GmDXS定位于叶绿体中。Krushkal et al(2003)对DXS进行亚细胞定位发现其在质体的类囊体中表达。本研究发现,冬凌草IrDXS基因N端存在一段30个氨基酸残基的质体转运肽序列,意味着该蛋白虽由核基因编码但却定位于质体。
不同物种中DXS蛋白被数目不同的基因所编码,大多生物体内存在2个或2个以上DXS基因家族成员(Krushkal et al, 2003)。在植物中,共有两类 DXS 家族成员,分别编码 2 种不同类型的 DXS蛋白,可能在萜类物质的生物合成中发挥不同功能(程波等, 2015)。本研究选择冬凌草IrDXS氨基酸序列及其他在GenBank中已登录的全长DXS蛋白氨基酸序列进行系统进化分析,结果表明植物DXS基因能很好地和来自细菌、动物、原生生物的DXS基因区别开来,而植物DXS基因分为两支,IrDXS属于植物Class 2家族,且与来源于同科植物丹参等的DXS基因亲缘关系较近。DXS基因的表达具有组织器官特异性,且不同家族DXS基因表达趋势也有不同。属于植物Class 1家族的拟南芥DXS1(CLA1)在叶片等光合组织和根等非光合组织中均广泛表达, 尤其在幼苗和芽等幼嫩组织中的表达较强。大豆GmDXS1在叶片、茎、种子等组织表达量较高,而在根中则不表达。通过对属于植物Class 2家族的IrDXS进行组织特异性表达分析发现,其表达模式与不同家族的DXS基因有一定差异,IrDXS在冬凌草根和叶中表达量较高,而茎、花和愈伤组织中表达量较低,推测可能与冬凌草中萜类成分的分布有关。
本研究克隆所得IrDXS可能只是冬凌草DXS基因家族中的一个成员,而冬凌草中是否存在植物class 1家族的DXS基因,不同家族的DXS基因在冬凌草萜类代谢中所起到的作用还有待进一步的研究。
BAOR, SHU Y, WU X, et al, 2014. Oridonin induces apoptosis and cell cycle arrest of gallbladder cancer cells via the mitochondrial pathway [J]. BMC Canc, 1(14): 217.
CHEN J, ZHAO DG, 2004. Research advances on the enzymes and their coding gene involved in plant terpene biosynthesis [J]. Mol Plant Breed,6(2): 757-764. [ 陈建, 赵德刚, 2004. 植物萜类生物合成相关酶类及其编码基因的研究进展 [J]. 分子植物育种, 6(2): 757-764.]
CHENG B, YANG WJ, HE J, et al, 2015. Bioinformatics analysis of DXS in ten medicinal plants [J]. Chin Agric Sci Bull , 2(31): 146-152. [程波, 杨伟俊, 何江, 等, 2015. 10种药用植物萜类合酶(DXS)生物信息学分析 [J]. 中国农学通报,2(31): 146-152.]
ESTEVEZ JM, CANTERO A, REINDL A, et al, 2001. 1-Deoxy-D-xylulose-5-phosphate synthase, a limiting enzyme for plastidic isoprenoid biosynthesis in plants [J]. J Biol Chem, 25(276): 22901-22909.ESTEVEZ JM, CANTERO A, ROMERO C, et al, 2000. Analysis of the expression of CLA1, a gene that encodes the 1-deoxyxylulose 5-phosphate synthase of the 2-C-methyl-D-erythritol-4-phosphate pathway in Arabidopsis [J]. Plant Physiol, 1(124): 95-104.
FENG WS, LI HW, ZHANG XK, et al, 2008. Progress in studies of chemical compositions fromIsodonrubescens[J]. Chin J New Drug, 23(17): 2003-2007. [冯卫生, 李红伟, 郑晓珂, 等, 2008. 冬凌草化学成分研究进展 [J]. 中国新药杂志, 23(17): 2003-2007.]KHEMVONG SSW, 2005. Molecular cloning and expression of a cDNA encoding 1-deoxy-d-xylulose-5-phosphate synthase from oil palmElaeisguineensisJacq [J]. Plant Sci,3(169): 571-578.KRUSHKAL J, PISTILLI M, FERRELL KM, et al, 2003. Computational analysis of the evolution of the structure and function of 1-deoxy-D-xylulose-5-phosphate synthase, a key regulator of the mevalonate-independent pathway in plants [J]. Gene(313): 127-138.LI F, YI S, WEN L, et al, 2014. Oridonin induces NPM mutant protein translocation and apoptosis in NPM1c+ acute myeloid leukemia cellsinvitro[J]. Acta Pharmacol Sin, 6(35): 806-813.
MUNOZ BERTOMEU J, ARRILLAGA I, ROS R, et al, 2006. Up-regulation of 1-deoxy-D-xylulose-5-phosphate synthase enhances production of essential oils in transgenic spike lavender [J]. Plant Physiol, 3(142): 890-900.
RODRIGUEZ CONCEPCION M, AHUMADA I, DIEZ-JUEZ E, et al, 2001. 1-Deoxy-D-xylulose 5-phosphate reductoisomerase and plastid isoprenoid biosynthesis during tomato fruit ripening [J]. Plant J, 3(27): 213-222.
WEI L, WU XJ, LI SH, et al, 2014. Cloning and expression analysis of 1-deoxy-D-xylulose-5-phosphate synthase 1 gene inHouttuyniacordata[J]. Chin Trad Herb Drugs, 11(45): 1607-1612. [魏麟, 伍贤进, 李胜华, 等, 2014. 鱼腥草1-脱氧-D-木酮糖-5-磷酸合成酶1基因克隆与表达分析 [J]. 中草药, 11(45): 1607-1612.]
ZENG CH, HUANG QL, YANG JF, et al, 2011. Construction of prokaryotic expressional vector of DXS gene fromAmomumvillosumLour [J]. Guangdong Agric Sci, 22:141-143. [曾春红, 黄琼林, 杨锦芬, 等, 2011. 阳春砂DXS基因原核表达载体的构建 [J]. 广东农业科学, 22: 141-143.]
Cloning and expression analysis of 1-deoxy-D-xylulose 5-phosphate synthase gene inIsodonrubescens
ZHU Yun-Hao1,2, SU Xiu-Hong1,2, DONG Cheng-Ming1,2*, CHEN Sui-Qing1,2,SHAO Yuan-Yang1, ZHANG Feng-Bo1
( 1. School of Pharmacy, Henan University of Traditional Chinese Medicine, Zhengzhou 450046, China; 2. Collaborative InnovationCenterforRespiratoryDiseaseDiagnosisandTreatment&ChineseMedicineDevelopmentofHenanProvince,HenanUniversityofTraditionalChineseMedicine, Zhengzhou 450046, China )
1-Deoxy-D-xylulose-5-phosphate synthase (DXS) catalyses the first committed step of the 2C-methyl-D-erythritol-4-phosphate (MEP) pathway, and its expression level affects the contents of terpenoid. This study was aimed to clone the 1-deoxy-D-xylulose 5-phosphate synthase(DXS)gene fromIsodonrubescensand analyze the bioinformatics and expression of the gene.The primers were designed according to the transcript sequence ofIrDXSfromI.rubescenstranscriptome database. The physical and chemical characteristics, signal peptide, subcellular localization, secondary structure ofIrDXSprotein were analyzed and predicted by the tools of bioinformatics. In this work, a DXS cDNA (IrDXS, KT831764) was isolated fromI.rubescens. The full-length cDNA of IrDXS encoded 722 amino acid residues with a predicted molecular mass of 77.7 KD. Sequence alignment showed thatIrDXShad high homology to known DXS proteins from other plant species and contained the conserved N-terminal plastid transit peptide, the N-terminal thiamine binding domain and pyridine binding DRAG domain. Phylogenetic analysis indicated thatIrDXSbelonged to the plant DXS2 cluster. Quantitative real-time PCR analysis showed that the expression ofIrDXSwas tissue-specific, and accumulation of transcripts was greater in roots and leaves. This study provides valuable information for future experiments on the molecular mechanisms underlying the isoprenoid biosynthesis inI.rubescens.
Isodonrubescens, 1-deoxy-D-xylulose 5-phosphate synthase, bioinformatic analysis, qPCR, diterpene
10.11931/guihaia.gxzw201511015
2015-11-10
2016-03-23
国家自然科学基金(81173486);河南中医学院创新人才项目(2011XCXRC02);河南省高等学校青年骨干教师计划项目(2011GGJS-089) [Supported by the National Natural Science Foundation of China (81173486); Foundation for University Key Teachers in Henan Province(2011GGJS-089); Innovative Talents of Henan University of Traditional Chinese Medicine (2011XCXRC02)]。
朱畇昊(1986-),男,河南郑州人,博士,讲师, 从事药用植物分子生物学研究,(E-mail)guxinhan123@163.com。
*通讯作者: 董诚明,教授,从事药用植物规范化种植研究,(E-mail)dcm371@sohu.corn。
Q943.2
A
1000-3142(2016)12-1476-07
朱畇昊, 苏秀红, 董诚明, 等. 冬凌草1-脱氧-D-木酮糖-5-磷酸合成酶基因克隆与表达分析 [J]. 广西植物, 2016, 36(12):1476-1482
ZHU YH, SU XH, DONG CM, et al. Cloning and expression analysis of 1-deoxy-D-xylulose 5-phosphate synthase gene inIsodonrubescens[J]. Guihaia, 2016, 36(12):1476-1482

