尼妥珠单抗和顺铂同步全盆腔调强放疗治疗无法手术切除宫颈癌的初步研究
朱丽红 田素青 曲 昂 孙海涛 王 皓 廖安燕 王俊杰
(北京大学第三医院肿瘤放疗科,北京 100083)
·临床研究·
尼妥珠单抗和顺铂同步全盆腔调强放疗治疗无法手术切除宫颈癌的初步研究
朱丽红①田素青 曲 昂 孙海涛 王 皓 廖安燕 王俊杰*
(北京大学第三医院肿瘤放疗科,北京 100083)
目的 探讨每周尼妥珠单抗和顺铂同步全盆腔调强放疗治疗无法手术切除宫颈癌的安全性和有效性。方法2013年12月~2015年7月24 例FIGO分期为ⅠB1~ⅣA期、活检组织病理学证实为鳞癌的无法手术切除宫颈癌接受全盆腔调强放射治疗(50.4 Gy/28次)和5~6次(30~36 Gy/5~6 次)的后装近距离治疗,化疗方案为每周尼妥珠单抗200 mg和顺铂40 mg/m2,共 6 周期。急性反应评价按照CTCAE 4.03标准,晚期反应评价按照RTOG/EORTC标准。结果所有患者完成6周期化疗并在7~8周内完成盆腔放疗。3级白细胞减少、中性粒细胞减少和血小板减少的发生率分别为33.3%(8/24)、8.3%(2/24)和8.3%(2/24),经对症支持治疗后恢复至正常继续化疗。未出现4级血液学毒性。24例中位随访12 个月(5~24个月)。治疗后4个月22例完全缓解,2例部分缓解。2例部分缓解中,1例在治疗后8个月出现局部复发。1 年总生存率、无进展生存率和局部控制率分别为100%(24/24)、95.8%(23/24)和 95.8%(23/24)。1 例治疗后7个月出现 1级出血性放射性直肠炎。结论6周期的每周尼妥珠单抗200 mg和顺铂40 mg/m2同步全盆腔调强放疗治疗无法手术切除的宫颈癌安全、可行,显示较好的临床疗效。
调强放射治疗; 靶向药物疗法; 同步化疗; 宫颈癌
外照射和腔内照射相结合的放射治疗是宫颈癌的主要治疗方式之一。以顺铂为基础的同步放化疗可以降低死亡危险达30%~50%,同时提高局部控制率[1~5],目前已经成为无法手术切除的早期和中晚期宫颈癌的标准治疗方式[6]。调强放射治疗较三维适形放疗可明显减少危及器官的受照体积和剂量,从而减轻副反应[7]。85%以上的宫颈鳞癌患者存在表皮生长因子受体(epidermal growth factor receptor,EGFR)过度表达,且与高分期及不良预后有关[8]。尼妥珠单抗是我国第1个人源化单克隆抗体,可特异性阻断EGFR信号传导通路。Diaz-Miqueli等[9]报道尼妥珠单抗与放疗、细胞毒类药物联合应用时,通过调节肿瘤的化疗及放疗敏感性提高疗效且反应较小,并已在头颈部癌和脑胶质瘤等多种肿瘤中应用[10~12],但对于宫颈癌的临床研究较少。2013年12月~2015 年7月我科采用尼妥珠单抗(百泰生物药业有限公司,批文号:国药准字S20080001)和顺铂同步全盆腔旋转调强放疗治疗无法手术切除的宫颈癌,旨在评价该治疗方案的安全性和有效性。
1 临床资料与方法
1.1 一般资料
本组 24 例,年龄37~68岁,中位年龄54.5岁。ⅠB11例,ⅠB24例,ⅡA5 例,ⅡB7例,ⅢA1例,ⅢB3例,ⅣA3例。24例活检组织病理均为鳞癌。病理分级:角化型9例,非角化型15例。肿瘤直径≥4 cm(4~7.5 cm) 19例,直径<4 cm(2~3.7 cm) 5例。盆腔淋巴结转移14例,未转移10例。10 例ⅠB1~ⅡA因肿瘤较大(≥4 cm)和(或)盆腔淋巴结多发转移,预期手术切除后疗效差或无法手术切除或患者对手术耐受性差由妇科转至放疗科;14 例ⅡB~ⅣA局部晚期和晚期患者根据宫颈癌治疗指南直接行同步放化疗[6]。
病例选择标准:根据FIGO分期标准,宫颈癌可分为3期:早期(ⅠA~ⅠB1)、局部晚期(ⅠB2~ⅡB)、晚期(ⅢA~ⅣB)[13],选择经活检组织病理学证实为宫颈鳞癌且无法手术切除的FIGO分期ⅠB1~ⅣA患者;影像学检查无远处转移;年龄≤75岁;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)功能评分≤2,预期生存期≥3个月,初始影像学检查和生化检查在治疗前 2 周内完成。所有患者治疗前均签署知情同意书。
1.2 方法
1.2.1 放疗方案 定位前喝水憋尿,仰卧位。体膜固定激光定位,增强CT定位扫描,将扫描图像传送至医科达治疗计划系统(Oncentra 4.3)。勾画靶区和危及器官[6]:临床靶区(clinical target volume,CTV)包括子宫体、宫颈及肿瘤、肿瘤下3 cm阴道、宫旁和阴道旁组织,以及双髂总、髂外、髂内、闭孔、骶3以上骶前淋巴结引流区域和腹膜后淋巴结引流区。计划靶区(planning target volume,PTV)=CTV+0.3~1.5 cm。转移淋巴结肿瘤区(gross tumor volume of nodal metastases,GTVnd)指影像学可见的转移淋巴结。转移淋巴结计划靶区(planning target volume of GTVnd,PGTVnd)=GTVnd+0.3 cm。设计容积旋转调强放疗计划,保证或满足95%PTV接受处方剂量,避免热点出现在危险器官内。6 MV X线,处方剂量95%PTV=50.4 Gy/28 次,95%PGTVnd =60 Gy/28 次;36~40 Gy时予192Ir高剂量率后装近距离治疗,处方剂量参考点A点剂量为30~36 Gy /5~6次。按照正常组织器官物理剂量限值TD5/5制定治疗计划:膀胱和直肠 V40≤40%,小肠和结肠 V40≤25%,V30≤50%,股骨头V30≤10%。总治疗时间不超过8周。
1.2.2 化疗方案 采用6周期每周顺铂 40 mg/m2+尼妥珠单抗200 mg的化疗方案。放疗第1天开始化疗,1次/周,共6周期。尼妥珠单抗200 mg溶于0.9%生理盐水250 ml静脉滴注1 h以上。然后输入顺铂,按照顺铂40 mg/m2溶于0.9%盐水500 ml静脉滴注,并予充足水化。化疗期间给予胃黏膜保护剂和盐酸昂丹司琼止吐治疗。每周监测血液学指标和患者一般状况,根据病情给予对症支持治疗。
1.3 评估和随访
治疗后1 个月行MRI或CT或PET-CT检查以及妇科查体评估是否需要增加腔内照射,4个月再次评估。2年内每3个月复查,3~5年每6个月复查,以后每年复查。近期疗效按照RECIST 1.1 标准[14]进行评价,完全缓解(complete remission,CR):所有靶病灶消失,全部病理淋巴结短直径减小至<10 mm;部分缓解(partial remission,PR):靶病灶直径之和比基线水平减少至少30%;病变进展(progressed disease,PD):所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%,必须满足直径和绝对值增加至少5 mm(出现一个或多个新病灶也视为PD);病变稳定(stable disease,SD):靶病灶减小的程度介于PR和PD之间。急性反应按照CTCAE 4.03标准[15]进行评价,晚期反应按照RTOG/EORTC标准[16]进行评价。
2 结果
24例完成全盆腔调强放疗 50.4 Gy/28次和5~6次(30~36 Gy/5~6次)的后装近距离治疗以及6周期的尼妥珠单抗每周200 mg和顺铂40 mg/m2化疗。4 例有腹膜后淋巴结转移,在盆腔放疗结束后继续腹膜后区照射。
全盆腔照射治疗期间,88.9%(8/9)的严重血液学不良反应发生在4~6个化疗周期以后。3级白细胞减少、中性粒细胞减少和血小板减少的发生率分别为33.3%(8/24)、8.3%(2/24)和8.3%(2/24),经应用重组人粒细胞集落刺激因子和重组人白细胞介素11后恢复至正常后继续完成化疗。未发生 4 级血液学毒性。胃肠道反应多为 2 级以下的恶心、呕吐、腹泻或里急后重,1、2 级恶心发生率分别为75.0%(18/24)和0,1、2 级呕吐发生率分别为16.7%(4/24)和4.2%(1/24),3 级恶心和呕吐发生率分别为12.5%(3/24)、4.2%(1/24);1、2 级腹泻发生率均为8.3%(2/24);1、2 级直肠反应发生率分别为12.5%(3/24)、8.3%(2/24);1、2 级泌尿系症状发生率均为8.3%(2/24);1 级乏力发生率为20.8%(5/24)。上述症状经对症支持治疗后患者均能缓解和耐受,24例未延迟治疗。
24例全部随访,截止2015年12月19日,中位随访时间12个月(5~24个月)。治疗后4个月,22例CR(图1、2),2例PR。2例PR中,1例治疗后第8个月出现局部复发。患者全部生存,无进展生存率和局部控制率分别为95.8%(23/24)和95.8%(23/24),中位无进展生存时间为12个月。1例治疗后7个月时出现1级出血性放射性直肠炎。
3 讨论
尽管研究证明以铂类为主的同步放化疗可以提高局部晚期和早期宫颈癌的局部控制率和10%~15%的总生存率[1~5],但是放化疗后仍有超过35%的宫颈癌患者为肿瘤持续存在、复发或转移,生存期仅为 4.5~10 个月,局部或盆腔复发仍是主要的失败原因之一。由于同步放化疗中放射治疗联合的是细胞毒性药物,目前,最常用的是顺铂和(或)其他细胞毒性药物联合应用,因此,治疗的不良反应主要包括显著的骨髓抑制和腹泻、里急后重,导致治疗中断或延长治疗时间,一些患者甚至出现长期的慢性腹泻和营养不良。因此,寻找更加先进的放疗技术,以及有效且毒性较低的联合放疗药物成为目前关注的热点。
调强放疗技术较三维适形放疗技术不仅可以明显减少危及器官的受照剂量和体积,减轻不良反应和并发症的发生率[17],还可以通过同步补量技术实现不同靶区即肿瘤区域及转移淋巴结进行不同分割的高剂量照射[18]。本研究在给予全盆腔50.4 Gy/1.8 Gy/8次外照射的同时,对转移淋巴结给予 60 Gy/2.14 Gy/28次的照射剂量,从生物等效剂量上提高转移淋巴结的受照剂量,这是一种加速放疗补量技术,即通过增加分次剂量缩短治疗时间以克服肿瘤的加速再群体化,提高肿瘤的放射敏感性,从而有可能提高局部控制率,减少远处转移率。
EGFR主要介导细胞分裂增殖的信号,其过度表达与细胞分化、增殖、转移、血管生成和凋亡密切相关[19]。EGFR与配体结合后可引起下游一系列信号传导通路的活化,导致细胞增殖、逃避凋亡,与预后不良密切相关[20]。Diaz-Miqueli等[9]研究认为EGFR与肿瘤细胞的放射敏感抵抗有关。尼妥珠单抗是我国批准的第1个高度人源化单克隆抗体,通过阻断EGFR信号传导通路异常激活,减少肿瘤细胞对正常组织的侵袭以及向其他部位的扩散。Diaz-Miqueli等[9]报道尼妥珠单抗与放疗、细胞毒类药物联合应用时,可提高疗效而很少增加副作用。目前,尼妥珠单抗联合放射治疗已经用于头颈部癌、神经胶质瘤和直肠癌等多种实体肿瘤,证实了安全性和有效性[9~12,21]。
Villalba等[8]研究提示宫颈癌患者存在EGFR过度表达,因此,EGFR可能成为宫颈癌一个重要的治疗靶点。尽管目前仍未明确EGFR受体在宫颈癌组织上过表达的确切的生物学意义,但是已经进行了一些评价EGFR酪氨酸激酶受体抑制剂或抗EGFR单克隆抗体作用的临床研究[22]。Cetina等[23]对复发转移宫颈癌进行4周的单药尼妥珠单抗周疗的诱导治疗,然后给予尼妥珠单抗同步化疗18周,再继续尼妥珠单抗每2周维持治疗直至出现不能接受的不良事件,结果提示患者的耐受性较好,病变稳定率为 35%,无病生存时间和总生存时间分别为163、299 d。伍楚蓉等[24]对尼妥珠单抗联合同步放化疗与同步放化疗组治疗局部晚期宫颈癌进行对比,靶区90%PTV处方剂量为50~55 Gy/1.8~2.2 Gy,每周4次放疗;后装近距离治疗A点处方剂量为25 Gy/5次,每周1次;同步化疗药物为PTX 45 mg/m2和顺铂20 mg/m2。60例随机分为2组,观察组和对照组放疗后3个月客观有效率(CR+PR)分别为83.4%和70%,有统计学差异(P<0.05)。伍楚蓉等报道的客观缓解率较低,原因可能是总照射剂量较低,本组客观有效率较高,原因可能是41.7%(10/24)患者期别较早,其次照射剂量较高,不管是原发灶还是转移淋巴结都受到高剂量照射的缘故;再者化疗方案不同。但是伍楚蓉等[24]的研究中未报道生存率,本组1年总生存率、无进展生存率和局部控制率分别为100%、95.8%和95.8%,中位无进展生存时间为12个月,提示治疗有效。
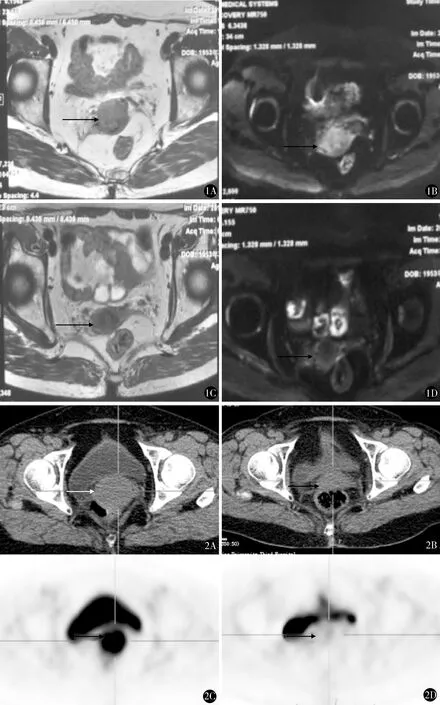
图1 女,62岁,宫颈鳞癌ⅡA1期。A.治疗前MRI T2WI横断位示宫颈软组织信号,累及范围3.7 cm×1.8 cm,向下累及阴道上段,可疑累及宫体下部,病变区浆膜面欠光整;B. DWI呈高信号,与膀胱后壁分界清。C.治疗后1个月MRI T2WI横断位宫颈软组织影明显缩小,显示不清;D. DWI未见明显高信号,局部浆膜面较前清晰,与膀胱后壁界限清晰,提示病变CR 图2 女,55岁,宫颈鳞癌ⅣA期,治疗前膀胱镜检示膀胱后壁2 mm瘘。A.治疗前PET-CT横断面示宫颈巨大肿物,累及范围5.2 cm×5.2 cm×6.1 cm,向上累及宫体,浆膜面毛糙,累及膀胱后壁;B.治疗后1个月PET-CT横断面示宫颈肿瘤消失,形态大致恢复正常。C.治疗前PET-CT示肿物放射性异常浓聚,SUVmax10.3;D.治疗后PET-CT示肿物放射性浓聚显著减低,SUVmax2.5,提示病变CR
在Cetina等[25]的研究中,每周顺铂 40 mg/m2同步放疗出现3~4级的血液学不良反应发生率为 30%。本研究结果与其类似,3 级骨髓抑制发生率为33.3%(8/24),其他急性胃肠道反应大部分为1~2级。上述各种急性反应在治疗期间通过密切观察,给予对症支持治疗后,均能恢复至正常,未影响治疗。尽管本研究中是尼妥珠单抗和顺铂两药联合放疗,Cetina等使用的是单药顺铂联合放疗,不良反应发生率类似,但是尼妥珠单抗是否会增加治疗的不良反应的发生率,仍需要对比研究来证实。
本组晚期损伤中仅1例治疗后7个月出现1级放射性直肠炎,偶尔便血,经予云南白药及灌肠治疗后缓解,其他患者未见到明显的晚期损伤,可能是随访时间较短的缘故。
综上所述,本研究证实6周期的每周尼妥珠单抗200 mg和顺铂40 mg/m2同步全盆腔调强照射原发宫颈癌安全、可行,显示了较好的临床疗效,至于是否有助于提高局部控制率,降低远处转移率,并最终产生生存获益还有待于进一步研究。
1 Whitney CW,Sause W,Bundy BN,et al. Randomized comparison of fluorouracil plus cisplatin versus hydroxyurea as an adjunct to radiation therapy in stage ⅡB-ⅣA carcinoma of the cervix with negative para-aortic lymph nodes:A Gynecologic Oncology Group and Southwest Oncology Group study. J Clin Oncol,1999,17(5):1339-1348.
2 Morris M,Eifel PJ,Lu J,et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high risk cervical cancer. N Engl J Med,1999,340(15):1137-1143.
3 Rose PG,Bundy BN,Watkins EB,et al. Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer. N Engl J Med,1999,340(15):1144-1153.
4 Peters WA 3rd,Liu PY,Barrett RJ 2nd,et al. Concurrent chemotherapy and pelvic radiation therapy compared with radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. J Clin Oncol,2000,18(8):1606-1613.
5 Keys HM,Bundy BN,Stehman FB,et al. Cisplatin,radiation and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage ⅠB cervical carcinoma. N Engl J Med,1999,340(15):1154-1161.
6 中华人民共和国国家卫生和计划生育委员会.宫颈癌及癌前病变规范化诊疗指南(试行).中国医学前沿杂志(电子版),2013,5(8):40-49.
7 朱丽红,苏 星,吴 昊,等.宫颈癌限定盆骨的全盆调强放疗骨髓受照的剂量学研究.中华放射医学与防护杂志,2008,28(1):57-60.
8 Villalba SR,Planell DC,Grau JMC,et al. Current opinion in cervix carcinoma. Clin Transl Oncol,2011,13(6):378-384.
9 Diaz-Miqueli A,Martinez GS. Nimotuzumab as a radiosensitizing agent in the treatment of high grade glioma:challenges and opportunities. Oncol Targets Ther,2013,6(5):931-942.
10 Reddy BKM,Lokesh V,Vidyasagar MS,et al. Nimotuzumab provides survival benefit to patients with inoperable advanced squamous cell carcinoma of the head and neck:A randomized,open-label,phase Ⅱb,5-year study in Indian patients. Oral Oncol,2014,50(5):498-505.
11 Jin T,Zhu Y,Luo JL,et al. Prospective phase Ⅱ trial of nimotuzumab in combination with radiotherapy and concurrent capecitabine in locally advanced rectal cancer. Int J Colorectal Dis,2015,30(3):337-345.
12 Wang Y,Pan L,Sheng XF,et al. Nimotuzumab,a humanized monoclonal antibody specific for the EGFR,in combination with temozolomide and radiation therapy for newly diagnosed glioblastoma multiforme:First results in Chinese patients. Asia Pac Clinic Oncol,2016,12(1):e23-e29.
13 Minig L,Patrono MG,Romero N,et al. Different strategies of treatment for uterine cervical carcinoma stage ⅠB2-ⅡB. World J Clin Oncol,2014,5(2):86-92.
14 Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumors:revised RECIST guideline (versien 1.1).Eur J Cancer,2009,45(2):228-247.
15 Cancer Therapy Evaluation Program. http://ctep.cancer.gov.
16 Cox JD,Stetz J,Pajak TF,et al. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys,1995,31(5):1341-1346.
17 Liu YM,Shian CY,Lee ML,et a1. The role and strategy of IMRT in radiotherapy of pelvic tumors:Dose escalation and critical organ sparing in prostate cancer. Int J Radiat Oncol Biol Phys,2007,67(4):1113-1123.
18 朱丽红,徐 博,吴 昊,等.宫颈癌调强放疗补量与常规照射剂量分布比较.中华放射医学与防护杂志,2009,29(4):405-409.
19 Yarden Y,Sliwkowski MX. Untangling the ErbB signalling network. Nat Rev Mol Cell Biol,2001,2(2):127-137.
20 Selvaggi G,Novello S,Torri V,et al. Epidermal growth factor receptor overexpression correlates with a poor prognosis in completely resected non-small-cell lung cancer. Ann Oncol,2004,15(1):28-32.
21 陈志明,薛 强,陈晓钰,等.同步加量调强放疗联合尼妥珠单抗治疗局部晚期食管癌.中华医学杂志,2016,96(8):640-642.
23 Cetina L,Crombet T,Jiménez-Lima R,et al. A pilot study of nimotuzumab plus single agent chemotherapy as second-or third-line treatment or more in patients with recurrent,persistent or metastatic cervical cancer. Cancer Biol Ther,2015,16(5):684-689.
24 伍楚蓉,唐武兵,杨 文,等.尼妥珠单抗联合同期放化疗治疗局部晚期宫颈癌的近期疗效观察.国际肿瘤学杂志,2015,42(8):589-592.
25 Cetina L,Rivera L,Hinojosa J,et al. Routine management of locally advanced cervical cancer with concurrent radiation and cisplatin,five-year results. BMC Womens Health,2006,6:3.
(修回日期:2016-08-03)
(责任编辑:李贺琼)
A Preliminary Study on Nimotuzumab and Cisplatin Chemotherapy Combined with Concurrent Intensity Modulated Radiotherapy for Unresectable Cervical Carcinoma
ZhuLihong,TianSuqing*,QuAng*,etal.
*DepartmentofRadiationOncology,PekingUniversityThirdHospital,Beijing100083,China
WangJunjie,E-mail:wjj_1964@163.com
Objective To determine the safety and effectiveness of weekly nimotuzumab and cisplatin combined with concurrent whole pelvic irradiation for unresectable cervical carcinoma. Methods Between December 2013 and July 2015,a total of 24 patients with unresectable cervical carcinoma (FIGO stage ⅠB1-ⅣA,squamous cell carcinomas confirmed by histology) were enrolled into this study. These patients received intensity modulated radiotherapy (50.4 Gy/28 f) and 5-6 fractions of afterloading brachytherapy (30-36 Gy/5-6 f). The chemotherapy scheme was 200 mg nimotuzumab and 40 mg/m2cisplatin weekly for six cycles. The patients were monitored for acute toxicity by using the Common Toxicity Criteria (version 4.03) and for late toxicity by using the RTOG/EORTC. Results All the patients finished 6 cycles of chemotherapy,as well as pelvic radiotherapy within 7-8 weeks. The incidences of the grade 3 hematologic toxicity,the leucopenia and the neutropenia were 33.3% (8/24),8.3% (2/24),and 8.3% (2/24),respectively. They recovered to normal level before next chemotherapy by using of colony stimulating factors and recombinant human interleukin-11. No grade 4 toxicity occurred. The median follow-up was 12 months (range,5-24 months). At 4 months after treatment,22 patients obtained complete remission (CR) and 2 patients had achieved partial remission (PR). Of the 2 patients with PR,one developed local recurrence 8 months after finishing treatment. The 1-year overall survival rate,progression free survival rate,and local control rate were 100% (24/24),95.8% (23/24),and 95.8% (23/24),respectively. One patient had grade 1 haemorrhagic radiation proctitis at 7 months after treatment. Conclusions Combination use of nimotuzumab 200 mg and cisplatin 40 mg/m2weekly for 6 cycles concurrently with pelvic intensity modulated radiotherapy can be safely administered. Preliminary results show a good clinical outcome.
Intensity modulated radiotherapy; Targeted drug therapy; Concomitant chemotherapy; Cervical carcinoma
*通讯作者,E-mail:wjj_1964@163.com
①现工作单位:首都医科大学附属北京妇产医院妇瘤科,北京 100006
A
1009-6604(2016)08-0711-05
10.3969/j.issn.1009-6604.2016.08.010
2016-07-20)

