卒中后焦虑患者早期白介素-6及皮质醇变化
邹为,张晓凡,杨渊
卒中后焦虑患者早期白介素-6及皮质醇变化
邹为,张晓凡,杨渊
目的:探讨白介素-6(IL-6)以及皮质醇水平与卒中后焦虑(PSA)发生的相关性。方法:选取卒中患者132例,在发病后第1周采用ELISA法检测血清IL-6水平和化学发光免疫分析法检测皮质醇波动变化(8:00与16:00)。另选择健康体检者50例为正常对照组,同样检测IL-6及皮质醇水平(8:00)。发病3周后根据是否发生PSA,将卒中患者分为PSA组32例和非PSA组100例。结果:PSA组的IL-6水平与非PSA组及正常对照组相比均升高,差异有统计学意义(P<0.05)。与正常对照组相比,PSA组和非PSA组的皮质醇均升高(P<0.05),PSA组的皮质醇生物学节律消失。结论:IL-6和皮质醇水平检测可能有助于PSA的早期筛查。
卒中后焦虑;皮质醇;白介素-6
卒中患者由于其神经功能缺损以及神经生化等改变易出现焦虑抑郁等情绪障碍[1]。约18%~25%卒中患者并发焦虑障碍,卒中后焦虑(post-stroke anxiety,PSA)阻碍患者的神经功能恢复、增加并发症、影响生活质量,甚至增加复发率[2]。近年对于卒中后情绪障碍的病理生理机制研究,着重于卒中后抑郁患者生物学标记物的变化[3]。但PSA的病理生理研究少,机制尚不清。有研究认为,焦虑障碍与下丘脑-垂体-肾上腺素(hypothalamic-pituitary-adrenal,HPA)轴功能失调及促炎因子、抗炎因子改变有关[4-6]。卒中患者存在皮质醇与炎性细胞因子改变,且这些改变与卒中进展及预后相关[7,8]。因此,本研究通过对卒中患者血清中皮质醇及IL-6变化的研究,探讨PSA患者的血清生物学标记物变化,为PSA的早期筛查及发病机制提供依据。
1 资料与方法
1.1 一般资料
选取2014年7月至2015年12月于同济医院神经内科首次住院的急性脑卒中患者150例,入组标准:脑卒中诊断均符合第四届1995年全国脑血管病学术会议修订的诊断标准[9],并经头颅CT或MR确诊;年龄18~80岁,意识清楚,无明显的语言障碍(可包括部分运动性失语,但无感觉性失语)。排除标准:脑卒中病情严重或伴有意识障碍、明显失语、失认、痴呆以及认知功能障碍,或检查不合作;既往有神经疾病、精神病史或近半年内有免疫相关疾病、使用过免疫抑制剂、抗精神病药物、激素制剂;合并严重心肺功能衰竭或其他严重躯体疾病不能配合检查;近期有酒精、药物滥用史、急性感染、组织损伤等病史。同时选择我院健康体检者50例为正常对照组。
1.2 方法
正常对照组于8:00采集空腹静脉血,检验血清皮质醇及IL-6水平。卒中患者于发病1周后8:00采集空腹静脉血检验皮质醇及IL-6水平,同日16:00再次抽取静脉血来检测血清皮质醇水平,分析皮质醇的节律变化。IL-6测定采用ELISA法(北京晶美生物工程有限公司试剂盒),皮质醇测定采用直接化学发光免疫分析法(西门子医学诊断产品(上海)有限公司)。发病后3周,由2名经过训练的医师对所有卒中患者进行精神科检查及汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)独立评分。根据DSM-V的其他躯体疾病所致的焦虑障碍诊断标准[10]及HAMA评分≥7分判定是否存在PSA,将卒中患者分为PSA组和非PSA组。
1.3 统计学处理
应用SPSS19.0统计软件分析数据,计量资料以(均数±标准差)表示,方差分析;计数资料采用率(%)表示,χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
由于部分患者脱失,最终完成测试的卒中患者为132例。PSA组32例(24.2%),男19例,女13例;平均年龄(60.6±5.8)岁;脑梗死13例,脑出血19例;非PSA组100例,男62例,女38例;平均年龄(62.3±6.3)岁;脑梗死43例,脑出血57例。正常对照组50例,男30例,女20例;平均年龄(63.3±4.5)岁。3组的年龄、性别比较差异无统计学意义(P>0.05)。
2.2 3组IL-6水平比较
PSA组的IL-6水平与非PSA组及正常对照组相比均升高,差异有统计学意义(P<0.05),非PSA组与正常对照组相比差异无统计学意义(P>0.05),见表1。
2.3 皮质醇节律变化
8:00 PSA组与非PSA组的皮质醇水平较正常对照组明显升高,有显著性差异(P<0.001);PSA组较非PSA组升高更明显(P<0.01)。非PSA组16:00的皮质醇水平低于8:00,有显著性差异(P<0.001),存在皮质醇节律变化,与正常人群的皮质醇节律一致;PSA组 16:00的皮质醇水平与8:00比较差异无统计学意义(P= 0.396),提示皮质醇节律性消失,见表1。
表1 3组IL-6、皮质醇水平比较及昼夜节律性变化(±s)
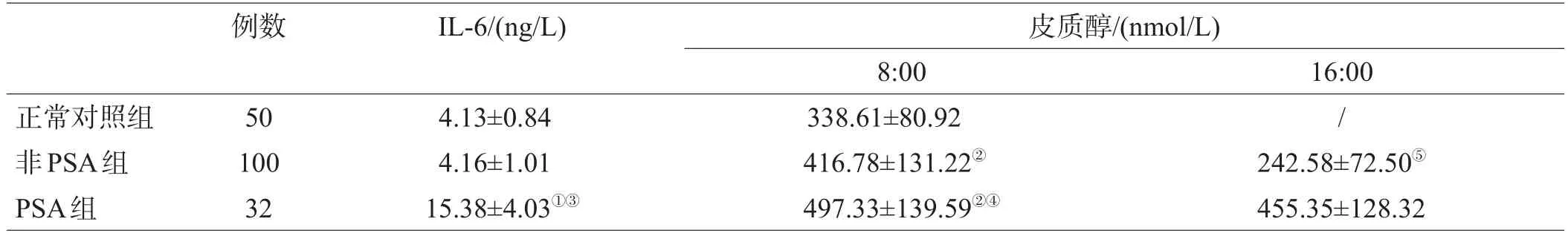
表1 3组IL-6、皮质醇水平比较及昼夜节律性变化(±s)
注:与正常对照组比较,①P<0.05,②P<0.001;与非PSA组比较,③P<0.05,④P<0.01;与同组8:00比较,⑤P<0.001
例数IL-6/(ng/L)皮质醇/(nmol/L)正常对照组非PSA组PSA组50 100 32 4.13±0.84 4.16±1.01 15.38±4.03①③8:00 338.61±80.92 416.78±131.22②497.33±139.59②④16:00 / 242.58±72.50⑤455.35±128.32
3 讨论
本研究发现,脑卒中后3周,PSA的发生率为24.2%,与以前的研究相近[2,11]。脑卒中患者的焦虑抑郁情绪不仅会增加脑血管意外的发生率,同时负面情绪减少患者主动及被动活动,影响其康复治疗[1]。PSA的发病机制尚不清楚。现有的研究表明,卒中后5-羟色胺及去甲肾上腺素能神经递质功能失调、HPA轴的活化、炎性细胞活化等可能是引起PSA的发生机制[7]。
本研究结果显示,卒中后1周PSA组的IL-6水平明显升高。许多研究表明,卒中后抑郁患者的IL-6水平明显增高。推测焦虑作为抑郁的共病,其IL-6的增高同样也参与焦虑的发生[12]。对广泛性焦虑障碍、创伤后应激障碍等研究发现,皮质醇、细胞因子均可能参与焦虑障碍的发病[13]。广泛性焦虑障碍、创伤后应激障碍和强迫障碍患者的IL-4、IL-6、IL-10、TNF-α、IL-1β水平增加,IL-5、IL-10水平下降[4]。卒中发生后,体内的免疫系统激活、淋巴细胞功能失调,过多的促炎因子(TNF-α、IL-1β、IL-6等)由破坏的血脑屏障进入中枢系统,耗竭体内色氨酸及促进HPA轴活化,并引起神经细胞丢失[14]。因此,卒中后早期IL-6的变化可能参与后期PSA的发生。
本研究结果显示,无论是PSA组还是非PSA组,其皮质醇水平均较正常对照组升高,证实卒中后HPA轴的激活、功能亢进。卒中患者整体皮质醇水平较正常对照组升高,考虑为脑卒中急性期应激状态引起,是为保护机体免遭更严重损害而产生的应激反应、保护措施。在早期研究中提出不同的生长时期,持久、高强度、各种形式的压力、糖皮质激素的暴露,导致大脑对HPA轴长期的不适应,HPA轴过度活化参与焦虑的形成[15]。进一步的研究表明,多种因素作用使最终HPA轴表观遗传学变化导致焦虑抑郁的形成[16]。本研究同时发现,PSA患者在卒中发生第1周,不仅存在皮质醇水平的升高,而且皮质醇的节律消失,提示皮质醇水平的改变可用于卒中预后的预测[8]。这些都能反映HPA轴的活化可能参与PSA的发生,与本研究结果相似。因此,卒中后早期皮质醇的增多及节律改变可能高度提示今后PSA的发生。
本研究分析皮质醇节律的变化,但未针对卒中患者进行地塞米松抑制实验来分析有无脱抑制现象,今后进一步完善该实验能进一步明确皮质醇水平变化在PSA发生中的作用。其次,有严重认知障碍和失语的卒中患者未入组,这可能给本研究带来偏差,今后可针对有认知功能障碍和失语的患者采用特殊的焦虑评定量表进行评估。
[1]Ferro JM,Caeiro L,Figueira ML.Neuropsychiatric sequelae of stroke [J].Nat Rev Neurol,2016,12:269-280.
[2]Campbell Burton CA,Murray J,Holmes J,et al.Frequency of anxiety after stroke:a systematic review and meta-analysis of observational studies [J].Int J Stroke,2013,8:545-559.
[3]Duman RS,Aghajanian GK,Sanacora G,et al.Synaptic plasticity and depression:new insights from stress and rapid-acting antidepressants[J]. Nat Med,2016,22:238-249.
[4]Furtado M,Katzman MA.Neuroinflammatory pathways in anxiety, posttraumatic stress,and obsessive compulsive disorders[J].Psychiatry Res,2015,229:37-48.
[5]Duivis HE,Vogelzangs N,Kupper N,et al.Differential association of somatic and cognitive symptoms of depression and anxiety with inflammation:findings from the Netherlands Study of Depression andAnxiety(NES-
DA)[J].Psychoneuroendocrinology,2013,38:1573-1585.
[6]Hoge EA,Brandstetter K,Moshier S,et al.Broad spectrum of cytokine abnormalities in panic disorder and posttraumatic stress disorder[J]. DepressAnxiety,2009,26:447-455.
[7]Castellanos M,Castillo J,García MM,et al.Inflammation-mediated damage in progressing lacunar infarctions a potential therapeutic target[J]. Stroke,2002,33:982-987.
[8]Zi WJ,Shuai J.Cortisol as a prognostic marker of short-term outcome in chinese patients with acute ischemic stroke[J].PloS one,2013,8:e72758.
[9]王新德.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,26:379-380.
[10]Zulauf Logoz M.[The Revision and 5th Edition of the Diagnostic and Statistical Manual of Mental Disorders(DSM-5):Consequences for the Diagnostic Work with Children and Adolescents].[J].Prax Kinderpsychol Kinderpsychiatr,2014,63:562-576.
[11]Burvill PW,Johnson GA,Jamrozik KD,et al.Anxiety disorders after stroke:results from the Perth Community Stroke Study[J].Br J Psychiatry, 1995,166:328-332.
[12]Spalletta G,Boss P,Ciaramella A,et al.The etiology of poststroke depression:a review of the literature and a new hypothesis involving inflammatory cytokines[J].Mol Psychiatry,2006,11:984-991.
[13]Lueken U,Zierhut KC,Hahn T,et al.Neurobiological markers predicting treatment response in anxiety disorders:A systematic review and implications for clinical application[J].Neurosci Biobehav Rev,2016,66:143-162.
[14]Petrovic-Djergovic D,Goonewardena SN,Pinsky DJ.Inflammatory Disequilibrium in Stroke[J].Circ Res,2016,119:142-158.
[15]Gądek-Michalska A,Tadeusz J,Rachwalska P,et al.Cytokines,prostaglandins and nitric oxide in the regulation of stress-response systems[J]. Pharmacol Rep,2013,65:1655-1662.
[16]Lee RS,Sawa A.Environmental stressors and epigenetic control of the hypothalamic-pituitary-adrenal axis[J].Neuroendocrinology,2014, 100:278-287.
(本文编辑:王晶)
Changes in Interleukin-6 Levels and Cortisol Fluctuations in Post-stroke Anxiety Patients
ZOU Wei,ZHANG Xiao-fan,YANG Yuan.Department of Neurology,Tongji Hospital,Tongji Medical College, Huazhong University of Science and Technology,Wuhan 430030,China
Objective:To observe the association of interleukin-6(IL-6)and cortisol levels with post-stroke anxiety(PSA).Methods:Total 132 stroke patients and 50 health people(normal control group)were enrolled. The serum of all patients was collected at 8:00 and 16:00 respectively one week after stroke.The serum of the normal control group was collected only at 8:00.The level of IL-6 were analysed by enzyme-linked immunosorbent assay kit,the levels of cortisol were detected by chemiluminescence immunoassay.On the 3rd week after stroke,the patients were divided to the groups PSA and non-PSA based on the Diagnosis of PSA.Results:The IL-6 level was elevated significantly in the PSA groups as compared with non-PSA group and normal control group respectively(P<0.05 for both).The patients in the both PSA group and non-PSA group had significantly elevated morning cortisol levels in comparison with those in the normal control group(P<0.05).The biological rhythm of cortisol in the PSA group disappeared.Conclusion:Detection of IL-6 and cortisol may be helpful for PSA diagnosis in the early stage.
post-stroke anxiety;cortisol;interleukin-6
R741;R749.1+2
ADOI10.16780/j.cnki.sjssgncj.2016.05.016
华中科技大学同济医学院附属同济医院神经内科武汉 430030
2016-01-22
杨渊yuanyang70@hotmail.com

