RNAi技术沉默星形胶质细胞Adam10基因模型的建立
徐姣,刘扬,潘邓记,杨园,张函,熊颖,张强
·论著·
RNAi技术沉默星形胶质细胞Adam10基因模型的建立
徐姣a,刘扬b,潘邓记a,杨园a,张函a,熊颖c,张强a
目的:建立离体星形胶质细胞Adam10基因沉默模型。方法:体外培养SD大鼠乳鼠星形胶质细胞,采用免疫荧光方法标记胶质纤维酸性蛋白(GFAP)以鉴定星形胶质细胞及其纯度。通过RNA干扰(RNAi)技术,使用转染试剂Lipofectamine2000将靶向作用于大鼠Adam10基因的siRNA序列转染至星形胶质细胞内,通过Real time-PCR和Western blotting技术在RNA水平和蛋白水平检测沉默效率。结果:靶向作用于星形胶质细胞Adam10基因的siRNA序列成功转染入星形胶质细胞,并且转染Adam10基因靶向干扰序列的星形胶质细胞Adam10基因的表达在RNA水平和蛋白水平较阴性对照组明显降低(P<0.05)。结论:可以通过RNAi技术建立离体星形胶质细胞Adam10基因沉默模型。
星形胶质细胞;Adam10基因;RNA干扰
ADAMs(a disintegrin and metalloprotease)是I型跨膜蛋白,因其结构上具有解聚素(disintegrin)和金属蛋白酶(metalloprotease)二个重要的结构域而命名[1]。ADAM10表达于星形胶质细胞、少突胶质细胞、部分正在分化的大脑皮质细胞和神经元细胞[2]。ADAM10是ADAMs家族的一个亚型,其作用底物很广泛,目前已发现的包括Notch[3]、Cadherin[4,5]、Ephrin[6]、APP[7,8]等30余种跨膜蛋白质,这些底物分子在中枢神经系统中均具有重要作用[9-12]。已有研究表明,Adam10基因敲除小鼠因心血管系统发育紊乱于胚胎第9.5 d即死亡,并出现体节和中枢神经系统发育异常[13]。选择性敲除小鼠神经干细胞的Adam10基因,小鼠大脑皮质发育出现异常,主要表现为神经元的分化和迁移异常[14]。Adam10基因缺失导致海马和皮质组织中胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和CaMKⅡα的mRNA、蛋白质表达水平增高,导致胶质细胞增多,造成神经元丢失和功能抑制[15]。但ADAM10干预上述底物分子的功能和活性,进而影响突触可塑性和神经网络功能重建的具体作用机制尚待进一步阐明。近年来,多种研究证明RNA干扰(RNA interfering,RNAi)技术靶向沉默Adam10基因对心肌细胞、肿瘤细胞的生物学活性有着重要影响。本研究尝试过RNAi技术靶向沉默离体星形胶质细胞Adam10基因,以研究星形胶质细胞在Adam10基因低表达情况下生物学功能的变化,为后续实验研究建立离体细胞培养模型。
1 材料与方法
1.1 材料
1.1.1 实验动物 出生24 h内的SPF级SD大鼠乳鼠,购自华中科技大学同济医学院实验动物中心。
1.1.2 主要试剂 ①Adam10siRNA干扰序列:按照RNAi实验原理和siRNA设计原则,设计3种靶向作用于Adam10基因的干扰序列为目的siRNA,分别命名为Si-r-Adam10-001、Si-r-Adam10-002、Si-r-Adam10-003(表1);1种与以上目的siRNA序列有相同碱基组分,但碱基排列顺序不同,与Adam10无同源性的序列作为阴性对照序列;1种与Adam10无同源性的荧光标记(cy3)的阴性对照序列,由于此序列带荧光,可以在荧光显微镜下观察序列在转染试剂的作用下是否被转入细胞内,直观地评价转染效率。序列设计完成后,由广州锐博生物有限公司合成。②转染试剂Lipofectamine2000(购于美国Invitrogen公司),小鼠抗大鼠GFAP单克隆抗体(购于美国CST公司),小鼠抗大鼠ADAM10单克隆抗体(购于美国Santa Cruz公司),FITC标记羊抗小鼠IgG、HRP标记兔抗小鼠IgG(购于美国Jackson ImmunoResearch实验室),Trizo(l购于北京Aidlab公司),M-MLV Reverse Transcriptase(购于美国GeneCopoeia公司),qPCR Mix(购于美国GeneCopoeia公司)。
1.2 方法
1.2.1 星形胶质细胞原代培养和传代 取出生24 h内的SD大鼠乳鼠大脑,小心去除脑膜及血管,取皮质组织置于无血清DMEM/F12培养基中,剪碎,0.25%胰酶消化,用15%胎牛血清DMEM/F12细胞培养基中和胰酶 ,200目滤网滤过,4 ℃800 rpm离心8min后,用20%胎牛血清DMEM/F12细胞培养基重悬,种于细胞培养瓶内,置于CO2培养箱37 ℃培养,每2~3 d换液,细胞密度至90%~100%时,进行细胞传代以纯化细胞。
1.2.2 星形胶质细胞鉴定 星形胶质细胞爬片,冰甲醇固定15 min,PBS洗5 min×3次,0.2%Triton X-100破膜15 min,PBS洗5 min×3次,5%BSA封闭1 h,PBS洗5 min×3次,小鼠源单克隆GFAP一抗4 ℃湿盒孵育过夜,PBS洗5 min×3次,FITC标记山羊抗小鼠IgG抗体避光室温孵育1 h,PBS洗5 min×3次,DAPI染核8 min,PBS洗5 min×3次,50%甘油封片,荧光显微镜下观察。
1.2.3 细胞转染 0.25%胰酶消化,15%胎牛血清DMEM/F12细胞培养基中和胰酶,4 ℃800rpm离心8 min,无血清Opti-MEM培养基重悬细胞,置于无酶离心管中以备用。用无血清的Opti-MEM培养基分别稀释siRNA和转染试剂lipofectamin2000,置于无酶EP管中,室温静置5 min,将稀释后的siRNA和lipofectamin2000轻轻混匀,室温静置20 min以形成siRNA/lipofectamin2000复合物,将siRNA/lipofectamin2000复合物加到盛有细胞的离心管中,轻轻摇匀,静置5 min,将细胞种于12孔板内,置于CO2培养箱中37 ℃,温育6 h后,弃培养基,用PBS洗1次,加入15%胎牛血清的DMEM/F12培养基,继续培养;通过转染cy3标记阴性对照序列以检测转染效率。
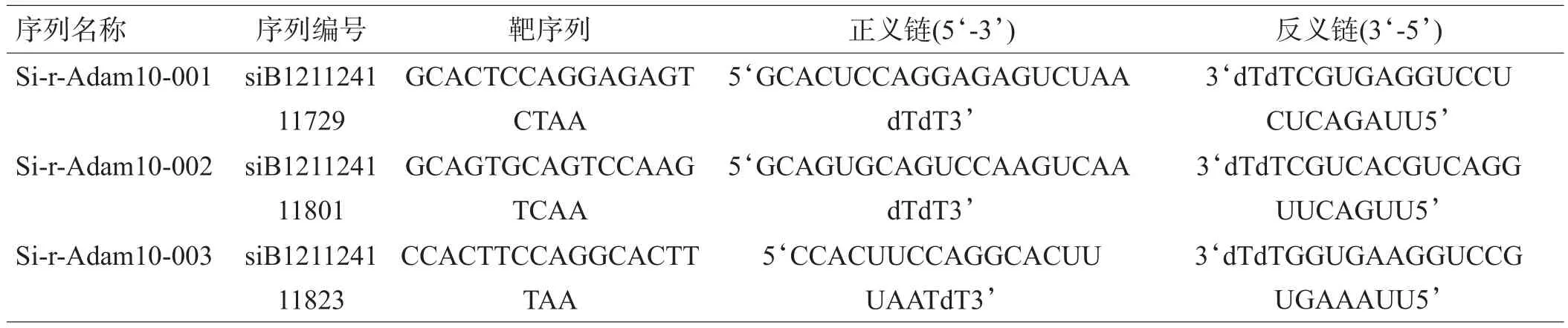
表1 3种siRNA序列

表2 引物序列
1.2.4 实验分组 细胞分为5组:SiT1组、SiT2组、SiT3组、NCSi组、Lipo组;星形胶质细胞体外转染ADAM10-siRNA,分别有三组目的siRNA序列供筛选,即Si-r-Adam10-001(SiT1)、Si-r-Adam10-002(SiT2)、Si-r-Adam10-003(SiT3),对应分组为SiT1组、SiT2组、SiT3组,分别加入 SiT1/Lipofectamine2000、SiT2/Lipofectamine2000、SiT3/Lipofectamine2000复合物。由于Lipofectamine2000有一定的细胞毒性,故另设置Lipo组为对照组,只加入Lipofectamine2000,排除Lipofectamine2000对实验的影响。设置NCSi组为阴性对照组,加入NC-siRNA/Lipofectamine2000复合物,NC-siRNA与目的siRNA序列有相同碱基组分,但碱基排列顺序不同,与Adam10无同源性的序列,排除转入碱基对细胞的影响。
1.2.5 Real time PCR检测转染效率 ①提取RNA:将6孔板内转染24 h后的细胞,PBS洗3次,每孔加1 mL Trizol冰上吹打均匀,静置5 min,4 ℃12 000rpm 5 min离心,留取上清;加入200 μL氯仿,充分颠倒摇匀,室温静置15 min,4 ℃12 000rpm 15 min离心;吸取上层水样液体500 μL至无酶EP管中,加入500 μL异丙醇(1∶1),用力摇匀,室温静置10 min;4 ℃12 000 rpm 10 min离心;弃上清,加入75%乙醇1 mL(无水乙醇用DEPC水配置),震荡均匀,8 000 rpm 5 min离心;弃去上清液,用滤纸吸干EP管中RNA水分,加入适量DEPC水溶解EP管中RNA。②RNA纯度及浓度测定:取溶解后的RNA 1 μL用DEPC水稀释200倍后,用紫外分光光度计测定OD260、OD280以及OD260/OD280值,计算RNA的纯度和浓度。根据OD260/OD280比值,估测RNA质量,比值在1.8~2.0满足实验要求。吸光光度值按下列公式计算样品RNA的浓度:总RNA浓度(μg/μL)=OD260值×40×200×10-3。将总RNA放于-80 ℃冰箱内保存以备用。③RNA逆转录:把RNA在65 条件下反应5 min后,立即放于冰上冷却使其变性,依次加入2 μL 5×RT Buffer,0.5 μL RT Enzyme Mix,0.5 μL Primer Mix,1 μg RNA,加Nnase free water定容至10 μL体系;在37 条件下,进行15 min的逆转录反应;在98 ℃条件下进行5 min的酶失活反应,反应结束后将cDNA置于-20 ℃条件下保存。④Real Time-PCR:依次加入10 μL SYBR Green Realtime PCR Master Mix,0.8 μL上游引物,0.8 μL下游引物(表2),2 μL cDNA样品,6.4 μL蒸馏水;设置PCR反应程序:95 →5 s,55 →10 s,72 →5 s;根据扩增曲线数据,最终数据以2-△△Ct进行分析,计算ADAM10相对表达量。
1.2.6 Western Blotting检测ADAM10蛋白的表达 转染72 h后RIPA法提取各组细胞总蛋白,BCA法测蛋白浓度。32 μg总蛋白进行10%SDS-PAGE电泳,350mA 2 h转至NC膜,NC膜经5%脱脂奶粉的TBST溶液室温封闭2 h后,小鼠源抗大鼠ADAM10抗体(1∶500)4﹣孵育过夜,TBST洗膜10 min×3次后,HRP标记兔抗小鼠二抗(1∶1 000)室温孵育1 h,用TBST洗膜10 min×3次,ECL发光液化学发光后采集图像,Gene Genius Bio-Imaging system凝胶成像分析系统结合Image J软件采集并分析图像。
1.3 统计学处理
应用SPSS13.0软件包分析数据,计量资料以(均数±标准差)表示,组间差异行单因素方差分析后采用Tukey’s post hoc test,P<0.05为差异有统计学意义。
2 结果
2.1 星形胶质细胞体外培养鉴定结果
SD大鼠乳鼠体外星形胶质细胞原代培养24 h后,镜下可见细胞贴壁良好,细胞呈梭形或圆形,细胞折光性较差,细胞体较小,细胞培养瓶中可见少量死细胞和细胞碎片;待细胞培养至3~4 d时,可见细胞贴壁牢固,细胞体变大,伸出多处指状突起,折光性增强;待细胞培养至5~6 d时,星形胶质细胞呈星状,进一步培养至细胞融合时传代。传代后得到纯化的星形胶质细胞(F1代),F1代星形胶质细胞呈不规则形,边界清晰,细胞体丰满扁平,细胞间彼此连接,折光性强,当星形胶质细胞长满至80%~90%时,即可用于实验。将F1代星形胶质细胞传代至多聚赖氨酸包被好的12孔板中,当细胞密度约为50%~60%时,对细胞进行GFAP及DAPI免疫荧光染色(图1A),用于鉴定星形胶质细胞纯度,鉴定结果提示F1代星形胶质细胞纯度>95%。
2.2 星形胶质细胞体外转染Adam10-siRNA
培养细胞至对数增长期,向细胞内加入Cy3-siRNA/lipofectamin2000复合物,继续培养24 h后,固定细胞,免疫荧光染色。蓝色荧光标记细胞核,红色荧光标记转染序列。Cy3标记siRNA转染入星形胶质细胞,包绕细胞核周围(图1B),提示siRNA组转染成功,转染效率为95%,后续实验用转染Cy3-siRNA同样的方法进行转染。
2.3 ADAM10-siRNA沉默效率
通过Western blotting、Real time-PCR筛选最有效沉默星形胶质细胞Adam10基因的序列。Western Blotting结果示,SiT1序列在蛋白水平沉默效率最大,与NCSi组相比,差异有统计学意义(P<0.05,图2A);Real time-PCR结果示,SiT1在RNA水平沉默效率最大,差异有统计学意义(P<0.05,图2B);后续实验可选择SiT1为靶向干扰序列。
3 讨论
ADAM10是一种大约由750个氨基酸组成的I型跨膜蛋白质,具有一个大的膜外结构域、一个跨膜结构域和一个富含脯氨酸的细胞质结构域,膜外结构域由几种不同的功能结构域组成[16]。ADAM10底物众多,在神经系统发育中不仅起到调节细胞增殖、迁移、分化的作用,还参与轴突生长和髓鞘化[17,18],但ADAM10在上述过程中的分子细胞学机制尚待阐明。为了进一步研究Adam10在中枢神经系统分化发育和病理过程中的具体机制,近年来人们尝试通过基因工程学的方法建立干扰Adam10基因表达模型。前期研究发现,Adam10常规基因全敲除小鼠由于严重的心脑等器官缺陷而夭折于胚胎发育早期,而不能获得成年Adam10基因敲除小鼠进行研究。为了解决这一问题,本实验尝试通过RNAi技术建立离体星形胶质细胞选择性Adam10基因沉默模型,达到沉默Adam10基因的作用,为后续实验研究提供研究工具。
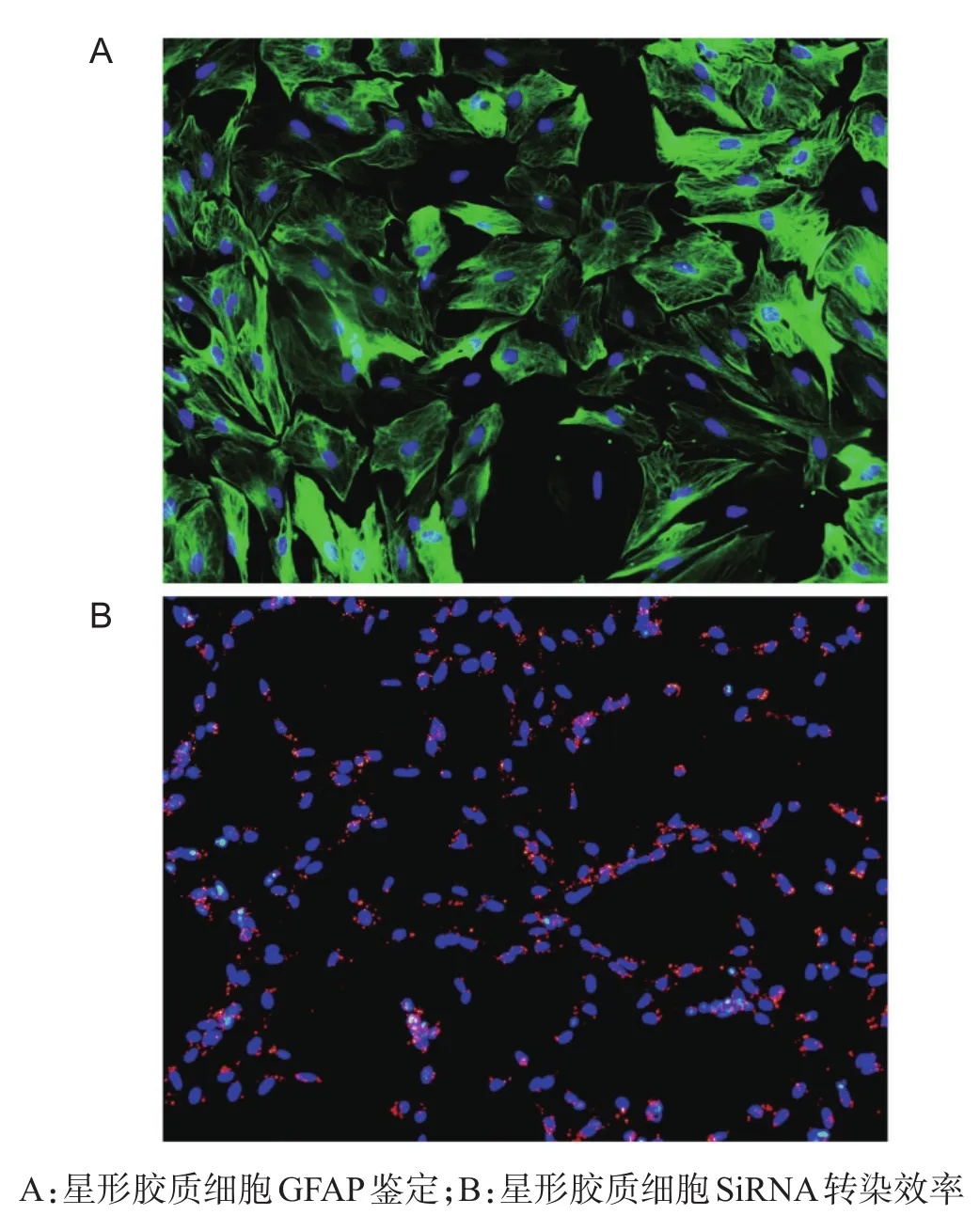
图1 星形胶质细胞鉴定及体外转染Adam10-siRNA(免疫荧光染色,×400)
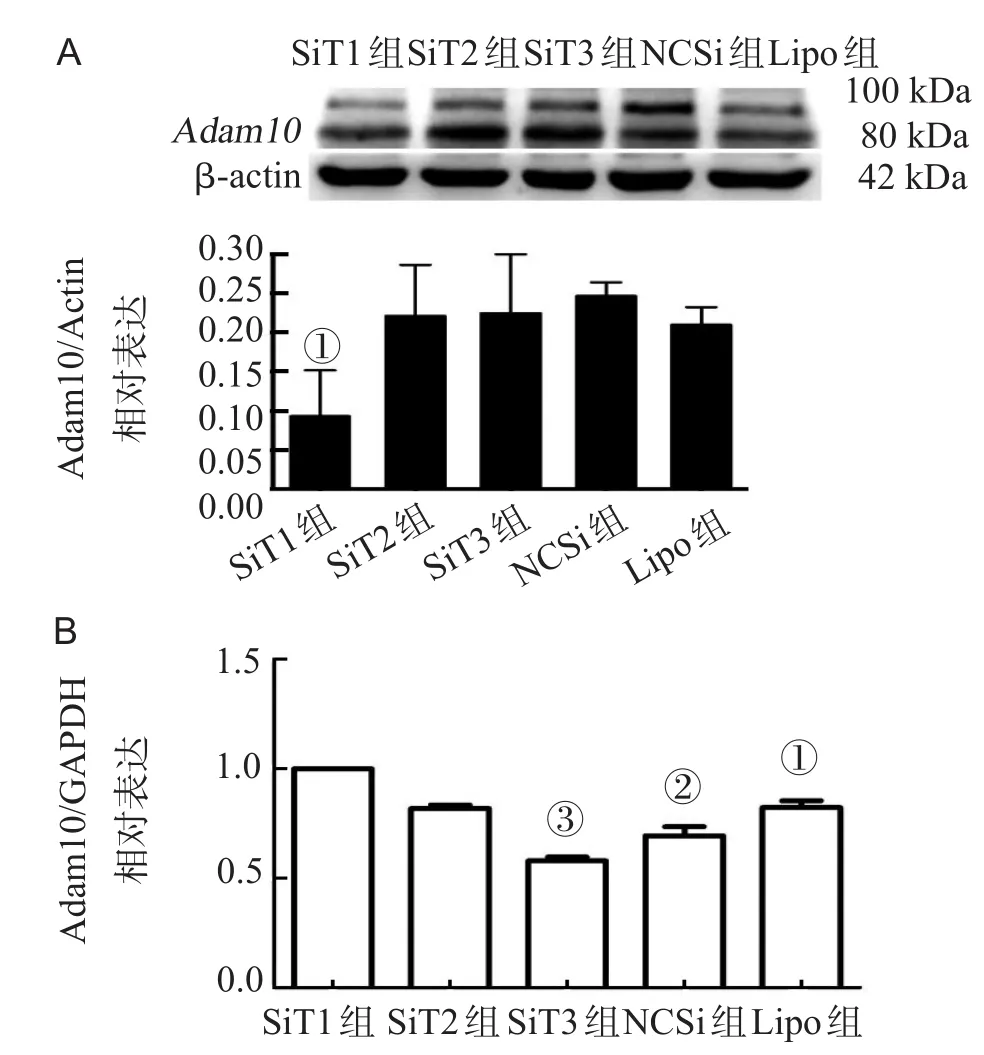
图2 转染SiRNA后的Western blotting和Real time PCR结果
为了能建立离体星形胶质细胞Adam10基因沉默模型,首先需要获得高纯度离体培养的星形胶质细胞。早期发育过程中,神经元与胶质细胞的增殖高峰期不同,神经元增殖在胚胎期完成,而神经胶质细胞的大量增殖却发生在胚胎晚期和出生后[19]。因此,本实验取出生后24 h内的新生大鼠大脑皮质细胞,目的是分离获得更多的星形胶质细胞。在取得乳鼠大脑皮质细胞前,用软头毛笔小心去除所有脑膜和血管,旨在减少成纤维细胞。鉴于成纤维细胞贴壁速度较星形胶质细胞快,采用差速贴壁培养方法获得纯度更高的星形胶质细胞。即原代和传代培养星形胶质细胞时,将离心重悬后获得的细胞悬液置于培养瓶内,于培养箱内培养15 min后,轻轻翻转培养瓶,将上清液移至另一培养瓶中,放入培养箱中继续培养,从而去除成纤维成分。由于星形胶质细胞的增殖速度远大于少突胶质细胞和其它神经细胞,而且星形细胞与其它细胞分层生长,星形细胞在底层,经过一定力度的摇动处理,可选择性地使在星形细胞上层生长的细胞脱落。因此,在星形胶质细胞传代培养前,37 -200 r/min摇床18 h以去除少突胶质细胞和小胶质细胞,换液培养l d后传代,以得到纯对较高的星形胶质细胞,为实验提供高纯度的星形胶质细胞。
RNAi是由与靶基因序列同源的双链RNA引发的广泛存在于生物体内的序列特异性基因转录后的沉默过程。本研究按照siRNA干扰序列设计原则,设计对Adam10基因有沉默作用的序列,由于目前未发现siRNA的干扰效率与mRNA中具体位置的关系,为确保对mRNA的有效抑制,针对Adam10基因设计3条siRNA干扰序列,进行化学合成,并通过实验筛选出沉默效率最高的siRNA序列,旨在获得能有效抑制星形胶质细胞Adam10基因的siRNA序列。
本研究遵循RNAi实验原则,通过转染试剂lipofectamin2000,借助于Cy3标记阴性对照序列,不断优化转染条件,保证转染效率≥95%,按照转染Cy3标记阴性对照序列的方法和实验条件,将靶向作用于星形胶质细胞Adam10基因的siRNA序列成功转入星形胶质细胞内。Real time-PCR检测结果示,在RNA水平SiT1组ADAM10相对表达量较对照组最低,差异有统计学意义(P<0.05),表明SiT1序列对星形胶质细胞Adam10基因沉默效率最大。Western blotting检测结果示,在蛋白水平SiT1组ADAM10表达量较对照组最低,同样表明SiT1序列对星形胶质细胞Adam10基因沉默效率最大。
本研究通过RNAi技术成功建立离体星形胶质细胞Adam10基因沉默模型,并筛选出对星形胶质细胞Adam10基因沉默效率最大的序列,为后续研究Adam10基因对中枢神经系统的作用及机制奠定了基础。
[1]Huovila AP,Turner AJ,Pelto-Huikko M,et al.Shedding light on ADAM metalloproteinases[J].Trends Biochem Sci,2005,30:413-422.
[2]Jorissen E,Prox J,Bernreuther C,et al.The Disintegrin/Metall-oproteinase ADAM10 is essential for the establishment of the brain cortex[J].J Neurosci,2010,30:4833-4844.
[3]Lieber T,Kidd S,Young MW.Kuzbanian-mediated cleavage of Drosophila Notch[J].Genes Dev,2002,16:209-221.
[4]Uemura K,Kihara T,Kuzuya A,et al.Characterization of sequential N-cadherinin cleavage by ADAM10 and PSI[J].Neurosci Lett,2006,402:278-283.
[5]Reiss K,Maretzky T,Ludwig A,et al.ADAM10 cleavage of N-cadherin and regulation of cell-cell adhesion and beta-catenin nuclear signalling[J].EMBO J,2005,24:742-752.
[6]Janes PW,Saha N,Barton WA,et al.Adam meets EPh:an ADAM aubatrate recognition modules acts as a molecular switch for ephrin cleavage in trans[J].Cell,2005,123:291-304.
[7]Marcinkiewicz M,Seidah NG.Coordinated expression of bete-amyloid precursor protein and the putative beta-secretase BACE and alphasecretase ADAM10 in mouse and human brain[J].J Neurochem,2000,75:2133-2143.
[8]Postina R,Schroeder A,Dewachter I,et al.A disintegrin-metalloproteinase prevents amyloid plaque formation and hippocampal defects in an Alzheimer disease mouse model[J].J Clin Invest,2004,113:1456-1464.
[9]Yoon K,Gaiano N.Notch signaling in the mammalian central nervous system:insights from mouse mutants[J].Nat Neurosci,2005,8:709-715.
[10]Redies C.Cadherins in the central nervos system[J].Prog Neurobiol, 2000,61:611-648.
[11]Goldshmit Y,McLenachan S,Turnley A.Roles of Eph receptors and ephrins in the normal and damaged adult CNS[J].Brain Res Rev,2006,52:327-345.
[12]Thinakaran G,Koo EH.Amyloid precursor protein trafficking,processing,and function[J].J Biol Chem,2008,283:29615-29619.
[13]Hartmann D,de Strooper B,Serneels L,et al.The disintegrin/metalloprotease ADAM10 is essential for Notch signalling but not for alpha-secretase activity in fibroblasts[J].Hum Mol Genet,2002,11:2615-2624.
[14]Jorissen E,Prox J,Bernreuther C,et al.The disintegrin/metalloproteinase ADAM10 is essential for the establishment of the brain cortex[J].J Neurosci,2010,30:4833-4844.
[15]李朋.ADAM10缺失对CaMKⅡα基因表达,胶质细胞增殖及突触可塑性的影响[D].福建:福建医科大学,2014.
[16]Asai M,Hattori C,Szabó B,et al.Putative function of ADAM9,ADAM10,and ADAM17 as APP alpha-secretase[J].Biochem Biophys Res Commum,2003,301:231-235.
[17]Hooper NM,Turner AJ.The search for alpha-secretase and its potential as a therapeutic approach to Alzheimer disease[J].Curr Med Chen, 2002,9:1107-1119.
[18]Postina R,Schroeder A,Dewachter I,et al.A disintegrin-metalloproteinase prevents amyloid plaque formation and hippocampal defects in an Alzheimer disease mouse modle[J].J Clin Invest,2004,113:1456-1464.
[19]Liberto CM,Albrecht PJ,Herx LM,et al.Pro-regenerative properties of cytokine-activated astrocytes[J].Neurochemistry,2004,89:1092-1100.
(本文编辑:王晶)
siRNA Interfering of Astrocytic Adam10 Gene Slience
XU Jiaoa,LIU Yangb,PAN Deng-jia,YANG Yua-na,ZHANG Hana,XIONG Yingc,ZHANG Qianga.a.Department of Neurology,b.Department of Neurosurgery, c.Department of Radiology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective:To establish an in vitro model of Adam 10 gene silence in astrocytes by RNAi.Meth⁃ods:The purified astrocytes were isolated from neonatal SD rats cerebral cortex in fresh culture medium.The quality and purity of astrocytes were identified by glial fibrillary acidic protein(GFAP)staining.The Adam10 gene siRNA sequence were transfected to astrocytes via Lipofectamine2000.The silence efficiency was counted via examination of the relative expression RNA and protein level of Adam10by real time PCR and western blot respectively.Results:The Adam10 siRNA sequence was transfected into astrocytes successfully.The level of Adam10RNA and protein in RNAi group is significantly lower than that in control groups(P<0.05).Conclu⁃sion:Adam10gene silencing model can be established by RNAi technology in vitro.
astrocyte;Adam10gene;RNA interfering
R741;R741.02
ADOI10.16780/j.cnki.sjssgncj.2016.05.001
华中科技大学同济医学院附属同济医院a.神经内科b.神经外科c.放射科武汉 430030
1.国家自然科学基金(No.81471230)2.国家自然科学基金(No.81571206)
2016-02-01
张强550251415@qq. com

